南亚热带6种人工林土壤微生物生物量和群落结构特征
2020-04-23李雪万晓华周富伟邹秉章王思荣
李雪,万晓华*,周富伟,邹秉章,王思荣
(1.福建师范大学 a. 地理科学学院,b. 湿润亚热带山地生态国家重点实验室培育基地,福州350007;2. 上杭白砂国有林场,福建 龙岩364000)
0 引言
20世纪50年代以来,中国亚热带地区大规模种植以杉木(Cunninghamialanceolata)和马尾松(Pinusmassoniana)为主的针叶树种,片面追求经济效益,林地针叶化及纯林化严重,导致中国亚热带地区树种单一,森林生态效益、土壤肥力和生物多样性下降等不良后果[1]。近年来,为了减少针叶纯林带来的不利影响,中国南方鼓励营造阔叶林、针阔混交林等多种林分类型,调整树种结构。然而如何合理的选择树种从而提高退化的人工林地力仍然还有很多不清楚的地方。特别是树种组成变化以后,土壤微生物组成如何变化。
土壤微生物调控包括土壤碳(C)和氮(N)循环在内的各种生物地球化学循环过程[2-3],土壤微生物群落结构的变化可以反映其生存环境的变化[4]。同时,微生物作为土壤中主要的分解者,可通过分解动物、植物残体影响土壤养分进而影响植物生长[5]。树种主要通过改变凋落叶和根系输入的数量和质量影响土壤微生物,不同树种下会形成独特的微生物群落[6],不同树种下的土壤微生物生物量与微生物群落对磷添加的响应也不同[7]。有研究表明,针叶树种凋落叶碳氮比和木质素含量高于阔叶树种,因此针叶树种下的真菌与细菌比值大于阔叶树种[8-10],凋落叶的质量和数量可能是影响微生物群落组成的主要原因。然而,Huang等[11]以杉木砍伐后的19年生阔叶树种米老排和针叶树种杉木为研究对象,利用磷脂脂肪酸方法分析发现,米老排显著提高土壤微生物生物量,而米老排凋落叶质量高于杉木,但是两个树种下土壤微生物群落组成无显著差异,认为可能与不同树种叶片的次生代谢物质有关。有研究表明,由于固氮树种与根瘤菌共生,能够在根际固定大量的氮,杉木采伐迹地上营造的固氮树种黑木相思的微生物生物量大于杉木人工林且群落组成也有显著差异[12],但也有研究认为固氮树种与非固氮树种的微生物群落组成没有显著差异[13],不同树种的生长速率不同,在生长过程中对养分的需求也不一样,可能是造成研究结果不同的主要原因。目前对不同树种的研究多集中在针阔叶树种混生生态系统,对人工纯林的研究一般涉及树种类型较少,且较少将针叶树种与阔叶树种,固氮树种与非固氮树种同时进行比较。
选取亚热带针叶树种杉木(Cunninghamialanceolata)、湿地松(Pinuselliottii)、福建柏(Fokieniahodginsii),阔叶树种木荷(Schimasuperba)、马占相思(Acaciamangium)和台湾相思 (AcaciaconfusaMerr) 6种不同树种人工林为研究对象,其中马占相思和台湾相思属于固氮树种,其他树种属于非固氮树种, 分析不同树种土壤微生物生物量与群落结构的特征,并探究树种对土壤微生物群落结构变化的影响机制,以期为该地区人工林的树种选择和合理经营提供科学依据。
1 研究地区与研究方法
1.1 研究区概况
研究区位于福建省厦门市汀溪国有林场(118°07′E,24°49′N),平均海拔202~390 m。该地区属南亚热带海洋性季风气候,多年平均气温为20.6 ℃,平均月最低和最高气温分别为12.6 ℃ 和28.0 ℃;年均降水量1 468 mm,降水主要发生在3—9月,年均相对湿度78%。主要地貌类型为低山丘陵,地带性土壤以花岗岩或砂岩发育而来的酸性红壤为主。
本研究选择6个坡度、海拔一致,林龄接近的(21~25年)常见造林树种人工林:针叶树种杉木(Cunninghamialanceolata)、湿地松(Pinuselliottii)、福建柏(Fokieniahodginsii),阔叶树种木荷(Schimasuperba)、马占相思(Acaciamangium)和台湾相思林(AcaciaconfusaMerr),它们的初始密度均为1 500株·hm-2,前茬树种均为马尾松人工林。不同人工林样地之间距离大于2 km,杉木、湿地松、福建柏林随机布设3个20 m×30 m的实验小区,木荷、马占相思、台湾相思林随机布设4个20 m×30 m的实验小区。于2016年2月进行人工林情况调查,在每个树种人工林中,设置5个0.5 m×0.5 m的凋落物框用于收集凋落物。
凋落叶在室内60 ℃中烘干至恒重,磨粉过100目筛,用元素分析仪(Elemental Analyzer Vario ELII,德国)测定凋落叶碳、氮含量;凋落叶全磷用浓 HNO3-H2O2消煮,电感耦合等离子体发射光谱仪(ICP-OES) (Optima 8000)测定;凋落叶纤维素、木质素分别采用中性洗涤纤维( NDF) 及酸性洗涤纤维( ADF)方法测定。
土壤pH根据土水比为1∶ 2.5测定;根据用烘干法测定土壤含水率;土壤全碳、全氮含量用碳氮元素分析仪(Elemental EL MAX CNS analyzer,德国)测定;土壤可溶性有机碳、可溶性有机氮测定方法为:冷水浸提后(土水比为1∶4)用总有机碳分析仪(SHIMADZU TOC-VCPH/CPN Analyzer,日本岛津)测定浸提液中有机碳含量,用连续流动分析仪(SkalaSan++, 荷兰)测定有机氮含量。6种人工林树高、胸径和凋落叶、0~10 cm土壤层理化性质如表1所示。

表 1 不同树种人工林基本特征比较Table 1 Comparison of site features in different plantation types
注:同一列不同小写字母表示不同树种人工林之间差异显著(P<0.05),下同。杉木、湿地松、福建柏的样本量n=3;木荷、马占相思、台湾相思的样本量n=4,下同。
1.2 样品采集与测定
于2016年5月,在每个实验小区内去除地表的枯枝落叶层后,用内径为3.5 cm的土钻沿对角线等距离取10个点,采集0~10 cm土壤层样品,将同一小区的土样均匀混合为一个样品,用冰盒运回。在实验室内挑出土壤样品中的石砾、植物碎屑等杂质,过2 mm筛后用于磷脂脂肪酸(PLFA)和微生物生物量碳、微生物生物量氮的测定。
用氯仿-熏蒸法测定微生物生物量碳[14]、微生物生物量氮[15]。其中熏蒸处理为25 ℃黑暗真空条件下培养24 h,用0.5 mol·L-1K2SO4浸提液提取。用总有机碳分析仪(SHIMADZU TOC-VCPH /CPN analyzer,日本岛津)测浸提液中的有机碳浓度,用连续流动分析仪(Skalar San++,荷兰)测定无机氮(NH4+-N和NO3--N)和土壤可溶性有机氮浓度。微生物生物量碳(MBC)、微生物生物量氮(MBN)的计算公式如下:
MBC=EC/0.45
(1);
MBN=EN/0.54
(2)
式(1~2)中:EC、EN分别为熏蒸和未熏蒸样品中有机碳、有机氮含量的差值(mg·kg-1),0.45为微生物生物量碳的转换系数,0.54为微生物生物量氮的转换系数。
土壤微生物群落组成用磷脂脂肪酸(PLFA)方法测定[16]。简单操作方法如下:(1)称取8 g冷冻干燥后的干土于35 ml离心管中,依次加入 5 mL 磷酸缓冲液、6 mL 三氯甲烷、12 mL甲醇,振荡2 h后离心(1 000 r·min-1,10 min),转移上层清液到分液漏斗中;(2)向剩余土壤中再加入12 mL三氯甲烷和 12 mL 磷酸缓冲液,振荡离心后转移上层清液;(3)合并两次上清液并摇匀,黑暗环境下静置一夜;(4)收集下层氯仿相,在氮气下吹干,通过硅胶柱分离出磷脂,加甲醇∶甲苯(1∶1) 和0.2 mol·L-1氢氧化钾溶液进行皂化和甲基化形成脂肪酸甲酯;(5)每一个脂肪酸甲酯通过气象色谱仪(Agilent6890N,美国) ,根据它们的停留时间结合MIDI 微生物识别系统( MIDI Inc.,Newark,DE) 来进行鉴定。用异构甲基支链和前异构甲基支链脂肪酸指示革兰氏阳性细菌(GP∶i14∶0, i15∶0, a15∶0, i16∶0, i17∶0和a17∶0),单一不饱和脂肪酸和环丙烷脂肪酸指示革兰氏阴性细菌(GN∶16∶1 ω7c, 16∶1 ω9c, cy17∶0, 18∶1 ω7c, 18∶1ω5c和cy19∶0),18∶1ω9c和18∶2ω6,9c指示真菌,16∶1ω5c指示丛枝菌根真菌,10Me 16∶0, 10Me 17∶0和10Me 18∶0脂肪酸指示放线菌[16]。真菌∶细菌(F∶B)用18∶2 ω6,9c和18∶1 ω9c的总量与各细菌指示物的总量比来计算。
1.3 数据处理
统计分析主要用SPSS 21.0和Canoco 5.0软件进行。利用单因素方差(One-way ANOVA)分析及Duncan多重比较法检验不同树种凋落叶性质和土壤理化性质的差异情况(α=0.05),采用Person相关分析土壤、凋落叶理化性质与微生物生物量、真菌与细菌比值、革兰氏阳性菌与革兰氏阴性菌比值的相关性。不同树种下土壤微生物群落结构的差异,土壤微生物群落结构与土壤理化性质、凋落叶理化性质的关系分别进行主成分分析(principal component analysis,PCA)和冗余分析(redundancy analysis,RDA)。利用Sigmaplot 10.0辅助作图。图表中的数据为平均值±标准差。
2 结果与分析
2.1 不同树种的土壤微生物生物量与群落组成
氯仿-熏蒸法和磷脂脂肪酸法结果均表明,不同树种土壤微生物生物量存在差异。氯仿-熏蒸法结果表明,木荷林土壤微生物生物量碳(408.3 mg·kg-1)、微生物生物量氮(43.1 mg·kg-1)最高,马占相思和台湾相思林土壤微生物生物量碳(分别为204.0 mg·kg-1和154.5 mg·kg-1)、微生物量氮(分别为18.6 mg·kg-1和25.7 mg·kg-1)最低(图1a、b)。
磷脂脂肪酸法结果表明,木荷林土壤总微生物生物量、真菌生物量、细菌生物量均最高,而马占相思和台湾相思林最低;福建柏林土壤真菌/细菌高于其他树种,杉木和马尾松林土壤革兰氏阳性菌与革兰氏阴性菌比值高于其他树种。福建柏林和木荷林土壤真菌生物量(分别为5.5 nmol·g-1和5.2 nmol·g-1)最高,显著高于马占相思和台湾相思林(图2b)。木荷林土壤总细菌生物量、革兰氏阳性菌、革兰氏阴性菌生物量(分别为26.8 nmol·g-1、14.0 nmol·g-1、10.1 nmol·g-1)均最高(图2c),显著高于马占相思和台湾相思林。福建柏林土壤的真菌与细菌比(0.3)显著高于其他树种(图2d),而杉木林和马尾松林的革兰氏阳性菌与革兰氏阴性菌比(分别为1.56和1.6)显著高于其他树种(图2e)。
对6种人工林样地提取的19种磷脂脂肪酸进行主成分分析表明,不同树种人工林的微生物群落组成存在显著差异(图3)。第1、2主成分对微生物群落结构差异的贡献值分别为39.0%、18.9%。其中,马占相思和台湾相思林与杉木林、马尾松林具有显著性差异(P<0.01),与木荷林无显著差异;福建柏林与杉木林、马尾松林具有显著差异(P<0.05),木荷林与3种针叶树种(杉木林、马尾松林、福建柏林)均具有显著差异(P<0.05)。
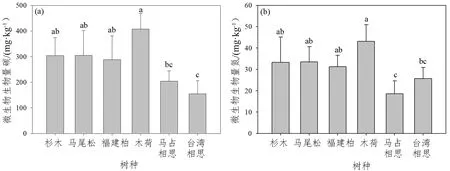
图 1 不同树种微生物生物量(氯仿-熏蒸法)Figure 1 Microbial biomass in different tree species (chloroform-fumigation method)

图 2 不同树种微生物生物量与组成(磷脂脂肪酸法)Figure 2 Microbial biomass and composition in different tree species (phospholipid fatty acid method)

图 3 不同树种土壤中磷脂脂肪酸的主成分分析 Figure 3 Principal component analysis of PLFAs structures in soils of different tree species
2.2 土壤微生物生物量、群落结构与土壤、凋落叶性质关系
由表2相关分析表明,微生物生物量和组成与土壤性质、凋落物质量具有显著相关性。革兰氏阳性菌与革兰氏阴性菌的比值、真菌与细菌比值、总微生物生物量与土壤pH均无显著相关性,而革兰氏阳性菌与革兰氏阴性菌比值、总微生物生物量与土壤含水量极显著正相关(P<0.01),真菌与细菌比值与土壤碳氮比极显著正相关(P<0.01),与土壤含水量显著负相关(P<0.05)。凋落叶碳氮比、木质素/氮与革兰氏阳性菌与革兰氏阴性菌比值均为极显著正相关(P<0.01),与总微生物生物量显著负相关(P<0.05)。
土壤微生物摩尔丰度与凋落叶、土壤理化性质冗余分析结果表明,凋落叶木质素/氮、碳氮比,土壤碳氮比、总碳、pH是影响微生物群落的主要环境因子(图4)。其中,凋落叶木质素/氮、碳氮比与革兰氏阴性细菌(16∶1ω7c, 18∶1ω7c, cy19∶0)负相关,与革兰氏阳性菌(i14∶0, i15∶0, a15∶0, i17∶0, a17∶0)正相关,土壤总碳与放线菌(10Me 16∶0, 10Me 17∶0, 10Me 18∶0)和真菌(18∶1ω9c)正相关,与土壤碳氮比与真菌(18∶1ω9c, 18∶2ω6,9c)与革兰氏阴性细菌(18∶1ω5c)正相关。

表 2 不同树种土壤微生物与环境因子的相关系数Table 2 Correlations between microbial and environmental factors
注:*表示2个变量之间的相关性达到显著水平,P<0.05;**表示相关性达到极显著水平,P<0.01。
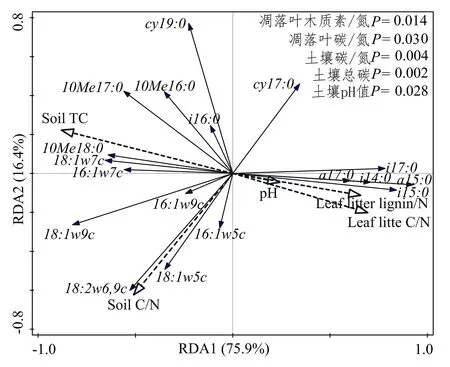
图 4 土壤微生物摩尔丰度与凋落叶、土壤理化性质冗余分析Figure 4 Redundancy analysis of PLFA (% mol abundance), leaf litters and soil properties
3 讨论
3.1 树种对微生物生物量的影响
本研究发现,阔叶树种木荷林土壤微生物生物量高于针叶林土壤微生物生物量。微生物生物量主要受到凋落叶、根系分泌物和土壤养分等的综合影响[18-19,9]。凋落叶是土壤微生物重要的地上碳源,较高质量的凋落叶输入,由于分解较快而且易变性有机质含量高,容易被微生物所利用;相反较低质量的凋落叶输入,由于难分解组分含量较高,一般不易被微生物所分解[6]。凋落叶碳氮比和木质素/氮是表征凋落叶质量的指标,值越高,凋落叶分解越缓慢,释放的矿质氮越少[20]。本研究中,阔叶树种木荷凋落叶碳氮比和木质素/氮显著低于针叶树种,而木荷林的微生物生物量最高。Aponte等[21]也发现,阔叶树种凋落叶质量(碳氮比)高于针叶树种,微生物生物量高于针叶树种。表明,阔叶树种由于较高质量的凋落叶输入为微生物提供了大量易变性碳源,从而提高了土壤微生物生物量。除凋落叶质量外,土壤含水量能影响土壤酶活性和土壤养分状况、氧气及其他气体含量[22],从而影响微生物生物量。本研究中,含水量与微生物生物量极显著正相关,木荷林含水量显著高于针叶林,也可能是造成木荷微生物生物量增高的原因。其他研究也指出针阔树种下微生物生物量存在差异,阔叶树种微生物生物量大于针叶树种[9,23-26],这主要是由于凋落叶性质的不同导致土壤性质的差异,从而影响微生物生物量。
本研究中,马占相思和台湾相思属于固氮树种,但林下土壤微生物生物量最低。丁国昌等[12]和Luo等[27]研究发现,固氮树种可以通过固氮增加土壤氮含量,从而使固氮树种黑木相思微生物生物量高于阔叶树种巨尾桉和针叶树种杉木。而本研究中,两种固氮树种土壤总氮含量高于其他树种,但微生物生物量反而低于其他树种,表明虽然固氮树种可以通过固氮增加土壤氮含量,但并不会增加土壤微生物生物量。这可能主要因为根瘤菌固定的氮更多集中在根际,被植物和固氮菌利用,而不能增加土壤总微生物生物量[13]。
3.2 树种对微生物群落的影响
本研究中,不同树种间土壤微生物群落组成存在显著差异,杉木和马尾松的革兰氏阳性菌显著高于其他树种,福建柏的真菌与细菌比值显著高于其他树种。树种主要通过多种机制影响微生物群落组成:(1)通过凋落叶和根系分泌物的数量和质量直接影响微生物;(2)通过土壤pH、土壤水分、养分和土壤碳氮比等间接影响微生物[28-29]。本研究发现,凋落叶木质素/氮、碳氮比,土壤碳氮比、总碳、pH是影响土壤微生物群落组成差异的主要因子。
以往研究发现,革兰氏阳性细菌偏向于利用难分解有机质,而革兰氏阴性细菌偏向于利用新鲜输入的植物来源有机质[30]。本研究也发现,凋落叶碳氮比、木质素/氮与革兰氏阳性细菌与革兰氏阴性细菌比值极显著正相关,表明凋落叶质量可改变细菌群落。革兰氏阳性菌与革兰氏阴性菌的比值可作为碳有效性的指示因子[30]。本研究中马尾松凋落叶碳氮比和木质素/氮最高,革兰氏阳性菌与革兰氏阴性菌比值也最高,不同树种可能通过其凋落叶质量影响革兰氏阳性菌与革兰氏阴性菌的比值,进一步影响土壤肥力。Ushio等[9]通过研究2种针叶树种和3种常绿阔叶树种也发现,针阔叶树种间土壤微生物群落组成差异显著,针叶树种的革兰氏阳性菌与革兰氏阴性菌比值高于阔叶树种。本研究中福建柏的凋落叶碳氮比低于杉木林,而真菌与细菌比值显著高于杉木林。这主要是由于福建柏林是一种特殊的针叶林,其凋落叶的易分解物质(水溶性物质、半纤维素和粗蛋白)含量高于杉木[31],表层土层中细根生物量显著高于杉木林[32]。
土壤性质在土壤微生物群落形成过程中起着重要的作用。一般来说,微生物群落结构和活性会受到碳源和养分状况的限制,例如细菌比真菌更容易在低碳氮比的土壤中生存[33]。本研究中土壤碳氮比与真菌与细菌比值显著正相关。13C标记的凋落物添加实验证明,真菌与细菌比值高的土壤中,有利于增加土壤有机质含量而降低碳的周转[34]。本研究中,福建柏的碳氮比显著高于其他树种,真菌与细菌比值也显著高于其他树种,表明不同树种土壤碳氮比的差异可能造成真菌与细菌比值的不同,进一步影响土壤有机质含量。本研究还发现,土壤含水量与革兰氏阳性菌和革兰氏阴性菌比值呈正相关关系,杉木和马尾松的含水量大于马占相思,其革兰阳性菌与革兰氏阴性菌的比值也大于马占相思。但木荷含水量高于杉木和马尾松,而革兰氏阳性菌与革兰氏阴性菌比值低于杉木,可能是由于本研究中木荷凋落物质量(纤维素含量、碳氮比)高于杉木,造成革兰氏阴性菌增加,进而降低革兰氏阳性菌与革兰氏阴性菌的比值。本研究中土壤pH对微生物生物量、真菌与细菌比值和革兰氏阳性菌与革兰氏阴性菌比值均无显著影响,这可能是因为本研究中pH范围较窄(4.31~4.71),远小于Rousk等[35]的pH梯度范围(4.17~8.09)。
4 结论
本研究发现不同树种会通过其凋落叶质量(如碳氮比、木质素/氮)以及影响土壤特性(如pH、总碳、总氮含量等)来调控土壤微生物生物量和群落组成。其中凋落物质量高(如低碳氮比和木质素/氮)的树种,由于高质量的凋落物输入能够为微生物提供大量碳源,提高土壤中微生物生物量,改善群落组成,进而对于改善土壤肥力、提高森林生产力具有重要作用。本研究结果能够为中国南亚热带地区人工林的树种优化选择和改善森林生态功能提供科学参考。
