体外模型在中药代谢研究中的应用
2020-04-23王莎刘斯琪丁鹏敏庞月笙陶志王如峰
王莎,刘斯琪,丁鹏敏,庞月笙,陶志,王如峰
(北京中医药大学生命科学学院,北京 102488)
广义的药物代谢,也就是药物的体内过程,是指机体对药物的处置过程,包括吸收(absorption)、分布(distribution)、代谢(metabolism)和排泄(excretion)4 个阶段。代谢使药物的结构发生变化,导致其活化、失活、解毒或增毒,因此,药物代谢对药效和毒性有重要影响[1]。药物代谢研究在提高药物疗效、安全合理用药、新药研发等方面的意义不可忽视。中药由于其成分复杂,疗效和毒副作用受代谢过程的影响更大,其中涉及化学成分的修饰、成分之间以及成分与人体内原有物质的相互作用等。通过追踪中药成分的体内过程,结合药理活性研究,可以发现和辨识中药的有效成分,有助于阐明药效物质及其作用机制。中药成分代谢研究分动物体内实验和体外模拟实验2 种方式。动物体内实验直接采用活体动物作为研究载体,其研究结果更接近中药成分在人体内的真实情况。然而,由于动物体内过程的影响因素较多,体内成分及其代谢产物微量,现有检测和分析技术的局限性,以及种属差异导致的代谢途径和代谢酶的差异等,限制了其在中药代谢特别是代谢机制研究中的应用。但是,体外模拟实验可以通过组合药物代谢模型模拟中药成分在动物体内的代谢过程,再结合药理活性实验,发现活性代谢产物并阐明其作用机制,弥补动物体内实验的不足。
体外模型通常具有替代(replacement)、简化(reduction)、精准(refinement)等特点[2]。首先,用体外研究替代动物体内研究能降低成本、简化操作、精确控制。其次,体外研究排除了体内复杂因素的影响,避免了动物个体差异,对药效物质及其作用机制的研究更加精确。再次,体外研究可通过大规模培养得到足量代谢产物,用于准确结构鉴定和药理活性研究。最后,通过体外研究还可预测和完善体内研究的结果,两者为互补关系。但是,需要对体外模型进行标准化,以便最大程度地模拟生物体内的实际状况。不同体外模型也各有其特点和局限性,在中药代谢研究中应有选择地使用。
1 体外吸收模型及其应用
口服药物的主要吸收场所是小肠,其研究方法分为体外(in vitro)、原位(in situ)和体内(in vivo)法。目前药物肠吸收的体外研究方法主要有2 类,一类是通过分离动物肠黏膜或肠段来评价药物肠吸收,另一类是通过分离人肠细胞并给予模拟的肠环境来分析药物的肠吸收。常用的体外肠吸收模型有大鼠肠囊模型和细胞培养模型,另外还包括尤斯灌流室模型(Ussing chamber)、平行人工膜渗透模型(parallel artificial membrane permeability analysis,PAMPA)、溶出/吸收仿生系统模型(drug dissolution and absorption simulating system,DDASS)等。
1.1 常用的体外吸收模型
1.1.1 大鼠肠囊模型
大鼠肠囊模型包括外翻肠囊模型和非外翻肠囊模型。前者应用较多,后者由于肠囊内部空间狭小、通气条件不易控制、渗透到外测的药物浓度低导致检测困难等原因而应用较少。外翻肠囊模型被用于胃肠段的药物吸收、代谢、外排转运、多药耐药性以及药物相互作用等研究。该模型的优点是吸收表面积较大和存在黏液层;其缺陷在于:翻转小肠时易造成形态破坏,因缺乏血液供应易导致全肠段失活,只能观察药物透过肠壁的浓度,无法计算较详尽的吸收动力学参数等。
外翻肠囊模型适合于药物的分段吸收研究,例如在十二指肠、空肠、回肠和结肠的吸收。根据采用该模型进行的研究结果,中药成分大部分在十二指肠和空肠被吸收,少部分在回肠被吸收,极少部分在结肠被吸收[3-5]。外翻肠囊模型也可作为一种预测中药有效成分的工具,有学者采用该模型研究了吴茱萸汤的吸收成分,结合药效学结果推测吴茱萸碱和吴茱萸次碱是吴茱萸汤治疗偏头痛的有效成分[6]。
1.1.2 细胞培养模型
研究药物吸收的细胞模型较多,主要包括Caco-2、HT29-MTX、MDCK、MDCK-MDR1 等。
1.1.2.1 Caco-2 细胞模型 Caco-2 细胞系来源于人结肠腺癌(human colon adenocarcinoma)上皮细胞,它在体外培养过程中可以自行分化成单层细胞,在形态学、标志酶的功能表达以及渗透性等方面与人成熟的小肠上皮细胞类似。Caco-2 细胞模型在20 世纪80 年代后期建立,是首个被国外制药企业和实验室推广的肠吸收细胞模型,2002 年被国际认定为动物实验替代方法,现在已被广泛应用于药物的肠吸收研究[7]。该模型用带聚碳酸酯膜的Transwell 孔板构建,笔者团队发现高糖培养基DMEM 比基础培养基MEM 更适合该模型[8]。杨秀伟等[9]对细胞培养、种板、相关指标检测等研究后制定了Caco-2 细胞模型标准操作规程(SOP)。
Caco-2 细胞可自发进行上皮样分化且可形成紧密连接,形成肠腔侧(顶端绒毛面)和肠壁侧(底端基底面),并表达刷状缘肽酶、某些细胞色素酶和异构酶,这些特点使其适用于吸收特性和机制研究。笔者团队采用该模型研究了金莲花化学成分的肠吸收,发现酚酸类和生物碱类比黄酮类更易被吸收,并且黄酮类的吸收机制与其母核C-7、C-2 和C-3 位上的取代基有关[10-12]。然而,由于Caco-2 细胞来源于人的结肠癌,仍与小肠黏膜存在差异,例如Caco-2 细胞单层缺少黏液层,代谢酶组成和外排转运体数量也与小肠黏膜有区别。鉴于此,有研究者对Caco-2 细胞模型进行了改进和完善,Lozoya-Agullo 等[13]将 Caco-2/HT29-MTX 共培养、Caco-2/HT29-MTX/Raji-B 三重培养并用模型药物进行验证,发现共培养、三重培养模型更适合药物的转运机制研究。邓旭东[14]将Caco-2 细胞培养于聚醚砜(PES)中空纤维内,构建了一种新型的中空纤维反应器,细胞在7 d 内完成功能分化,其药物吸收、转运能力与传统Caco-2 模型相当。
1.1.2.2 HT29-MTX 细胞模型 HT29-MTX 细胞模型是HT29 细胞系(来源于人结肠癌细胞)与甲氨蝶呤(methotrexate,MTX)共培养后形成。该模型含有分泌黏蛋白的杯状细胞,可模拟小肠的黏液层,用于研究肠黏液对被吸收药物的影响。与Caco-2 细胞相比,HT29-MTX 中的杯状细胞增强了对亲脂性化合物的吸收[15]。Gagnon 等[16]对Caco-2、HT-29、HT29-MTX 细胞模型进行了比较研究,证明HT29-MTX 细胞模型比较适合于细胞与病原体的相互作用研究。
1.1.2.3 MDCK 细胞模型 MDCK 细胞系来源于马丁达比犬肾上皮细胞,由Madin S H 和Darby N B于1958 年从成年雄性西班牙猎犬的肾脏获取[17]。MDCK 接种于 Transwell 半透膜上 2 ~ 6 d 即能分化成柱状单层上皮细胞并形成致密连接,是较为理想的上皮细胞系[18]。在主动吸收药物的渗透性研究中,MDCK 细胞模型的表观渗透系数(Papp)与Caco-2 细胞模型的Papp有良好相关性,两者包含的外排转运体及摄取转运体区别较大[19]。综合比较而言,MDCK 细胞模型更适用于快速膜通透性筛选,也常用作血脑屏障(blood-brain barrier,BBB)模型。MDCK-MDR1 是利用基因转染技术将多药耐药基因 1(multidrug resistance gene 1,MDR1)转染至MDCK 细胞所建立的稳定高表达人源P-糖蛋白(P-glycoprotein,P-gp)的细胞系。将MDCKMDR1 细胞接种于Transwell 的聚碳酸酯膜上生长形成极化的细胞层,可作为研究药物双向转运、快速筛选、转运机制和预测体内吸收的模型[20]。胡亚等[21]通过MDCK-MDR1 细胞模型研究了马钱子生物碱类成分的转运机制,发现马钱子碱、士的宁的吸收以被动转运为主,可能是P-gp 的底物。
综上所述,细胞模型在药物肠吸收研究中应用相对较多,不同细胞培养模型适用范围不同(见表1),在具体应用中可根据研究目的灵活选择。

表1 药物肠吸收细胞模型比较Table 1 Comparison of drug intestinal absorption cell models
1.1.3 尤斯灌流室模型
尤斯灌流室模型由Ussing 于1951 年提出,经过多年发展已应用于药物吸收、物质转运等多种研究领域。该模型操作简捷,可对药物肠段特定位置的吸收与分泌过程,以及药物转运的不同阶段进行研究[25]。通过微电极检测细胞膜的电生理变化,该模型可测量药物在上皮细胞及脉络膜中的转运。该模型既可采用动物的上皮组织细胞,也可采用培养的上皮细胞,适合研究药物的吸收特性和动力学,常用于吸收成分的初筛。李明华等[26]采用该模型发现,京大戟提取物与紫杉醇合用能提高紫杉醇的生物利用度。另有研究者采用该模型研究了两色金鸡菊4 种代表成分在大鼠肠道中的吸收,发现这4 种成分均可被吸收[27]。尤斯灌流室也可以与样品前处理和检测设备在线串联,例如尤斯灌流室-固相萃取-高效液相色谱(Ussing chamber-SPE-HPLC)平台,可提高活性成分的筛选效率[28]。
1.1.4 其他肠吸收体外模型
其他肠吸收体外模型有PAMPA、DDASS 等。PAMPA 将人造磷脂作为生物膜模拟药物吸收转运,对药物膜透过进行研究。该模型能进行高通量药物测定,成本低、灵活性好、检测方便快捷[29],但是,只能检测以被动扩散为吸收方式的药物。DDASS 将药物体外溶出模型和跨膜透过模型有机结合,可用于表征药物变化规律的动力学特点,阐明不同生理状况对药物释放度和吸收率的影响[30]。
1.2 体外吸收模型在中药研究中的应用概况
对于中药及其复方研究而言,体外吸收模型是降低研究复杂性、简化实验步骤的一种有效手段,也可以视作有效成分的初筛工具。目前,中药成分肠吸收研究集中在判断化学成分的吸收难易程度、吸收机制以及吸收过程中的相互作用等方面。其中,重点关注的是活性成分的吸收难易或吸收后含量高的成分,而对于中药复方的整体肠吸收研究较少且欠深入。这主要是由于中药及其复方成分复杂,检测手段难以满足所致。然而,中药是多种成分的复合体,微量成分的疗效贡献现在还没有定论,仅关注主要成分是否能准确反映中药的真实药效有待进一步考察。
多种体外模型联用是目前中药体外肠吸收研究的有效方式,因为各种模型来源不同,在细胞组织特性、转运体的种类和数量方面与真实小肠黏膜存在差异。多模型联用可以相互补充,更接近真实的药物吸收转运过程。笔者团队通过外翻肠囊模型、Caco-2 细胞模型对金莲花的有效成分进行了研究,结果证明除了黄酮类之外,酚酸类和生物碱类也是金莲花的主要体内活性成分[31]。有研究者通过体外-生物信息学-体内(in vitro-in silico-in vivo)联合策略研究了栀子大黄汤的吸收特性及不同组分的相互作用,明确了汤剂的吸收成分,并证明不同成分间存在相互作用[32]。
2 体外分布模型及其应用
药物被吸收后,以游离状态或结合状态随血液循环分布到各组织间液和细胞内液。在药物分布过程中,会受到各种屏障如BBB 和胎盘屏障(placental barrier)的阻碍,药物透过这些屏障的能力是影响其分布的重要因素。
2.1 常用的体外分布模型
目前,药物体外分布模型研究中较为成熟的是BBB 体外模型,研究BBB 对药物分子的透过作用有助于中枢神经系统药物的筛选和开发[33]。目前已建立了多种BBB 体外模型,例如Transwell 模型、永生化内皮细胞模型、三维(3D)微流体模型、微流控芯片模型等。
2.1.1 Transwell 培养模型
Transwell 培养模型可分为单细胞培养Transwell模型、共培养Transwell 模型、三培养Transwell 模型。单细胞培养Transwell 模型是最简单的BBB 体外模型,通过在静态条件下,将单层脑毛细血管内皮细胞培养于可渗透支架上而得到。该模型比较稳定、成本低、允许细胞迁移,但缺少与周围细胞群之间的信号转导,并且静态培养无法模拟体内BBB的血流、剪切力等[34]。为弥补单细胞培养的不足,共培养模型将星形胶质细胞与脑血管内皮细胞共同培养,形成的屏障作用更加紧密。三培养模型是将神经元、星形胶质细胞与周细胞进行共培养。三培养Transwell 模型跨内皮细胞电阻明显升高,紧密连接蛋白表达增强,与体内环境更相似[35]。
2.1.2 永生化内皮细胞模型
永生化细胞是能保留亲代细胞特性且增殖能力强的细胞。Rahman 等[36]总结了36 种利用永生化内皮细胞建立的BBB 模型,应用较广的是人脑微血管内皮细胞系hCMEC/D3、大鼠脑血管内皮细胞系RBE4 和小鼠脑微血管内皮细胞系bEnd.3。hCMEC/D3 能够表达细胞色素P450(cytochrome P450,CYP450)、P-gp、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)等多种酶或转运体。RBE4 可表达几乎所有脑微血管内皮细胞的特征标志物,应用于神经内分泌因子及药物转运机制的研究[37]。Cecchelli 等[38]建立了一种由脐带血造血干细胞分化出的人脑内皮细胞与周细胞共培养的BBB 模型,该模型稳定、重现性好,具有良好的体内外相关性。
2.1.3 3D 微流体模型
微流体模型是基于聚二甲基硅氧烷(polydimethylsiloxane,PDMS)的模型系统,目前已构建出多种微流体BBB 模型[39]。其中一种利用PDMS 制作了由微通道相互连接的16 个独立功能单元,每个功能单元由4 个均一的BBB 模型组成。另一种是将2 个微通道彼此独立地进行共培养,分别作为BBB 外部和内部的微环境。此外,还有三层PDMS 加上分隔2 个腔室的PC 膜及微流体芯片等多种模型。其中,微流体芯片模型在BBB 研究中展现出独特优势,该技术通过连接功能单元和通道网络来操纵微流体,实现微小芯片上的样品制备、反应、分离、检测等操作[40]。利用微流控芯片技术构建易调控,接近在体微环境的体外BBB 模型具有成本低、可控、高通量和可长期监测等优点[41]。3D 微流体模型不仅将脑微血管内皮细胞、星形胶质细胞及周细胞等多种细胞以管状结构包括在内,还考虑到变量因素,如脑皮层毛细血管微血流及内皮细胞间的剪切力。该模型更接近于体内环境,但是制作成本高,高通量模型制备困难,实验操作对结果影响较大,并且尚处于早期开发阶段,有待于进一步优化。
2.2 体外分布模型在中药研究中的应用概况
BBB 体外模型在中药研究中的应用主要涉及2 个方向:一是中药药效成分通过抑制病理状态下BBB 通透性来发挥机体保护作用,例如有研究证明黄芪甲苷、芍药苷通过抑制病理状态下BBB 的通透性而发挥大脑保护作用[42-43];二是中药药效物质促进BBB 通透性而增加药物透过率,例如冰片、大麻二酚能够开放BBB,促进其他药物透过[44-45]。BBB模型在芳香开窍药的研究中应用广泛,这类中药多数通过影响BBB 来发挥作用。王利苹等[46]总结了冰片、麝香、安息香和石菖蒲等芳香开窍药对BBB的作用机制:这类中药“芳香之性走窜”,首先本身易透过BBB;其次能够“引药上行”,促进其他药物透过BBB;再者能够保护病理状态下的BBB。有研究者通过单细胞培养BBB 模型发现,当葛根素与冰片合用时,冰片可使BBB 通透性增强,促进葛根素进入大脑[47]。汤丹丹等[48]采用共培养模型进一步证明冰片能促进葛根素入脑,发挥“引药上行”的作用。
当前的BBB 模型以细胞培养模型为主,在构建模型时除了关注BBB 的结构致密性之外,还要充分考虑药物转运体分布的特异性。中药研究中大部分采用共培养模型,研究者不断从培养条件、动力学、模型材质等方面加以改进,以期更接近人体BBB。
3 体外代谢模型及其应用
药物经吸收、分布后,进入代谢器官被代谢。机体主要的代谢器官是肝脏,在胃肠道中也会发生代谢。体外肝代谢模型在中药代谢研究中应用广泛,肠道菌代谢模型在揭示肠道菌、药物、机体相互作用的研究中被日益重视,胃肠液代谢模型例如人工胃液和人工肠液模型,常用于研究药物稳定性及降解动力学。
3.1 体外肝代谢模型及其应用
肝脏内的药物代谢主要分为2 个阶段:Ⅰ相代谢和Ⅱ相代谢[49]。Ⅰ相代谢主要是引入官能团,脂溶性药物经氧化、还原、水解、水合等反应生成极性基团,其中涉及的酶主要为CYP 450 酶系。Ⅱ相代谢主要进行结合反应,化合物的极性基团或由Ⅰ相代谢生成的极性基团与内源性极性小分子物质结合,其中涉及的酶主要包括葡萄糖醛酸转移酶(UDP-glucuronosyltransferases,UGT)、硫酸转移酶(sulfate transferase,SULT)、谷胱甘肽转移酶(glutathione S-transferase,GST)等。
3.1.1 常见的体外肝代谢模型
体外肝代谢模型分器官、组织、细胞、亚细胞组分、代谢酶5 个层次,目前应用较多的是肝细胞、肝微粒体、肝S9、肝组织胞质溶胶、基因重组酶系等。其他肝代谢模型还包括精密肝切片(precision-cut liver slices,PCLS)、离体肝脏灌流等。
3.1.1.1 肝细胞模型 肝细胞模型包括原代肝细胞、培养肝细胞和肝癌细胞系模型。原代肝细胞应用最早,以后又发展出培养肝细胞和肝癌细胞系。
原代肝细胞:来源于正常肝组织的培养物,在药物研发领域具有独特地位并且被广泛应用,被美国食品药品监督管理局(FDA)誉为CYP450 酶诱导的“黄金标准”[50]。相对于肝微粒体等亚细胞组分,原代肝细胞有完整的细胞膜,保留了完整的Ⅰ相和Ⅱ相代谢酶系统、辅因子以及药物转运体,在药物代谢研究中表现出良好的体内外相关性,是研究药物代谢和转运体相互作用最实用的模型之一。但是,原代肝细胞价格昂贵,在培养过程中可能发生表型改变,难以长期保持其原有特性,而且人源肝细胞个体差异大、保存困难,冻融会降低肝细胞的活力和代谢功能,其贴壁能力也会受到影响[51]。Aghdai等[52]用冷冻保存技术对原代肝细胞进行了优化,证明冻存时加入二硫苏糖醇和果糖,能够增加肝细胞复苏后的细胞活力和功能。通过对细胞处理条件如细胞冻存、细胞培养技术加以改进,原代肝细胞仍然是研究药物体内代谢的最佳体外模型[53]。
培养肝细胞:常用的肝细胞培养方法有凝胶包埋培养、聚球体培养以及2D 和3D 培养。肝细胞凝胶包埋培养和聚球体培养均属于肝细胞组织化培养,两者的肝细胞存活率及代谢酶活性均高于单层培养,而且聚球体培养高于凝胶包埋培养[54]。在体外药物代谢及清除率研究中,2D 和3D 培养比常规培养更具优势。2D 培养是将肝细胞培养于一层固相细胞外基质上,但肝细胞在坚硬的固相物上培养容易导致肝功能快速丧失,而3D 培养则可以规避该缺点。3D 培养包括多细胞球培养、共培养、肝器官芯片等[55-56]。例如,HepatoPac 是一种人原代肝细胞和小鼠纤维母细胞的共培养模型,可在7 d 内保持肝细胞的代谢功能。Chan 等[57]采用该模型测定了17种成分的体内清除率,证明该共培养模型可精准地预测某些药物的体内清除率。
永生化肝细胞:因其无限可培养性和表型稳定性,永生化肝来源的细胞系已被建议作为原代肝细胞的理想替代模型。但是,永生化肝细胞与原代肝细胞的最大区别是表达的代谢酶活性较低[58]。人肝源性细胞系包括HepaRG、HepG2、HCC-T 和Hep3B 等。HepaRG 细胞是一种从人肝癌细胞获取并建立的肝癌细胞系,用二甲基亚砜(DMSO)处理后可进行分化,分化的HepaRG 细胞培养物通常是肝样细胞(约50% ~ 55%)和胆管样上皮细胞的混合物[59]。该细胞系中CYP450 酶表达水平和活性明显弱于原代肝细胞,但是比HepG2 细胞更接近人肝细胞的水平,并且HepaRG 细胞对细胞毒性物质的敏感性高于HepG2 细胞[60]。HepG2 细胞系最初来源于一例15 岁白种人的肝癌组织,其功能特性已被广泛研究。该细胞系能够模拟多种肝功能,如血浆蛋白的合成和分泌、胆固醇和三酰甘油代谢、脂蛋白代谢和运输、胆汁酸合成、糖原合成等。HepG2 细胞系的主要缺点是药物代谢酶和转运蛋白的表达有限,大多数药物代谢CYP基因表达丰度较低,而且经过长期培养后,该细胞系的蛋白表达水平产生差异,不利于实验数据重现[61]。
3.1.1.2 肝细胞亚组分模型 肝微粒体、肝S9、肝胞质溶胶均属于肝细胞亚组分,可通过差速离心法制备(见图1)[62]。
肝微粒体:含有内质网亚细胞组分,包括CYP450 酶和少量Ⅱ相代谢酶。由于其制备过程简单、易于贮存、重现性好,肝微粒体被广泛用于药物代谢及药物相互作用研究。不同种属来源的肝微粒体的代谢研究结果存在差异,人肝微粒体应该是最理想的,但是其来源有限。刘文莉等[63]对香柑内酯在7 种不同肝微粒体(人、恒河猴、食蟹猴、豚鼠、大鼠、小鼠、比格犬)中的代谢差异进行了研究,发现该化合物在比格犬、大鼠、人肝微粒体中的代谢较为接近。一般认为肝微粒体代谢中主要发生Ⅰ相代谢,Ⅱ相代谢产物很少,这与制备的肝微粒体的转化效率有关。当肝微粒体转化效率足够高时,Ⅱ相代谢产物也经常被检测到,肝微粒体制备前实验动物的代谢酶诱导和实验过程中还原型辅酶系统NADPH 的加入对检测结果的影响很大[64-65]。
肝S9:肝组织去除匀浆沉淀物后的混悬溶液,其主要特征是含有较多Ⅱ相代谢酶,拥有比较完整的代谢功能,提供的代谢轮廓比肝微粒体更全面。然而,肝S9 的代谢酶活性普遍较低,反应体系灵敏度较差,部分代谢物无法检测到[66]。肝S9 中膜蛋白(CYP、UGT 和转运蛋白)浓度低于肝微粒体,但是其中的细胞质或细胞骨架相关蛋白的浓度高于肝微粒体[67]。笔者团队采用藜芦酸葡萄糖酯作为底物对肝微粒体和肝S9 代谢进行了比较研究,发现肝S9 模型对酯类的代谢能力高于肝微粒体模型[68]。
肝胞质溶胶:肝细胞匀浆经超速离心除去所有细胞器和颗粒后的上清液部分,主要含Ⅱ相代谢酶,Ⅰ相代谢酶较少。肝胞质溶胶所含Ⅰ相代谢酶比肝微粒体少,但Ⅱ相代谢酶多于肝S9,通常应用于单个可溶性酶活性、特定代谢途径的研究。肝胞质溶胶也可作为肝微粒体的辅助手段来确定药物代谢途径[69]。
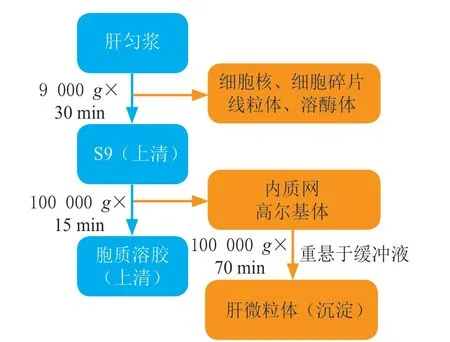
图1 差速离心法制备肝细胞亚组分示意图Figure 1 Schematic diagram of hepatocyte subfractions prepared by differential centrifugation
3.1.1.3 基因重组酶系 基因重组酶系是指利用基因工程及细胞工程方法,将人源的CYP450 或UGT 基因转染到大肠埃希菌或昆虫细胞中进行表达后产生的重组酶系。通过该酶系,能够定性研究酶系中单个亚型对整个代谢反应的相对贡献和代谢途径。基因重组CYP450 酶系与肝微粒体实验关联性好,适合对药物代谢进行微观化和细节化的研究[70]。但是,该酶系价格昂贵、成本高,与人体内相同酶的丰度也有较大差异,且用重组酶得到的代谢结果,不能直接外推到人体代谢。
3.1.1.4 其他体外肝代谢模型 精密肝切片应用于肝功能研究始于Krumdieck 切片机的引入[71],之后van Midwoud 等[72]建立了精密肝切片实时高效液相色谱分析系统(on-line HPLC analysis system)。精密肝切片保留了大部分肝药酶及细胞器,所有细胞类型均存在,并且有各种细胞类型之间的细胞通讯。但是肝切片活力维持时间仅为5 ~ 7 d,不适于长周期的代谢研究,且切片技术有待进一步提升。该技术现在已被用于药物代谢和转运、药物对酶的抑制或诱导、生物代谢速率动力学等研究[73],在肝毒性研究中也有报道,有研究者利用该技术发现何首乌细胞毒成分只有在高浓度时才有肝毒性[74]。离体肝脏灌流是将完整的肝脏置于体外,使用人工方法进行灌注以保持肝脏的组织结构和生理功能,在一定条件下离体肝脏与药物互相接触,确定药物在肝脏中的变化。该模型在器官水平上研究药物代谢,可以完整地揭示药物在肝脏中的代谢通路,但是实际操作中需要一定的环境条件,操作复杂且受时间的限制[75]。
3.1.2 体外肝代谢模型在中药研究中的应用概况
体外肝代谢模型的每个层次各有其适用范围,在中药代谢研究中应用较多的是亚细胞组分模型,例如肝微粒体和肝S9 模型,其中肝微粒体模型应用最多。笔者团队利用肝微粒体模型研究了金莲花中黄酮类和酚酸类化合物的肝代谢,发现这2 类成分既可发生羟基化、脱烷基等Ⅰ相代谢,又可发生糖基化、乙酰化等Ⅱ相代谢[65-66]。杨秀伟团队在中药成分的肝微粒体代谢研究方面也做了大量工作,制备了一系列代谢产物并进行了精准的结构解析[76-77]。汪祺等[78]采用肝微粒体模型研究了何首乌的肝毒性,阐明了大黄素、羟基大黄素等成分通过抑制UGT 1A1 而导致肝毒性的机制。郑梅等[79]采用肝微粒体模型研究了六味地黄丸与硝苯地平的相互作用,发现六味地黄丸与硝苯地平共孵育前后代谢指纹图谱无明显差异。
3.2 体外胃肠道代谢模型及其应用
胃肠道特定的酸碱环境和其中容纳的微生物所分泌的代谢酶对化学成分有修饰作用,药物的胃肠道代谢越来越受到重视。
3.2.1 常用的体外胃肠道代谢模型
体外胃肠道代谢模型主要有肠道菌代谢模型、肠微粒体代谢模型和人工胃肠液模型。
3.2.1.1 肠道菌代谢模型 肠道菌群是人和动物肠道内普遍存在且构成极为复杂的微生物群体,在肠道代谢过程中起重要作用[80]。肠道菌群含有丰富的代谢酶,可催化肠道内化学成分发生如水解反应、氧化反应、还原反应、含氧化合物向含氮化合物转化反应、聚合反应等各种反应[81]。肠道菌群中绝大多数细菌为厌氧菌,需要严格的厌氧条件,对环境的酸碱度、营养物质要求也比较苛刻。构建与体内真实情况最接近、实验结果重现性好的肠道菌培养模型是体外肠道菌代谢研究的关键。常见的肠道菌体外实验体系有分批培养、连续培养、多级连续培养等。笔者团队对肠道菌代谢的动力学进行了研究,发现模型达到稳态需要一个连续传代过程,并且肠道菌对底物的代谢过程一般表现为启动、加速和完成3 个阶段,这与其增殖曲线有关[82-83]。杨秀伟等[84]建立了人肠道菌代谢模型的标准操作规程,对培养基的配制、灭菌,人肠道混合菌株/菌丛的制备,菌株代谢活性筛选等实验操作进行了标准化。Molly 等[85]基于连续发酵模型建立了人肠道微生态模拟器,该系统由胃、小肠、升结肠、横结肠、降结肠5 个模拟反应单元组成,研究者利用该反应器研究了不同营养组分对肠道菌群的影响,通过测定菌群数量、酶活性等指标,证明该模型与人体内数据相吻合。随后有学者设计了电脑控制发酵系统,通过电脑控制相互连接的单元,使代谢物能在单元间流动[86]。
3.2.1.2 肠微粒体代谢模型 肠微粒体代谢模型是由肠微粒体与药物在模拟人体生理条件下进行生化反应的体系。肠微粒体可通过差速离心法制备,其CYP450 酶系统可催化多种药物进行氧化或还原反应。该模型具有制备技术和操作简单、代谢反应快、重现性好等优点,不足之处在于缺乏膜转运体及部分酶系统[87]。有研究者采用肝、肠微粒体对玳玳果效应组分新橙皮苷、柚皮苷进行了代谢比较,发现肝是新橙皮苷、柚皮苷的主要代谢部位[88]。某些成分在肠吸收过程中确实会被肠黏膜细胞中的代谢酶代谢,例如槲皮素及其衍生物会被代谢成酚酸等[89],但由于肠吸收的过程非常短暂,这方面的研究还没有引起足够重视。
3.2.1.3 人工胃肠液代谢模型 胃液中含有胃蛋白酶、黏液蛋白,肠液中含有胰蛋白酶、胆汁和肠系膜分泌液,这些物质均可参与药物代谢。口服药物在胃中与胃蛋白酶作用,蛋白质被分解成小肽,苷类化合物被代谢为苷元,而酯类化合物可被肠液水解。人工胃肠液模型主要应用于单体成分的胃肠液稳定性研究[90-91],基于药物在胃肠液的稳定性可进一步开展药物剂型、质量检测等研究。根据笔者的经验,药物成分在胃肠液中的变化不如预期明显,这可能与这些成分在胃中停留时间短,肠液pH 比较温和有关。
3.2.2 胃肠道代谢模型在中药研究中的应用概况
肠道菌群对中药成分的代谢有助于其吸收,这方面的研究已成为中药药效物质研究中不可忽视的环节。笔者团队开展了一系列研究来帮助明确中药的药效物质[31,82,92-94]。然而,不同个体体内的肠道菌群存在差异,由此导致中药成分在不同个体体内的代谢轮廓不同。例如某些能够代谢碳苷类化合物的细菌只存在于特定的个体内,导致不同个体对此类成分的生物利用度存在差异[95]。采用体外肠道菌代谢模型最好区分人种、年龄、性别、体质、饮食习惯、生理和病理状态等,需要在这些方面进行深入研究。
近年来随着肠道菌群研究的不断升温,肠道菌代谢模型已被用于肠道菌群结构研究,与代谢组学、宏基因组学、转录组学技术相结合,在中药作用机制研究中取得了不少值得关注的结果。有报道称,中药可通过调节肠道菌群发挥扶正祛邪作用,有助于肠道疾病、心血管疾病、肝脏疾病及神经性疾病的防治[96]。倪雅丽[97]通过分析代谢组学及肠道微生物表达谱的差异,明确了益智仁对蛋白表达、代谢通路的影响,阐释了益智仁治疗糖尿病肾病的机制。刘永平等[98]对肾病综合征患者肠道菌群进行了宏基因组学分析,发现患者的肠道菌群物种多样性显著减少。对现有的肠道菌代谢模型加以改造,开展中药-肠道菌群-人体的相互作用研究可能是未来肠道菌群研究的一个热点。另外,肠道菌群规模宏大,其自身代谢产物也会对人体健康产生影响[99],这方面的研究也值得期待。
4 体外排泄模型及其应用
药物排泄是指药物以原形或代谢物的形式,通过排泄器官排出体外的过程。药物排泄的主要方式为肾脏排泄和胆汁排泄。极性相对较小、相对分子质量小的药物主要通过肾脏排泄,肾脏中的转运体对许多内源性或外源性物质的消除有很大贡献[100]。极性大、相对分子质量大的药物主要通过胆汁排泄,胆汁排泄以主动转运为主,一些中药例如黄连、金银花、生姜、甘草和赤芍等通过促进胆汁分泌,起到利胆作用[101]。
4.1 常用的体外排泄模型
目前报道的体外药物排泄模型较少,常用的有离体肾脏灌流(isolated perfused kidney,IPK)模型和肝细胞三明治培养(sandwich-cultured hepatocytes)模型。
4.1.1 离体肾脏灌流模型
IPK 是一种在不受血液循环系统和神经体液调节影响的条件下,特异性地对肾脏排泄进行研究的技术。在建立之初,该模型用于肾脏的生理生化功能研究,经过多年发展,已广泛应用于药物的肾脏排泄、代谢、清除研究,也可用于研究药物之间的相互作用和肾毒性[102]。IPK 的优点在于可保留完整肾功能的前提下排除体内复杂因素的干扰,并且可对灌注液蛋白浓度、pH 等多种因素进行控制,能研究不同因素对肾脏功能的影响;其缺陷在于灌注液流速较高以及远端肾小管功能减弱等[103]。
4.1.2 肝细胞三明治培养模型
肝细胞三明治培养是将新鲜分离或冷冻保存的原代肝细胞接种于2 层基质(下层为胶原,上层为人工基底膜)之间进行培养[104]。三明治结构培养肝细胞可以改善肝细胞的形态和生存能力,重建体外肝细胞极性,形成极性的基底膜和类胆小管结构,分别介导细胞吸收和胆汁外排[105]。该模型是研究肝胆药物转运体功能及其调控的首选体外模型。沈国林等[106]采用该模型研究了P-gp 介导的洛哌丁胺胆汁排泄,发现洛哌丁胺与P-gp 抑制剂合用可显著降低洛哌丁胺经胆汁的排泄。
4.2 体外排泄模型在中药研究中的应用概况
当前中药成分的排泄研究还主要以动物实验为主,通过收集动物粪便、尿液或胆汁等方法进行研究。由于体内实验的影响因素较多,使中药的排泄研究还相对不够深入,特别是排泄机制的研究有待加强。采用体外模型进行的相关研究较少,律广富等[107]应用离体肾脏灌流模型研究了玉米须总黄酮的利尿作用,证明玉米须总黄酮能促进尿酸在肾脏中的排泄,改善尿酸对肾脏的损害。相信未来随着上述模型的日益完善和新模型的不断开发,中药成分的排泄研究水平会逐渐提升。
5 整体体外代谢模型及其应用
药物代谢是一个复杂而连续的过程,前述体外模型只能模拟某一阶段或层面的代谢过程,在连贯性和整体性方面与体内研究尚有差别。现代科学技术的发展促进了整体体外模型的建立,在近些年产生了一些前沿技术,如多“器官芯片”系统、微流控芯片技术等。
5.1 多“器官芯片”系统
多“器官芯片”系统也被称为“询问器(interrogator)”,是将多个人体“器官芯片”集成至一个自动化系统中,生成“器官芯片”平台,用于体外药代动力学和药效学研究。首个“器官芯片”——肺芯片由Huh 等[108]建立,它是一种微流体培养装置,由透明的柔性聚合物组成,其中包含2 个由多孔膜隔开的平行中空通道,器官特异性细胞培养于其中一个通道的膜的单侧,而血管内皮细胞在另一通道培养以重现血管,每个通道均灌注细胞类型特异性培养基。多孔膜允许2 个通道相互连通和进行物质交换,如细胞因子、生长因子、药物以及由器官特异性代谢产生的代谢产物等[109]。为了验证该系统是否能够模拟人体环境,Herland 等[110]把人的肠道芯片、肝脏芯片和肾脏芯片连接起来,将尼古丁加入系统中模拟口服药物的代谢过程。由系统得出的尼古丁到达不同组织通道所需的时间、各组织通道中最大尼古丁浓度,以及计算机模拟模型中的肝芯片清除率均与人体用药之后的测量值非常接近。该研究者还使用肝脏芯片、肾脏芯片和骨髓芯片连接的“器官芯片”装置对顺铂的药效学进行了考察,发现顺铂的肝肾代谢及清除率与顺铂化疗患者的相当,而且肾脏芯片中的细胞表达了与化疗期间人体肾脏相同的生物损伤标记物,说明多“器官芯片”系统能够对药物的吸收、分布、代谢、排泄和毒性进行精准预测。
5.2 微流控芯片技术
Jie 等[111]自主研发了双层微流控芯片,芯片上层蛇形中空纤维内腔接种Caco-2 细胞,模拟肠道药物吸收和运输行为;芯片下层接种HepG2 细胞,模拟肝脏进行代谢相关研究。研究者以抗癌药物染料木素和达卡巴嗪对该微流控芯片进行了测试验证,证明其可维持细胞的良好代谢能力,可作为有效的代谢模型用于药物联合机制研究。该技术可模拟肠肝行为,与质谱联用可分析组合药物的吸收和代谢。Choucha-Snouber 等[112]建立了肝肾共培养微流体生物芯片模型,以HepG2/C3a 和HepaRG 细胞系模拟肝,以MDCK 细胞系模拟肾,并通过异环磷酰胺经肝代谢产生肾毒性化合物的代谢过程证明了肝肾共培养模型的可用性。有研究者又进一步建立了肠、肝、皮肤、肾4 种器官共培养芯片,通过对各个模拟器官的功能测定证明了该共培养芯片在28 d 内具有稳定的代谢能力[113]。
6 结语与展望
经历数十年的发展,传统的体外模型日益完备,在中药代谢研究中发挥了积极作用。然而,大多数体外模型是在西药的代谢研究中建立的,适用于单一或少数成分的代谢研究。中药多以复方用药,成分复杂,代谢产物多种多样,还存在成分间的相互作用,这些均增加了研究难度,也对体外模型的构建和改良提出了更高要求。第一,需要构建和完善适合中药特色的体外模型,适应中药成分体内过程复杂的特点,例如引入放射性同位素示踪技术等先进的检测技术,提高检测的灵敏度和准确性,达到高通量、高内涵、精准和实时检测的目标。第二,现在的药物代谢研究已不再单纯是中药成分的代谢产物研究,已经扩展到“组学”范畴,例如代谢组学、基因组学、蛋白质组学,并且与机体的症候/疾病相联系诞生了方证代谢组学,如何建立模拟机体内复杂代谢网络的体外代谢模型,甚至是病理/症候代谢模型,是对科研人员的考验。第三,中医药强调整体观念,能精准反映体内过程的整体体外模型,例如上文提到的多“器官芯片”系统,微流控芯片技术等对于研究中药代谢也必不可少。虽然体外药代模型在中药研究中的应用尚需改进,但是随着科学技术的不断进步,其构建会愈发完善,研究结果会越来越逼近人体内的真实代谢轮廓,成为研究中药代谢必不可少的手段。
