SiO2-CaO-P2O5-CoFe2O4磁性玻璃陶瓷空心微球的制备及其药物缓释性能研究
2020-04-23巫海燕罗文钦林佳丽杨佳文
巫海燕, 李 彬, 罗文钦, 李 菲, 林佳丽, 黄 薇, 杨佳文
(1.湖州师范学院 生命科学学院, 浙江 湖州 313000; 2.湖州师范学院求真学院, 浙江 湖州 313000)
随着纳米技术的发展,多功能纳米材料在生命科学领域的应用越来越受到人们的关注.多孔纳米颗粒,如多孔SiO2微球在药物缓释中表现出巨大的应用前景[1-3].而磁性纳米颗粒,如Fe3O4在肿瘤靶向磁热疗方面表现出巨大潜力[4].Fe3O4@SiO2纳米晶集药物输运和靶向磁热疗于一体,在肿瘤治疗中的应用受到许多研究者的重视[5].但这类材料的生物相容性差,妨碍了其在生命科学领域中的进一步应用[6-7].组分中包含CaO、P2O5的玻璃材料,如SiO2-CaO-P2O5玻璃在人体液中可以矿化出存在于骨骼中的羟基磷灰石相,因而具有很好的生物相容性,在骨科和牙科的修复性材料、骨组织工程、癌症治疗等领域得到了广泛的应用[8-9].同时,SiO2-CaO-P2O5多孔玻璃空心微球也表现出很好的生物相容性和优异的药物装载与缓释性能[10-11].CoFe2O4是另一种优异的铁磁性材料,具有高饱和磁化强度、化学稳定性好、矫顽力高等特性,广泛用于光催化、生物细胞成像等领域[12-13].如果在SiO2-CaO-P2O5中添加CoFe2O4磁性晶粒,可以得到具有磁性、生物活性和药物缓释性能的新型玻璃陶瓷材料.
本文采用共沉淀-模板法制备SiO2-CaO-P2O5-CoFe2O4系玻璃陶瓷空心微球,系统研究SiO2、CaO及CoFe2O4组分含量对磁性空心微球形貌和晶化的影响,并将茶碱作为药物模型,研究SiO2-CaO-P2O5-CoFe2O4空心微球的药物缓释行为.
1 实验材料与方法
1.1 试剂
正硅酸乙酯(分析纯,阿拉丁化学试剂有限公司)、Ca(NO3)2·4H2O(分析纯,江苏永华精细化学品有限公司)、Fe(NO3)3·9H2O(分析纯,国药集团化学试剂有限公司)、氨水(分析纯,杭州长征化学试剂有限公司)、CoCl2·6H2O(分析纯,上海试四赫维化工有限公司)、聚乙烯吡咯烷酮(PVP)过硫酸钾(分析纯,优耐德引发剂(上海)有限公司)、氢氧化钠(分析纯,杭州萧山化学试剂厂)、无水乙醇(分析纯,杭州长征化学试剂有限公司)、十六烷基三甲基溴化铵(CTAB)(分析纯,上海伯奥生物科技有限公司).
1.2 材料制备
采用乳液聚合法制备聚苯乙烯(PS)模版小球.取14 mL苯乙烯,分别用25 mL NaOH溶液和去离子水洗涤4次,去除苯乙烯试剂中的稳定剂.接着将洗涤完毕的苯乙烯放入三颈烧瓶中,称取0.5 g聚乙烯吡咯烷酮(PVP)溶于100 mL蒸馏水后加入苯乙烯中.称取0.3 g过硫酸钾(KPS)溶于20 mL蒸馏水,加入上述混合液中,然后在40 ℃下持续通氮气30 min将溶液中的空气排出.接着将温度升到70 ℃,待三颈烧瓶中溶液由透明变为淡乳白色后停止通氮气,反应持续24 h后停止.得到的白色沉淀用无水乙醇洗涤3次,最后分散于无水乙醇中备用.
取50 mg PS小球分散于25 mL蒸馏水和25 mL无水乙醇混合液中,在40 ℃油浴锅中搅拌混合均匀.称取0.078 g 十六烷基三甲基溴化铵(CTAB)溶于10 mL蒸馏水中,然后加入上述溶液中,同时加入1 mL NH3·H2O(28 wt%).量取一定量的TEOS溶于5 mL无水乙醇中,反应25 min.接着称取Ca(NO3)2·4H2O、Fe(NO3)3·6H2O、CoCl2·6H2O,加入10 mL水溶解在烧杯中,缓慢滴入烧瓶,继续反应24 h后冷却至室温.将沉淀离心,并用无水乙醇洗涤1次,沉淀干燥后在马弗炉里煅烧,先在600 ℃下将PS小球分解,再将样品放在马弗炉中850 ℃保温2 h得到最终产品.
1.3 表征
采用差示扫描量热法(DSC)分析玻璃微球的热行为;采用XD-6 X射线粉末衍射仪分析产品的晶相组成;使用日立S-3400N扫描电子显微镜(SEM)分析样品的微观结构;通过能谱仪(EDS)分析样品微区成分元素的种类和含量.
1.4 药物缓释实验
将茶碱(TP)用作药物模型,研究玻璃陶瓷空心微球的药物缓释行为.首先将100 mg的TP溶解于10 mL去离子水,达到10 mg·mL的浓度.然后将30 mg SiO2-CaO-P2O5-CoFe2O4空心微球在超声下分散于10 mL的TP溶液中,再将混合物在真空下连续超声干燥,直至去离子水完全蒸发.将所得粉末用去离子水洗涤以除去残留的TP.在36.5 ℃下将45 mg装载了TP的玻璃陶瓷空心微球分散于45 mL的模拟体液中测定药物释放行为.模拟体液的配制步骤[14],在选定的时间间隔内,通过离心取出模拟体液的等分试样(1 mL),并用1 mL新鲜模拟体液补充.药物含量通过紫外分光光度仪测定239 nm处TP的吸光度来测定.药物释放行为表示为不同时间的药物释放百分比.
2 结果与讨论
图1为SiO250%- CaO25%-P2O55%-CoFe2O420%玻璃微球的TG和DTA曲线.从图1可以看出,样品在30~200 ℃有一个明显的6.4 wt%失重,伴随着较强的吸热峰(峰值位置在70 ℃),这对应着样品中吸附水的失去.同时在480~670 ℃之间有3 wt%的失重,这是由PS微球热分解产生的.随着温度的升高,850 ℃附近出现较明显的放热峰,在这个过程中没有明显的失重,结合XRD测试可知,该放热峰为CoFe2O4晶化峰.
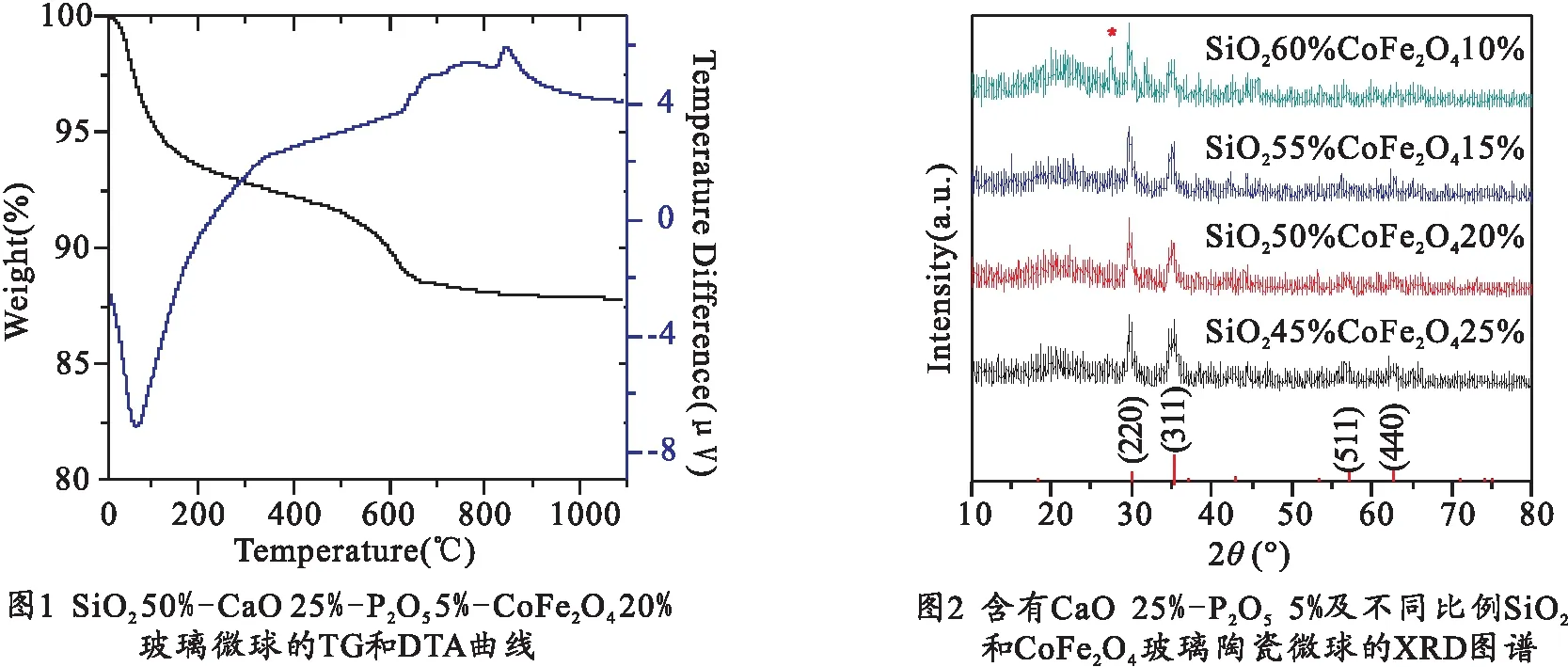
Fig.1 The TG-DTA curves of SiO250%-CaO 25%-P2O55%-CoFe2O420% glass microspheres Fig.2 The XRD patterns of glass-ceramic micropheres with CaO 25%-P2O55% and different SiO2, CoFe2O4contents
下面分析不同组分含量对空心微球晶化行为的影响.图2为保持CaO含量25%不变,CoFe2O4和SiO2相对含量不同的样品XRD图谱.从图2可以看出,经过800 ℃煅烧2 h后的不同组分样品,在2θ为29.8°、35.0°、57.0°和62.7°时出现衍射峰,这些衍射峰的位置和强度与CoFe2O4的XRD标准卡(JCPDS No. 22-1086)一致,表明晶化得到了CoFe2O4晶相.当微球中SiO2含量为45%~55%,相对应的CoFe2O4含量为25%~15%时,XRD谱图上只出现CoFe2O4的衍射峰,没有其他杂峰出现,表明此时晶化得到的为CoFe2O4纯相.当Si含量提高到60%时,出现SiO2的杂质峰(图2中用星号标示).
同时,保持SiO2含量不变,研究CaO和CoFe2O4相对含量的变化对玻璃晶化行为的影响.图3为SiO250%比例保持不变,CaO和CoFe2O4相对含量不同的样品XRD图谱.从图3可以看出,不同CoFe2O4含量的样品都析出CoFe2O4晶相.随着CoFe2O4在样品中组分含量的增加,CoFe2O4(311)晶面衍射峰的相对强度逐渐增强,表明CoFe2O4含量的增加有利于玻璃陶瓷中CoFe2O4晶粒沿(311)方向择优生长.
图4是用乳液聚合方法制得的PS小球在扫描电镜(SEM)下的照片.从图4可以清晰地看到PS小球的形貌特征,呈现出明显的球状,粒径大约为260 nm,颗粒尺寸分布均匀.
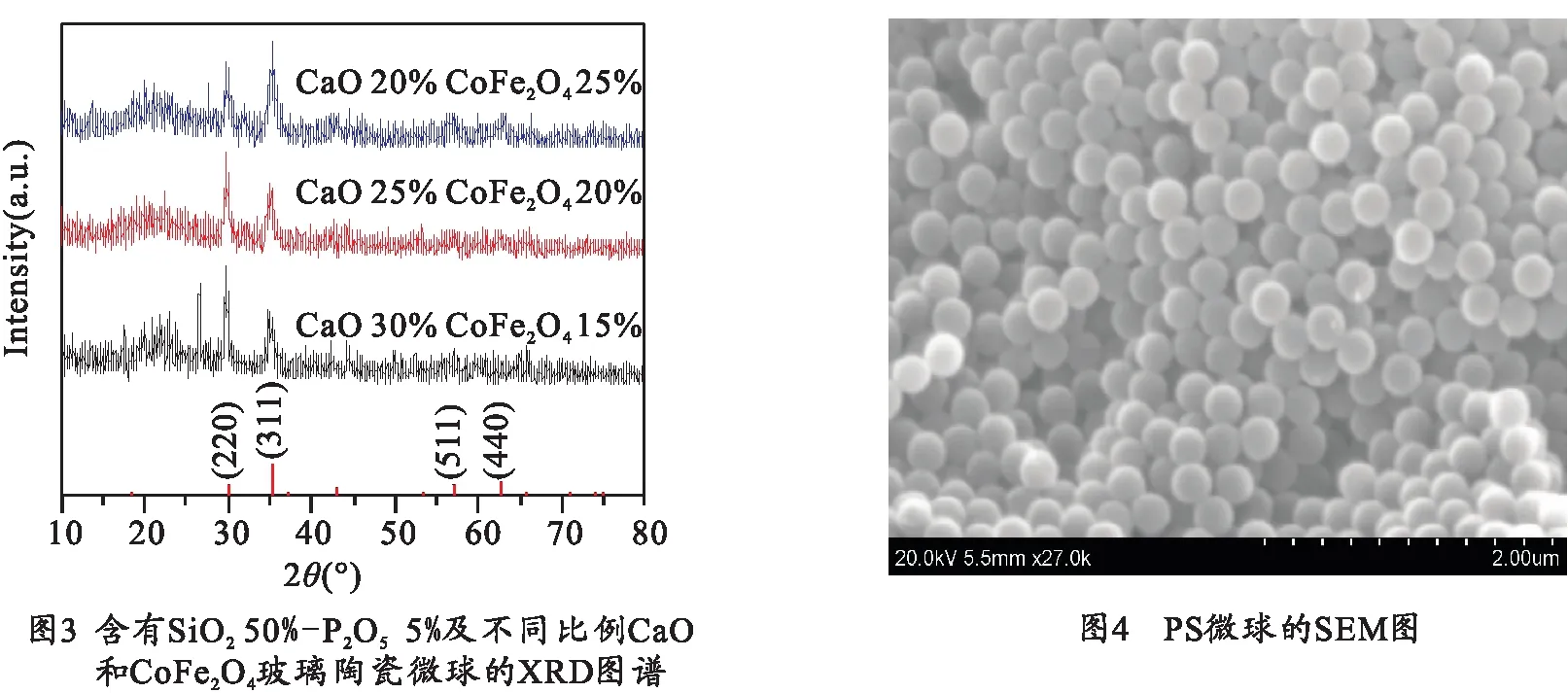
Fig.3 The XRD patterns of glass-ceramic micropheres with SiO250%-P2O55% and different CaO, CoFe2O4contents Fig. 4 SEM image of the obtained PS microspheres
如图5所示,在PS小球上进行包覆实验,选定样品组分P2O55%、CaO 25%保持不变,改变SiO2和CoFe2O4的百分含量,探究样品结构形貌的改变.从图5可以看出,经包覆的样品经过马弗炉煅烧后出现有团聚现象.如图5(a)所示,对于SiO245%-CaO25%-P2O55%-CoFe2O425%玻璃,经过800 ℃煅烧后,微球还能保持较好的球状,颗粒间黏连程度较轻,颗粒大小均匀,粒径在300 nm左右.从破裂的小球可以看出,获得的微米球为空心结构.随着SiO2含量的增大,空心微球间的团聚程度逐渐增大,且球状颗粒的破裂情况加剧,说明组分中SiO2含量的增加会加剧球状颗粒的脆性.从图5(d)可以看出,当SiO2含量达到60%时,获得的球形颗粒数量减少,出现大块团聚的破碎处.

Fig.5 The SEM images of the glass-ceramic micropheres with CaO 25%-P2O55% and
图6为SiO250%比例保持不变的不同样品SEM图.选定样品组分P2O55%、SiO250%保持不变,改变CaO和CoFe2O4相对百分含量,研究样品结构形貌的改变.图6中的(a)、(b)、(c)分别是CaO含量为20%、25%、30%的SEM图.从图6可以看出,不同组分的样品,颗粒还能保持球状,但随着CaO相对含量的提高,颗粒的形貌更加完整,颗粒间的粘连减弱.说明在玻璃组分中,一定含量的CaO有助于生成玻璃陶瓷网络骨架的稳定,并能降低颗粒间的烧结粘连.这主要是因为玻璃的CaO是参与形成骨架结构的,而CoFe2O4则起掺杂剂作用,CoFe2O4含量的提高会破坏玻璃陶瓷骨架的稳定性.

Fig.6 The SEM images of the glass-ceramic micropheres with SiO2 50%-P2O5 5% and
本文对SiO255%-CaO20%-P2O55%-CoFe2O420%空心微球做了EDS成分分析.由图7的EDS图谱表明,空心微球的主要元素组成为硅、氧、钙、铁、钴和磷.通过定量分析,得到不同元素的摩尔含量见图7.值得注意的是,在纳米球中探测到铁、钴和钙的含量比计算的化学计量低得多.这可能是由于在共沉淀过程中Ca、Fe和Co离子没有完全沉淀.从图7可以发现,空心微球玻璃陶瓷中Fe和Co的摩尔比接近2∶1,这与CoFe2O4分子中Fe和Co的比例一致,表明玻璃陶瓷中大部分的Fe和Co主要以CoFe2O4晶粒的形式存在.需要指出的是,Ca和P的含量会影响空心微球的生物活性,Ca和P的含量偏低会导致制备的微晶玻璃生物活性较弱.这也是我们下一步实验要重点解决的问题.
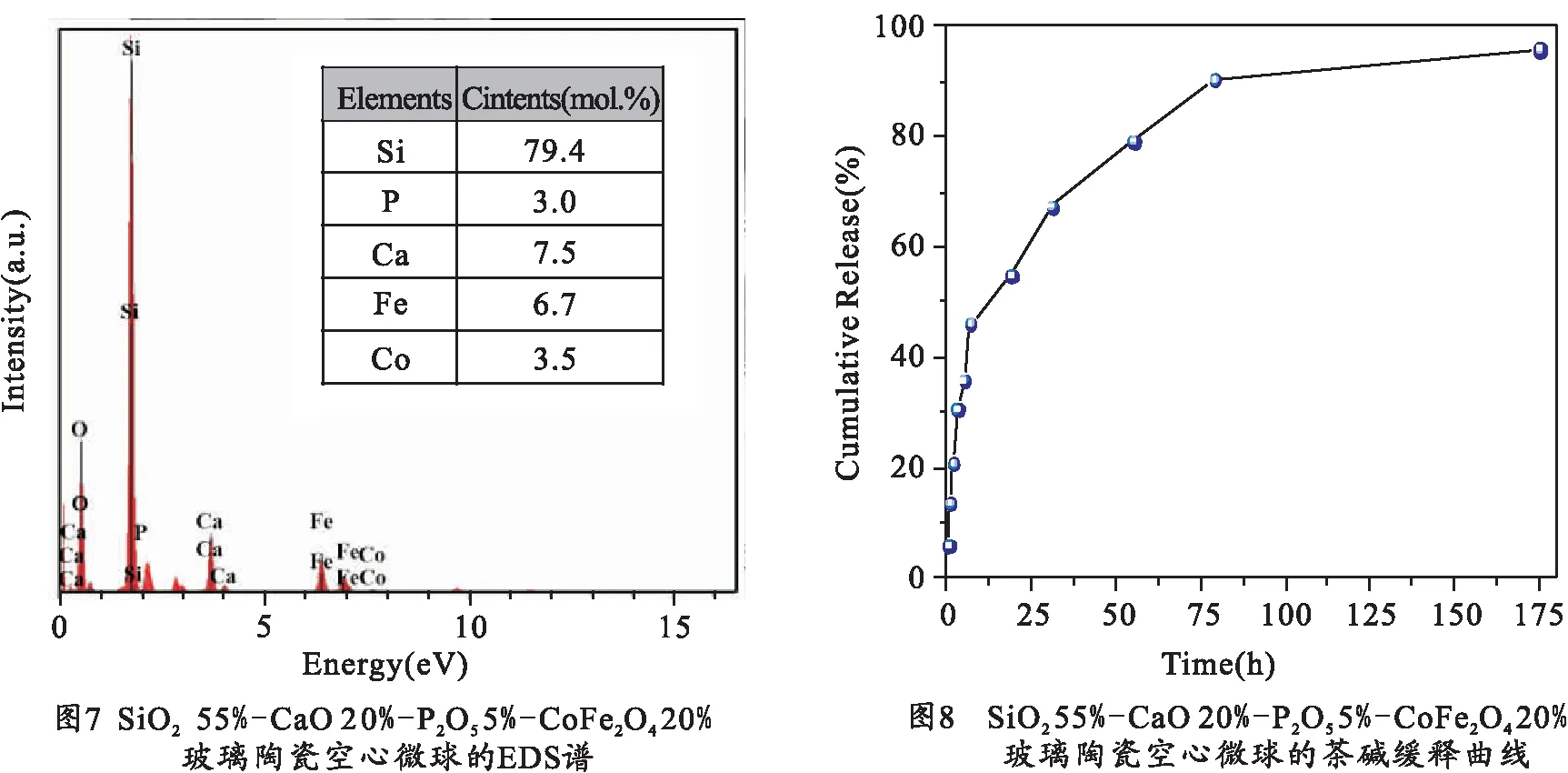
利用茶碱作为药物模型分析制备的玻璃陶瓷空心微球的药物缓释行为.图8为SiO255%-CaO20%-P2O55%-CoFe2O420%玻璃陶瓷空心微球的茶碱药物缓释曲线.从图8可以看出,茶碱在微晶玻璃中的缓释可以分为两个阶段:前9 h为快速释放阶段,在这一阶段药物释放量占总量的48%左右,药物缓释量随时间变化大致呈线性上升趋势,其中半小时内释放量为5.9%;9 h后为药物缓慢释放阶段,78 h时药物释放总量为90%,175 h时药物释放量达到96%.可见该样品具有良好的药物缓释能力,是一种较好的药物载体.
3 结 论
利用聚苯乙烯微球作为硬模版,采用共沉淀法制备SiO2-CaO-P2O5-CoFe2O4磁性玻璃陶瓷空心微球.热分析表明,制备的玻璃微球在850 ℃有一个明显的属于CoFe2O4的晶化放热峰.XRD结果表明,样品经过850 ℃煅烧2 h后,从玻璃基质中析出了CoFe2O4的晶化相.XRD和SEM实验结果表明,玻璃陶瓷的组分对玻璃的晶化和形貌都有重要影响,当玻璃中SiO2组分超过60%时,会从玻璃中析出SiO2杂相,同时得到的空心微球变得易碎.由于在共沉淀中Fe、Co和Ca离子沉淀不完全,导致最终得到的玻璃陶瓷中Fe、Co和Ca元素的含量远低于加入的化学计量比.此外,本文制备的玻璃陶瓷空心微球具有很好的药物缓释性能,在78 h内药物缓释量为90%.这种磁性玻璃陶瓷空心微球兼具靶向、磁热疗、生物相容性、药物缓释于一体,在肿瘤治疗方面有重要应用.
