miR-375 在变应性鼻炎小鼠鼻黏膜上皮细胞凋亡中的调控作用
2020-04-23汪涛王珮华陈东李莹
汪涛 王珮华 陈东 李莹
变应性鼻炎是耳鼻咽喉科的常见病,普通人群 患病率较高[1],而且对患者的学习、工作和生活都有明显的影响。变应性鼻炎是环境因素和遗传因素共同作用的结果,其发病机制非常复杂。研究证实参与变应性鼻炎免疫反应的分子机制具有多环节、复杂的瀑布效应[2],并有众多micro RNA、蛋白分子、细胞因子等参与其中。近年来研究热门的micro RNA在天然免疫和获得性免疫系统中作用巨大,可调控多种免疫细胞的增殖、分化及凋亡等功能,其中miR-375 就在肿瘤和炎症的发生和发展中起着重要的调控作用[3,4]。鼻黏膜上皮细胞异常凋亡会导致变应性鼻炎[5],miRNA-375 是否参与变应性鼻炎鼻黏膜上皮细胞的凋亡目前尚未知。因此,该课题设计运用变应性鼻炎动物模型来验证miR-375 参与变应性鼻炎的鼻黏膜上皮细胞凋亡的调控机制,为变应性鼻炎的基因靶向治疗方面提供新思路。
资料与方法
1 实验动物
实验用BALB/C 小鼠(SPF 级)雌性,5 周龄,购买于南京大学动物模型研究中心,所有动物饲养于上海交通大学医学院附属第九人民医院实验动物中心,饲养条件为SPF 级,动物的所有处理符合上海交通大学医学院附属第九人民医院动物实验伦理委员会要求。
2 实验分组
购买的40 只雌性BALB/C 小鼠(SPF 级)随机分为五组予以不同的实验干预。正常对照组(NC组):小白鼠仅用生理盐水进行腹腔注射和滴鼻处理;OVA 组:为卵清蛋白致敏的变应性鼻炎模型组(见变应性鼻炎动物建模部分);OVA+敲除JAK2组:为实验动物用卵清蛋白致敏后,用带有敲除JAK2(上海吉玛制药技术有限公司)的腺病毒感染实验动物;OVA+miR-375 组:为实验动物用卵清蛋白致敏后,继续用带有miR-375 模拟物(上海拓然生物科技有限公司)的腺病毒注射实验动物(每只小鼠20μM/5μl),连续4 天;OVA+miR-375+JAK2 组:为实验动物用卵清蛋白致敏后,继续用带有miR-375 模拟物的腺病毒腹腔注射和带有过表达JAK2的腺病毒(上海吉玛制药技术有限公司)灌注鼻腔,连续4 天。
3 BALB/C 小鼠变应性鼻炎模型的制备
3.1 腹腔注射用卵清蛋白溶液
每毫升1×PBS 缓冲液含10μg 卵清蛋白OVA(美国Sigma 公司)和1mg 氢氧化铝,使用前新鲜配置,震荡混匀后进行小鼠腹腔注射。
3.2 滴鼻用卵清蛋白
每20 微升1×PBS 缓冲液中含500μg 的OVA,使用前新鲜配置。
3.3 所有变应性鼻炎组小鼠于第0、7、14 天每只小鼠腹腔注射上述腹腔注射用卵清蛋白溶液500μL进行基础致敏,一天1 次;从第21 天开始经鼻给予每只小鼠含500μg OVA 的1×PBS 缓冲液20μL 局部激发,连续7 天。观察建模组小鼠有明显过敏性行为表现时,说明建模成功。正常对照组小鼠给予同等剂量生理盐水的缓冲液腹腔注射和滴鼻。
4 标本采集和处理
4.1 静脉血清的采集和处理
静脉采血:10%水合氯醛按0.01ml/g 剂量腹腔注射麻醉小鼠,小鼠约5 分钟后达到理想的麻醉状态,碘伏消毒眼周皮毛固定小鼠后使用毛细管进行穿刺。用离心管收集毛细管末端流出的血液后静置,待分离血清。
血清采集:将上述离心管中血样室温静置2 小时后,以3000 转/分钟在4℃下离心15 分钟,离心管上层清亮的液体即为血清,用200μl 离心管分装后置于超低温冰箱中保存,备用。
4.2 鼻黏膜标本的采集和处理
各实验组实验动物完成建模和预设的实验步骤后24 小时,麻醉后颈椎脱曰处死小鼠,取头部,与硬腭垂直方向剪开鼻正中缝,在显微镜下暴露小鼠鼻腔,使用显微器械刮取小鼠鼻中隔和双侧鼻腔外侧壁的鼻黏膜,放入冻存管,液氮中保存备用。
5 组织细胞的凋亡检测(TUNEL 实验)
各实验组实验动物的鼻黏膜标本,生理盐水冲洗后,用10%福尔马林固定后,石蜡包埋处理,切片(厚度为5μm),用TUNEL 试剂盒(Sangon Biotech Co. Ltd.)进行组织内细胞凋亡的检测,计数随机5个视野下TUNEL 阳性细胞的数量。
6 实时定量PCR(qRT-PCR)
使用TRIzolTMReagent(Cat#15596026,Invitrogen,USA)试剂提取实验动物鼻黏膜组织总RNA;按照标准方案,使用miRNA RT 试剂盒(Cat#1801,哈尔滨新海基因检测有限公司) 和EasyScript Reverse Transcriptase(北京全式金生物)将目标miRNA 逆转录成cDNA;使用SYBR Premix Ex TaqTM试剂盒(TaKaRa Bio Inc., USA)和Hairpin-itTMMicroRNAs Quantitation(上海吉玛制药技术有限公司)在ABI Prism 7500 (Applied Biosystems, Inc., USA)上选择性扩增目标miRNA,使用2-△△ct法计算miR-375 和每种转录物的表达水平。
7 酶联免疫吸附试验(ELISA)
实验小鼠血浆采集后取其血清,血清IL-6、IL-10 和TNF-α 的浓度检测按照ELISA 试剂盒的标准程序操作,ELISA 试剂盒购买于Abcam 公司(ab209519 用 于 IL -10;ab100712 用 于 IL -6;ab100747 用于TNF-α)。
8 蛋白质印迹试验(Western Blot)
与细胞凋亡相关的细胞内蛋白及酶的一抗抗体均购于Abcam 公司,包括抗JAK2 蛋白(ab108596),抗裂解的蛋白酶3(Cleaved caspase 3)(ab2302),抗聚 [ADP-核糖] 聚合酶裂解酶(Cleaved PARP)(ab32064),抗蛋白酶3(Caspase 3)(ab13847),抗聚[ADP-核糖]聚合酶(PARP)(ab32138),抗p-STAT3 蛋白(ab30647),抗STAT3 蛋白(ab119352)和抗β 肌动蛋白(β-actin)(ab8227)。蛋白电泳后,转移到硝酸纤维素膜,并与过氧化物酶缀合的抗体一起温育,使用增强的化学发光试剂盒(Millipore),利用暗室显影技术采集化学发光图像。
9 统计学分析
实验数据应用专业统计软件(SAS Release 8.01 TS Level 01m0)进行统计分析,两组间的比较用T 检验(T-test),不同实验组间的数据比较用方差分析(One-way ANOVA),P<0.01 为差异有统计学意义。
结果
1 免疫组织化学检测和TUNEL 实验
结果显示,JAK2 和p-STAT3 染色的阳性细胞数在OVA 组明显高于正常对照组(P<0.01)(图1);正常对照组、OVA 组和OVA+敲除JAK2 组中鼻黏膜上皮细胞凋亡情况显示,OVA+敲除JAK2 组的鼻黏膜上皮细胞凋亡和裂解的蛋白酶3(Caspase 3)的阳性细胞数明显低于OVA 组(P<0.01),与正常对照组无明显差异(图2);OVA+miR-375 组和OVA+miR-375+JAK2 组的TUNEL 染色和免疫组织化学检测结果显示(图3),注射miR-375 模拟物显著降低小鼠变应性鼻炎鼻黏膜上皮凋亡阳性和裂解的蛋白酶3 阳性的细胞数(P<0.01),这一保护作用可以被过表达JAK2 的腺病毒感染后而减弱。

图1 免疫组织化学染色显示JAK2 和p-STAT3 在正常对照组和OVA 组显色情况

图2 Tunel 阳性细胞百分比和裂解的蛋白酶3 显色阳性的细胞百分比,OVA 组明显高于OVA+敲除JAK2 组,(**显示有统计学差异性,P<0.01)

2 实时定量PCR(qRT-PCR)
如图4 所示,miR-375 在变应性鼻炎模型组(OVA 组)的表达水平较正常对照组明显偏低(P<0.01);而JAK2 miRNA 的表达水平在变应性鼻炎模型组(OVA 组)明显上调(P<0.01),研究证实JAK2/STAT3 信号通路与细胞凋亡和过敏有关[6];正常对照组、OVA 组和OVA+敲除JAK2 组中miR-375 的表达显示,JAK2 敲除并未影响OVA 诱导致敏后变应性鼻炎小鼠黏膜上皮内miR-375 水平的降低(图5),说明JAK2 可能是miR-375 的一个下游靶点。

图4 正常组和OVA 组miR-375 和JAK2 的比较(**显示有统计学差异性,P<0.01)
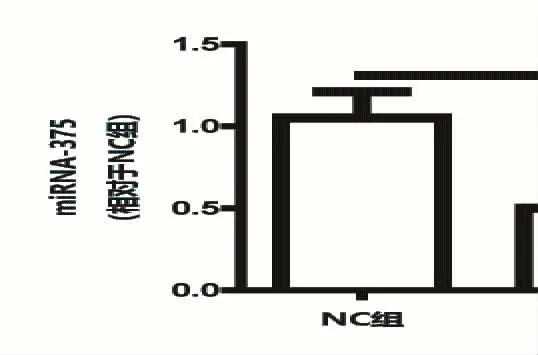
图5 miR-375 在OVA 组和OVA+敲除JAK2 组间并未显示有差异性
3 蛋白质印迹试验(Western Blot)
结果显示,与细胞凋亡的相关蛋白在正常对照组和OVA 组表达明显不同,JAK2 和p-STAT3 蛋白的表达在OVA 组明显浓聚,而β-actin 和STAT3 蛋白并未显示明显差别(图6-A);为了验证变应性鼻炎黏膜上皮的凋亡与JAK2 高表达有关,通过OVA组和OVA+敲除JAK2 组中凋亡相关蛋白的检测明显裂解的蛋白酶3 在OVA+敲除JAK2 组明显低于OVA 组(图6-B);并且裂解的蛋白酶3 在OVA+miR-375 组明显低于OVA 组和OVA+miR-375+JAK2 组(图6-C)。

图6 Western Blot 检测显示JAK2、p-STAT3、STAT3、β-actin 以及裂解的蛋白酶3、蛋白酶3 在各实验组间的比较
4 酶联免疫吸附试验(ELISA)
结果显示,敲除JAK2 可有效降低促炎细胞因子(IL-6 和TNF-α)的表达,同时增加变应性鼻炎小鼠血浆中抗炎细胞因子IL-10 的表达(图7),表明敲除了JAK2 可抑制变应性鼻炎小鼠鼻黏膜上皮的细胞凋亡和炎症反应;为了进一步探讨了miR-375是否通过JAK2 途径来调控变应性鼻炎小鼠鼻黏膜细胞凋亡和炎症反应,血清ELISA 检测结果显示,

图7 血浆IL-6、TNF-α、IL-10 细胞因子在OVA 组和OVA+敲除JAK2 组间有统计学差异性(**显示有统计学差异性,P<0.01)
讨论
变应性鼻炎常见并且多发,对患者的生活质量造成严重影响,其发病机理复杂。近年来研究热门的miRNA 在免疫系统中作用巨大,可调控多种免疫细胞的增殖、分化及凋亡等功能。微小RNA(micro RNA, miRNA)是一类内源性表达的小分子非编码RNA,在转录后基因调控中发挥重要的作用[7],是近年来生命科学研究中的重大突破,并且参与肿瘤和炎症中细胞的分化和凋亡等生理病理过程[8-11],针对miRNA 的研究可为变应性鼻炎的发病机制研究、免疫治疗方面提供新的方向。
miR-375 是作为调节胰岛素分泌的胰岛特异性miRNA[12],研究显示miR-375 通过靶向几个重要的基因如AEG-l,YAPl,IGFIR 和PDKl 等参与多种类型的恶性肿瘤的发生和发展。陆翰杰等[13]证实miR-375 的低表达可能与食管鳞状细胞癌的发生、发展、转移相关;前列腺癌患者血清miR-375 水平明显升注射miR-375 模拟物可降低OVA 致敏后上调的促炎症细胞因子(IL-6 和TNF-α)的表达,同时增加变应性鼻炎小鼠血浆中OVA 致敏后下调的抗炎细胞因子IL-10 的表达,这些调控作用同样可以通过过表达JAK2 腺病毒的感染而逆转(图8),因此该研究数据表明,miR-375 可通过JAK2 途径调控变应性鼻炎鼻黏膜上皮细胞凋亡和炎症反应。高,且与患者临床病理特征存在相关性[14];胃癌组织中的miR-375 基因的表达水平明显下降,而基因甲基化的比例明显上升,且均与肿瘤的分化程度有关[15],均表明miR-375 参与细胞凋亡的调控。变应性鼻炎的发生与鼻黏膜上皮细胞的异常凋亡有关[5],多项研究也证实JAK2/STAT3 信号通路参与了细胞凋亡的调控[6,16],并且证实JAK2 就是miR-375 的下游潜在靶点[17,18]。因此,miR-375 是否参与了过敏性鼻炎的鼻黏膜细胞的凋亡,并且miR-375/JAK2/STAT3 轴是否存在于鼻黏膜上皮细胞凋亡中并且参与变应性鼻炎是本研究需要证实的。

图8 血浆IL-6、TNF-α、IL-10 细胞因子在OVA 组和OVA+miR-375+JAK2 组与OVA+miR-375 组间有统计学差异性(**显示有统计学差异性,P<0.01)
我们通过对卵清蛋白致敏小鼠变应性鼻炎模型的鼻黏膜样本的基因检测得出miR-375 的含量较对照组明显降低,而JAK2 明显升高,JAK2 和p-STAT3 的蛋白表达水平在变应性鼻炎组明显升高,说明miR-375 在变应性鼻炎进展中有保护性作用,而JAK2 为miR-375 在鼻黏膜上皮细胞中的下游靶点;实验进一步通过miR-375 过表达或敲除JAK2的腺病毒感染OVA 致敏小鼠达到了有效抑制鼻黏膜上皮细胞凋亡和炎症,说明miR-375 可通过抑制JAK2/STAT3 通路阻止小鼠鼻黏膜细胞凋亡,改善变应性鼻炎。曾有研究表明黄芩苷可以通过阻断JAK2-STAT5 和NF-κB 信号通路来抑制卵清蛋白诱导豚鼠的变应性鼻炎和肥大细胞的激活[19]。在本研究中,我们通过qRT-PCR、蛋白质印迹、免疫组织化学、酶联免疫吸附实验方法均证明了JAK2 为miR-375 的下游直接靶标,并发现miR-375 可阻断JAK2/STAT3 通 路,与 先 前 的 研 究 报 道 一 致[20,21]。miR-375/JAK2 轴可能是多种病理过程中的常见现象,另外,由于过表达JAK2 可能会减弱miR-375 对变应性鼻炎小鼠的保护作用,并且miR-375 参与阻断或激活下游其他信号通路较多[22-25],因此,miR-375 介导的变应性鼻炎保护作用可能会涉及其他信号通路,仍需要进一步的研究来证实。本研究主要运用了小鼠变应性鼻炎的动物模型验证了miR-375在变应性鼻炎黏膜上皮细胞凋亡中的调控作用,并未证明miR-375 是否参与人类变应性鼻炎的发病过程,这也是我们下一步实验需要验证的。
总之,miR-375 在变应性鼻炎小鼠的鼻黏膜上皮细胞中的表达显著减少,并通过JAK2/STAT3 信号通路参与调控鼻黏膜上皮细胞凋亡和炎症反应,miR-375 的高表达是变应性鼻炎的保护性机制,miR-375 模拟物可能成为临床变应性鼻炎免疫治疗的潜在靶向药物。
