麦芽糖酶基因MAL62 的不同截断变体对面包酵母发酵性能的影响
2020-04-23褚凯文宋海岩王金晓张翠英肖冬光
褚凯文,宋海岩,王金晓,张翠英,肖冬光
(工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
面包酵母在面包生产过程中起着生物膨松、面筋扩展、增加风味等作用,是最重要的微生物发酵剂和生物疏松剂[1-3].麦芽糖是不加糖面团中最丰富的可发酵性糖,麦芽糖代谢能力是影响面团发酵能力的关键因素[4],而麦芽糖酶是麦芽糖代谢的关键酶[5-7].研究[8]发现在面包酵母发酵过程中存在葡萄糖对麦芽糖酶的产物抑制作用.
麦芽糖酶又称α-葡萄糖苷酶,根据其一级结构可将其归为α-葡萄糖苷酶Ⅰ家族,属于GH-13,含有α-淀粉酶催化部位的氨基酸的4 个保守部位[9].Yao等[10]通过研究麦芽糖、异麦芽糖及α,α-海藻糖对麦芽糖酶的抑制作用,得出在麦芽糖酶上至少存在3 个不同的单糖结合位点的结论.麦芽糖酶的亲核位点和水解位点已经被确认为Asp214 和Glu276,并且编码麦芽糖酶第13—582 氨基酸编码海藻糖treC 基因[11],在第511—562 氨基酸位点存在麦芽糖酶的末端结构域.另外,Yamamoto 等[12]通过定点突变技术研究来自酿酒酵母中的α-麦芽糖苷酶(麦芽糖酶和异麦芽糖酶)的底物特异性,发现α-麦芽糖苷酶保守序列Ⅱ中Val216 对识别α-1,4-和α-1,6-型底物起着十分重要的作用.因此,对麦芽糖酶基因MAL62 的截断表达,研究对面包酵母不加糖面团发酵性能的影响,对探究编码麦芽糖酶的氨基酸与该酶的催化功能之间的关系有重要意义.
本实验根据麦芽糖酶不同的催化位点过表达部分麦芽糖酶基因,比较重组菌株之间在发酵力、麦芽糖消耗速率及麦芽糖酶活力的差异,进而探究编码麦芽糖酶的氨基酸与其功能之间的关系.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
面包酵母工业菌株BY-14 由本实验室保藏;600-1B 是只含有MAL1 基因座中的MAL12 基因的面包酵母菌株,购自美国模式培养物集存库(ATCC);600-1BΔ12 是敲除MAL12 的面包酵母600-1B,由本实验室构建.
表达质粒Yep-PGK 由本实验室构建;质粒Yep-PKM 由本实验室保藏.
1.1.2 培养基
LB 细菌培养基(g/L):胰蛋白胨10,酵母粉5,氯化钠10,pH 7.0.
YEPD 酵母培养基(g/L):蛋白胨20,酵母粉10,葡萄糖20.
糖蜜培养基(g/L):将30~35 Brix 的糖蜜稀释至10~12 Brix,添加酵母粉5、硫酸铵0.5,pH 5.0.
LSMLD 液体模拟面团培养基:
(1)麦芽糖LSMLD(g/L):麦芽糖9.5,硫酸铵2.5,尿素5,磷酸二氢钾16,磷酸氢二钠5,硫酸镁0.6,烟酸0.022 5,泛酸0.005,维生素B10.002 5,维生素B60.001 25,维生素B20.001,叶酸0.000 5,蒸馏水配制.
(2)混合糖LSMLD(g/L):麦芽糖9.5,葡萄糖3.5,其他成分与(1)相同.
1.1.3 仪器与设备
DYYⅢ2 型稳压稳流电泳仪,北京六一仪器厂;PCT-200 型PCR 基因扩增仪,美国Bio-Rad 公司;全自动凝胶成像仪,美国Syngene 公司;发酵力测定仪,瑞典SIA 公司;1100 系列高效液相色谱仪,美国安捷伦科技有限公司.
1.2 方法
1.2.1 引物
实验室所用引物见表1.

表1 突变菌株构建所需引物Tab.1 Primers used in constructing the recombined strain
1.2.2 重组质粒的构建
以面包酵母BY-14a 基因组为模板,用引物Yep-PKM1-410-U 和 Yep-PKM1-410-D 扩增出目的基因M1-410,将M1-410插入到Yep-PGK 质粒的XhoⅠ酶切位点,得到重组质粒Yep-PM1-410;以质粒pUG6 为模板,以 KanMX-U 和 KanMX-D 为引物,扩增出KanMX 抗性基因片段.将 KanMX 片段插入到Yep-PM1-410质粒的SphⅠ酶切位点,得到质粒Yep-PKM1-410,其构建流程如图1 所示.
质粒Yep-PKM1-510和质粒Yep-PKM13-584的构建方法同上.

图1 重组质粒Yep-PKM1-410 的构建流程Fig.1 Construction of recombinant plasmid Yep-PKM1-410
1.2.3 发酵力的计算
称取利达面粉140 g,置于30 ℃恒温箱保温1~2 h,称取4.5 g 鲜酵母、2.0 g NaCl,分别加入30 mL和45 mL 的30 ℃水于鲜酵母和NaCl 中,搅拌溶解后,混合均匀倒入面粉中,快速揉和成面团,揉面时间控制在5 min 内,面团温度为(30±0.2)℃.将面团放入发酵测定仪的不锈钢盒中,送入活力室内,发酵温度为(30±0.5)℃.调节记录仪零点,关闭放气小孔,记录产气量.根据CO2产气量计算面团发酵力,即每小时每克干菌体产生CO2的体积.
1.2.4 重组菌株耗糖能力的测定
按1.2%的鲜酵母接种量将鲜酵母接入至装有不同碳源100 mL 液体模拟面团培养基中,在30 ℃静置培养,每隔1 h 取1 次样,采用高效液相色谱测定残糖含量[13].
1.2.5 麦芽糖酶活力测定
30 ℃水浴条件下,将0.1 mL 细胞抽提液加入4.9 mL pNPG 溶液(1 mg/mL),开始计时,20 min 内每隔 5 min 快速取出 1 mL 反应液加入装有 1 mL 0.1 mol/L 碳酸钠溶液的试管内终止反应,测定该反应液所生成的对硝基苯酚在410 nm 下的吸光度;细胞抽提液中的总蛋白含量采用Bradford(考马斯亮蓝法)[14]测定(使用上海美吉生物医药科技有限公司生产的M2031 型考马斯亮蓝法蛋白测定试剂盒);每个实验重复3 次,取平均值作为结果;麦芽糖酶活力单位为在30 ℃下每分钟每毫克蛋白释放对硝基苯酚的物质的量[15],即每分钟每毫克蛋白释放对硝基苯酚的物质的量.
2 结果与分析
2.1 重组质粒的构建
2.1.1 重组质粒Yep-PKM1-410的构建
参照 1.2.2 节质粒构建方法构建质粒 Yep-PKM1-410.分别对重组质粒 Yep-PM1-410和 Yep-PKM1-410进行PCR 及酶切验证,结果如图2 所示.以重组质粒Yep-PM1-410为模板,以Yep-PKM1-410-U 和Yep-PKM1-410-D 为引物,PCR 扩增编码M1-410的基因片段,可得到大小为1 233 bp 的片段;对重组质粒Yep-PM1-410进行SphⅠ单酶切可得到8 185 bp 的片段;重组质粒Yep-PKM1-410进行SphⅠ单酶切,可得到大小为8 185 bp 和1 613 bp 的片段,电泳鉴定结果与预期结果均一致,证明重组质粒Yep-PKM1-410构建成功.测序结果显示启动子与目的基因的方向一致,序列正确,进一步证明质粒构建成功.

图2 重组质粒Yep-PKM1-410 的验证Fig.2 Verification of recombinant plasmid Yep-PKM1-410
2.1.2 重组质粒Yep-PKM1-510的构建
重组质粒Yep-PM1-510和Yep-PKM1-510的酶切验证结果如图3 所示.以重组质粒Yep-PM1-510为模板,以Yep-PKM1-510-U 和Yep-PKM1-510-D 为引物,PCR扩增编码M1-510的基因片段,可得到大小为1 533 bp的片段;对重组质粒Yep-PM1-510进行SphⅠ单酶切可得到8 485 bp 的片段;对重组质粒Yep-PKM1-510进行SphⅠ单酶切,可得到大小为8 485 bp 和1 613 bp的片段,电泳鉴定结果与预期结果均一致,证明重组质粒Yep-PKM1-510构建成功.测序结果显示启动子与目的基因的方向一致,序列正确,进一步证明质粒构建成功.
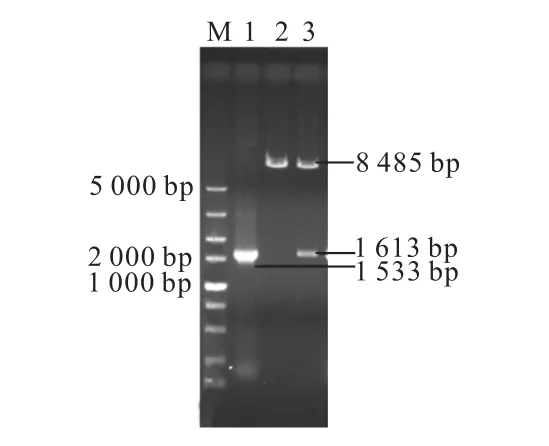
图3 重组质粒Yep-PKM1-510 的验证Fig.3 Verification of recombinant plasmid Yep-PKM1-510
2.1.3 重组质粒Yep-PKM13-584的构建
重组质粒Yep-PM13-584和Yep-PKM13-584的酶切验证结果如图4 所示.
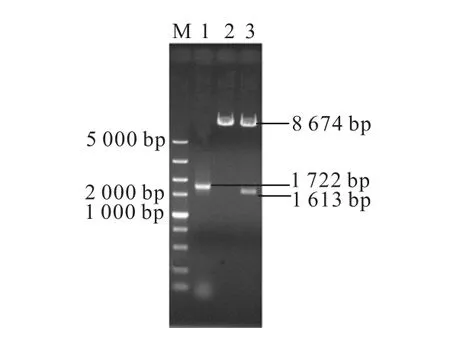
图4 重组质粒Yep-PKM13-584 的验证Fig.4 Verification of recombinant plasmid Yep-PKM13-584
以重组质粒 Yep-PM13-584为模板,以 Yep-PKM13-584-U 和Yep-PKM13-584-D 为引物,PCR 扩增M13-584基因,可得到大小为1 722 bp 的片段;对重组质粒Yep-PM13-584进行SphⅠ单酶切可得到8 674 bp的片段;对重组质粒Yep-PKM13-584进行SphⅠ单酶切验证,可得到大小为8 674 bp 和1 613 bp 的片段,电泳鉴定结果与预期结果均一致,证明重组质粒Yep-PKM13-584构建成功.测序结果显示启动子与目的基因的方向一致,序列正确,进一步证明质粒构建成功.
2.2 重组菌株的构建
2.2.1 重组菌株600-1BΔ12-PKM1-410的PCR 验证
以重组菌株600-1BΔ12-PKM1-410的酵母质粒和构建的重组质粒Yep-PKM1-410(阳性对照)为模板,用引物PGK-U 和Yep-PKM1-410-D 进行PCR 验证,获得2 条大小同为2 733 bp 的片段(图5).由图5 可以看出PCR 扩增产物单一,条带大小与预期结果一致,说明过表达重组菌株600-1BΔ12-PKM1-410构建成功.
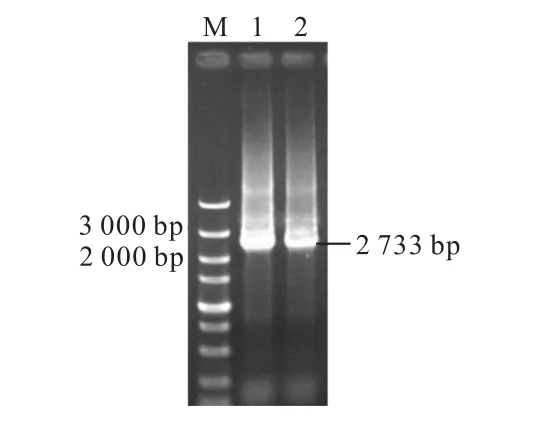
图5 重组菌株600-1BΔ12-PKM1-410 的PCR验证Fig.5 PCR verification of the recombiant strain 600-1BΔ12-PKM1-410
2.2.2 重组菌株600-1BΔ12-PKM1-510的PCR 验证
以重组菌株600-1BΔ12-PKM1-510的酵母质粒和构建的重组质粒Yep-PKM1-510(阳性对照)为模板,用引物PGK-U 和Yep-PKM1-510-D 进行PCR 验证,获得2 条大小同为3 033 bp 的片段(图6).由图6 可以看出PCR 扩增产物单一,条带大小与预期结果一致,说明过表达重组菌株600-1BΔ12-PKM1-510构建成功.

图6 重组菌株600-1BΔ12-PKM1-510 的PCR验证Fig.6 PCR verification of the recombiant strain 600-1BΔ12-PKM1-510
2.2.3 重组菌株600-1BΔ12-PKM13-584的PCR 验证
以重组菌株600-1BΔ12-PKM13-584的酵母质粒和构建的重组质粒Yep-PKM13-584(阳性对照)为模板,用引物PGK-U 和Yep-PKM13-584-D 进行PCR 验证,获得2 条大小同为3 222 bp 的片段(图7).由图7 可以看出PCR 扩增产物单一,条带大小与预期结果一致,说明过表达重组菌株600-1BΔ12-PKM13-584构建成功.
2.2.4 重组菌株600-1BΔ12-PKM 的PCR 验证
以重组菌株600-1BΔ12-PKM 的酵母质粒和构建的重组质粒Yep-PKM(阳性对照)为模板,用引物PGK-U 和Yep-PKM-D 进行PCR 验证,获得2 条大小同为3 255 bp 的片段(图8).由图8 可以看出PCR扩增产物单一,条带大小与预期结果一致,说明过表达重组菌株600-1BΔ12-PKM 构建成功.

图7 重组菌株600-1BΔ12-PKM13-584 的PCR验证Fig.7 PCR verification of the recombiant strain 600-1BΔ12-PKM13-584

图8 重组菌株600-1BΔ12-PKM的PCR验证Fig.8 PCR verification of the recombiant strain 600-1BΔ12-PKM
2.3 重组菌株与原菌发酵性能的比较
2.3.1 重组菌株与亲本麦芽糖酶活力的比较
将重组菌株 600-1BΔ12-PKM1-410、600-1BΔ12-PKM1-510、600-1BΔ12-PKM13-584、600-1BΔ12-PKM 及600-1BΔ12 分别按1.2%的接种量接入至100 mL 不同碳源模拟面团培养基中,每隔1 h 取1 mL 发酵液,12 000 r/min 离心1 min,菌体用1 mL PBS 缓冲液悬浮,用珠磨仪将酵母菌体破碎离心收集上清液,以pNPG 为反应底物测麦芽糖酶的酶活力.重组菌株与亲本菌株的麦芽糖酶活力的比较如图9 所示.
由图9 可知:突变菌株的酶活力随着时间的推移,酶活力都有逐渐增加的趋势.与重组菌株600-1B-PKM 相比,麦芽糖酶活力提高最大是 600-1BΔ12-PKM1-410,发酵 5 h 的时候酶活力提高了17%,说明敲除催化活性区域外的氨基酸序列对麦芽糖酶活力有提高作用.
2.3.2 重组菌株与亲本菌株在不加糖面团中的发酵力比较
根据食品加工用酵母国家标准方法测定改造菌株与亲本菌株无糖面团中CO2产气情况,可记录菌株发酵前1 h 释放CO2量及发酵结束时间,并计算酵母菌体发酵力.各菌株的发酵力(以干菌体质量计)结果见表2.与原始菌600-1BΔ12 相比,各重组菌的发酵力都有明显的提高(P<0.05).但是,与重组菌株600-1BΔ12-PKM 相比,过表达部分麦芽糖酶基因的重组菌株的发酵力没有显著提高.发酵力最高的为重组菌株 600-1BΔ12-PKM1-410,与 600-1BΔ12-PKM 相比,发酵力提高了10.63%.发酵力提高的原因可能是重组菌株600-1BΔ12-PKM1-410的麦芽糖酶活力高于600-1BΔ12-PKM.这说明麦芽糖酶基因MAL62 的截断表达虽然使其氨基酸序列不完整,但是对菌株的发酵力并未产生消极影响,甚至使发酵力略微提高.

表2 无糖面团中重组菌株及亲本菌株的发酵力比较Tab.2 Fermentation ability of parent and recombiant strains in unsugared dough
2.3.3 各重组菌株与对照菌株的耗糖曲线
将菌株600-1BΔ12-PKM1-410、600-1BΔ12-PKM1-510、600-1BΔ12-PKM13-584、600-1BΔ12-PKM 及600-1BΔ12分别按1.2%的接种量接入至100 mL 不同碳源模拟面团培养基中,每隔1 h 取样测定培养基中麦芽糖和葡萄糖含量,绘制耗糖曲线,每个实验重复3 次取平均值作为实验结果.菌株在不同碳源模拟面团培养基中的耗糖曲线结果如图10 和图11 所示.
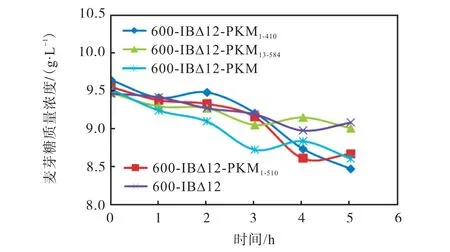
图10 麦芽糖LSMLD 液体模拟面团培养基中重组菌株与亲本菌株的耗糖曲线Fig.10 Sugar consumption curve of recombinant strain and parent strain in maltose LSMLD medium
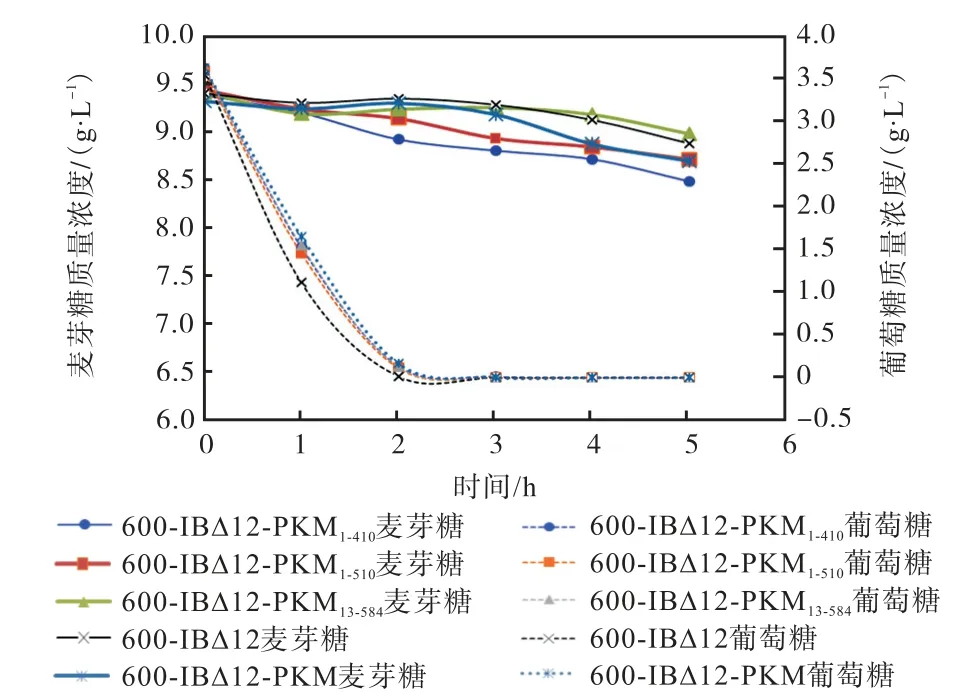
图11 混合糖LSMLD 液体模拟面团培养基中重组株菌株与亲本菌株的耗糖曲线Fig.11 Sugar consumption curve of recombinant strain and parent strain in mixed LSMLD medium
由图10 可以看出:在以麦芽糖为唯一碳源的模拟面团培养基中,重组菌株与亲本菌株的耗糖趋势是一致的,呈现出逐渐降低的趋势.发酵5 h 后,重组菌株中只有600-1BΔ12-PKM1-410的利用速率略优于600-1BΔ12-PKM.由图11 可以看出:重组菌株和亲本菌株在麦芽糖和葡萄糖的混合培养基中消耗麦芽糖的速率都很慢,麦芽糖利用速率慢是因为亲本600-1BΔ12 麦芽糖代谢系统(MAL1)被敲除.重组菌600-1BΔ12-PKM1-410利用麦芽糖的速率最快.根据图10 计算得出:菌株600-1BΔ12-PKM 的麦芽糖利用速率为0.16 g/(L·h),在发酵5 h 消耗了8.63%;与600-1BΔ12-PKM 相比,重组菌600-1BΔ12-PKM1-410利用麦芽糖的速率(0.21 g/(L·h))提高了31%,在发酵5 h消耗了10.84%的麦芽糖;重组菌600-1BΔ12-PKM1-510、600-1BΔ12-PKM13-584及600-1BΔ12 在发酵5 h 后麦芽糖分别消耗了8.46%、5.68%和6.70%.结果表明,重组菌600-1BΔ12-PKM1-410和重组菌600-1BΔ12-PKM1-510麦芽糖利用能力较菌株600-1BΔ12-PKM 略有提高,胞内酶活数据表明重组菌株 600-1BΔ12-PKM1-410酶活高于600-1BΔ12-PKM,推测耗糖能力的提高主要原因是麦芽糖酶活力提高,也可能是麦芽糖酶基因MAL62 的截断表达减弱了葡萄糖对麦芽糖酶的抑制作用.
3 结 语
本实验对麦芽糖酶基因MAL62 的截断表达,获得了表达不同长度麦芽糖酶编码基因的面包酵母菌株,研究了含有改造的麦芽糖酶的面包酵母菌株的发酵力、麦芽糖消耗速率及麦芽糖酶活力的变化.结果证明麦芽糖酶在含有糖苷水解酶GH13 家族的催化域第36—397 氨基酸的情况下,删除其他部分氨基酸序列对该酶的催化活性不会产生消极的影响,反而会对其酶活力、发酵速度有所提升.麦芽糖酶不同截断变体中600-1BΔ12-PKM1-410和600-1BΔ12-PKM1-510两个菌株破坏了海藻糖treC 基因,使得葡萄糖与酶无法正常结合,同时这两株菌不含有麦芽糖酶C 末端结构域,从而减弱了葡萄糖对麦芽糖酶的抑制作用,因此这两株菌的酶活力高于其他菌株.但是,也存在这两个变体只是单纯地提高了麦芽糖酶活力的可能,因此,还需进一步纯化该酶后分析酶活性质进行验证.
