鱼腥草素钠及与红霉素联用对产膜表皮葡萄球菌lrgB的影响
2020-04-22许甘霏
官 妍, 许甘霏
(1. 安徽中医药大学 中西医结合学院, 合肥 230012; 2. 安徽大学 生命科学学院, 合肥 230601)
表皮葡萄球菌已成为导致医院内感染最主要的病原菌之一[1]。而表皮葡萄球菌致病与其易在人体内置的人工装置(关节、隐形眼镜、心脏瓣膜、留置导管等)表面形成生物膜密切相关。细菌生物膜(Biofilm,BF)是指细菌黏附于惰性或活性实体表面,被自身分泌的胞外黏质物所包裹,具有高度组织化的多细胞细菌群体结构[2]。由于细菌生物膜一旦形成,可导致相关感染的慢性、持续性、反复性和难控性,故而对临床抗感染治疗造成了诸多困难。
程序性细胞死亡(Programmed cell death,PCD),是指由细胞内死亡程序介导的任何形式的细胞死亡,是个体发育中一个预定的,并受到严格控制的正常组成部分。其中的凋亡曾被认为是真核生物独有的特征。Lewis[3]提出细菌的自溶或类似于PCD的过程,可以起到与真核生物PCD相似的作用。而与真核生物凋亡类似的Cid/Lrg[4]系统成为近年来研究的热点。有关研究亦证实,cid、lrg操纵子调控的细菌细胞死亡和溶解对生物膜发展极为重要[5],其中lrg突变株的生物膜溶解作用增强,大量死亡细胞堆积,说明lrg介导的对细菌死亡、溶解和生物膜的控制是十分重要的。
我们前期的研究[6]已证实,亚抑菌浓度的鱼腥草素钠及其与红霉素联用,对表皮葡萄球菌生物膜形成有显著影响,对表皮葡萄球菌黏附和代谢均有抑制作用。因而,选择鱼腥草素钠及其与红霉素联用,在不同时间段,观察药物对悬浮状态下的产膜表皮葡萄球菌ATCC35984lrgB转录水平的影响,从分子水平评估鱼腥草素钠及其与红霉素联用抗产膜表皮葡萄球菌感染的效果。显微镜下观察鱼腥草素钠及与红霉素联用对表皮葡萄球菌生物膜形态的影响,以检验药物对表皮葡萄球菌生物膜的作用情况,为中药及中西药联用治疗由表皮葡萄球菌引起的相关临床感染,提供相关依据和实践参考。
1 材料与方法
1.1 材料
1.1.1 试验药物
红霉素标准品(中国食品药品检定研究院,批号130307-200716);鱼腥草素钠标准品(中国食品药品检定研究院,批号100247-199601);万古霉素标准品(中国食品药品检定研究院,批号130360-201302)。
1.1.2 菌株
表皮葡萄球菌产膜标准菌株ATCC 35984 (复旦大学上海医学院瞿涤教授馈赠)。
1.1.3 试剂
胰蛋白胨大豆肉汤培养基TSB(杭州微生物试剂有限公司);MH液体培养基(杭州微生物试剂有限公司);二甲基亚砜(天津市光复精细化工研究所);柱式细菌总RNA抽提纯化试剂盒(北京天根生化科技有限公司);反转录试剂盒(大连宝生物工程有限公司);其余所用试剂均为国产分析纯。
1.2 方法
1.2.1 引物合成
根据NCBI中 ATCC35984gryB和lrgB的基因序列,由上海生工生物有限公司设计和合成引物,引物扩增序列、片段大小见表1。

表1 实时荧光定量PCR相关基因引物序列
1.2.2 鱼腥草素钠、红霉素、万古霉素对ATCC35984最小抑菌浓度MIC的测定
以MH液体培养基采用连续稀释法[7],测定鱼腥草素钠、红霉素及万古霉素对ATCC35984的最低抑菌浓度(MIC)。
1.2.3 药物对悬浮状态下ATCC35984的干预
1)菌细胞制备。取2 mL 0.5 Mc的菌液于200 mL TSB液体培养基中(1%的接种量),37 ℃ 150 r/min培养。分光光度计测OD600达到1.6时,4 ℃ 8000 r/min,离心30 min,弃上清。分别用新鲜的200 mL TSB培养基重悬细胞。
2)药物处理。A:不添加药物(阴性对照);B:MIC万古霉素(阳性对照);C:1/2MIC万古霉素(阳性对照);D:MIC红霉素;E:1/2MIC红霉素;F:1/4MIC红霉素;G:MIC鱼腥草素钠;H:1/2MIC鱼腥草素钠;I:1/4MIC鱼腥草素钠;J:1/2MIC鱼腥草素钠+1/2MIC红霉素;K:1/4MIC鱼腥草素钠+1/4MIC红霉素;L:1/8MIC鱼腥草素钠+1/8MIC红霉素。
3)药物处理后菌细胞的保存。阴性对照组及加入药物的各组菌液,于37 ℃ 150 r/min培养。在1、6、12、24和48 h分别取样10 mL于Ep管(经DEPC水处理并灭菌)中,4 ℃ 12 000 r/min离心8 min;弃上清后置-70 ℃保存备用。
1.2.4 对ATCC35984 总RNA抽提
参照文献[7],取冻存于-70 ℃的菌体,抽提总RNA,置-70 ℃保存备用。
1.2.5 目的基因表达的测定
参照文献[7],采用荧光定量 PCR 检测ATCC35984菌株的lrgB转录水平。
1.2.6 药物对生物膜作用情况的形态学观察
参照文献[8],将预先灭菌的盖玻片浸在浊度为0.5 Mc菌液的培养基中,分别培养6 h、1 d和3 d(每天换1次菌液),使之成为未成熟或成熟的生物膜模型。为了观察鱼腥草素钠和红霉素联用的效果,综合以往研究结果[6],实验分别以1/4MIC 的红霉素、1/4MIC 的鱼腥草素钠、 1/16MIC的鱼腥草素钠加1/4MIC的红霉素为给药浓度,对各模型分别作用6 h、1 d和3 d(每隔1天更换含药培养基1次)。分别以结晶紫染色法[8]光镜下观察和镀银染色法[9]电镜下观察各模型形态的变化,根据其形态结构的变化情况判断各药物的作用效果。
1.2.7 数据分析
1)qRT-PCR结果计算。自动调节基线(Base line)至适合处,扩增曲线与阈值线的交叉点所对应的横坐标,即为Ct值。根据标准曲线浓度与Ct值的对应关系,求出各待测标本的初始浓度。以gryB作内参基因,lrgB/gryB为衡量lrgB转录水平的指标。
2 结果与分析
2.1 鱼腥草素钠、红霉素及万古霉素对ATCC35984 MIC的结果
万古霉素对ATCC35984 MIC为8 mg/L,红霉素对ATCC35984 MIC为8 mg/L,鱼腥草素钠对ATCC35984 MIC为64 mg/L。
2.2 药物干预后的目的基因表达
药物作用1 h时,鱼腥草素钠及其与红霉素联用对lrgB的表达有明显上调作用(P<0.05),见图1-A。而在6、12、24和48 h,亚抑菌浓度的鱼腥草素钠与红霉素联用,对lrgB的表达有明显下调作用(P<0.05),见图1-B、C、D及E。


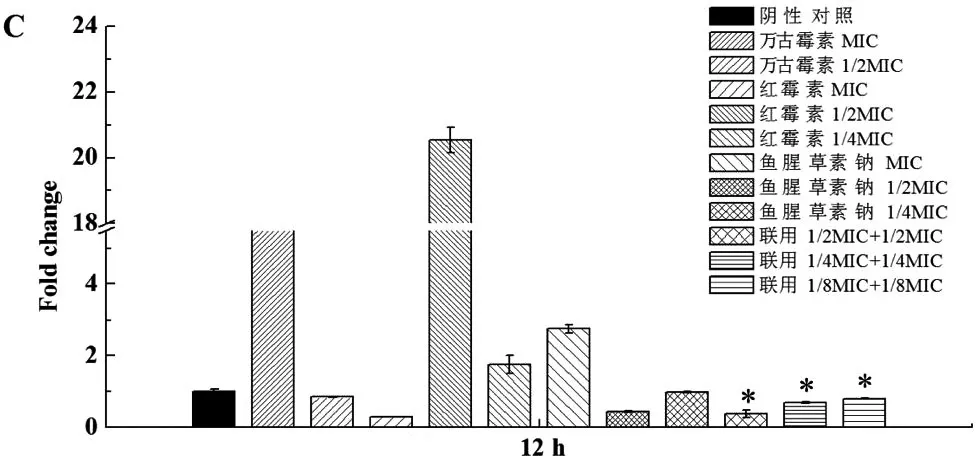
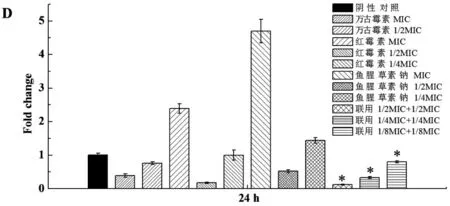

药物干预时间(h)
*表示与阴性对照组比较 P < 0. 05

2.3 药物对生物膜作用的形态学观察
随着培养时间的增加,表皮葡萄球菌生物膜逐渐形成。在TSB中培养6 h时,放大1000倍观察可见盖玻片表面细菌均匀黏附分布,表明表皮葡萄球菌已经完成黏附(图2-A)。与其对比,1/4MIC红霉素对表皮葡萄球菌的黏附影响并不显著,细菌黏附量未见明显减少(图2-B)。经鱼腥草素钠及与红霉素联合用药后,盖玻片表面细菌黏附量均有所减少(图2-C、D)。培养1 d后,表皮葡萄球菌生物膜已经初步形成,可见细菌所分泌的黏性物质将细菌包裹其中,形成膜状物(图3-A)。而鱼腥草素钠、红霉素及二者联合用药作用1 d后,生物膜结构均有明显破坏(图3-B、C和D)。
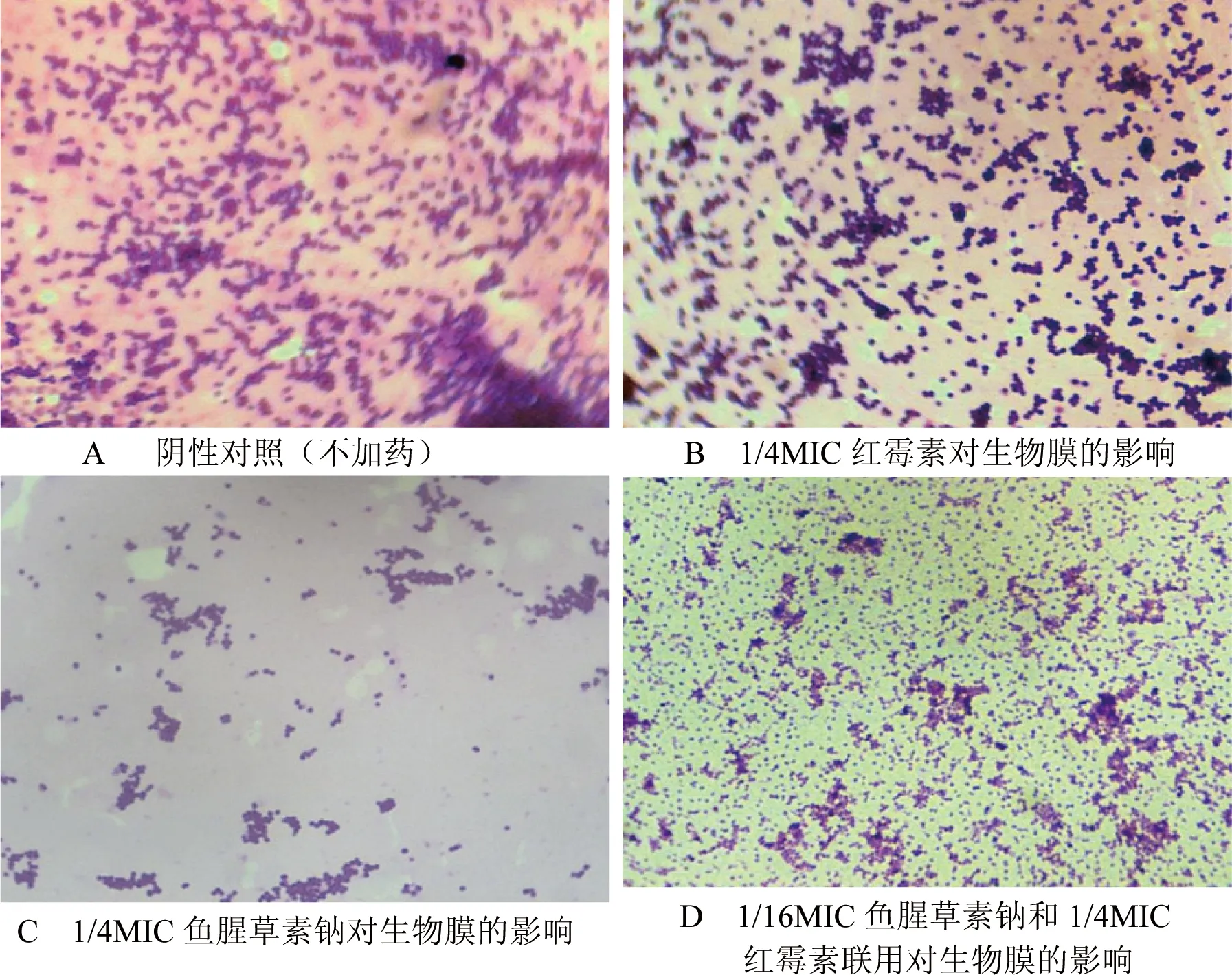
图2 药物对ATCC35984生物膜的影响(6 h, ×1000)
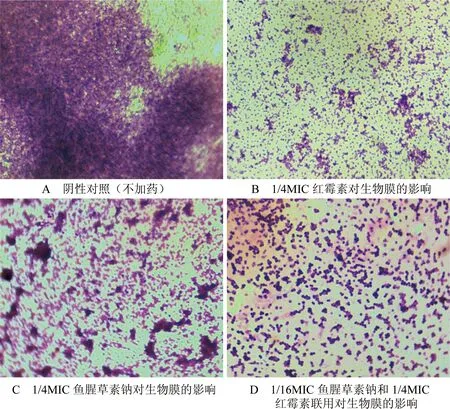
图3 药物对ATCC35984生物膜的影响(1 d, ×1000)
通过电镜观察培养3 d未加药物干预的阴性对照,盖玻片表面已形成了厚厚的生物膜(图4-A)。与其比较,红霉素作用3 d后,密集的生物膜结构被显著破坏,但细菌细胞间尚存一些黏液质(图4-B)。鱼腥草素钠作用3 d后,生物膜被严重破坏,只剩下分散的细菌,细菌间几乎没有了黏液质(图4-C)。鱼腥草素钠和红霉素联合用药3 d后,不仅生物膜被破坏,无黏液质,且细菌数量更少,细菌形态亦发生了改变(图4-D)。

图4 药物对ATCC35984生物膜的影响(3 d, ×10 000)
3 讨论与结论
目前已知细菌细胞裂解死亡的调控,主要由其自身的CidAB/LrgAB体系来完成;Brunskill等[10]在研究金黄色葡萄球菌中影响胞壁质水解酶活性和细菌自溶的一种新型双组份调节系统——LytSR时发现了cid和lrg操纵子。两种操纵子功能相反,它们通过控制胞壁质水解酶的释放进而操纵细胞的命运。细菌的胞壁质水解酶参与细胞壁生长和肽聚糖再循环,在特定信号作用下可导致细胞壁破坏和细胞溶解,亦称为“自溶素”。在表皮葡萄球菌中也存在与cid和lrg具有序列高度一致的基因,所以表皮葡萄球菌生物膜形成过程中可能存在与金黄色葡萄球菌相似的溶解调节机制[11]。
研究证实,一方面cid突变株导致胞壁质水解酶活性降低,lrg突变株可以引起胞壁质水解酶活性增强,说明cid、lrg操纵子编码了“类穿孔素”和“类反穿孔素”[12];另一方面,cid突变株溶解细菌能力缺失,产生的生物膜更加疏松,对表面物质黏附性下降,而lrg突变株的生物膜溶解作用增强,大量死亡细胞堆积,说明两种突变对生物膜的形成都有不利影响[5]。由于lrgA、lrgB是受其上游lytSR调控的,是共转录的,而lytSR操纵子只表达于G+菌,且高度保守,lrgB又位于lrgA的下游,研究鱼腥草素钠及其与红霉素联用对lrgB的影响,就便于了解药物对细胞溶解死亡和生物膜形成可能的作用。
本研究发现,鱼腥草素钠及其与红霉素联用在作用伊始(1 h),对lrgB有显著上调作用(图1-A)。lrgB过量表达使细菌裂解死亡受阻,因此推测该阶段药物是通过抑制细菌分裂,降低细菌的黏附性发挥作用。在作用6、12、24和48 h时,亚抑菌浓度的鱼腥草素钠与红霉素联用,对lrgB表达亦有显著下调作用(图1-B、C、D及E),表明在这几个时间段,它们主要是通过引起细菌溶解死亡、破坏和溶解生物膜结构来发挥作用;形态学观察亦证实了药物作用效果的存在(图2-4)。
目前,在治疗感染性疾病方面,一般首选抗生素杀死细菌以控制感染。然而抗感染治疗是一个漫长的过程,治疗过程中抗生素的使用会导致病原菌对这些常规药物逐渐产生耐药性。院内感染分离株中,对万古霉素中度耐药的表皮葡萄球菌亦已出现并逐渐增多[13]。而中药在抗细菌生物膜方面具有独特的优势[14]。在人类面临细菌耐药性和抗生素不良反应不断增加的严峻形势下,对抗感染中药的研究与探索就显得更加重要与迫切[15]。
中药及其有效成分对细菌耐药具有逆转作用并可减轻细菌选择压力,较少出现耐药,在细菌细胞内作用途径多样化,能产生多方面的药理效应。但由于中药杀菌作用弱,起效慢等特点限制了其在临床上的选用。鉴于细菌生物膜的结构与功能特点, 选择中药与抗生素联合使用,一方面中药发挥作用途径多样化、减缓和消除细菌耐药性;另一方面抗生素发挥其杀菌作用强、起效快的特点,二者联用可成为药物减量增效的一种选择。希望本研究以及本课题组的前期研究[16-20]能为中药及中西药联用治疗表皮葡萄球菌引起的相关感染提供实践参考。
