在乳腺癌细胞中构建CRISPR多基因编辑系统
2020-04-22梅义王真戴晓峰
梅义, 王真, 戴晓峰
(1. 江南大学 生物工程学院, 无锡 214122; 2. 江南大学 医学院, 无锡 214122)
CRISPR技术作为一种常见的基因编辑手段被使用于在各个领域中,其中对于没有剪切活性的CRISPR-dCas9编辑系统的应用同样越来越广泛[1-5]。例如在微生物中,有团队利用CRISPR-dCas9基因编辑系统在链霉菌中实现了多基因的抑制[4];在植物中,基于CRISPR-dCas9系统实现了多重转录激活或者抑制效果[6]。但是在乳腺癌研究中,关于CRISPR-dCas9多基因编辑系统的应用却鲜有报道。乳腺癌是严重威胁女性健康的肿瘤疾病之一,也是全球女性中发病率最高的肿瘤疾病[7-8],如果在乳腺癌研究中构建一套简单、高效、精确、可靠的基因编辑技术,将有利于肿瘤基础研究。
2006年,Takahashi等[9]首次发现导入特定的转录因子OCT4、KLF4、MYC和SOX2,可以将已经分化的细胞重新编程,使已分化的细胞回归到胚胎细胞状态,得到了具有重新分化潜力与自我更新能力的多能干细胞,这4个基因诱导形成的多能干细胞也成了科研人员所常用的细胞模型[10-11]。在本研究中,作者通过将tRNA与sgRNA串联组合,构建了一套CRISPR-dCas9多基因编辑系统,并在MCF7、SUM149PT细胞系中对OCT4、KLF4、MYC和SOX2 4个转录因子进行调控,进一步在基因表达、蛋白表达以及功能改变3个层次进行检测,以此验证系统的稳定与可靠性。
1 材料与方法
1.1 材料
实验所用细胞系MCF7、SUM149PT来源于美国模式菌种收集中心(American Type Tissue Culture Collection,ATCC);DMEM、F12培养基购于HyClone公司,胎牛血清(Fetal Bovine Serum, FBS)购于Lonsera公司;CRISPR相关编辑质粒购于爱必梦生物科技有限公司;CCK-8检测试剂盒购于东仁化学公司;ALDEFLUORTM试剂盒购于STEMCELL Technologies公司;超纯RNA提取试剂盒、反转录试剂盒以及荧光定量PCR试剂盒购于Takara公司;GAPDH、OCT4、KLF4、MYC及SOX2抗体购于Proteintech公司。
1.2 方法
1.2.1 多基因串联质粒的构建
利用内源性tRNA自剪切系统的原理来改造构建多串联sgRNA (single guide RNA),将构建好的多基因多sgRNA片段用BbsI单酶双切处理后同载体质粒进行酶切连接,得到4基因串联好的目的质粒。4基因的sgRNA序列如下:

基因sgRNA1sgRNA2OCT4GGAAAACCGGGAGACACAACGGATGTTTGCCTAATGGTGGKLF4CTCTTTCCGCCTGTTCCCGGCAGTTCACGCTGCACAGTGSOX2AAACAGCACTAAGACTACGTGCCCCCTTTCATGCAAAACCMYCAGCTAGAGTGCTCGGCTGCCGAACCCGGGAGGGGCGCTTA
1.2.2 细胞培养与转染
细胞系MCF7用含有10%FBS的DMEM培养基,细胞系SUM149PT用含有5%FBS的F12培养基,置于37 ℃,5%CO2的细胞培养箱中进行培养。将构建好的CRISPR质粒与LipofectamineTM2000按1∶3转入到细胞中,转染4 h后换新鲜培养基,24 h后添加200 mg/mL的G418与0.1 mg/mL的puromycin抗生素筛选。
1.2.3 实时定量qPCR
将6孔板内转染好的细胞用Trazol消化下来后,使用RNA提取试剂盒按步骤提取总的RNA,取1 μg提取的RNA使用反转试剂盒进行操作即得到cDNA,将cDNA稀释成终浓度为10 ng/μL,按反应布局向96孔板或八孔条中加入8 μL PCR反应混合液,再加入2 μL模板cDNA溶液,用透明胶膜封好96孔板或用8孔条盖封好8孔条,用Vortex震荡混匀后离心收集溶液到管底,按PCR程序用ABI 7500运行PCR反应。各基因的qPCR引物如下:

基因正向引物(5′-3′)反向引物(5′-3′)OCT4GGGAGATTGATAACTGGTGTGTTGTGTATATCCCAGGGTGATCCTCKLF4CGGACATCAACGACGTGAGGACGCCTTCAGCACGAACTSOX2GCTTAGCCTCGTCGATGAACAACCCCAAGATGCACAACTCMYCGGCTCCTGGCAAAAGGTCACTGCGTAGTTGTGCTGATGTERCAGGCATTCGGTTTGATGAGTTTGGACGAAGTACAGTTCCCGHER2TGTGACTGCCTGTCCCTACAACCAGACCATAGCACACTCGGGAPDHCCCACTCCTCCACCTTTGACATGAGGTCCACCACCCTGTT
1.2.4 Western Blot检测
胰酶消化细胞离心后用预冷的磷酸盐缓冲液重悬洗涤,加入100 μL细胞裂解液(加入1%的PMSF)吹吸混匀后放置于冰上裂解10 s左右,10 000 r/min 4 ℃离心5 min,得到上清液后加入5×loading buffer,煮沸5 min,冷却后即可上样跑胶,结束后转膜,200 mA恒流转膜90 min,转膜结束后,用TBST洗涤3遍后用封闭液(TBST加5%BSA配制)室温封闭120 min,再洗涤3遍膜,置于一抗稀释液中过夜,再洗涤3次后置于二抗稀释液中120 min,随后添加显色液上机检测。
1.2.5 细胞迁移实验
将细胞铺板于6孔板待其长满后,吸取培养基,用枪头在孔中划直线,用PBS清洗3遍后加入含1%血清的培养基培养。分别在0、8、16和24 h拍照记录。
1.2.6 细胞增殖实验
将细胞铺板于96孔板,每孔细胞数为4000个,分别在24、48及72 h后重新换液后添加5 μL的CCK8试剂,并于37 ℃孵育2 h后置于450 nm处测定吸光度。
1.2.7 干细胞比例检测
将细胞铺板于6孔板中,每孔接种3×105个,待其处理后放入CO2培养箱中培养24 h,吸去培养基,用PBS清洗2次后用无EDTA的胰酶消化,1000 r/min,离心5 min后弃掉上清液,用PBS重悬;1000 r/min离心5 min后弃上清,添加分析缓冲液重悬细胞,制5×105cells/mL的细胞悬液,每500 μL悬液作为一个细胞样品;分别取500 μL细胞悬液加入到两个管子中,其中一个管子要先加入10 μL二乙氨基苯甲醛(DEAB),然后再分别加入2.5 μL活化的氟硼二吡咯-氨基乙醛-乙酸氨基丙二酸二乙酯(BAAA),混匀,37 ℃避光孵育30~40 min,1000 r/min,离心5 min后弃掉上清液,每个管子用500 μL分析缓冲液重悬细胞,制备好细胞样品;将流式管低温,避光放置使用流式细胞仪检测干细胞比例。
2 结果与分析
2.1 CRISPR-dCas9多基因编辑系统的构建
内切酶RNaseP与RNaseZ两种酶可以特异性识别tRNA[12]两端序列从而达到剪切的作用。通过设计,将OCT4、KLF4、MYC及SOX2 4个转录因子的sgRNA与tRNA相连接构建成串联的sgRNA质粒,再配合没有酶切活性的C端修饰有协同激活介质(SAM)的dCas9-SAM质粒转染进乳腺癌细胞内,就可以实现同时调控多个基因的目的,其后通过抗生素筛选并进行单细胞培养即可得到基因编辑后细胞。实验结果显示,通过CRISPR-dCas9系统调控,MCF7细胞形态明显变化,显示出了外部形态上的差异,出现了多能性干细胞外部特征(图1)。将其命名KMSO。以上结果初步揭示,CRISPR-dCas9多基因编辑系统构建成功并正常工作。
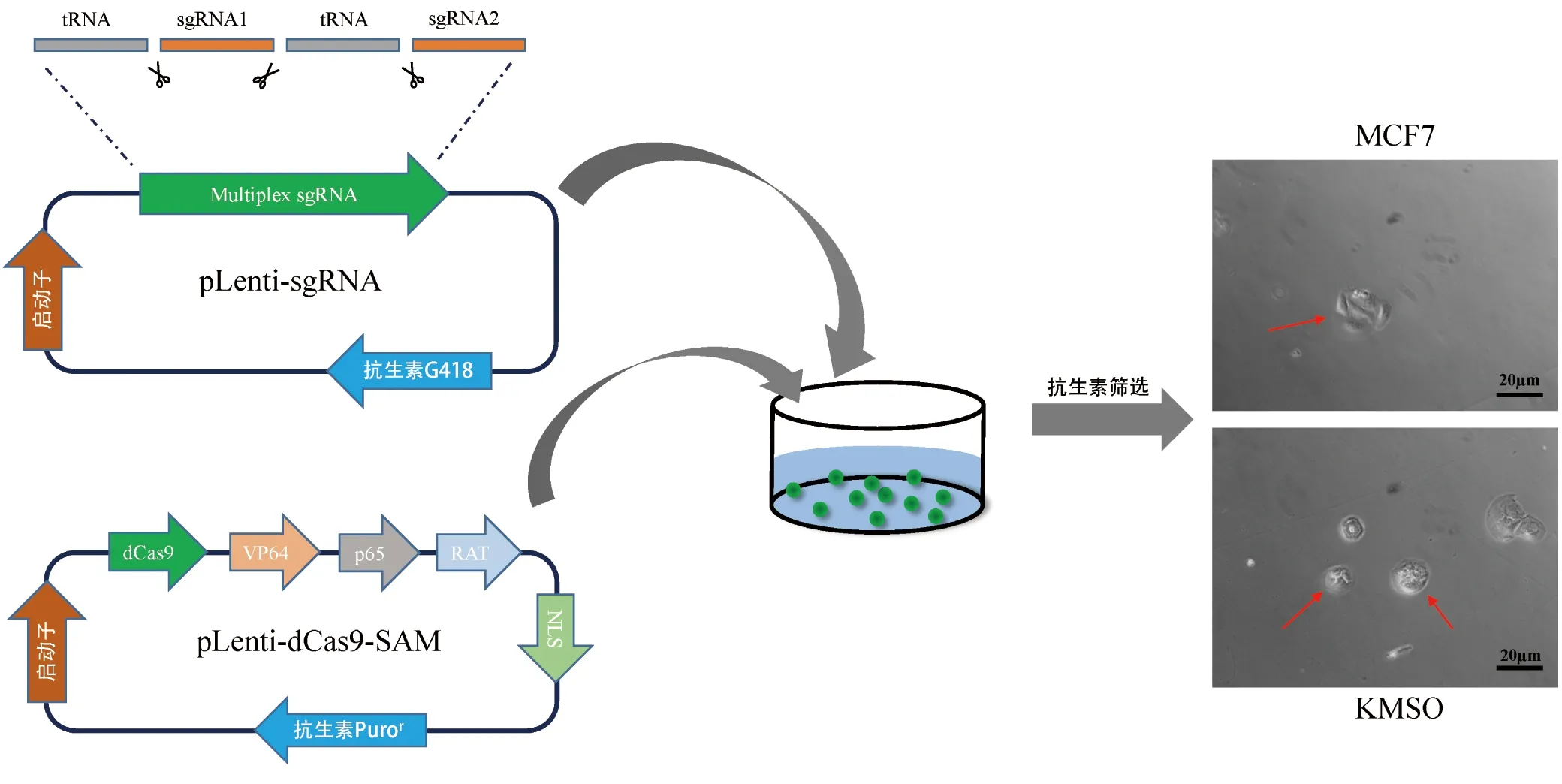
图1 串联质粒的构建与表达
2.2qPCR与Western Blot结果分析
将MCF7、SUM149PT细胞通过CRISPR-dCas9基因编辑技术高表达OCT4、KLF4、MYC和SOX2 4个基因后进行转录水平检测。qPCR实验结果(如图2-A和图2-B)显示,在MCF7细胞中,4个转录因子的表达量相对于对照组都提高至少2倍以上,其中KLF4基因的表达量更是达到16倍(P<0.001),在SUM149PT细胞中,4个基因的表达量在基因编辑前后也发生了明显的变化(P<0.001)。qPCR实验结果在转录水平验证了CRISPR-dCas9基因编辑系统的成功构建。选择MCF7细胞系进行Western Blot实验检测,结果显示其蛋白表达层次与基因表达层次一致(图2-C),将蛋白检测结果通过灰度值量化分析软件统计后得到图2-D,结果显示各基因蛋白表达至少提高了2.62倍,Western Blot实验结果在蛋白表达水平证明了CRISPR-dCas9多基因编辑技术在乳腺癌细胞MCF7中可以同时调控多达4个基因,实现了多基因编辑的目的。
2.3MCF7细胞在基因编辑后增殖、迁移和干细胞比例的变化
MCF7细胞在CRISPR-dCas9多基因编辑技术下使得OCT4、KLF4、MYC和SOX2 4个基因高表达。通过细胞划痕实验发现,在培养8、16及24 h后,其迁移能力明显的增强(图3)。通过CCK8试剂测定后发现KMSO细胞的增殖能力显著增强,细胞的存活率提高50%(图4-A),同时通过流式细胞仪测定被荧光标记的乙醛脱氢酶(ALDH)的活性底物BAA(BodipyTM-aminoacetate),结果显示KMSO细胞的干细胞比例明显增大,干细胞比例由2.57%增加到18.5%(图4-B)。以上结果进一步表明CRISPR-dCas9多基因编辑技术在乳腺癌细胞中实现了编辑目的,使得MCF7细胞恶性程度增大。
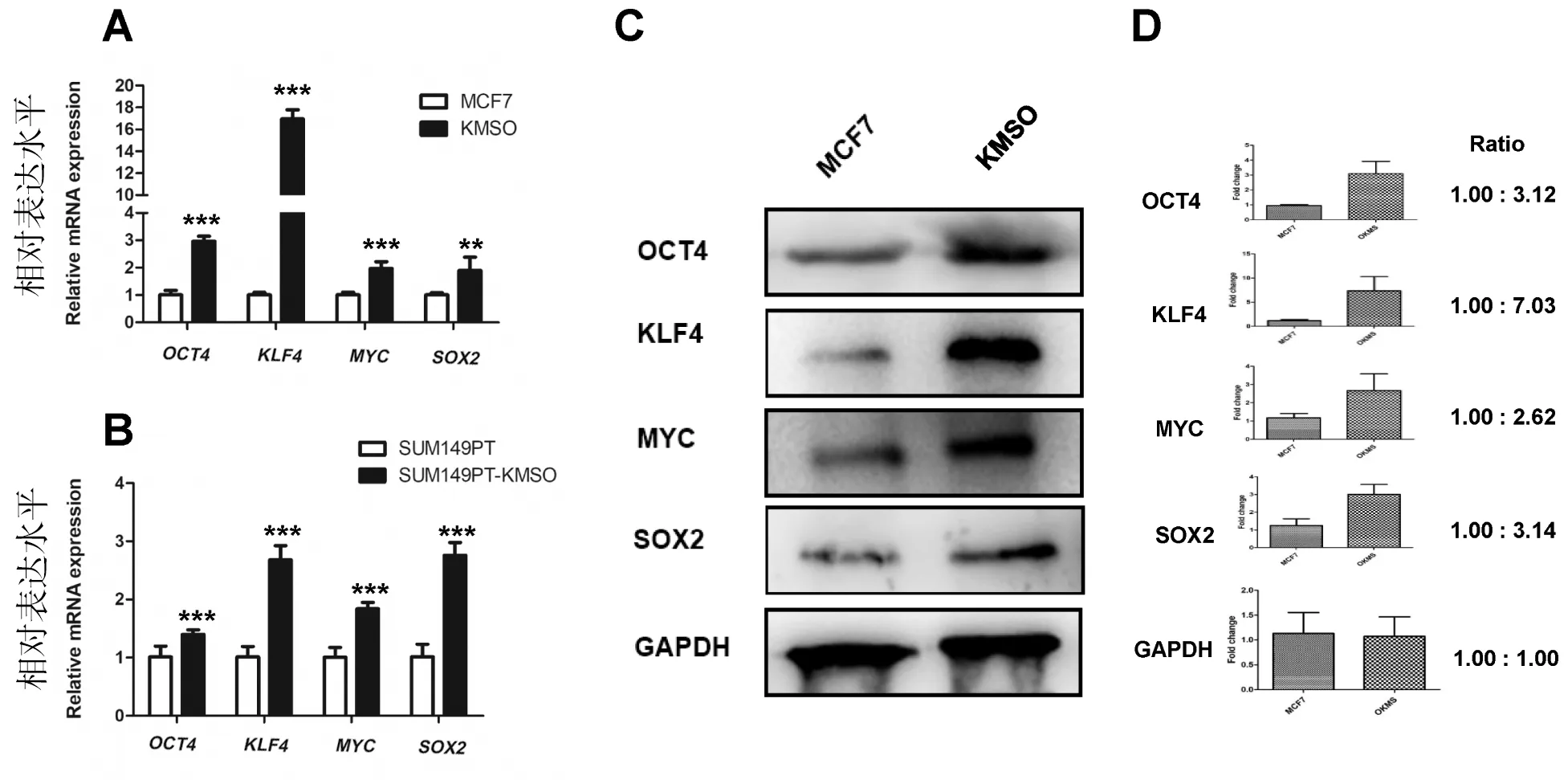
A:MCF7细胞转录水平的检测;B:SUM149PT细胞转录水平的检测;C:MCF7细胞蛋白水平检测;D:MCF7细胞蛋白表达量化图。* P < 0. 05; **P < 0. 01; ***P < 0. 001
图2 重编程细胞的转录水平与蛋白水平表达
Figure 2 Transcription level and protein level expression in reprogrammed cells
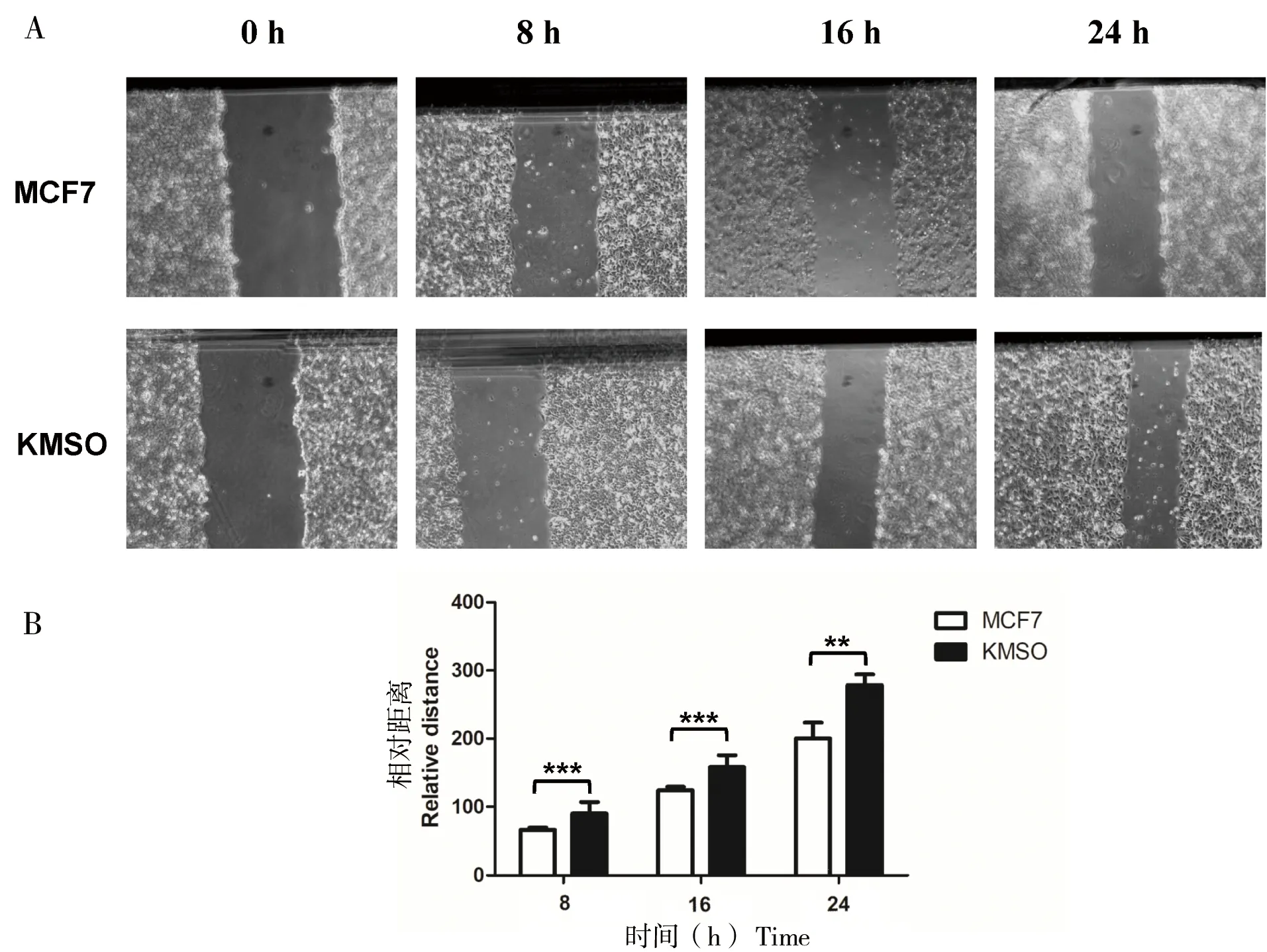
A: MCF7与KMSO细胞划痕实验图;B:划痕实验量化图。* P < 0. 05; **P < 0. 01; ***P < 0. 001
图3 细胞重编程对MCF7迁移能力的影响
Figure 3 Effect of cell reprogramming on MCF7 cell migration
3 讨论与结论
本研究中采用了被广泛使用的CRISPR编辑技术[1,3,5,12-13],此项技术被不断的优化与改进[14]并被应用在不同的物种中。例如,Xie等利用内源性tRNA剪切系统可以准确地切割tRNA前体的两端,将其设计成一个简单、通用的平台,提高了CRISPR/Cas9系统的靶向性和多重编辑能力,并且在水稻中成功的证明了该系统可以指导Cas9编辑多个染色体靶点[15]。亦有报道称将dCas9系统优化后,可以在体内精确地转录激活神经系统中的多个基因和长链非编码RNA,此技术在转基因小鼠上得到验证,为科研工作提供了一个灵活、快速的筛选平台[16]。而在乳腺癌的研究领域中,使用CRISPR多基因编辑系统的报道相对较少[17-18],本实验则提供了一套标准、精确、可复制、高效的基因编辑工具,可以实现在乳腺癌细胞中多个基因的同时调控,为接下来的科研工作提供了基础且强大的基因编辑平台。
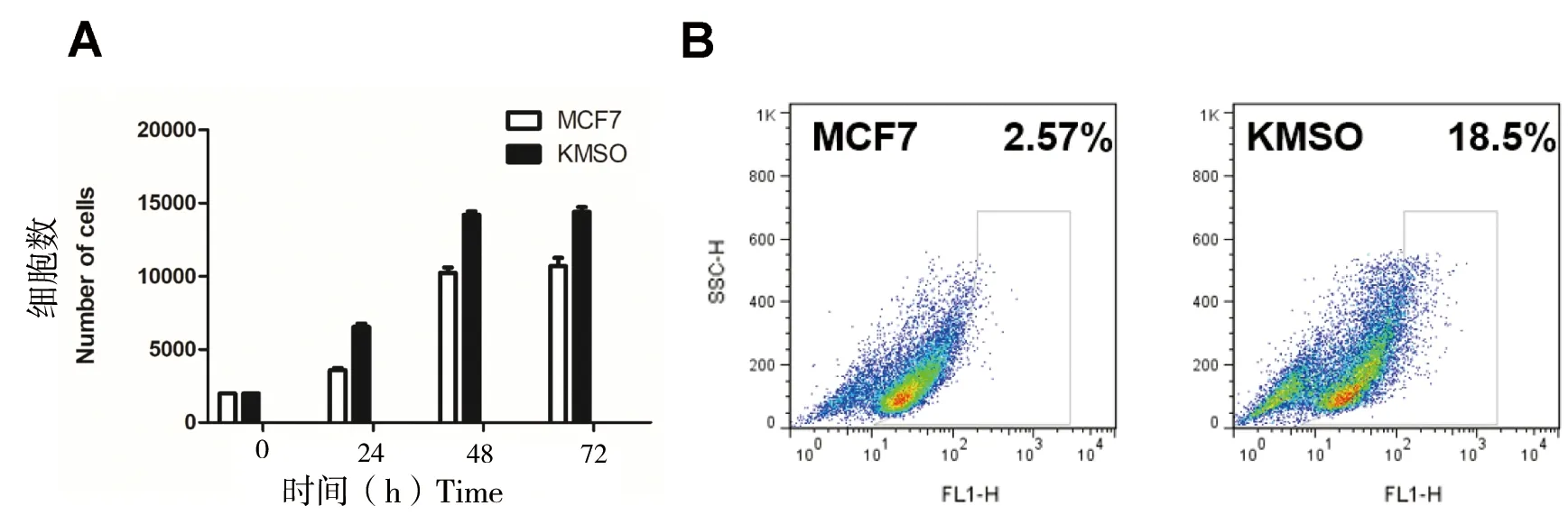
A: MCF7与KMSO对细胞增殖的影响; B:流式细胞术检测MCF7与KMSO的干细胞比例
图4 细胞重编程对MCF7与KMSO细胞增殖和干细胞比例的影响
Figure 4 Effect of cell reprogramming on MCF7 and KMSO cell proliferation and stem cell ratio
Takaishi等人报道通过重编程OCT4、KLF4、MYC和SOX2 4个转录因子使得鳞状细胞癌发生了上皮间质转化,并且发现了这种重编程降低了肿瘤的恶性程度[19]。而在本研究中,通过CRISPR/dCas9多基因编辑系统,成功在MCF7、SUM149PT细胞系中实现了4个转录因子的调控,并且使得MCF7细胞发生了分化[20]改变程度,得到了一株高分裂、高增殖及高干性的新细胞系KMSO。初步说明了不同分化程度的乳腺癌亚型之间与OCT4、KLF4、MYC及SOX2存在着一定的调控关系。这为低分化、高干性乳腺癌寻求转化成高分化,低干性的乳腺癌而获得有效治疗提供了一个治疗策略。
综上所述,本研究通过在乳腺癌细胞系MCF7、SUM149PT中高表达OCT4、KLF4、MYC和SOX2 4个细胞重编程转录因子,并且在基因表达、蛋白表达以及功能改变3个层次进行验证,揭示了CRISPR/dCas9多基因编辑系统的成功构建,为后续乳腺癌研究工作提供了基本的实验工具。
