头穴围刺结合运动疗法对脑梗死大鼠血管新生机制的影响*
2020-04-22佟晓薇韩盛旺孙琦月栾凯迪朱红奇齐慧敏马祺昊李虹霖
师 帅,佟晓薇,韩盛旺,孙琦月,栾凯迪,朱红奇,齐慧敏,马祺昊,李虹霖△
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
脑梗死在全球有较高的发病率和死亡率[1],其中85%~87%为缺血性卒中[2],与人类追求健康生活相背驰。研究表明脑缺血发生后若在梗死灶的缺血半暗带有血供的恢复,则可明显改善缺血区周围的组织灌注,缩小脑梗死面积,重建血管微循环,使神经功能快速修复[3]。经典的Wnt/β-catenin信号通路在细胞的增值中发挥着关键的作用,并与血管新生有密切的联系,β-连环蛋白(β-catenin)是血管新生相关通路Wnt/β-catenin中的效应因子,在Wnt信号通路中,作为核心的β-catenin分子可以与转录因子Tcf/Lef结合,诱导cyclin D表达[4],从而促进内皮细胞增殖。GSK-3β是糖原酶激酶的限速酶,参与了Wnt/β-catenin信号通路,其生物学作用与血管新生过程密切相关[5-6]。大量研究已经证实,生长因子相关基因VEGF是Wnt/β-catenin信号通路的靶基因,梗死脑组织中若有VEGF的升高则可能有新生血管的生成。本实验通过头穴围刺结合运动疗法干预大脑中动脉梗死(Middle cere-bral artery occlusion,MCAO)大鼠,观察β-catenin、GSK-3β和VEGF蛋白水平的变化,探索其促进血管新生的机制。
1 材料与方法
1.1 实验动物及分组
选用健康雄性Wistar大鼠,体质量(260±20)g,75只,由哈尔滨医科大学附属第二医院实验动物中心提供,动物使用许可证号SCXK(黑)2019001。大鼠随机分为假手术组、模型组、头穴围刺组、运动组、围刺+运动组,每组15只。按组别饲养于笼子中统一喂养由动物中心配制的鼠粮和水,保持正常的12 h白天和黑夜交替周期。
1.2 主要试剂及仪器
1.2.1 相关抗体 β-catenin(Cat.No.51067-2-AP);GSK-3β(Cat.No.22104-1-AP);VEGF(Cat.No.19003-1-AP);β-actin(60008-1-lg);Proteintech(武汉三鹰生物技术公司)。
1.2.2 PCR试剂盒 实时定量PCR试剂盒:SYBR®Premix Ex TaqTM II(Perfect Real-time)(TaKaRa);cDNA制备试剂盒:Transcriptor First Strand cDNA Synthesis Kit(Roche)。
1.2.3 PCR主要仪器 PCR热循环仪(Applied Biosystems公司);梯度PCR热循环仪(Eppendorf公司);超低温冰箱(Thermo Scientific公司);掌上离心机(Eppendorf公司);实时荧光定量PCR仪(ABI)。
1.2.4 western blot试剂 蛋白酶抑制剂(Roche公司);丙烯酰胺(Amresco公司);甲叉(Amresco公司);过硫酸铵(Sigma公司);巯基乙醇(Sigma公司);PVDF膜(Merck Millpore公司);3M滤纸(Whatman公司);Page Ruler Plus Prestained Protein Ladder(Fermentas公司);甲醇(国药集团化学试剂有限公司)。
1.2.5 western blot仪器 高速台式离心机(EP);荧光显微镜(Zeiss);恒温水浴锅(天津泰斯特公司);涡旋振荡器(Thermolyne);紫外凝胶检测盒成像系统(Bio-Rad);垂直板电泳及转膜系统(BIO-RAD);Odyssey红外荧光扫描成像系统(Li-COR)。
ZH-PT型动物实验跑台(徐州利华)。
1.3 模型制造及筛选方法
1.3.1 模型制造 MCAO模型的制备参照Zealand-Longa报道的线栓法[7],大鼠测量体重后用10%的水合氯醛0.3 mL/100 g腹腔注射麻醉,在大鼠颈部正中的位置切约2 mm的切口,将右侧颈总动脉(Common carotid arternal,CCA)、颈内侧动脉(Internal carotid artery,ICA)和颈外侧动脉(External carotid artery,ECA)分离。结扎ECA分支和CCA近心端,在CCA剪一细小切口并将线栓插入ICA,最后将线栓与CCA一并结扎,30 min后去除栓线并缝合。假手术组不插入栓线,术后回笼饲养,不予任何治疗,只予以同等条件抓取。其余各组均进行MCAO制备。
1.3.2 筛选方法 术后大鼠清醒后采用Zea-longa神经功能评分法进行评分,无神经功能缺损表现为0分;轻微局灶性神经功能缺损,不能完全伸展左前肢,提尾悬吊时左前肢屈曲为1分; 中度局灶性神经功能缺损,爬行时向左侧转圈,追尾为2分;重度局灶性神经功能缺损,爬行时向左侧倾倒为3分;不能独立行走,意识障碍为4分。1~3分者为造模成功,可纳入试验。
1.4 治疗方法
1.4.1 头穴围刺组 造模后24 h进行头穴围刺治疗。根据大鼠针灸穴位定位法及拟人比照法定位,以病灶区即大脑中动脉支配区为中心在其边缘采用5根0.25 mm×13 mm的针灸针围刺(穴位详细说明:以百会穴为点向外侧引1条1 cm的直径做一圆周,5个进针穴位中1个为百会穴其余在圆周上五等分的各点上),针尖朝向圆心[8]。每日1次,30 min/次。每10 min捻转1次。
1.4.2 运动组 造模后24 h,利用跑台训练运动治疗(术前已经经过为期3天的适应性训练,每天10 min)。时间:30 min/天;速度:1~3天8 m/min,4~7天12 m/min,7天后15 m/min;坡度:0°;1次/天[9]。
1.4.3 围刺+运动组 造模后24 h在头穴围刺留针下进行跑台训练,每日1次,训练方法同头穴围刺组和运动组。
1.5 行为学评估
采用改良神经功能缺损评分(modified Neurological Severity Score,mNSS),mNSS行为学评分主要用于检测小鼠运动、感觉、平衡、反射等一系列能力,评分量表的分值由0~14分,分数越高代表神经功能缺损越严重[10]。各组小鼠于14天后进行mNSS行为学检测,并予以记录。
1.6 脑梗死面积比
将脑组织置入-20℃冰箱中冷冻5 min后切成厚度为2 mm的5层冠状切片,37℃避光下放入2%的TTC磷酸盐缓冲液里30 min,染色成功后用4%多聚甲醛固定保存,此时,正常脑组织应为红色,梗死部分脑组织为白色。用数码相机拍照后将图像输入计算机,利用Image-Pro Plus 5.1软件进行分析,使用校正后的 Swanson[11]方法计算梗死面积,计算公式:脑梗死面积比=(片健侧总面积-片患侧非梗死区面积)/二倍的片健侧总面积×100%。
1.7 RT-PCR法检测大鼠脑组织β-catenin mRNA和GSK-3β mRNA表达水平
用总RNA提取试剂盒提取脑梗死区脑组织总RNA,应用Promega公司提供的逆转录试剂盒按说明书合成cDNA,选择相应引物扩增基因,序列如下:β-catenin F-GGCAGCAACAGTCTTACCT,R-CATACAGGACTTGGGAGGT;GSK-3β F-GGGGCAACCTTAATTTCATT,R-GTGTCTGTATAACTGACTTC。使用1.5%琼脂糖凝胶电泳检测PCR产物,结果照相保存。
1.8 Western Blot检测VEGF蛋白表达
大鼠断头取脑,将组织匀浆裂解,离心去沉淀,取上层清液。按照BCA试剂盒要求测量蛋白质浓度,取等浓度等体积上样变性蛋白,SDS-PAGE(10%)电泳2 h后,半干转膜法转移到PVDF膜上,用含5%脱脂奶粉的TBST封闭2 h,一抗孵育过夜,VEGF(1∶1 000稀释),温度保持4℃,TBST清洗膜5次×5 min,加入二抗(1∶8 000稀释)室温孵育2 h,TBST清洗5次×5 min,用ECL显色,于数字成像系统下显影,采用Image J检测条带密度。实验重复3次。
1.9 统计学分析
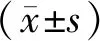
2 结果
2.1 各组大鼠mNSS神经功能缺损评分
治疗14天后,与模型组相比,各治疗组评分均低于模型组(P<0.01);头穴围刺+运动组评分低于头穴围刺组和运动组,差异具有统计学意义(P<0.01)。结果见表1。
2.2 脑梗死面积比
用TTC染色法可将大鼠正常脑组织染成红色,梗死脑组织染成白色,实验结果表明,假手术组无脑梗死,其它各组均有不同程度的脑梗死,各治疗组脑梗死面积比均小于模型组(P<0.01);围刺+运动组脑梗死面积比小于头穴围刺组和运动组(P<0.01)。结果见表1、图1。
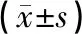
表1 各组大鼠神经功能缺损评分、脑梗死面积比比较
注:与模型组比较,aP<0.01;与围刺+运动组比较,bP<0.01。
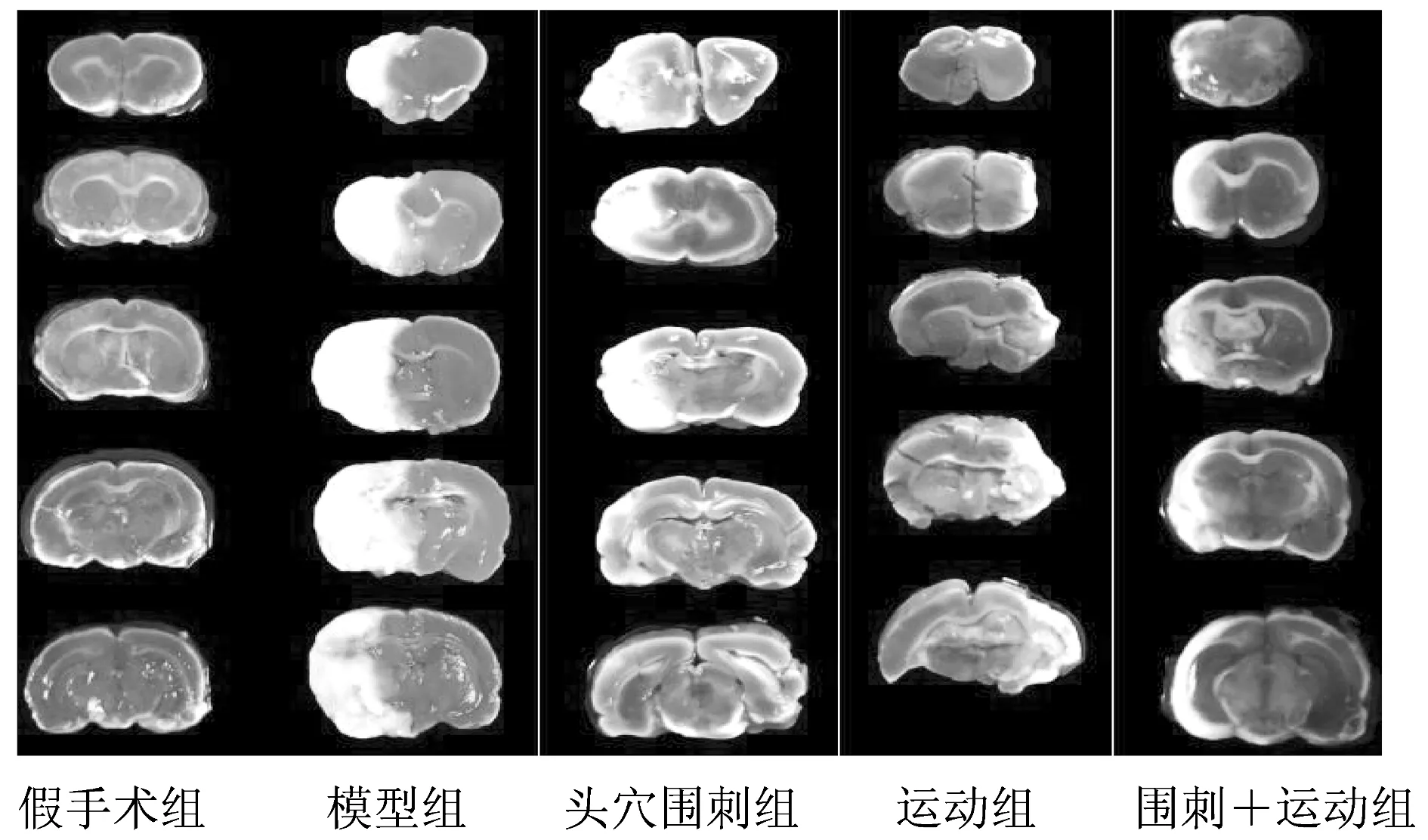
图1 大鼠脑梗死面积(TTC染色)
2.3 血管新生相关蛋白β-catenin mRNA、GSK-3β mRNA表达水平
实验结果表明,与假手术组比较,其它各组β-catenin mRNA表达高于假手术组,围刺+运动组表达高于头穴围刺组和运动组,P<0.05;与假手术组相比,GSK-3β mRNA表达只有模型组高于假手术组,其中围刺+运动组表达最低,差异具有统计学意义(P<0.01)。结果见图2。

图2 各组大鼠β-catenin mRNA、GSK-3β mRNA水平
2.4 VEGF蛋白表达
由图3可知,假手术组、模型组、头穴围刺组、运动组和围刺+运动组的灰度越来越大,其中头穴围刺组和运动组差异不明显,围刺+运动组的灰度最大,则表明VEGF表达最高。

图3 各组大鼠VEGF蛋白表达
3 讨论
头针作为一种安全、有效的治疗手段,一直广泛地应用于脑血管疾病的康复过程中,头穴围刺是《内经》中扬刺的发展,是传统医学在现代研究中的应用,体现了传统中医近治作用的治疗原则,围刺头部病灶处有助于改善病灶周围的神经代谢,有助于脑部神经因子的生长,促进受损细胞恢复,提高脑内源性神经生长因子的激活能力,促进脑功能的恢复[12]。运动疗法作用于功能障碍的肢体,通过重复性的动作,反复刺激受损的中枢系统,提高脑功能及结构的重建。头穴围刺与运动疗法两者共同作用可加快恢复脑功能。
血管新生是近年来研究的一个热点,脑梗死发生后,重建缺血脑组织血流或是增加缺血区的血液供应是修复受损脑组织的重要条件。近年来研究发现,Wnt信号通路在炎症反映的调控和促进血管新生方面起重要的作用,其经典Wnt/β-catenin信号通路是近年来公认的与血管发生和新生密切相关的通路,关键分子是β-catenin,β-catenin分子水平受GSK-3β、Axin、APC和CK-1所形成的复合物控制,当Wnt通路未激活时,β-catenin被GSK-3β所形成的复合物磷酸化,最终被蛋白酶降解。Wnt通路存在时,细胞质中Dsh被募集到细胞膜下,作用在GSK-3β复合物上使其不能形成,抑制β-catenin降解,使关键分子β-catenin进入细胞核与TCF/LEF结合,参与调控靶基因转录[13-14],激活靶基因VEGF。
实验结果表明,与模型组比较,脑缺血再灌注损伤模型大鼠在经过头穴围刺治疗、运动训练和围刺+运动治疗均可改善大鼠的神经功能障碍,缩小脑梗死面积,使血管新生相关蛋白β-catenin表达有所增多,进一步抑制了GSK-3β复合物的形成,上调大鼠脑组织损伤区VEGF的阳性表达,加速血管新生的生成。与头穴围刺组和运动组比较,围刺+运动治疗更加明显的改善大鼠神经功能障碍,有效缩小脑梗死面积,β-catenin表达明显升高,更加明显抑制GSK-3β生成,血管内皮生长因子VEGF表达明显增多。而头穴围刺组与运动组相比各项指标差异无统计学意义。
综上,围刺+运动组治疗的正向调节作用比单一头穴围刺和运动训练更强,提示围刺+运动疗法对脑缺血再灌注模型大鼠的血管新生机制的作用更明显。笔者根据文献资料推测在Wnt/β-catenin信号通路基础上上调梗死区β-catenin蛋白表达、下调GSK-3β表达的同时作用于靶基因VEGF,可能为血管新生机制之一,下一步会更加深入研究此条通路对血管新生机制的影响,为围刺+运动疗法的临床应用提供理论依据。
