水热法沉淀三价铁工艺条件对产物形态影响的研究
2020-04-22戴江洪孙宁磊
戴江洪,孙宁磊,岳 明
(1.中国恩菲工程技术有限公司,北京,100038;2.西宁国家低碳产业基金投资管理有限公司,西宁,810000)
有色金属湿法冶炼硫酸浸出工艺中,铁元素伴随着有价金属进入至溶液中。由于其化学性质,回收有价金属之前,一般都要先将铁去除。目前工业中除铁有很多方法,如黄钾铁矾法、中和除铁法、针铁矿法等等,这些方法都能有效保证铁的沉淀率。
铁在浸出过程中消耗硫酸,去除过程消耗中和剂,含铁较低的铁渣无法作为工业原料而被废弃堆存,不仅占地而且对环境构成了威胁。目前的除铁工艺方法皆将铁看作为杂质从主工艺中去除,而不是看做一种资源,这主要是由于无论采用哪一种方法,除铁后铁渣中铁含量都<45%,同时含有大量的杂质,比如铁矾渣中含有大量碱金属及硫等杂质,这样的铁渣不能作为工业原料使用。
针对这一问题,业界目前主要有三类研究路线,一是改变浸出方法,使得铁不浸出;二是采取不同的除铁方式,使铁渣可以直接作为产品;三是在现有除铁工艺下,研究铁渣的综合回收利用方法。其中,采用赤铁矿法除铁是第二类路线中的一种工艺,这种方法既能保证铁较高的沉淀率,又可以产出铁红产品出售。但由于这种方法工艺中需要高温高压的条件,其设备投资较高,工艺操作较为复杂,工业中目前很少使用。
日本秋田公司饭岛锌冶炼厂[1]是世界上唯一一家采用该工艺的企业。其所采用的赤铁矿法工艺,要先将铁酸锌中的三价铁采用二氧化硫还原为二价铁,在后续的工艺中中和除杂后再泵入高压釜内氧化沉淀。
此工艺中,将三价铁还原为二价铁再进行氧化沉淀的原因如下:铁酸锌的浸出较为困难,若采用还原浸出的方法则可以保证锌有较高的回收率;还原浸出后液存在镓、锗、铟等有价金属离子,三价铁还原后避免在中和沉淀回收过程中三价铁水解沉淀。还原工序是锌冶炼过程中较为特定的要求,但若将此方法进行推广至其他情况,还原工序的必要性需要斟酌,浸出后含有大量三价铁若直接沉淀成为赤铁矿[2],则使此方法更加经济可行。
本文对这一问题进行了深入研究,并在小型实验中获得了阶段性成果。本文介绍了硫酸盐溶液体系初始三价铁浓度、初始pH对沉淀产物物相的影响,为三价铁赤铁矿除铁工艺开发及优化提供了方向。
1 实验部分
1.1 实验原料
实验采用化学药剂均为分析纯,配制含不同浓度的Fe3+的硫酸高铁溶液,Fe3+浓度为10-30g/L,采用硫酸调节溶液初始pH值。
1.2 实验方法
取一定体积的上述溶液,采用硫酸调整初始pH值后,加入至2L容积的加压反应釜内,加热到一定温度,在相同搅拌速率下反应一段时间,真空过滤洗涤并烘干,取固体分析。
1.3 分析方法
低含量元素的测定:原子吸收光谱仪(GGX-600AAS),北京科创海光仪器有限公司;高含量元素的测定:化学滴定;产品物相:日本玛珂科学仪器公司(MAC Science Co. Ltd)的M21X超大功率X射线衍射仪。
2 实验结果及讨论
2.1 实验工艺条件对产物物相的影响
在固定温度200℃、初始pH=0.65及反应停留时间1.0h的条件下,对不同浓度Fe3+硫酸盐溶液沉铁反应后的产物进行了物相的定性分析。图1-5分别为Fe3+浓度为30g/L、25g/L、20g/L、15g/L和10g/L时获得沉淀产物的XRD图谱。

图1 CFe3+=30g/L时沉淀物的XRD图谱
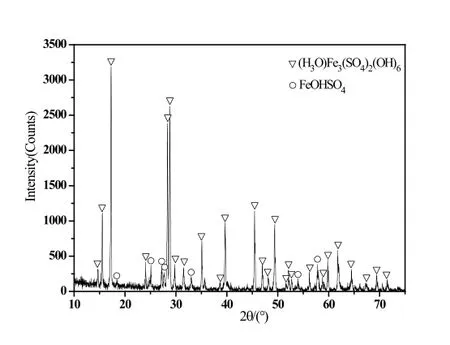
图2 CFe3+=25g/L时沉淀物的XRD图谱

图3 CFe3+=20g/L时沉淀物的XRD图谱
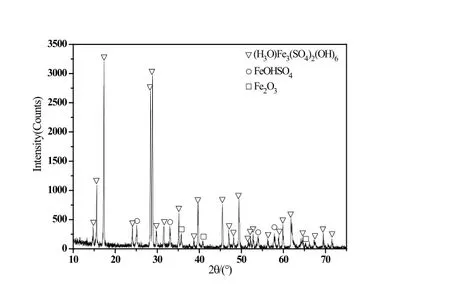
图4 CFe3+=15g/L时沉淀物的XRD图谱
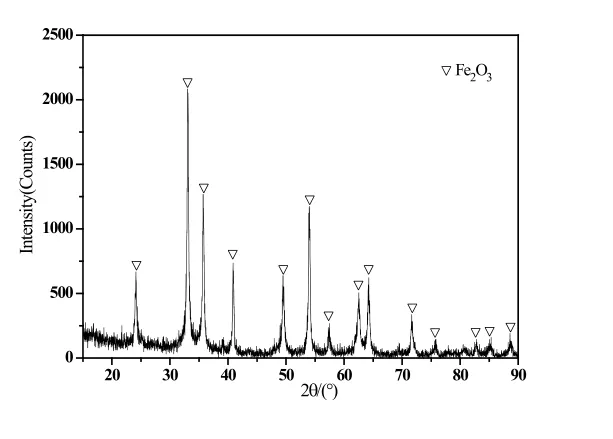
图5 CFe3+=10g/L时沉淀物的XRD图谱
Fe3+浓度等于30g/L的硫酸铁溶液经水热反应后所得沉淀的衍射图谱反应出了单一的碱式硫酸铁(FeOHSO4)相;Fe3+浓度等于25g/L时沉淀为以水合氢黄铁矾((H3O)Fe3(SO4)2(OH)6)相为主,并伴有少量碱式硫酸铁(FeOHSO4)相的混合物;当降低至20g/L时,情况基本与25g/L类似;Fe3+浓度等于15g/L的硫酸铁溶液经水热反应后所得沉淀的物相以水合氢黄铁矾((H3O)Fe3(SO4)2(OH)6)相为主,并伴有少量碱式硫酸铁(FeOHSO4)相并出现少量氧化铁(Fe2O3)相的混合物;Fe3+浓度等于10g/L的硫酸铁溶液经水热反应后则为单一的氧化铁(Fe2O3)相。图6从左至右依次为上述顺序的产物照片,从产物颜色对比也可以反映出形态的变化。

图6 不同Fe3+浓度下反应产物实物照片
在固定温度200℃、初始Fe3+浓度30g/L、反应停留时间1.0h的条件下,对初始pH不同情况下反应产物进行了物相定性分析。
图1、图7、图8所示pH分别为0.65、1.0、1.5情况下沉淀产物XRD图谱,对比看出pH为0.65、1.0情况下,沉淀为单一的碱式硫酸铁(FeOHSO4)相,提高pH后,出现了氧化铁(Fe2O3)相。结合下图9产物颜色,可以反应出这一变化。
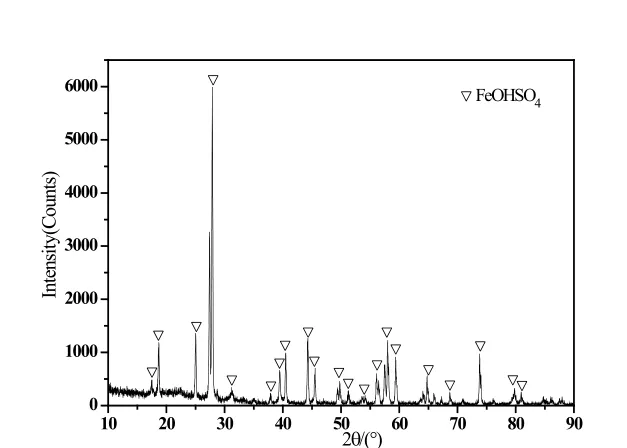
图7 原液pH=1.0沉淀物XRD图谱
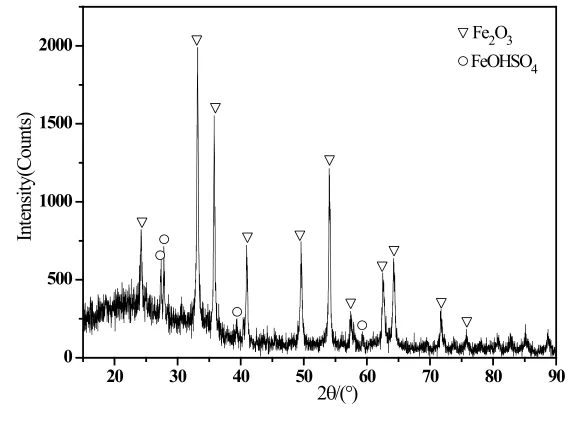
图8 原液pH=1.5沉淀物XRD图谱

图9 不同初始pH下反应产物实物照片
Fe2O3-SO3-H2O体系[3],温度高于120℃时,开始出现Fe2O3相,随着温度的进一步升高,Fe2O3的稳定区间逐渐增大,本研究中,温度选择在200℃下进行浓度及pH的实验。由Fe2O3-SO3-H2O体系200℃状态图可以计算出Fe2O3生成的Fe3+浓度边界条件,大约为25g/L左右。由Fe3+浓度条件实验可以看出,Fe3+浓度逐渐降低,产物的物相呈现碱式硫酸铁→水合氢黄铁矾→三氧化二铁的变化趋势。但似乎在15-20g/L浓度区间,才有Fe2O3相出现,这是由于状态图中未考虑到H+对平衡的影响。溶液酸度的降低有利于Fe3+沉淀Fe2O3,并促进了该体系溶液内其它的沉淀相向Fe2O3相的转化。由pH值条件系列实验的研究可以看出,在含酸的200℃下Fe2O3-SO3-H2O体系内,Fe3+浓度并非决定该体系溶液内能否由三价铁直接沉淀出氧化铁的唯一因素。
小釜实验中,初始浓度即为配制浓度,与此不同的是,工业生产中,加压釜的给料通过加压泵送入釜中,由于此氧化沉淀反应是一个快速反应,反应体系浓度要远远小于进料浓度,所以在一定pH的条件下,生成Fe2O3的Fe3+浓度上限可以提高。pH是生成Fe2O3的一个很关键的因素,可以看出,提高pH可以提高Fe3+浓度上限,但是,Fe3+浓度30g/L时计算可知,当pH=1.8左右时,Fe3+开始水解沉淀,生成了氢氧化铁,pH=3.2时沉淀完全,所以,反应中pH也是不能任意提高的。
3 结论
(1)在固定温度200℃、初始pH=0.65及反应停留时间1.0h的条件下,在三价铁浓度逐渐降低过程中,铁沉淀产物逐渐由碱式硫酸铁向三氧化二铁转变。
(2)在固定温度200℃、Fe3+浓度30g/L及反应停留时间1.0h的条件下,pH逐渐提高,铁沉淀产物逐渐由碱式硫酸铁向三氧化二铁转变。
