Mg2+和F-共掺杂提高LiNi0.8Co0.15Al0.05O2电化学性能
2020-04-21张文展邱小林陆志香
肖 和,张文展,邱小林,陆志香
(1.南昌理工学院机电工程学院,南昌 330044;2.南昌理工学院江西省光电材料重点实验室,南昌 330044; 3.南昌理工学院计算机信息工程学院,南昌 330044)
0 引 言
能源短缺与环境问题已成为世界性问题,为了缓解石油资源紧张与汽车尾气造成空气污染等问题,对替代传统燃油车的新能源汽车的开发已经到了刻不容缓的地步。目前,可作为新能源汽车动力能源包括太阳能、氢燃料、风能及锂离子电池等。其中最受人关注、应用范围最广的是锂离子电池。锂离子电池已广泛应用于移动电子设备,如手机、电脑、照相机。近年来,特别是自特斯拉诞生以来,锂离子电池在电动汽车行业的应用引起了人们的广泛兴趣。锂离子电池在电动汽车行业的应用要求其具有高容量、高稳定性和安全性。限制锂离子电池进一步发展的关键在于正极材料,常见的正极材料有LiCoO2、LiFPO4、Li2MnO4及三元材料LiNixCoyMnzO2(NCM)和LiNixCoyAlzO2(NCA)等。能满足高容量、高循环稳定性和安全性的正极材料屈指而数,其中,高镍系LiNi0.8Co0.15Al0.05O2正极材料表现出较高的放电比容量以及较好的稳定性受到人们的广泛关注。但该正极材料仍然面临诸多问题,如循环过程不可逆相变、离子混排和较差的热稳定等,限制了其大规模应用[1-4]。
提高锂离子电池正极材料性能的主要方法有表面包覆和体相掺杂。表面包覆是在正极材料颗粒表面包覆一层稳定的保护层,用于隔离电解液与活性材料,减缓界面副反应的发生,提高正极材料的循环稳定性[5-6]。表面包覆物主要有氧化物与非氧化物,常见的氧化物有SiO2、Al2O3及TiO2等,非氧化物有Al2(PO4)3、AlF3等。此外,常用的包覆物还有快离子导体,如Li2O-B2O3、Li2SiO3等。掺杂的作用是在正极材料基体引入其他元素以提高材料晶体结构的稳定性,降低阳离子混排,提高材料电化学性能,常用的掺杂元素有Mg2+,Na+,Mg2+,Zr4+,Ti4+等[7-9]。
据文献[10-11]报导,Mg2+掺杂可以强化O-Ni-O键,抑制NCA正极材料充放电循环过程中的相变,因此能稳定材料晶体结构,提高材料的循环稳定性。F-表现出较大的电负性,且具有与O2-相近的离子半径,用部分F-取代正极材料中的O2-,可以提高材料的结构稳定性。因此,本文采用固相烧结法将Mg2+和F-共同引入到NCA正极材料晶格,以提高NCA正极材料的循环稳定性,并研究共掺杂对材料结构、微观形貌及电化学性能的影响。
1 实 验
1.1 原料及仪器
实验所用Ni0.8Co0.15Al0.05(OH)2前驱体为商业化购买,LiOH·H2O(AR,98%)、NH4F(AR,98%)及Mg(NO3)2· 6H2O(AR,98%)均购自阿拉丁试剂。
1.2 实验过程
1.2.1 制备方法
将摩尔比为1∶1.05的Ni0.8Co0.15Al0.05(OH)2与LiOH· H2O研磨混合均匀,过量5mol%的LiOH·H2O是为了弥补高温烧结过程的锂损失。将研磨均匀的混合物置于箱式炉中,先450 ℃保温5 h,然后升温至750 ℃保温15 h,制备得到成品NCA样品,标记Bare(未掺杂)。对于Mg2+和F-共掺杂的样品,首先将适量的NH4F和Mg(NO3)2·6H2O溶于无水乙醇中,然后加入Ni0.8Co0.15Al0.05(OH)2,置于水浴锅80 ℃搅干,将获得的混合物配锂烧结,烧结制度同上。Mg2+和F-的掺杂量均为1mol%,样品标记为Mg-F-1(共掺杂)。
1.2.2 分析测试
样品的形貌利用美国Veeco公司生产Multimode NS-3a型扫描探针显微镜观察,采用放大倍数为100 000倍。XRD分析Mg2+和F-共掺杂对样品结构的影响,仪器为德国布鲁克公司 D-8 型 XRD 衍射仪(Cu Kα靶,λ=0.154 18 nm),扫描范围为10°~90°,扫描速度为2°·min-1。并用GSAS软件精修XRD数据,计算得出材料晶胞参数和离子混排程度。利用SEM观察样品的形貌和颗粒大小,型号为日本日立 (Hitachi) S-4800。通过2016型扣式电池测试材料的电化学性能。活性物质、乙炔黑和粘结剂(PVDF)按质量比8∶1∶1混合,滴入适量有机溶剂NMP,研磨成均匀糊状物后涂于铝箔上,置于真空干燥箱120 ℃干燥12 h。在氩气保护气氛的手套箱里,以金属锂为负极,以EC∶DMC∶EMC=1∶1∶1(体积比)的1 mol·L-1的LiPF6为电解液组装2016型扣式电池,在BTS-51 二次电池性能检测仪上测试样品的充放电性能;利用电化学工作站测量电池循环后的阻抗图,测试频率为100 kHz~10 mHz。
2 结果与讨论
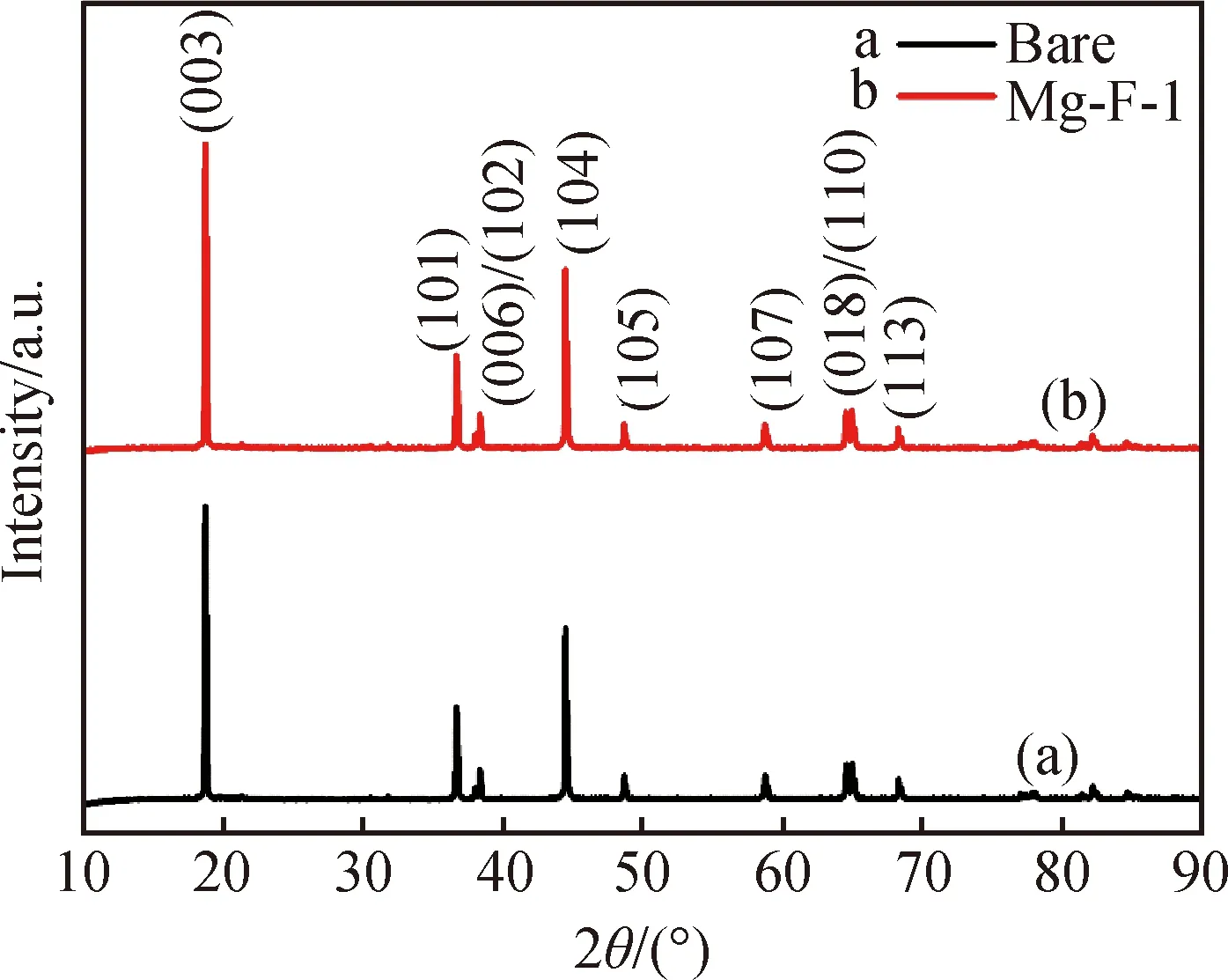
图1 Bare和Mg-F-1样品的XRD谱Fig.1 XRD patterns of bare and Mg-F-1 samples
图1为掺杂前后样品的XRD谱,从图中可以看出掺杂后正极材料的结构并未发生改变,属于六方层状α-NaFeO2结构(空间组群R-3m),(006)/(102)和(018)/(110)两对衍射峰分裂明显,表明材料具有良好的层状结构。共掺杂样品衍射峰无杂质峰,且峰型尖锐,强度较高,说明Mg2+和F-进入到基体材料晶格,掺杂未改变材料晶型和结晶度。为探究Mg2+和F-共掺杂对晶体结构的影响,采用GSAS软件对XRD数据进行精修(图2),精修结果如表1所示。较小的Rwp和Rp值表明实验数据与计算结果吻合度较高,说明精修数据是可靠的。和未掺杂样品相比,掺杂后的样品晶胞参数a和c有所增加,这利于Li+在晶胞中的扩散。未掺杂样品和Mg-F-1样品I(003)/I(104)比值分别为1.27和1.65,Mg2+和F-共掺杂样品的I(003)/I(104)比值比未掺杂样品大,说明掺杂样品具有更低的Li+/Ni2+阳离子混排。阳离子混排是造成材料电化学性能不佳的主要原因之一,Ni2+与Li+离子半径相近,Ni2+会占据Li位,阻碍Li+的扩散[12-13]。c/a值反应材料主体结构的三角扭曲程度,其值越大,表明材料的层状六方结构越完整,Mg-F-1样品的c/a值略大于未掺杂样品,且比值大于4.9,证明掺杂后样品具有序的α-NaFeO2结构[14]。以上结果表明Mg2+和F-进入基体晶格起到稳定晶格,减少阳离子混排的作用,这也可以从精修结果中占据Li位的Ni2+含量中得以证明,可以预想Mg-F-1具有良好的电化学性能。

表1 Bare和Mg-F-1样品的XRD数据精修结果Table 1 Rietveld refinement results of the XRD data for bare and Mg-F-1 sample
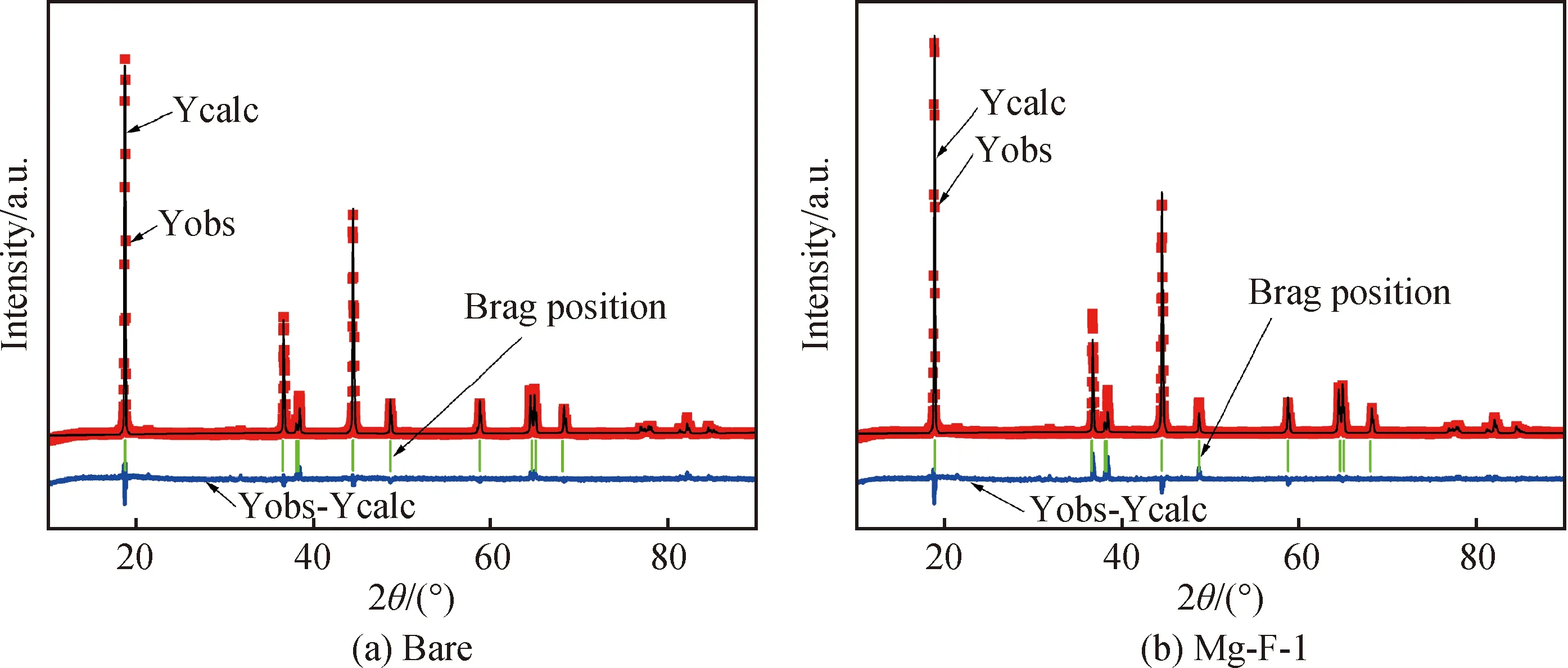
图2 XRD数据精修结构
Fig.2 Rietveld refinement patterns of XRD data
图3(a)、(b)分别是未掺杂(Bare)样品和Mg-F-1样品的SEM照片,从图中可以看出样品均由10~100 nm的小颗粒无规则团聚在一起组成,从图中可以看出,Mg2+和F-共掺杂前后样品的形貌无明显变化,这可能是掺杂量太少的缘故[15-16]。
图4(a)为样品在0.2 C倍率下的首次充放电曲线图,电压范围为2.8~4.3 V。未掺杂和Mg-F-1首次充电容量为224.1 mAh·g-1和214.1 mAh·g-1,首次放电比容量为184.0 mAh·g-1和183.3 mAh·g-1,效率分别为82.1%和85.1%。Mg2+和F-共掺杂后样品的首次放电比容量略有下降,但首次充放电效率明显提升,这表明Mg2+和F-共掺杂起到了稳定材料晶体结构的作用。图4(b)为样品1 C倍率的循环曲线图,200圈循环后,未掺杂和Mg-F-1样品分别具有74.1 mAh·g-1和144.1 mAh·g-1放电比容量,循环保持率分别为43.5%和83.1%。Mg-F-1样品表现出良好的循环稳定性,这归因于Mg2+和F-共掺杂稳定了材料的晶体结构,减缓了充放电循环过程中正极材料晶体结构的衰减。

图3 样品的SEM照片
Fig.3 SEM images of samples

图4 (a)样品在0.2 C下的首次充放电曲线;(b)样品在1 C下的循环曲线
Fig.4 (a) Initial charge/discharge curves at 0.2 C; (b) cycling performance of products at 1 C

图5 样品的倍率性能图Fig.5 Rate capability of obtained samples
图5为样品在2.8~4.3 V 下的倍率循环性能图,电池在0.2 C倍率下充电,然后在不同倍率下进行放电,每个倍率下循环5圈。在0.2~5 C时,Mg-F-1样品的放电比容量分别为183 mAh·g-1,175 mAh·g-1,171 mAh·g-1,165 mAh·g-1和158 mAh·g-1,相比与未掺杂样品的放电比容量184 mAh·g-1,175 mAh·g-1,170 mAh·g-1,159 mAh·g-1和150 mAh·g-1,其高倍率性能有较大的提升,这是由于Mg2+和F-共掺杂增加了Li层间距,利于Li+扩散,因此表现出较好的倍率性能[17]。
图6为未掺杂(Bare)样品和Mg-F-1样品前2次的循环伏安曲线(CV),扫描的电压范围为3.0~4.3 V,扫描速度为0.1 mV·s-1。从图中可以看出,曲线由一对大的氧化还原峰和两对小的氧化还原峰组成,分别对应的是H1↔M,M↔H2和H2↔H3相变。H2↔H3相变会使得材料产生较大的体积变化,进而生成较大的应力,最终导致材料产生裂纹,对材料的循环稳定性不利;而Mg2+和F-共掺杂后,H2↔H3相变峰强度降低,一定程度上减少了材料的相变应力,从而提高材料的循环稳定性。此外,循环伏安曲线氧化还原峰的峰值电位差ΔV反应材料的可逆程度和极化作用的强弱,ΔV越大,则说明材料极化程度越严重、相变可逆性差[18-19]。从图6中可以看出,Mg-F-1样品的极化程度要小于未掺杂样品,表明Mg2+和F-共掺杂利于稳定材料结构和有效抑制相变。
图6 Bare和Mg-F-1样品的循环伏安曲线
Fig.6 Cyclic voltammetry curves of bare and Mg-F-1 samples

图7 样品的电化学阻抗图Fig.7 EIS of all sampels
为进一步探究Mg2+和F-共掺杂提高正极材料循环稳定性的原因,对循环200圈后的电池进行了电化学阻抗(EIS)测试,如图7所示。从图中可以看出,所有样品的阻抗谱均由高频区和中频区的两个半圆,以及低频区的1条斜线组成。通常认为高频区的半圆对应的是膜阻抗(Rsf);中高频区的半圆对应的是电解液-电极界面位置的电荷转移阻抗(Rct);低频区的斜线为Warburg 阻抗,对应的是Li+在固相材料中的扩散阻力[19-22]。可以发现,掺杂前后样品的Rsf数值几乎无变化,无明显区别,但电荷转移阻抗值相差较大,未掺杂样品的Rct值为900 Ω左右,明显高于Mg-F-1样品的575 Ω,这表明Mg2+和F-共掺杂有利于抑制电荷转移阻抗的增加,因此提高了材料电化学性能。
Mg+和F-共掺杂LiNi0.8Co0.15Al0.05O2电化学性能提升及电化学阻抗变好的原因归结如下:(1)Mg2+和F-共掺杂增大了Li层间距,利于Li+扩散;(2)Mg2+和F-起到稳定晶体结构作用,减少了极化,抑制了充放电过程的相变,减缓了晶体结构的衰变;(3)稳定的晶体结构可以减少界面副反应的发生,进一步提高材料的循环性能,因此,Mg+和F-共掺杂提高了LiNi0.8Co0.15Al0.05O2正极材料的电化学性能。
3 结 论
采用传统固相法成功将Mg2+和F-掺入基体LiNi0.8Co0.15Al0.05O2正极材料,对其晶体结构、微观相貌和电化学性能进行了研究。XRD及其精修结果表明,Mg2+和F-共掺杂样品仍保持良好的层状α-NaFeO2结构,更小的Li+/Ni2+阳离子混排程度和更大的Li层间距。SEM结果表明,共掺杂并未改变材料的微观形貌。电化学测试表明,Mg2+和F-共掺杂样品表现出较为优异的电化学性能,特别是循环稳定性,1 C循环200圈容量保持率高达83.1%,而未掺杂样品只有43.5%的容量保持率。CV测试表明,Mg2+和F-共掺杂抑制了H2↔H3相变,降低了材料极化程度。EIS测试结果进一步证明共掺杂样品具有更低的Rct值,这归因于共掺杂稳定了材料的晶体结构,缓解在反复充放电过程中所导致的晶体体积变化引起的机械应力。共掺杂方法手段对于提高其他高倍率、高循环稳定性的正极材料也具有一定的参考价值。
