菲胁迫下蒿柳抗氧化系统的响应
2020-04-21马晓东邹竣竹周晓星孙振元
李 霞,马晓东,邹竣竹,周晓星,孙振元,韩 蕾*
(1. 中国林业科学研究院林业研究所,国家林业和草原局林木培育重点实验室,北京 100091;2. 菏泽学院农业与生物工程学院(牡丹学院),山东 菏泽 274000;3. 岳阳市林业科学研究所,湖南 岳阳 414000)
人类的生存环境离不开地表水体和土壤,然而,由于工业化进程的加速,有害物质的种类和数量急剧增加,破坏生态平衡,且易通过食物链的富集作用危及人类健康。多环芳烃(PAHs)具有难降解性、毒性(致癌、致突变、致畸效应)和生物蓄积性[1-2],是各国优先控制的一类污染物,美国国家环保局(EPA)将萘、菲、芘、苯并[α]芘等16种PAHs列为优先控制污染物[3]。在中国东部109个农业土壤点收集的表层土壤样本中,PAHs的总浓度从 8.8 到 3 880 μg·kg-1不等[4]。菲是三环的PAHs类,主要来源于焦化厂、炼油厂等企业生产的废水、废气及汽车的尾气排放、垃圾焚烧等,是PAHs的代表,通常在土壤、水体和沉积物中的含量较高。
植物修复是一种利用根系和地上部分修复污染土壤和沉积物的低成本修复技术,近年来得到了广泛的研究;但目前植物修复多环芳烃的研究多以草本植物为主,而木本植物具有生物量大、根系发达及地上部分可多年生长等优点。生长较快的洋白蜡(Fraxinus pennsylvanicaMarsh.) 、 DN 34杨(Populus deltoidesMarsh.×P. nigraL. DN 34)和黑柳(Salix nigraMarsh.)相比,黑柳对土壤中PAHs的降解率最高[5]。Hultgren等[6]温室实验表明,蒿柳(Salix viminalisL.)种植土壤中菲和芘的降解率分别是没有植物存在的1.47倍和1.27倍。
植物在修复PAHs的过程中,应能承受由污染物引起的胁迫,但高浓度PAHs对植物具有毒害作用,导致其形态学、细胞学以及代谢紊乱[7],甚至死亡[8]。活性氧(ROS)是逆境下破坏植物防御系统,使细胞中毒死亡的重要因素,而抗氧化系统(AOS)在活性氧的清除中起重要作用,常被用于植物的抗性评价[9]。关于植物对PAHs胁迫活性氧生成及抗氧化反应的研究有少量报道,如Salehi-Lisar等[10]用芴处理小麦(Triticunt aestivumL.)、紫花苜蓿(Medicago sativaL.)和向日葵(Helianthus annuusL.),认为过氧化氢酶(CAT)是植物抵御胁迫的重要酶。Weisman等[11]研究表明,PAHs可诱导拟南芥(Arabidopsis thalianaL.)的谷胱甘肽-S-转移酶(GST)活性增加。Shen等[7]认为,类胡萝卜素和超氧化物歧化酶(SOD)是菲胁迫下参与活性氧清除的最有效的抗氧化剂。这些报道表明了抗氧化系统和PAHs之间的关系,但关于木本植物这方面的研究未见报道,而揭示植物膜脂过氧化的原因及关键抗氧化剂的响应是提高植物在PAHs污染环境中抗性的关键。因此,本研究以蒿柳为研究对象,通过前期浓度筛选试验得出其在1.0 mg·L-1菲处理下,植物的生长及根系生理指标受到显著影响,因此,研究该浓度下抗氧化系统的响应,为提高木本植物在PAHs胁迫下的抗性及加强修复效应的研究奠定基础。
1 材料与方法
1.1 供试植物
选取蒿柳同一无性系、直径为(1.0±0.2)cm的1年生枝条,在水中剪成10 cm长插条,扦插在灰色塑料箱(容量20 L)内,用PVC板支撑并用海绵固定。用自来水培养2周后抹芽,保留1个枝芽,改用1/2 Hoaglang营养液培养,每3 d换1次营养液,继续培养8周。实验在玻璃温室内进行,自然光照。
1.2 有机污染试剂
供试有机污染物为菲(纯度>97%),其分子量 为 178.238 g·mol-1, 25℃ 纯 水 中 溶 解 度 为7.3 μmol·L-1,辛醇-水分配系数(LogKow)为 4.46。用甲醇(色谱纯)做溶剂配制菲的标准溶液。
1.3 试验设计
将长势一致的植株移入玻璃容器中适应1周后处理。菲标准溶液与蒸馏水配制的改良1/2Hoagland营养液混合,配制成菲浓度为1.0 mg·L-1的处理液,以未加菲的蒸馏水配制的改良1/2 Hoagland营养液为对照,pH值为6.0,处理液中甲醇的浓度为 0.05%。Chapin等[12]报道,甲醇浓度小于0.1%的营养液对植物根系生长没有影响。每个处理3个重复,每个重复15根插条。容器外壁用锡箔纸包裹,保持根系和溶液避光且防止菲的光降解,每2 d更换1次处理液,每4 d随机交换容器在温室中的位置。自然光照,对培养液全程通氧。分别于试验第0、4、8、12、16天采样,测定叶片的O2·-生成速率、H2O2含量,SOD、过氧化物酶(POD)、CAT、GST、谷胱甘肽还原酶(GR)的活性,还原型谷胱甘肽(GSH)、还原型抗坏血酸(AsA)以及丙二醛(MDA)的含量。
1.4 指标测定方法
1.4.1 O2·-生成速率和H2O2的测定及原位染色每个重复将3棵植株中上部叶片剪碎混匀,放入液氮迅速冷冻并研磨。每个重复称取0.1 g,O2·-生成速率的定量测定采用盐酸羟胺法[13],H2O2含量的测定参考Brennan等[14]的方法进行。原位染色取上部第7~9片成熟叶,用打孔器形成圆形叶盘(直径1 cm),采用NBT染色法测定O2·-(图1A),DAB染色法测定H2O2(图1B)。
1.4.2 抗氧化物质及MDA含量的测定 取样方法同1.4.1节。SOD活性测定采用氮蓝四唑法[15];POD活性测定采用愈创木酚法[16];CAT活性测定采用紫外吸收法[17];GST活性测定参考Habdous等[18]的方法;GR活性测定采用Parida等[19]的试验方法。GSH含量测定参考Baker等[20]的方法;AsA含量测定参考Foyer等[21]的方法。MDA含量测定采用硫代巴比妥酸法[22]。
1.5 数据分析
用Excel2016进行数据整理,用GraphPad PrismVersion7.0( GraphPad software, La Jolla,CA,USA)对测定数据作图,并进行单因素、双因素方差分析和多重比较。图中数据均为重复测定的平均值和标准误差。
2 结果与分析
2.1 菲胁迫下 O2·-生成速率和 H2O2的变化
图1表明:O2·-生成速率与H2O2均在菲处理后即大幅度增加。O2·-生成速率在处理后一直极显著高于对照(p<0.01),其中,第4天上升最快,为对照的2.42倍,之后有所下降。H2O2在菲处理后第4天和第8天与对照达极显著差异(p<0.01),分别为对照的1.95倍和1.92倍,之后呈下降趋势,处理第16天时与对照相比无显著差异(p>0.05)。
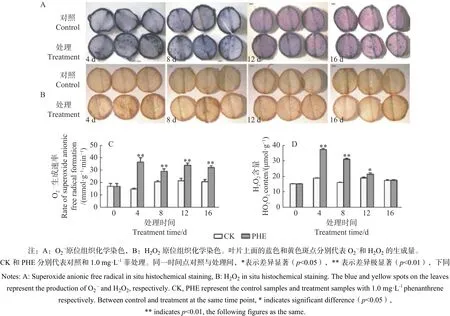
图 1 菲处理下蒿柳活性氧的动态变化Fig. 1 Changes of ROS contents under phenanthrene treatment
2.2 菲胁迫下SOD、POD和CAT活性的变化
图2 表明:菲胁迫下,SOD、POD和CAT活性均升高。与对照相比,SOD活性和POD活性均在处理第8天出现显著变化(p<0.05),分别为对照的1.32和1.23倍,之后 SOD的变化不大,POD一直升高,第16天时达到最高,为对照的2.03倍。CAT在处理第4天迅速升高,为对照的2.69倍,之后出现下降,但与对照相比一直呈显著(p<0.05)或极显著差异(p<0.01)。

图 2 菲处理下蒿柳SOD、POD、CAT活性的变化Fig. 2 Changes of SOD、POD、CAT activity under phenanthrene treatment
2.3 菲胁迫下GST和GR活性的变化
图3 表明:菲处理后,GST和GR活性均上升;GST活性在处理第4天和第8天与对照相比差异不显著,第12~16天迅速上升,第16天时为对照的1.94倍,差异极显著(p<0.01)。GR活性在处理后即迅速上升,与对照相比呈极显著差异(p<0.01),第16天为对照的2.24倍。
2.4 菲胁迫下GSH和AsA含量的变化
图4表明:菲处理后,GSH含量迅速升高,且一直处于较高水平,与对照相比呈极显著差异(p<0.01),最大为对照的2.43倍。AsA的含量处理后即低于对照,第4天时为对照的60.6%,但随着胁迫时间的延长呈上升趋势,第16天时高于对照(p<0.01),为对照的1.23倍。

图 3 菲处理下蒿柳GST和GR活性的变化Fig. 3 Changes of GST and GR activity under phenanthrene treatment
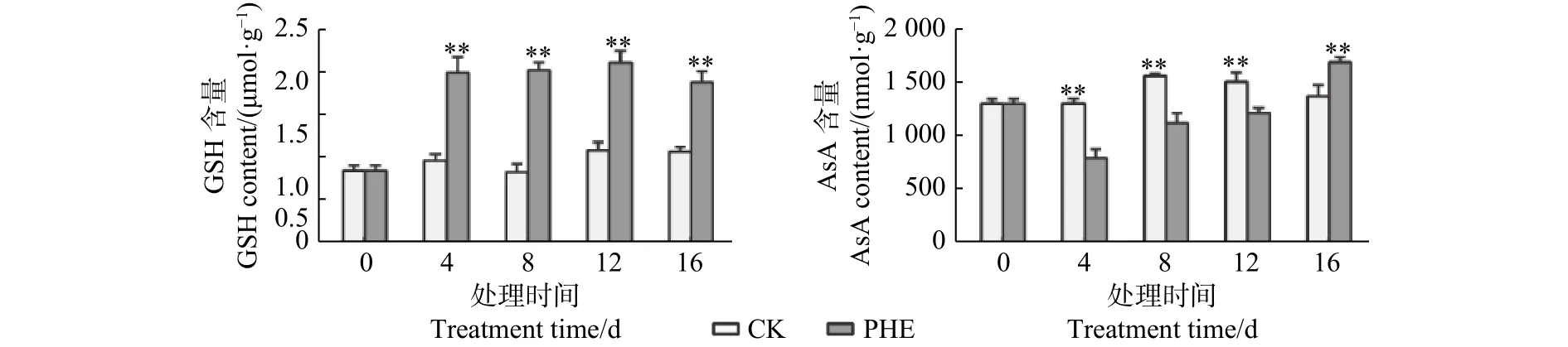
图 4 菲处理下蒿柳GSH和AsA含量的变化Fig. 4 Changes of GSH and AsA contents under phenanthrene treatment
2.5 菲胁迫下MDA含量的变化
图5 表明:菲胁迫下,MDA含量一直高于对照,第8天上升最快,与对照相比差异极显著(p<0.01),为对照的1.24倍,第16天时有所下降,为对照的1.14倍。
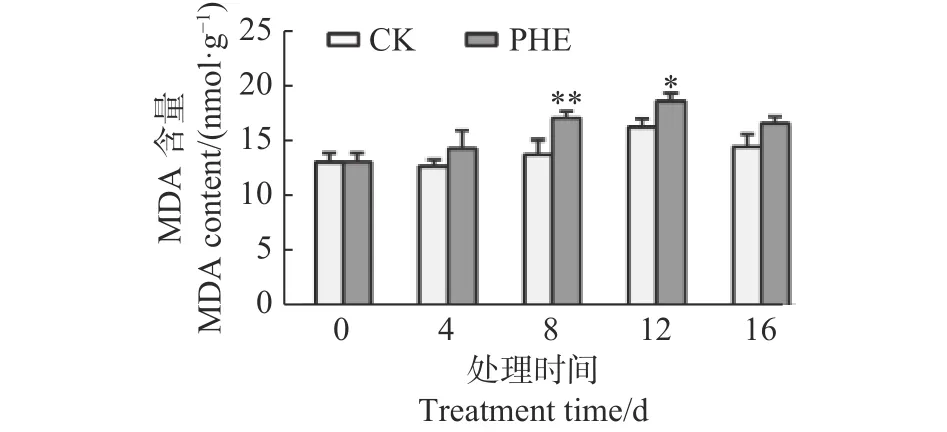
图 5 菲处理下蒿柳MDA含量的变化Fig. 5 Changes of MDA contents under phenanthrene treatment
3 讨论
3.1 菲胁迫下活性氧的动态变化
植物遭受胁迫后往往体内活性氧增加,主要包括 O2·-、 H2O2、 单 线 态 氧 (1O2) 和 羟 自 由 基(·OH)。O2·-和H2O2能直接氧化细胞内的许多组分,破坏生物大分子,造成膜脂过氧化。本试验中,O2·-生成速率在菲处理后一直高于对照,这是因为PAHs被植物吸收后首先在体内发生羟基化反应,单加氧酶(如细胞色素P-450)可使单环和PAHs转化为羟基化合物,在此过程中可能把电子漏给O2形成O2·-,或者在无氧条件下发生氧化还原反应形成超氧化物和过氧化物[23-24]。随着处理时间的延长,O2·-生成速率的增加量有所下降,这与SOD活性的升高有关,SOD歧化O2·-生成H2O2,但SOD的升高不足以清除产生的O2·-,因此,O2·-一直高于对照。菲处理后H2O2含量迅速升高,之后一直下降,最后与对照无显著差异,这说明CAT和POD活性的上升可以清除多余的H2O2。较高浓度的H2O2可以在过氧化物酶体和乙醇酸循环中被CAT催化转化为O2和H2O,而在不含CAT的叶绿体、细胞质及含CAT很少的线粒体中,H2O2又在POD的催化下反应生成O2和H2O[25]。
3.2 菲胁迫下抗氧化物质的动态变化
诱导植物氧化应激是PAHs已知的效应[26],研究表明,抗氧化酶对PAHs有不同的响应,依据植物种类和PAHs的浓度而不同。拟南芥在0、0.25、0.5 mmol·L-1菲处理下,CAT活性无显著变化,SOD和POD活性上升[27]。在荧蒽处理下,拟南芥随荧蒽浓度的升高叶片SOD活性提高,GSH、H2O2和MDA含量均有不同程度的增加[28]。本试验中,3种酶活性在菲处理后都升高,对于缓解氧化胁迫起重要作用。SOD以O2·-为底物,将其歧化为H2O2。CAT可直接清除H2O2,是早期反应的重要保护酶。POD则有不同的反应机制,Chroma等[29]研究得出,POD和细胞色素P450这2种酶系统在植物体内对外源物质多氯联苯(PCBs)和PAHs的解毒机制中都有部分参与。本研究中,POD与H2O2成显著负相关(p<0.05),POD可能利用H2O2氧化菲或其代谢中间产物,使其变成低毒或无毒的物质,这与Gao等[30]的研究结果一致。
GSH和AsA是植物体内重要的抗氧化剂。本试验中,菲处理后GSH含量迅速上升,GR的活性上升使蒿柳保持较高的GSH含量。GSH除清除活性氧外以外,对有毒的外来化合物具有解毒作用,是植物防御系统的重要组成部分[31]。GST专一催化GSH的巯基与其它化合物的亲电基团作用,生成谷胱甘肽衍生物[32]。本试验中,菲诱导了GST活性上升,且在第16天时达到对照的2.1倍,说明随着菲向地上部分的转运增多,经细胞色素第一步代谢后,代谢生成的羟基化合物等中间产物可以在GST的催化下与GSH结合,从而达到解毒的目的。AsA含量与对照相比降低,Caviglia等[33]也报道了类似的结果,长期(2周和4周)施用除草剂百草枯后,植物组织中的抗氧化剂浓度显著降低,植物组织产生大量草酸钙,草酸钙的前体是抗坏血酸。这是因为植物组织中的AsA可以被在细胞中积累的H2O2迅速转化。Wieczorek等[34]把蒽和苯并[k]荧蒽喷洒在芹菜叶片上,导致AsA含量降低,总酸含量升高,可以间接证明这种转化。本研究在处理过程中,虽然AsA低于对照,但一直呈上升趋势,而H2O2的含量一直下降,间接证明了这种相关性。
3.3 菲胁迫下MDA的动态变化
MDA含量是活性氧积累和脂质过氧化的生物标志物[35],通常用于说明植物对氧化应激的敏感性[36]。植物中PAHs毒性引起的MDA积累在拟南芥和菜心(Brassica campestrisvar.campestrisL.)中已有报道[27,37]。本研究中,MDA在胁迫过程中一开始上升,后呈下降趋势,这与Salehi-Lisar等[10]用芴处理下盆栽小麦、紫花苜蓿和向日葵的研究结果一致。这是由于蒿柳在一开始产生氧化应激反应,应激条件下的代谢失衡导致活性氧的产生,活性氧作为信号分子被传导到植物体内,触发抗氧化系统的防御机制,从而达到适应环境的目的,从而缓解应激条件[36,38]。
4 结论
PAHs是一种能诱导蒿柳叶片细胞氧化应激反应的污染物。菲处理下,首先,O2·-和H2O2大量增加,MDA含量升高,蒿柳表现出积极的防御措施,表现为抗氧化酶和抗氧化剂的上升;SOD活性升高,但不足以清除多余的 O2·-,O2·-是造成细胞膜脂过氧化的主要活性氧;CAT与POD的升高可以清除菲胁迫下产生的过量H2O2,对于缓解氧化胁迫起重要作用,其中,CAT是蒿柳早期响应的重要标志物;抗氧化剂中,GSH对PAHs的反应最敏感,GSH是蒿柳应对菲胁迫的重要抗氧化剂,并通过GST的催化对植物体内菲的代谢中间产物进行解毒。
