HDV重叠感染可增加慢性乙型肝炎患者的肝细胞癌风险
2020-04-21杨永平
于 哲, 杨永平,2
1 北京大学三〇二临床医学院, 北京 100039;2 解放军总医院第五医学中心 肝脏肿瘤诊疗与研究中心, 北京 100039
全球约有2.92亿人感染HBV,其中1500~2000万人合并HDV感染[1]。虽然致病机制尚不明确,但HDV/HBV重叠感染会加速肝炎病程,尤其是肝细胞癌(HCC)的发生率明显增高。迄今HDV相关标志物检测方法的精确度有待提升,治疗措施和新药研发亟需突破。现将HDV病毒学、HDV相关HCC流行病学、致病机制和诊疗等方面的进展综述如下。
1 病毒学
HDV是一种有缺陷的小RNA病毒,基因组长度约1.7 kb,其复制和传播依赖于HBsAg存在[2]。该病毒利用肝细胞的RNA聚合酶Ⅱ合成其病毒RNA,仅编码一个开放阅读框来表达两种δ抗原(HDAg),即S-HDAg和L-HDAg(p27)。HDAg和HDV RNA被包裹在由HBsAg组成的包膜中形成有传染性的病毒[3]。HDV有8种基因型,且呈不同区域分布:基因Ⅰ型全球普遍分布;基因Ⅱ型分布在日本、中国台湾和俄罗斯东北部;基因Ⅲ型分布于南美亚马逊地区,与重症爆发性肝炎相关;基因Ⅳ型分布在日本和中国台湾;基因Ⅴ~Ⅷ型在非洲土著等地有发现[4]。我国主要流行基因Ⅰ型和Ⅱ型。
2 流行病学
2.1 HDV流行情况 得益于全球乙型肝炎疫苗接种计划,HDV流行发生根本性改变。如意大利从23%降为8.3%[5];德、英等国受移民影响维持在8%~11%[6];美国成年人中HBsAg阳性率0.36%,其中有42%HDV抗体阳性[7]。发展中国家HDV流行差异较大,高流行区多超过20%,如中非、罗马尼亚、蒙古、巴基斯坦、伊朗、南美洲北部及亚马逊河地区等[8];低流行地区如越南、北非和中国大陆及台湾[9]。高流行地区HDV相关HCC发生风险增高问题尤其引人关注。
2.2 HDV相关HCC的流行病学 HDV/HBV重叠感染是否增加HCC发生风险仍有争议,但多数研究表明该风险显著增高(表1)。
从16个临床研究分析HDV/HBV重叠感染,不增加HCC发生风险的仅有2个[10-11];余下14个临床研究结果均提示HDV/HBV重叠感染可增加HCC发生风险[12-25],尤其瑞典一项中位随访11年的研究[19],9160例HBV患者中有650例HDV重叠感染,重叠感染标准化HCC发生率为6.11(95%CI:2.77~11.65),提示HDV/HBV重叠感染是HCC发生的高风险因素。美国一项对2175名退伍军人进行HDV检测的回顾性研究[21]表明,HDV阳性是HCC的独立影响因素。最近意大利一项前瞻性研究[24]表明HCC在HDV/HBV重叠感染者中发生率为3.12例/千人月,而CHB患者为1.12例/千人月。从上述临床研究结论分析,应重视对HDV/HBV重叠感染者的筛查,将该特定人群作为HCC发生的高危人群,建立科学有效的筛查管理规范,提高HDV相关HCC患者早期HCC的诊断率和5年生存率。
3 致病机制
HDV有3种感染模式,即HBV/HDV共感染、HBV/HDV重叠感染和不依赖HBV的HDV感染。共感染是指HBV和HDV同时感染,多表现急性病程,仅2%感染者发展为慢性HDV感染;重叠感染是指在慢性HBV感染基础上合并HDV感染,70%~90%重叠感染转为慢性;不依赖HBV的HDV感染很罕见,首次报道于肝移植术后,患者未感染HBV却可经免疫组化方法检测到HDV[26]。
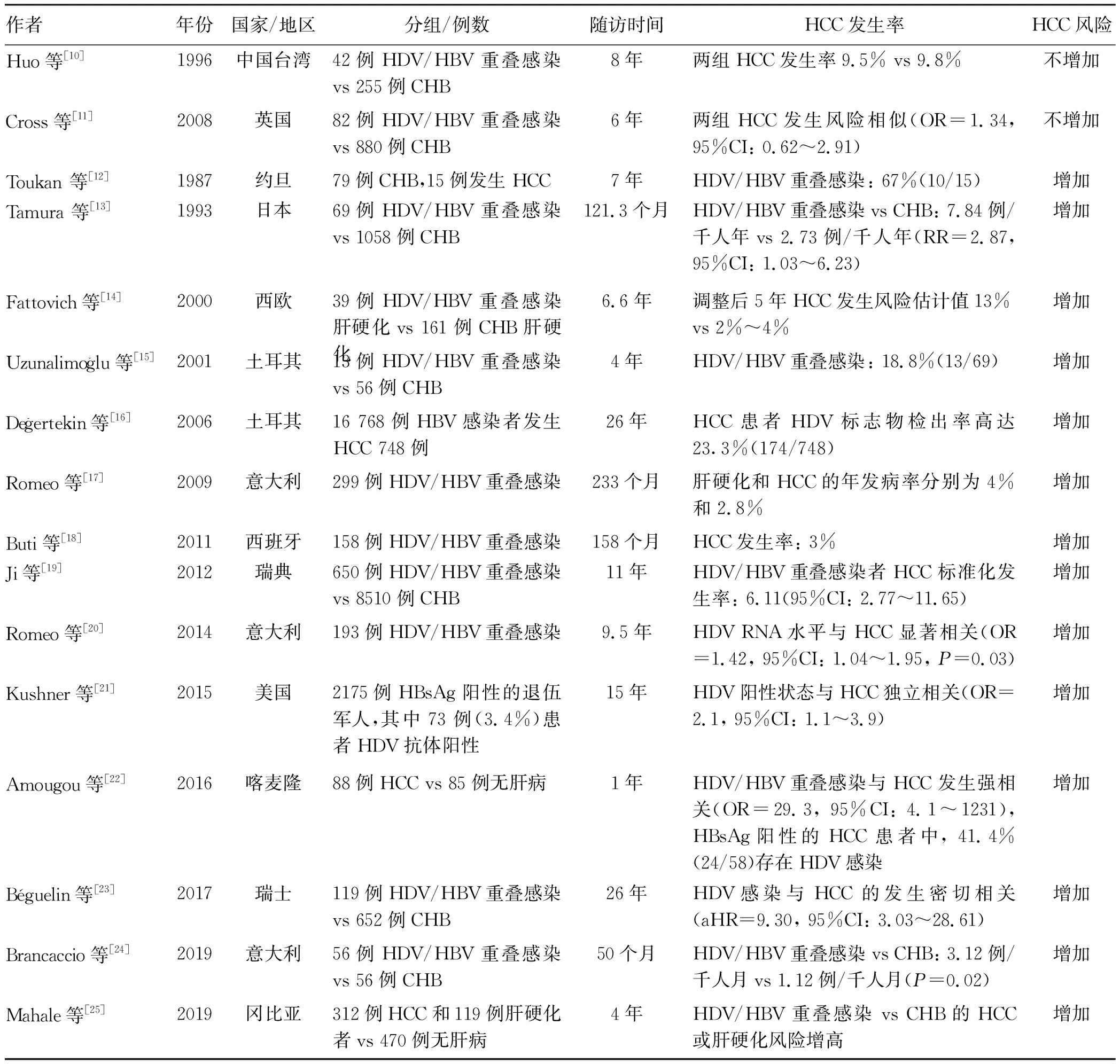
表1 HDV相关HCC的流行病学
注:OR,比值比;RR,危险比;aHR, 调整的风险比;95%CI,95%可信区间;CHB,慢性乙型肝炎。
HDV可诱发侵袭性肝损伤,虽机制尚不清楚,但有研究[27]表明细胞毒性T淋巴细胞会破坏HDV感染的肝细胞,特异性的免疫应答造成肝损伤。p27可通过异戊二烯化调节TGFβ所诱导的信号转导促进肝纤维化[28]。HDV诱发HCC风险增高的机制尚不清楚。一些研究[29]认为HDV除可促进纤维化沉积和肝硬化发展外,并无直接致癌作用。但有研究[30]通过差异基因分析发现,HDV和HBV通过不同的分子机制促进HCC的发生。这个复杂的过程包括多种致癌因素的累积和抑癌因素的丢失。
首先,丁型肝炎是一种免疫介导疾病,患者体内产生多种自身抗体破坏新陈代谢,促进HCC的发生,例如肝-肾微粒体抗体3型,针对的是尿苷二磷酸葡萄糖酰转移酶[31],代谢紊乱可促进HCC的发展。HDV相关严重坏死性炎症导致氧化应激也是一个重要因素,p27通过异戊二烯化过程产生大量活性氧[32],过量的活性氧可诱导NF-κB和STAT3的活性显著增加[33-34];此外,p27还可通过TNFα促进肿瘤坏死因子受体相关因子2、IκB激酶β和p65介导的NF-κB活化,活化信号的传导进一步促进肝脏炎症,最终促进了HCC的发生[33]。
其次,DNA甲基转移酶 (DNA methyltransferase,DNMT)对抑癌基因的异常沉默也是HCC的形成机制之一。p27通过酪氨酸残基磷酸化激活STAT3下调DNMT1,导致DNMT3b过表达,最终沉默抑癌基因促进HCC发生[35]。
此外,p27还可通过组蛋白修饰作用参与聚集素启动子组蛋白H3乙酰化的增加[36],聚集素在HCC中的表达水平增加与HCC的转移相关[37];长链非编码RNA(lncRNA)可通过HDV特有的lncRNA失调促进HCC的发生[38]。
总之,HDV致癌机制较复杂,不能通过一种或几种机制来解释,系统的机制仍有待进一步阐明。
4 诊疗进展
目前HDV致癌机制不清楚,HBV治愈率低,HDV/HBV重叠感染促进HCC发生风险增高使人类面临巨大的挑战。现将近年诊疗进展总结如下。
4.1 HDV感染的诊断精准性有待提升 HCC诊断的金标准是肝活组织检查,HDV与HBV引起的HCC均可通过对肝穿刺组织中癌细胞及病毒抗原的检测得到确诊。但在HCC的筛查方面,对纤维化的监测尤为重要,常用于CHB纤维化评价的无创手段(如瞬时弹性成像、血清标志物等)在HDV感染者中的应用价值尚有待验证[39];HDV相关HCC与HBV相关HCC在致病机制上的差异可能为新的诊断方法提供线索,差异主要体现在HDV相关HCC及肝硬化患者的肝组织和血清中HBV DNA含量极低,肿瘤组织中HDV复制水平也明显低于癌旁组织和肝硬化组织[30]。
HDV感染的确诊是HDV相关HCC诊断的主要诊断依据,有利于HDV相关HCC的早期干预及治疗方案的决策,但迄今HDV的诊断水平仍有待提升。HDV抗原和抗体检测在疾病不同阶段有较大差异,常因假阴性结果影响治疗决策,抗原抗体检测需联合血清HDV RNA检测才能确诊HDV感染。2016年有研究[40]发现全球28个实验室的HDV RNA检测结果差异较大,主要原因在于HDV RNA中GC含量和互补性高使其扩增困难,加之HDV的高度遗传变异性更加凸显引物和探针设计的重要性。HDV RNA的定量检测仍期待一个精准的国际标准。
4.2 HDV相关HCC的治疗方法期待新突破 目前针对HDV相关HCC的治疗除广泛应用的内外科方法外,主要进展是针对HDV感染的治疗。HDV利用宿主合成酶的特性,限制了抗病毒药物直接杀伤HDV的可能。核苷类抗HBV药物无法清除HDV,PEG-IFNα虽然是目前HDV慢性感染的唯一治疗药物,但效果不佳[41],关于PEG-IFNλ的临床研究[42]表明,其疗效和耐受性均优于PEG-IFNα。目前仍处于临床研究的新药主要从病毒进入细胞、装配、合成与释放等靶点入手,如Myrcludex B是牛磺胆酸钠协同转运多肽抑制剂,可抑制病毒进入肝细胞;洛那法尼是异戊烯化抑制剂,可抑制病毒的装配;REP2139-Ca是核酸聚合物,可抑制HBsAg的分泌与释放[43]。
针对致癌机制的潜在疗法主要是靶向STAT3和NF-κB通路的药物,如利用转录因子诱饵选择性消除激活的STAT3,可抑制头颈部癌细胞的增殖[44],但尚缺乏针对HDV相关HCC的临床试验。
5 展望
慢性丁型肝炎呈全世界流行现状,是一种具有高度HCC倾向的肝炎类型,主要结局是肝脏相关并发症,HDV/HBV重叠感染者比单独HBV感染者的肝脏疾病更为严重,可快速进展为肝硬化、肝衰竭和HCC。深入探索HDV的致病致癌机制、提升HDV的检测水平以及加快新药物研发,都将对控制HDV流行、提高丁型肝炎的疗效以及减少HDV相关HCC的发生有重大意义。
