非诺贝特对非酒精性脂肪性肝病小鼠模型肠道菌群多样性的影响
2020-04-21吕俊衍王金香耿坐涛罗粟风应昀晏文代艳施春晶普光宇马岚青
张 丹, 周 波, 邓 溢, 文 玉, 吕俊衍, 王金香, 耿坐涛, 罗粟风, 应昀晏, 文代艳, 施春晶, 普光宇, 姜 鑫, 马岚青
1 昆明医科大学第一附属医院 消化内科, 昆明 650032; 2 昆明医科大学基础医学院, 昆明 650500;3 丽江市儿童医院 普外科, 云南 丽江 530721
非酒精性脂肪性肝病(NAFLD)是指除酒精和其他确定的损伤因素外所导致的临床病理综合征,主要特征为肝细胞内脂肪过度堆积。包括非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎、相关肝硬化和肝细胞癌[1]。NAFLD不仅会影响患者的肝胆系统,还与胰岛素抵抗、血脂紊乱、动脉粥样硬化、脂肪栓塞、血液系统疾病等密切相关[2]。随着生活水平的提高,NAFLD的发病率逐年提高且呈低龄化[3]。据估计,世界范围内NAFLD的发病率为25%[4],在我国一线城市NAFLD的发病率为15%[5]。面对NAFLD的现状,对NAFLD的预防及治疗的研究显得尤为重要。
非诺贝特是一种纤维酸衍生物,其作为过氧化物酶体增殖物激活受体亚型 α(PPARα)的合成配体,能刺激脂肪分解,被广泛用于治疗高甘油三酯血症、血脂异常、糖尿病等代谢性疾病[6-7]。众多文献[8-10]证实,PPARα与NAFLD关系密切,PPARα激动剂可通过刺激脂肪酸氧化、改善脂蛋白代谢有效改善NAFLD。
一系列研究[11]表明,肠道菌群结构改变及过度生长等都是NAFLD发生的原因,而恢复肠道菌群平衡、降低其通透性可改善NAFLD的进展。近年来,Illumina 高通量测序等前沿技术的应用使得肠道菌群与NAFLD的联系得以更深入的研究。肠道菌群可通过肠肝轴影响NAFLD的发展[12],肠道菌群还可能改善NAFLD的组织学特征,包括脂肪变性,炎症和纤维化;临床研究[13]也发现NAFLD患者的肠道菌群与正常人相比发生组成变化。肠道菌群失调已成为NAFLD发病的重要原因之一,纠正肠道菌群失调可以预防和减轻NAFLD的发生发展,NAFLD同样也可以影响肠道菌群的数量和质量[14]。
益生菌、益生元及抗生素等可调控肠道菌群[15-16],同时有研究[17-18]得出,虾青素、康普茶等减轻NAFLD可能是通过影响肠道菌群。这些均提示NAFLD与肠道菌群有着密切的联系,但是目前尚未有关于非诺贝特对NAFLD的治疗作用与肠道菌群关系的研究报道,故本研究旨在探讨非诺贝特治疗NAFLD后小鼠的肠道菌群多样性变化,为非诺贝特治疗NAFLD的机制研究提供新思路。
1 材料与方法
1.1 材料
1.1.1 药物试剂 非诺贝特(货号:F6020)购自美国Sigma公司;羧甲基纤维素钠(货号:C8621)购自北京索莱宝公司,用0.5%的羧甲基纤维素钠将非诺贝特制为混悬液,浓度为4 g/L;油红O染色试剂盒(货号:G1261)、苏木精伊红染色试剂盒(货号:G1261)均购自索莱宝公司。高脂饲料自制(总热量为25.07 kJ/g,其热比为蛋白质20%、碳水化合物20%、脂肪60%);普通饲料购自昆明医科大学实验动物中心。
1.1.2 实验动物 6周龄C57BL/6雄性小鼠30只,SPF级,体质量21.50~22.50 g,购自南京生物医药研究院[许可证号: SCXK(苏) 2015-0001],恒温20℃±2℃及湿度50%±5%条件饲养,人工照明明暗各12 h,自由进食水,并每周监测小鼠体质量变化情况。
1.1.3 仪器与设备 组织包埋机、组织切片机均为日本樱花牌;Leica显微镜。
1.2 方法
1.2.1 动物分组与NAFLD小鼠模型的制备 普通饲料适应性喂养1周后随机分组,分为正常组(N组)、高脂组(H组)及非诺贝特治疗组(P组),每组10只。正常组持续给予普通饲料,其他组给予高脂饲料,饲料量为每只小鼠(5±1) g/d,持续喂养10周建立NAFLD小鼠模型。非诺贝特治疗组在高脂干预满10周后,开始给予非诺贝特,剂量为40 mg·kg-1·d-1,持续灌胃给药4周。3组小鼠在满14周后,禁食12 h,收集粪便,异氟烷吸入麻醉后脱颈椎处死并迅速取肝组织进行固定。
1.2.2 肝组织HE染色及油红O染色 用10%中性甲醛溶液固定肝组织,脱水、包埋、4 ℃保存,进行常规HE染色;取新鲜肝组织做冰冻切片,利用油红O染色试剂盒,光镜下观察小鼠肝脏脂肪变性情况。
1.2.3 小鼠肠道生物群落多样性分析 Miseq测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU(operational taxonomic units)聚类分析和物种分类学分析。基于OTU聚类分析结果,可以进行多种多样性指数分析,以及对测序深度进行检测;基于分类学信息,可以在各个分类水平上进行群落结构的统计。在上述分析的基础上,可以进行一系列群落结构和系统发育等深入的统计学和可视化分析,以上过程均由美吉生物公司完成。
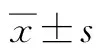
2 结果
2.1 小鼠体质量变化情况 实验过程中各组小鼠状态均良好,食欲佳,性情温顺,饮水和尿量均无明显差异,活动正常。适应性喂养1周后,小鼠平均体质量为(22±0.15)g;高脂饮食干预4周时,H组、P组小鼠体质量较N组有轻微增加,差异无统计学意义(P>0.05);干预饮食4周后,H组与P组小鼠体质量均呈上升趋势,且在干预10周时,H组、P组小鼠体质量与N组相比明显增加(P值均<0.05);P组高脂饮食10周后开始给予非诺贝特连续灌胃4周,体质量较H组呈现明显下降趋势(P值均<0.05)(表1)。
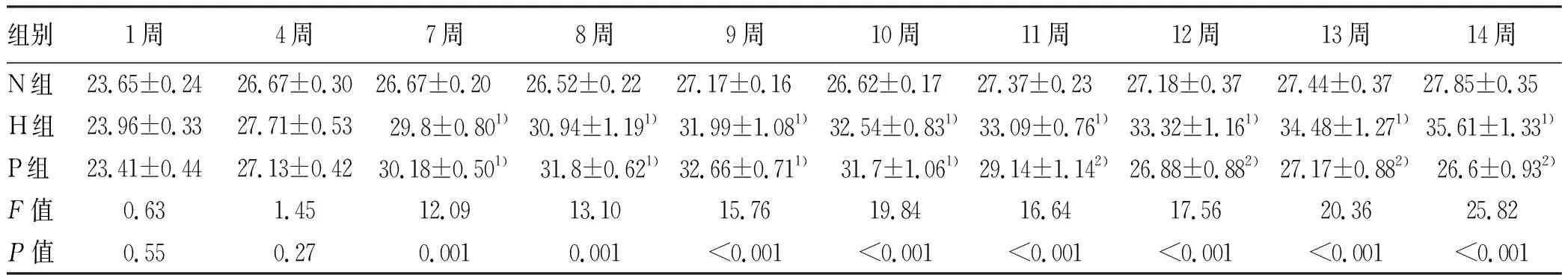
表1 各组小鼠体质量变化情况(g)
注:1) 与N组比较,P<0.05;2) 与H组比较,P<0.05。
2.2 肝组织HE染色及油红O染色结果 HE染色结果显示,N组肝细胞排列整齐,核大而圆,结构清晰,无脂肪空泡出现;H组肝细胞胞浆内广泛分布大量大小不等的脂肪空泡;与H组相比,P组无明显空泡状结构。油红O染色结果显示,N组未见明显脂滴,H组可见大量橘红色的脂滴,而P组与H组相比脂滴明显减少,且与N组相似(图1)。
注:H组中HE染色结果显示脂肪空泡(如黑色箭头所示),油红O染色结果显示橘红色脂滴(如黑色箭头所示)。
2.3 小鼠肠道微生态多样性改变
2.3.1 粪便样本微生物测序OTU分类结果 在97%相似水平下的OTU进行生物信息统计分析,经Miseq测序后,3组12个样本总共获得278 328条优化序列、3089个OTUs,平均每个样本23 194条序列、257个OTUs,其中N组4个样本,共92 776条序列、1169个OTUs;H组4个样本,共92 776条序列、968个OTUs;P组4个样本,共92 776条序列、952个OTUs(表2)。
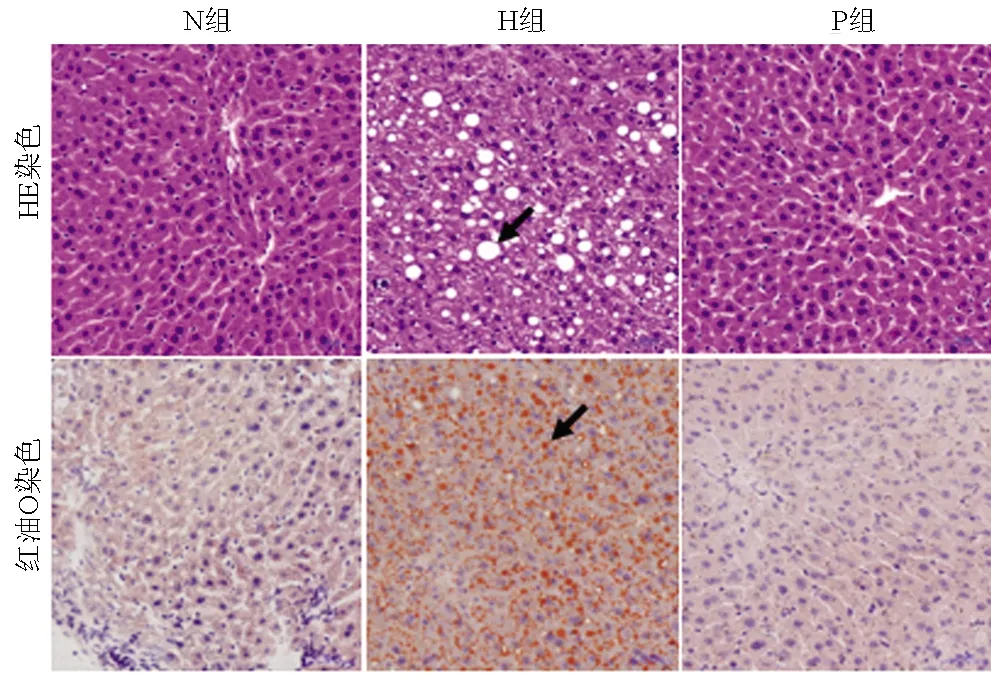
2.3.2 各组小鼠菌群多样性情况 Shannon-Wiener是反映样本中微生物多样性的指数,其数值的高低可以表示菌群数量的变化,Shannon值越大,说明群落多样性越高。H组与N组相比,H组菌群Shannon指数平均值明显降低,其菌群数量明显减少;P组Shannon指数平均值较N组降低,其菌群丰度减少,但是P组Shannon指数平均值较H组略增加,其菌群丰度相对增高(图2)。
图2 小鼠细菌的Shannon稀疏性曲线
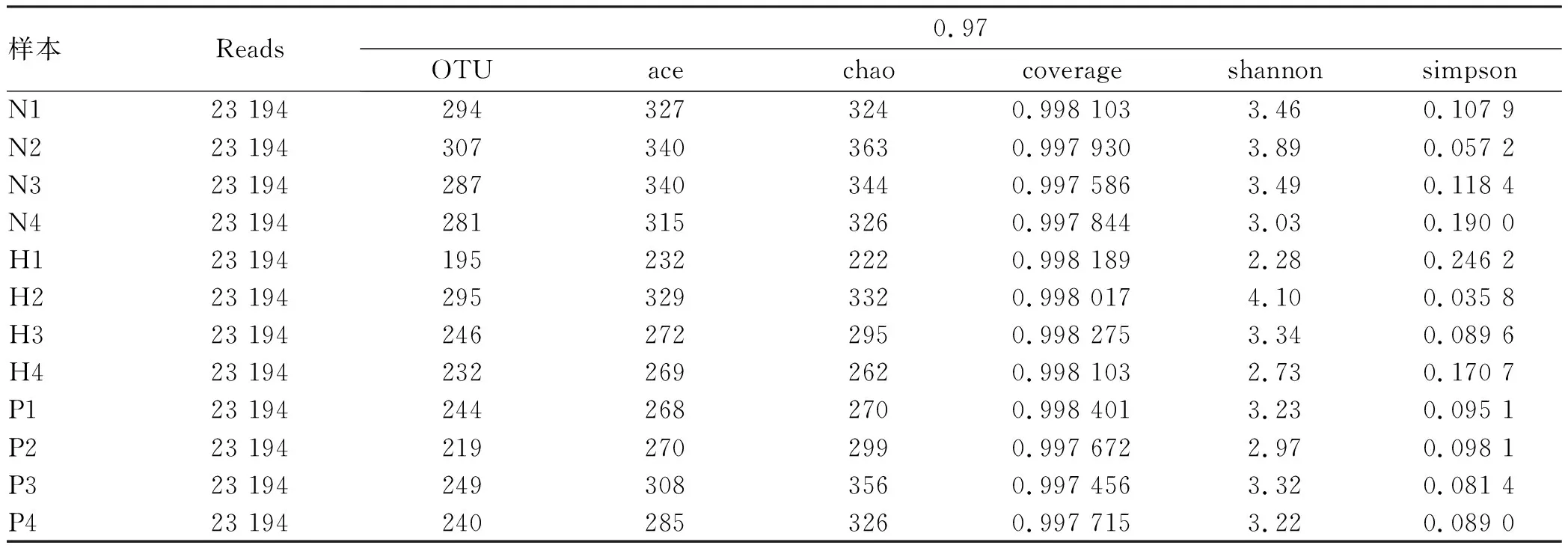
表2 各组小鼠粪便样品测序结果及多样性指数
2.3.3 各组小鼠菌群结构组成 在门分类学水平(图3),3组样本中拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)差异最为明显。厚壁菌门在H组中占比最高,拟杆菌门在N组中占比最高。3组样本中菌群占比较小的是放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria),其中放线菌门在H组中占比较高,仅次于厚壁菌门;疣微菌门在H组中占比较N组显著降低;变形菌门在H组中占比较N组显著增加。
在属分类学水平(图4),各组菌群的结构组成和菌属占比存在明显的差异,在N组中,Muribaculaceae_norank、毛螺菌科NK4A136组(Lachnospiraceae_NK4A136_group)在肠道菌群中占比最高。与N组相比,H组新增菌属Dubosiella,同时瘤胃球菌属(Ruminococcus_1)消失,其优势菌属的比例也发生变化:在N组为优势菌群的Muribaculaceae_norank、毛螺菌科NK4A136组的占比均明显降低,以Muribaculaceae_norank最为明显;梭菌属(Clostridium)、Turicibacter、双歧杆菌属(Bifidobacterium)成为H组中的优势菌群。与H组相比,P组样本菌群结构基本不变,而优势菌属的比例有所变化:梭菌属、Turicibacter、双歧杆菌属占比降低;Faecalibaculum占比增加,丰度仅次于梭菌属,Muribaculaceae_norank、阿克曼菌属(Akkermansia)、螺杆菌属(Helicobacter)、Lachnospiraceae_unclassified占比也有增加。
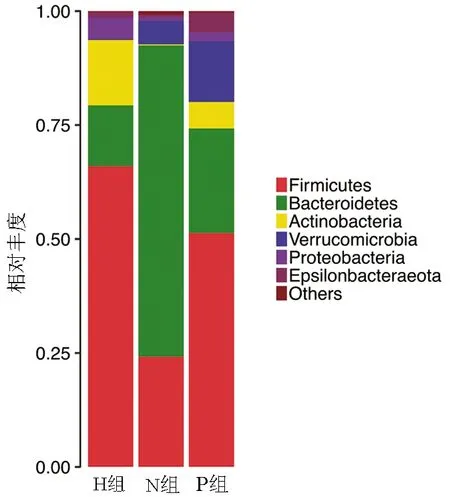
图3 门分类水平的分类学组成分析
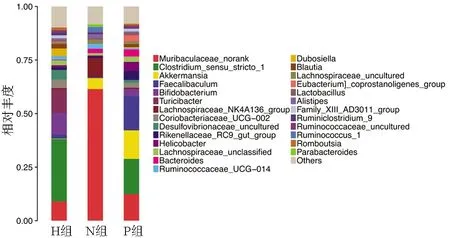
图4 属分类水平的分类学组成分析
2.3.4 各组菌群整体结构变化 PCA分析,即主成分分析,样本组成越相似,反映在PCA图中的距离越近。H组与N组相比,样本的距离明显增加,样本组成差异性增加;P组与H组相比,样本的距离缩短,样本组成差异性降低(图5)。
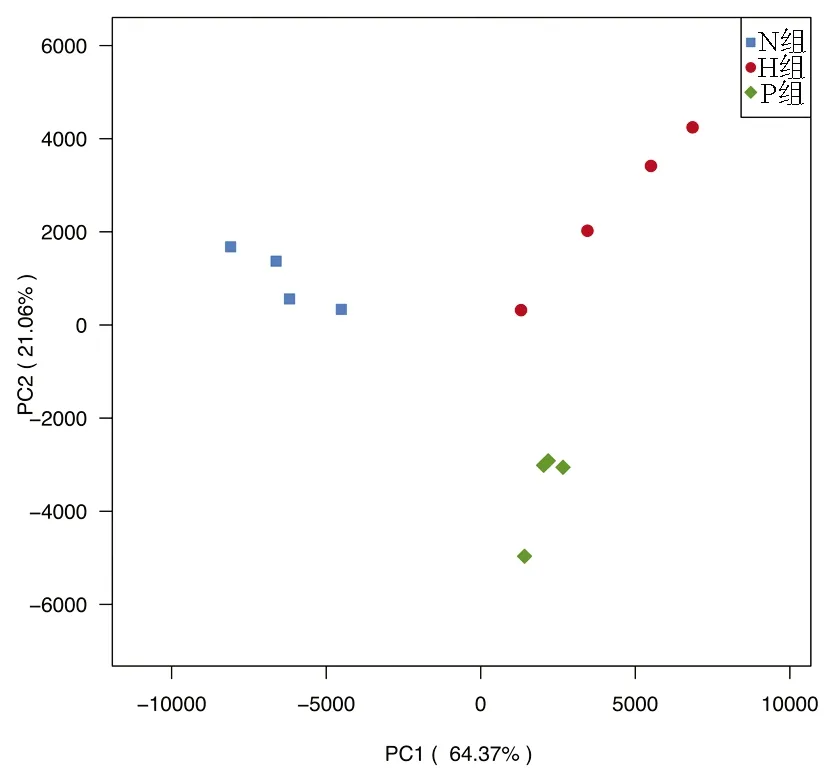
图5 小鼠肠道菌群 PCA 分析
2.3.5 各组菌群差异 为了确定各组小鼠中具有显著差异的物种,在组间进行LEfSe分析,结果见图6。在属分类水平上,其中Parabacteroides、Muribaculaceae_g_norank、瘤胃球菌属、毛螺菌属(Lachnospira)等在N组富集;双歧杆菌属(Bifidobacterium)、梭菌属、Turicibacter等在H组富集;拟杆菌属(Bacteroides)、Faecalibaculum、优杆菌属(Eubacterium)等在P组富集。根据LDA值大小(LDA>4),在N组中拟杆菌门、毛螺菌科(Lachnospiraceae)、瘤胃球菌属(Ruminococcus)、霍尔德曼氏菌属(Holdemania)等占优势,H组中厚壁菌门、梭菌属、放线菌门、双歧杆菌科、脱硫弧菌科(Desulfovibrionaceae)、红蝽菌目(Coriobacteriales)等占优势,P组中拟杆菌门、丹毒丝菌目(Erysipelotrichales)、疣微菌纲(Verrucomicrobiae)、Acetatifactor、Ruminiclostridium_1等占优势。
3 讨论
在本研究中,通过对小鼠体质量监测、肝组织病理学观察再次验证非诺贝特对NAFLD具有明显的改善作用,在此基础上对小鼠粪便进行高通量测序16S rRNA分析菌群的多样性及差异发现:非诺贝特可能通过增加如拟杆菌门等菌群的丰度,同时降低如厚壁菌门等菌群的丰度,来达到治疗NAFLD的目的。
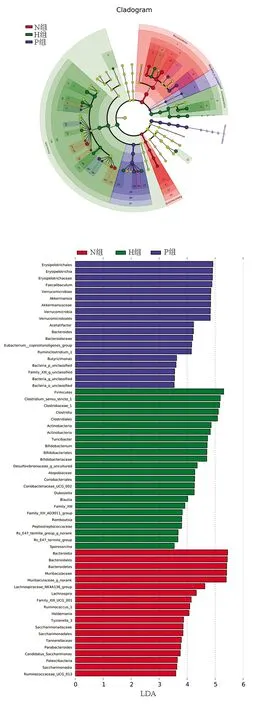
图6 LEfSe 多级物种层级树图
非诺贝特治疗NAFLD的机制尚不清楚,目前的研究发现非诺贝特主要通过以下途径对NAFLD起保护作用:(1)通过下调AKT/FSAN通路和降低活性氧自由基累积达到降低脂质累积改善NAFLD的目的[19];(2)通过IRE1α-XBP1-JNK途径减轻肝内质网应激改善NAFLD[20];(3)激活PPARα调控肝脏脂质代谢[21];(4)增强脂肪三酰甘油酶活性,增加甘油三酯水解活性,起到治疗NAFLD的作用[22]。近年来,越来越多的研究[23-24]表明,肠道微生态在NAFLD的发展中起着重要的作用。Lu等[25]和Liu等[26]的研究均表明,以厚壁菌门为代表的有害细菌的数量减少,以拟杆菌属为代表的有益细菌的数量增加可改善NAFLD;Lu等[12]研究提出,有效的调控肠道菌群, 如乳酸杆菌相对丰度增加、厚壁菌门某些属相对丰度减少、厚壁菌门/拟杆菌门比值降低与肝脂质累积降低可能存在一定的联系。同样临床上有研究[13]对NAFLD患者的粪便微生物菌群特征进行了检测,发现NAFLD中厚壁菌门相对丰度较高。在本研究中,非诺贝特治疗的NAFLD小鼠肠道中拟杆菌门丰度增加,厚壁菌门丰度降低,这与以上研究相一致。
本研究中,利用非诺贝特治疗NAFLD的同时,观察了小鼠肠道微生态的多样性变化,尽管目前还不清楚在非诺贝特治疗NAFLD的过程中,肠道微生态扮演着怎样的角色,但这为非诺贝特改善NAFLD的机制研究提供了新思路。究竟是非诺贝特改善了肠道菌群进而改善了NAFLD,还是非诺贝特改善了NAFLD从而恢复了肠道微生态,亦或是非诺贝特协同肠道菌群对NAFLD产生了治疗作用,值得进一步研究。
