海南西海岸红树林伴生植物内生放线菌多样性及其延缓衰老活性初筛
2020-04-20李蜜易湘茜杨彩妮庞晓婷姜舒高程海
李蜜 易湘茜 杨彩妮 庞晓婷 姜舒 高程海


摘 要:为寻找新型抗衰老药物,该文以海南西海岸红树林伴生植物为研究对象,采用9种不同培养基从7种伴生植物21份样品中分离纯化放线菌,通过PCR扩增,16S rRNA基因序列分析已纯化放线菌的多样性,利用秀丽隐杆线虫(Caenorhabditis elegans) 模型筛选菌株来进行延缓衰老活性研究。结果表明:(1)从7种伴生植物21份样品中共分离到26株海洋放线菌,隶属于9科15属,分别为拟诺卡菌属、短状杆菌属、短小杆菌属、Demequina、戈登氏菌属、类诺卡氏菌属、Lysinimicrobium、细杆菌属、假诺卡氏菌属、微球菌属、原小单孢菌属、拟无枝酸菌属、Yimella、北里孢菌属和链霉菌属,其中链霉菌属为优势菌属。(2)经秀丽隐杆线虫模型筛选,发现有2株海洋放线菌的发酵粗提物具有延缓秀丽隐杆线虫衰老的作用。综上结果说明海南西海岸红树林伴生植物中含有丰富多样的药用放线菌资源,为海洋放线菌抗衰老研究奠定了基础。
关键词:伴生植物,物种多样性,内生放线菌,抗衰老活性
Abstract:In order to search for new anti-aging drugs,actinobacteria were isolated from seven associated mangrove plants and nine different isolation media. The strain diversities were analyzed by using PCR amplification and comparison of 16S rRNA gene sequences. The anti-aging activities of the actinobacteria were analyzed by using Caenorhabditis elegans screening models. The results were as follows:(1) A total of 26 marine actinobacteria were isolated from 21 samples of seven associated mangrove plants,belonging to nine families and fifteen genera consist of Nocardiopsis,Brachybacterium,Curtobacterium,Demequina,Gordonia,Nocardioides,Lysinimicrobium,Microbacterium,Pseudonocardia,Micrococcus,Promicromonospora,Amycolatopsis,Yimella,Kitasatospora and Streptomyces,and the dominant genus was Streptomyces. (2) Two kinds of actinobacteria were found to have anti-aging effect by Caenorhabditis elegans screening models. All the above results indicate that there are abundant medical actinobacteria resources in the west coast of Hainan,and the study provides research fundamental data for anti-aging research of marine actinobacteria.
Key words:associated mangrove plants,species diversity,endophytic actinobacteria,anti-aging activity
紅树林是热带亚热带海岸潮间带的木本植物群落,其伴生植物指偶尔出现于红树林最内缘或边缘地带的海岸、海滨、盐生或陆生植物,被认为是红树林的边缘物种(陶曙红等,2016)。近年来,随着陆地生物资源的广泛研究和日渐枯竭,海洋微生物资源备受科学家们的关注。许多海洋微生物与海洋动植物共生,以获得生存必需的营养(李艳华和张利平,2003)。海南西海岸分布着丰富多样的红树林植物,为保护国家资源建立了多个红树林自然保护区,包括儋州新英湾红树林市级自然保护区、临高文澜江县级自然保护区和临高彩桥红树林县级自然保护区等,为科学研究提供丰富的研究材料。与其他近海环境相比,红树林是分离放线菌的理想环境(洪葵,2013)。目前已发现22 000多个微生物活性产物,其中约70%由海洋放线菌产生,具有多种生理活性,包括抗菌、抗肿瘤、抗病毒、增强免疫等(Manivasagana et al.,2014)。李飞娜等(2017)从澳门红树林植物中分离到192株内生放线菌,其中获得2株放线菌新种,6株潜在放线菌新种中5株具有抗菌活性。有研究报道,海洋放线菌ACMA006的发酵产物具有很强的抗肿瘤活性和较好的抑菌活性(袁献温和杨瑞丽,2009)。有关微生物次级代谢产物的药理活性报道很多(李菲等,2017;袁献温和杨瑞丽,2009),但对于微生物抗衰老方面的研究则相对较少。线虫是经典模式生物,具有生命周期短、易培养、易观察、基因组容量小且图谱清晰等优势(吕婷,2014),目前已广泛应用到抗衰老药物的筛选和研究过程中(吕婷,2014;王艳菊等,2014)。随着社会的发展和人们生活水平的不断提高,人口老龄化已成为当前不可阻挡的趋势(薛晓利等,2017)。2010年全国60岁以上的老年人口占人口总数的13.26%,预计到21世纪中叶,将达到4.5亿,约占总人口的1/3(曾尔亢等,2012)。由此可见,抗衰老药物的研究是当前重要而紧迫的任务(吕婷,2014)。
目前,国内外关于线虫延缓衰老模型的研究主要集中于中药提取物和保健产品的延缓衰老研究(黄正杰等,2013),而关于利用海洋微生物发酵产物对线虫衰老模型的研究报道较少。海洋微生物拥有独特的活性次级代谢产物,其代谢产物的抗衰老研究值得深入探讨。到目前为止,未见有关于红树林伴生植物共生微生物多样性的研究报道。本研究采用秀丽隐杆线虫作为延缓衰老研究的模式生物,以特殊生境的海洋伴生植物为研究对象,采用纯培养技术开展其内生放线菌多样性及其发酵产物对线虫衰老活性的研究,为研究红树林放线菌群落组成提供参考,以及期望获得强活性菌株,为开发新型抗衰老药物提供强活性菌源。
1 材料与方法
1.1 材料
所用材料为7种伴生植物样品:海马齿(Sesuvium portulacastrum)、厚藤(Ipomoea pes-caprae)、鱼藤(Derris trifoliata)、曼陀罗(Datura stramonium)、苦郎树(Clerodendrum inerme)、猩猩草(Euphorbia cyathophora)、弯枝黄檀(Dalbergia candenatensis)。材料由广西中医药大学高程海研究员鉴定。样品于2017年7月采集于海南西海岸的红树林,经纬度、物种编号、植物种类及组织等信息见表1所示。分别采取花、茎、叶和胚轴,先用无菌水冲洗样品表面3遍,立即装入密封采样袋,置于采样冰盒中24 h内送回实验室;然后进行研磨、稀释涂布、培养。野生秀丽线虫用于本研究抗衰老活性的初步筛选,由广西科学院汪斌博士惠赠。
1.2 方法
1.2.1 伴生植物样品的处理 去除伴生植物表面的杂质,分别选取完整无病虫害的花、茎、叶、胚轴进行表面消毒,先用5%的次氯酸钠溶液浸泡8 min,无菌水冲洗3次;再用75%的酒精溶液浸泡5 min,无菌水冲洗3次。分离培养基参考李飞娜等(2017)。分别取少量表面消毒后的植物材料约2 g于研钵中充分研磨,吸取2 mL无菌水与研磨后的浆液混匀,此浓度液作为样品原液,再依次稀释到104组织悬液。分别取100 μL 104组织悬液涂布在9种分离培养基(AGG、M4、M5、M7、M9、M10、ISP7、ISP3和M11)上,样品原液置于4 ℃冰箱暂存。
1.2.2 菌株的分离纯化及保藏 参考吴家法等(2017)的方法,分离平板置于28 ℃恒温培养箱培养2~8周通过形态观察,挑选质地致密程度较高,边缘内陷明显的放线菌菌落在ISP2培养基上进行三区划线纯化,如有杂菌则进行二次纯化或多次纯化,直至得到单一纯净的菌落,并记录菌落数及菌落的形态特征。获得纯菌株采用Chelex-100法(周双清等,2010)提取基因组DNA;参照Walsh et al.(1991)的方法进行PCR梯度扩增,扩增引物为通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)。
PCR反应条件:94 ℃预变性5 min,后进行30 个循环(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s),循环结束后,72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测,利用Bio-RAD凝胶成像仪观察电泳结果。Gel Logic 2200 Pro凝胶成像仪检验条带合格后委托上海美吉生物医药技术有限公司广州分公司进行测序。测序结果经DNA Star软件整理,利用数据库EzBioCloud(http://www.eztaxon.org/)(Kim et al.,2009)及Blast网站进行在线比对;对16S rRNA基因序列进行相似性比对搜索。将纯化好的菌株制成20%(V/V)甘油管保存于-80 ℃超低温冰箱中。
1.2.3 放线菌粗提物的制備 参考覃媚等(2016)的方法,从ISP2 固体培养基上挑取26株对数生长期的菌丝接种到200 mL ISP2液体培养基中,在恒温振荡培养箱中28 ℃、180 r·min1发酵7 d;离心收集发酵液,发酵液用乙酸乙酯萃取(用符号E表示),取上层乙酸乙酯层浓缩备用;菌体(用符号T表示)用丙酮破壁后甲醇萃取浓缩干燥,收集粗提物,用于线虫抗衰老活性的初步筛选。
1.2.4 线虫的寿命实验 参考Lakowski & Hekimi (1998)的方法,检测26株放线菌发酵粗提物是否具有延缓线虫衰老的作用。将线虫涂布于含有OP50的NGM(nematode growth media)固体培养基上,置于20 ℃恒温培养箱培养约48 h后可见L4期成熟线虫,此时线虫可用于实验(Brenner,1974)。NGM固体培养基(黄正杰等,2013):Nacl 3 g,蛋白胨 2.5 g,Agar 17 g,去离子水975 mL。121 ℃,20 min,灭菌后,待培养基温度降至55 ℃,依次加入CaCl2 1 mL,MgSO4 1 mL,K3PO4 25 mL,5 mg·mL1胆固醇1 mL,混匀后,倒入一次性平板,平板至少放置1 d后可用或置于4 ℃下一个月内使用完毕。
线虫的同期化:取传代后线虫用约10 mL的M9缓冲液(Na2HPO4 6 g,KH2PO4 3 g,NaCl 5 g,MgSO4·7H2O 0.25 g,去离子水1 L)重复清洗到15 mL离心管中,用微孔滤膜过滤,取下层液体备用。100 mL大肠杆菌发酵液离心,去掉上清液,备用。取含有大量虫卵的液体滴加于涂布有OP50的NGM平板中心,平板中还需加入一定量的FDU抑制线虫后代的产生。
寿命实验:将菌体粗提物样品浸膏溶解于2% DMSO 中,终浓度为100 mg·L1(实验组),阿维菌素100 mg·L1(阳性对照),DMSO 0 mg·L1(空白对照)涂布于含有OP50的NGM平板上,每块平板挑去20条处于L4期的线虫,每组取5个平板,置于20 ℃下恒温箱培养,此时记为寿命实验第0天。每天观察并记录线虫存活的数量。DMSO在线虫寿命实验中的安全剂量为2%,本研究未超过安全使用剂量,不会影响实验结果。
活性菌株粗提物液质谱图:取具有延缓线虫衰老活性的菌株粗提物5 mg,配制成一定浓度的溶液来进行液质联用(HPLC-MS)谱图扫描,液相色谱柱为 Luna 5u C18(2) 100A 150 mm × 4.60 mm 5 micron,流动相为甲醇-水(含0.1%甲酸),流速为1 mL·min1,分析时间为 50 min,梯度洗脱。质谱采用电喷雾离子源(ESI 源),源喷射电压(IS)为4 500 V,雾化温度为180 ℃。根据质谱图信息分子离子峰,通过查阅SciFinder来初步推断代谢产物类型。
1.3 统计分析
所有数据采用SPSS Statistics 17.0进行统计分析,图表采用Excel 2013和Graphpad prim 5绘制,通过DNA Star软件进行序列整理和MEGA5.0软件构建系统发育树及聚类分析,DataAnalysis进行液质联用分析。
2 结果与分析
2.1 红树林伴生植物内生放线菌多样性分析
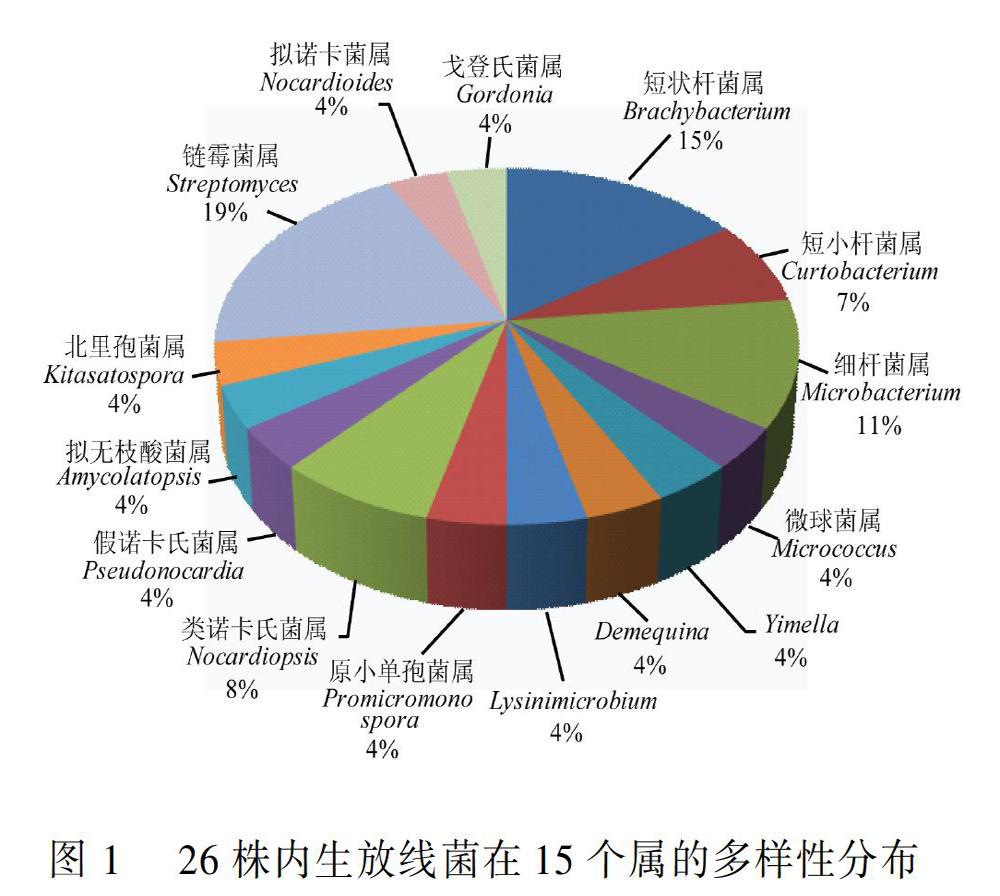
根据菌落形态特征进行初步排重后,选择62株菌进行16S rRNA基因扩增和序列比对分析,结果表明62株细菌中26株为放线菌,分布于6个目9个科15个属。26株内生放线菌在15个属的多样性分布如图1所示,链霉菌属(Streptomyces)分离出5株菌,占所分离放线菌株总数的19.23%。此次研究分离到的稀有放线菌包括拟诺卡菌属(Nocardiopsis)、短状杆菌属(Brachybacterium)、短小杆菌属(Curtobacterium)、Demequina、戈登氏菌属(Gordonia)、类诺卡氏菌属(Nocardioides)、Lysinimicrobium、细杆菌属(Microbacterium)、假诺卡氏菌属(Pseudonocardia)、微球菌属(Micrococcus)、原小单孢菌属(Promicromonospora)、拟无枝酸菌属(Amycolatopsis)、Yimella、北里孢菌属(Kitasatospora),占分离放线菌总数的80.76%。
26株可培养内生放线菌的物种组成见表2。
根据放线菌菌株与典型菌株比对,16S rRNA基因序列相似性小于98.5%的菌株是新种的可能性为80%(徐丽华等,2007)。16S rRNA基因序列相似性比对分析结果显示菌株IMDGX 6028、IMDGX 6049、IMDGX 6137、IMDGX 6173、IMDGX 6270、IMDGX 6239和IMDGX 6469-1与有效发表菌株Amycolatopsis niigatensis、Brachybacterium sacelli、Microbacterium saccharophilum、Lysinimicrobium pelophilum、Brevibacterium permense、Nocardiopsis prasina和Yimella lutea的最高相似度分别为97.76%、97.23%、98.15%、98.32%、97.75%、98.44%和98.39%,即这7株菌株有可能为潜在的放线菌新物种。
2.2 26株内生放线菌在植物组织、植物种类及培养基中的分布
由图2可知,M7培养基分离得到的菌株数量和多样性最多,分别为12株放线菌,隶属于9个属;其次是P3培养基,分离得到11株放线菌,隶属于8个属;第三是M4培养基,分离得到9株放线菌,隶属于7个属。其中,M7和M4两种培养基均含有L-天冬酰胺作为氨基酸来满足放线菌的营养需求。这三种不同的培养基分离得到的菌株数量和多样性均较多,可作为今后培养放线菌的首选培养基。M11培养基(棉子糖-组氨酸培养基)分离得到菌株数量和多样性均最少,为4株放线菌,隶属于4個属。
从不同植物组织分离得到的放线菌菌株数量和多样性结果见图3。从茎中分离得到的放线菌菌株数量和多样性最多,为18株放线菌,隶属于12个属;其次是叶子分离得到16株放线菌,隶属于10个属;胚轴中分离得到的菌株数量和多样性较少。
从图4可见,H5苦郎树植物分离得到13株放线菌,隶属于8个属;H3鱼藤分离得到10株放线菌,隶属于5个属;H7弯枝黄檀分离得到8株放线菌,隶属于8个属。
根据液质联用谱图信息可知,IMDGX 6193T的代谢产物在3.3 min存在一较明显的峰,IMDGX 6364T在3.0 min有明显的峰,分析两活性菌株的高分辨质谱图可知分子离子峰分别为MS m/z 305.2110和MS m/z 190.1078,根据SciFinder检索初步推断其代谢产物分别为Elsinopirin A (Frank et al.,2018)和N-Methylcalystegine B3(Naoki et al.,1997),其中Elsinopirin A的化学结构如图5所示。
3 讨论与结论
我国红树林主要分布于海南、广东、广西、福建及台湾、香港、澳门等地。红树林相比陆地环境,强辐射、高盐和低氧等特殊生境,所蕴育的放线菌类群丰富,使放线菌具有更高的拮抗性。近年来,红树放线菌及其次生代谢产物的研究逐渐增多(吴家法等,2017;李菲等,2017)。许敏等(2016)从广东湛江红树林植物中分离得到的内生放线菌中有3株具有较强杀线虫活性,同时22.64%菌株具有抗生素合成基因簇。为探索海南西海岸红树林伴生植物内生放线菌资源的特征,本研究对采集的7种伴生植物,利用9种分离培养基,对样品各个部位的内生放线菌进行分析,共分离获得内生放线菌26株,隶属于6个目9个科15个属。植物不同部位,其内生放线菌的含量有所不同,茎中分离的放线菌含量最多,叶子中次之,胚轴中最少。海南西海岸海洋生物多样化,本研究从伴生红树中分离发现8株链霉菌外,还发现短状杆菌属(Brachybacterium)、短小杆菌属(Curtobacterium)、戈登氏菌属(Gordonia)、北里孢菌属(Kitasatospora)等稀有放线菌,为寻找新抗生素提供丰富菌源。
以线虫为模型测定26株内生放线菌是否具有抗衰老活性。结果显示,2株内生放线菌Pseudonocardia carboxydivorans和Streptomyces marokkonensis具有显著延缓线虫衰老的活性,分别归属于假诺卡氏属和链霉菌属。根据液质联用谱图信息,可知这两株放线菌分别含有结构类似N-Methylcalystegine B3和Elsinopirin A的化合物。据报道,Pseudonocardia carboxydivorans可从土壤和植物样品中分离得到(Navarromartinez et al.,2017),Park et al.(2008)发现它对枯草芽孢杆菌类可产生抑制作用。Tanvir et al.(2016)通过HPLC-MS测试其主要活性次级代谢产物为酰胺类化合物。本研究通过秀丽隐杆线虫的衰老模型表明两者均能显著延缓线虫衰老,具有一定的抗衰老活性。
通常环境微生物中只有1%能够被实验室培养(吴家法等,2017)。本实验通过综合各研究团队所用的分离培养基营养成分,用9种不同营养成分的分离培养基共得到分布于9个科15个属的26株放线菌,所获稀有放线菌数量和种类相对较高,说明海南西海岸红树林伴生植物具有丰富的多样性,为后期放线菌分离方法研究提供可靠依据,为进一步解决人类疾病的实际问题,寻找具有延缓衰老药物提供活性菌株。目前,人类对海洋内生放线菌的了解很有限,摸索适合红树内生菌研究的方法,尽可能多地分离纯化难培养或未培养的微生物仍是当前微生物研究的重要内容。
参考文献:
BRENNER S,1974. The genetics of caenorhabditis elegans [J]. Genetics,77(1):71.
CHEN L,WANG W,ZHANG Y,et al.,2009. Recent progresses in mangrove conservation,restoration and research in China [J]. J Plant Ecol,2(2):45-54.
FRANK S,KATHRIN P,SCHROERS HJ,et al.,2018. Elsinopirins A-D,decalin polyketides from the ascomycete elsino pyri [J]. Biomolecules,8(8):1-10.
HONG K,2013. Actinomycetes from mangrove and their secondary metabolites [J]. Acta Microbiol Sin,53(11):1131-1141. [洪葵,2013. 紅树林放线菌及其天然产物研究进展 [J]. 微生物学报,53(11):1131-1141.]
HUANG ZJ,CUI JY,REN FZ,et al.,2013. Study on anti-aging effects of crude extract of giant salamander on Caenorhabditis elegans [J]. J Food Ind,34(1):122-125. [黄正杰,崔建云,任发政,等,2013. 大鲵粗提物延缓秀丽线虫衰老的研究 [J]. 食品工业,34(1):122-125.]
KIM KH,ROH SW,CHANG HW,et al.,2009. Nitratireductor basaltis sp. nov. isolated from black beach sand [J]. Int J Syst & Evol Microbiol,59(1):135-8.
LAKOWSKI B,HEKIMI S,1998. The genetics of caloric restriction in Caenorhabditis elegans [J]. Proc Natl Acad Sci USA,95(22):13091-6.
LI F,GAO CH,YU L,et al.,2017. Diversity of endophytic bacteria isolated from Kandelia candel and its in-vitro activity against Ustilago scitaminea Sydow [J]. Chin J Antibiot,42(4):318-320. [李菲,高程海,余炼,等,2017. 秋茄内生细菌多样性及抑制甘蔗黑穗霉菌活性研究 [J]. 中国抗生素杂志,42(4):318-320.]
LI FN,PAN Z,TUO L,et al.,2017. Studies on the diversity and novelty of endophytic actinobacteria isolated from mangrove plants collected in Macao [J]. Chin J Antibiot,42(4):284-293. [李飞娜,潘臻,庹利,等,2017. 澳门红树林植物内生放线菌多样性及新颖性研究 [J]. 中国抗生素杂志,42(4):284-293.]
LI YH,ZHANG LP,2003. Exploitation and utilization of marine microbial resources [J]. Microbiol Chin,30(3):113-114. [李艳华,张利平,2003. 海洋微生物资源的开发与利用 [J]. 微 生 物 学 通 报,30(3):113-114.]
LT,2014. Study on the anti-aging of plant extracts by using the model organism samsonite [D]. Nanjing:Nanjing Normal University. [吕婷,2014. 利用模式生物秀丽隐杆线虫对植物提取物抗衰老的研究 [D]. 南京:南京师范大学.]
NAVARROMARTINEZ,A,COROMINAS N,SAINZ DBC,et al.,2017. Pseudonocardia carboxydivorans in human cerebrospinal fluid:A case report in a patient with traumatic brain injury [J]. Bmc Infect Dis,17(1):472.
NAOKI A,ATSUSHI K,MIWA M,et al.,1997. Specific agalactosidase inhibitors,N-methylcalystegines structure and activity relationships of calystegines from Lycium chinense [J]. Eur J Biochem,248:296-303.
MANIVASAGAN P,VENKATESAN J,SIVAKUMAR K,et al.,2014. Pharmaceutically active secondary metabolites of marine actinobacteria [J]. Microbiol Res,169(4):262-278.
PARK SW,PARK ST,LEE JE,et al.,2008. Pseudonocardia carboxydivorans sp. nov. a carbon monoxide-oxidizing actinomycete and an emended description of the genus Pseudonocardia [J]. Int J Syst Evol Microbiol,58(11):2475-2478.
QIN M,YU QW,ZHU LB,et al.,2016. Diversity of epiphytic bacteria of three species of gracilaria and their bacteriostatic activities [J]. J S Agric,47(11):1966-1973. [覃媚,于清武,竺利波,等,2016. 三種江蓠共附生细菌多样性及抑菌活性分析 [J]. 南方农业学报,47(11):1966-1973.]
TANVIR R,SAJID I,HASNAIN S,et al.,2016. Rare Actinomycetesnocardia caishijiensis and Pseudonocardia carboxydivorans as endophytes,their bioactivity and metabolites evaluation [J]. Microbiol Res,185:22.
TAO SH,YANG YX,ZHANG Y,et al.,2016. Study on the chemical constituents of the mangrove associated plant Abrus precatorius L. [J]. J Guangdong Pharm Univ,32(4):425-427. [陶曙红,杨雅贤,张玙,等,2016. 红树伴生植物相思子的化学成分研究 [J]. 广东药学院学报,32(4):425-427.]
WALSH PS,METZGER DA,HIGUCHI R,1991. Chelex 100 as a medium for simple extraction of DNA for PCR-based typing from forensic material [J]. Biotechniques,10(4):506-513.
WANG YJ,MA JW,WANG XZ,et al.,2014. Potential anti-aging effects of grape seed procyanidins on Caenorhabditis elegans [J]. Sci Technol Food Ind,35(20):369-373. [王艳菊,马建伟,王曦茁,等,2014. 葡萄籽原花青素对秀丽隐杆线虫抗衰老的影响 [J]. 食品工业科技,35(20):369-373.]
WU JF,WU ST,LI ZM,et al.,2017. Biodiversity and screening of culturable actinobacteria against fusarium oxysporum isolated from mangrove soil in Maowei Sea [J]. Chin J Antibiot,42(4):294-301. [吴家法,吴思婷,李智鸣,等,2017. 茅尾海红树林土壤可培养放线菌多样性及其抗尖孢镰刀菌活性分析 [J]. 中国抗生素杂志,42(4):294-301.]
XUE XL,ZHANG JQ,SONG SJ,et al.,2017. Aging and aging related neurodegenerative disease models and drug screening based on Caenorhabditis elegans:Research progress [J]. Chin J Pharmacol Toxicol,31(5):429-438. [薛晓利,张建琴,宋少娟,等,2017. 秀丽隐杆线虫衰老与衰老相关神经退行性疾病模型及药物筛选研究进展 [J]. 中国药理学与毒理学杂志,31(5):429-438. ]
XU LH,LI WJ,LIU ZH,et al.,2007. Actinomycete systema-tics—principle method and practice [M]. Beijing:Science Press. [徐丽华,李文均,刘志恒,2007. 放线菌系统学——原理、方法及实践 [M]. 北京:科学出版社.]
XU M,LI J,DAI SJ,et al.,2016. Study on diversity and bioactivity of actinobacteria isolated from mangrove plants collected from Zhanjiang in Guangdong Province [J]. Chin J Antibiot,41(1):26-34. [许敏,李静,戴素娟,等,2016. 广东湛江红树林植物内生放线菌资源勘探及生物活性研究 [J]. 中国抗生素杂志,41(1):26-34.]
YUAN XW,YANG RL,2009. Isolation and identification of one marine actinomycete strain exhibiting antitumor activity [J]. Microbiol Chin,36(1):78-83. [袁献温,杨瑞丽,2009. 一株具有抗肿瘤活性的海洋放线菌的分离和鉴定 [J]. 微生物学通报,36(1):78-83.]
ZENG EK,SUN YH,DUAN L,et al.,2012. Aging of Chinese population and science of aging [J]. Chin J Soc Med,29(6):388-389. [曾尔亢,孙煜昊,段凌,等,2012. 我国人口老龄化与衰老科学 [J]. 中国社会医学杂志,29(6):388-389.]
ZHOU SQ,HUANG XL,HUANG DY,et al.,2010. A rapid method for extracting DNA from a ctinomycetes by Chelex-100 [J]. Biotechnol Bull,(2):123-125. [周雙清,黄小龙,黄东益,等,2010. Chelex-100快速提取放线菌DNA作为PCR扩增模板 [J]. 生物技术通报,(2):123-125.]
