大蓟不同药用部位的HPLC特征图谱与化学模式识别研究
2020-04-20谢明晏张正黄瑶张志鹏胡瑶程学仁
谢明晏 张正 黄瑶 张志鹏 胡瑶 程学仁

摘 要 目的:建立大蓟不同药用部位的高效液相色谱(HPLC)特征图谱,并结合化学识别方法全面比较大蓟不同药用部位化学成分的差异,为大蓟药材的质量控制及评价提供参考。方法:采用HPLC法分别对大蓟药材(即地上部分)、叶、花、主茎和侧茎进行测定,按《中药色谱指纹图谱相似度评价系统》(2012A版)对色谱图进行匹配生成各药用部位的HPLC特征图谱,通过单因素方差分析共有特征峰峰面积差异,通过与对照品比对进行色谱峰指认,并结合主成分分析和聚类分析对大蓟不同药用部位进行化学模式识别研究。结果:分别建立了大蓟药材、叶、花、主茎、侧茎的HPLC特征圖谱,大蓟药材、叶和花的图谱中共确定了15个共有峰,主茎、侧茎的图谱中共确定了11个共有峰(7、9、12、13号峰缺失),不同药用部位之间化学成分含量差异较大;指认峰1、2、3、10、11分别为新绿原酸、绿原酸、隐绿原酸、蒙花苷和柳穿鱼叶苷。主成分分析和聚类分析结果显示,大蓟花与茎的化学模式识别聚类区别清晰,可分别聚为一类;但大蓟叶分布较为分散,难以很好地聚类。结论:建立的HPLC特征图谱-化学模式识别分析模型能够整体、全面、真实地反映大蓟不同药用部位之间的差异,对大蓟药材的基源鉴别、质量控制及整体性评价具有重要意义。
关键词 大蓟;药用部位;特征图谱;方差分析;主成分分析;聚类分析
ABSTRACT OBJECTIVE: To establish HPLC characteristic chromatogram of different medicinal parts of Cirsium japonicum, and to compare the difference of chemical components in different medicinal parts of C. japonicum according to chemical identification method, and to provide reference for quality control and evaluation of C. japonicum. METHODS: Medicinal material(overground part), leaves, flower, main stem and lateral stem of C. japonicum were determined by HPLC. According to the TCM Chromatographic Fingerprint Similarity Evaluation System (2012A edition), the chromatograms were matched to generate the HPLC characteristic chromatogram of each medicinal part. The differences of common characteristic peak area were analyzed according to variance analysis of single factor. The chromatographic peaks were identified by comparison of reference substance. Meanwhile, the chemical pattern recognition was performed to research the different medicinal parts of C. japonicum according to principal component analysis (PCA) and cluster analysis. RESULTS: HPLC characteristic chromatograms of medicinal material, leaves, flower, main stem and lateral stem from C. japonicum were established respectively, and 15 common peaks were confirmed for medicinal material, leaves and flower of C. japonicum; 11 common peaks were confirmed in chromatograms of main stem and lateral stem from C. japonicum (absence of No. 7, 9, 12, 13 peak). The contents of chemical components were different greatly among different medicinal parts. No. 1, 2, 3, 10, 11 peaks were identified as neochlorogenic acid, chlorogenic acid, cryptochlorogenic acid, linarin and pectolinarin. Results of PCA and cluster analysis showed that chemical pattern recognition and clustering of the flower and stem of C. japonicum were distinct and can be clustered into one category respectively. However, the leaves distribution of C. japonicum was relatively scattered, so it was difficult to cluster. CONCLUSIONS: Established HPLC characteristic chromatogram-chemical pattern recognition can reflect the differences of different medicinal parts of C. japonicum integrally, comprehensively and truly, which has vital significance for origin indentification, quality control and overall evaluation of C. japonicum.
KEYWORDS Cirsium japonicum; Medicinal parts; Charac- teristic chromatogram; Variance analysis; Principal component analysis; Cluster analysis
大蓟为菊科植物蓟(Cirsium japonicum Fisch. ex DC.)的干燥地上部分,其味甘、苦,性凉,有凉血止血、散瘀解毒消痈之功效,主治衄血、吐血、尿血、便血、崩漏、外伤出血、痈肿疮毒等病症[1],为临床常用止血药。研究表明,大蓟的化学成分主要为黄酮类、甾醇类、木脂素类、长链炔烯醇类、苷类及挥发油类等,具有凝血止血、抗肿瘤等药理作用,并且其发挥止血凝血作用的主要活性成分为柳穿鱼叶苷和蒙花苷等黄酮类成分[2-7]。
大蓟在中国大部分地区均有分布,由于其产地众多、生产环境多样,不同地区大蓟的植物形态有一定差异,形成了众多同种不同型的大蓟药材[8]。而古代本草关于大蓟的记载十分简略,仅以叶裂和有针刺为特征,导致目前市场上大蓟药材较为混乱,基源鉴定十分困难[9]。1985-2000年版的《中国药典》规定,大蓟药用部位为干燥地上部分或根。后因其不同部位组织特征差异显著,药理作用差异较大,自2005年版《中国药典》开始,将大蓟药用部位改为地上部分,除去了地下部分——大蓟根。据文献报道,大蓟地上部分中茎、叶具有较显著的止血功效;并且大蓟叶提取物可抑制脂肪的形成,具有潜在的肥胖症治疗功效[2,10]。但目前,關于大蓟药材和不同药用部位的研究较少,仅是基于柳穿鱼叶苷和蒙花苷的含量研究[11],无法全面表征大蓟药材质量和不同药用部位化学成分的差异性。因此,本研究采用高效液相色谱(HPLC)法,分别建立大蓟药材(即地上部分)、叶、花、主茎、侧茎的特征图谱,并结合主成分分析和聚类分析对大蓟不同药用部位进行化学模式识别研究,全面比较大蓟不同药用部位化学成分的差异,为大蓟药材的质量控制及评价提供科学依据。
1 材料
1.1 仪器
ARC型HPLC仪(美国Waters公司);KQ-500DE型数控超声清洗器(昆山市超声仪器有限公司);ME204E型万分之一天平(瑞士Mettler Toledo公司);MiliQ Direct 8型超纯水机(德国Merck股份有限公司);111B型二两装高速中药粉碎机(浙江瑞安市永历制药机械有限公司);HWS-28型电热恒温水浴锅(上海一恒科学仪器有限公司)。
1.2 药品与试剂
10批大蓟药材分别于2018年采集自江苏和安徽,经广东一方制药有限公司魏梅主任药师鉴定均为菊科植物蓟(C. japonicum Fisch. ex DC.)的干燥地上部分,将每批药材的叶、花、主茎、侧茎分开,将药材和不同药用部位分别粉碎、过筛后备用(来源信息详见表1,将编号S1~S10药材对应的叶记为S11~S20,对应的花记为S21~S30,对应的主茎记为S31~S40,对应的侧茎记为S41~S50);柳穿鱼叶苷对照品(批号:111728-201703,纯度:99.6%)、绿原酸对照品(批号:110753-201817,纯度:96.8%)、蒙花苷对照品(批号:111528-201509,纯度:97.5%)均购自中国食品药品检定研究院;新绿原酸对照品(批号:wkq18030107,纯度:≥98%)、隐绿原酸对照品(批号:wkq16081903,纯度:≥98%)均购自四川省维克奇生物科技有限公司;甲醇、乙腈、磷酸为色谱纯,其余试剂均为分析纯,水为实验室自制超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Waters XBridge C18(250 mm×4.6 mm,5 μm);流动相:乙腈-甲醇(4 ∶ 1,V/V)(A)-0.1%磷酸(B),梯度洗脱(0~16 min,91%B→83%B;16~18 min,83%B→79%B;18~36 min,79%B→72%B;36~46 min,72%B→5%B);检测波长:330 nm;柱温:30 ℃;流速:1.0 mL/min;进样量:10 μL。
2.2 混合对照品溶液的制备
分别取新绿原酸、绿原酸、隐绿原酸、蒙花苷、柳穿鱼叶苷对照品适量,精密称定,加70%甲醇溶解,制成每1 mL中分别含新绿原酸88.278 μg、绿原酸29.958 μg、隐绿原酸52.431 μg、蒙花苷21.561 μg和柳穿鱼叶苷87.768 μg的混合对照品溶液。
2.3 供试品溶液的制备
取样品粉末约0.5 g,精密称定,置于具塞锥形瓶中,精密加入70%甲醇100 mL,称定质量,加热回流1 h,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,用0.22 μm滤膜滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 精密度试验 精密称取编号为S7的药材样品(地上部分,下同),按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件重复进样6次,记录色谱图。以11号峰(柳穿鱼叶苷峰)为参照峰,计算得各特征峰的相对保留时间及相对峰面积的RSD均小于3%(n=6),表明仪器精密度良好。
2.4.2 稳定性试验 精密称取编号为S7的药材样品,按“2.3”项下方法制备供试品溶液,分别于室温下放置0、2、4、8、12、24 h时,按“2.1”项下色谱条件进样测定,记录色谱图。以11号峰(柳穿鱼叶苷峰)为参照峰,计算得各特征峰的相对保留时间及相对峰面积的RSD均小于3%(n=6),表明供试品溶液在室温条件下放置24 h内稳定。
2.4.3 重复性试验 精密称取编号为S7的药材样品6份,按“2.3”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录色谱图。以11号峰(柳穿鱼叶苷峰)为参照峰,计算得各特征峰的相对保留时间及相对峰面积的RSD均小于3%(n=6),表明该方法的重复性良好。
2.5 HPLC特征图谱研究
2.5.1 HPLC特征图谱的建立 按“2.3”项下方法分别制备10批大蓟药材、叶、花、主茎、侧茎的供试品溶液,按“2.1”项下色谱条件进行测定,记录色谱图。采用《中药色谱指纹图谱相似度评价系统》(2012A版)分别进行色谱峰匹配,建立大蓟药材及不同药用部位的特征图谱。以S1号图谱作为参照图谱,设置时间窗宽度为0.1 min,通过多点校正、全谱峰匹配分别生成10批大蓟药材、叶、花、主茎和侧茎的共有特征图谱,同时采用中位数法分别生成对照特征图谱。10批大蓟药材、叶、花、主茎和侧茎的共有特征图谱详见图1,对照特征图谱详见图2。
2.5.2 HPLC特征图谱的分析 由图2显示,大蓟不同药用部位对照特征图谱存在明显差异。大蓟花和叶的对照特征图谱中均具有与大蓟药材相同的15个特征峰;大蓟主茎和侧茎征特对照图谱中均有4个共有峰(峰7、9、12、13)缺失,提示这4个特征峰为大蓟花和叶的主要标志成分,确定的11个特征峰同时也为花和叶所共有。
采用SPSS 20.0软件对10批大蓟药材及不同药用部位特征峰的峰面积进行单因素方差分析。结果显示,大蓟药材与叶以及大蓟主茎与侧茎的各特征峰峰面积差异均无统计学差异(P>0.05),但大蓟药材与花的特征峰11和12,与主茎的特征峰7、9~13,以及与侧茎的特征峰5、7、9、12、13的峰面积差异均有统计学意义(P<0.05);大蓟叶与花的特征峰6、9~13、15,以及与主茎和侧茎的特征峰6、7、9~13、15的峰面积差异均有统计学意义(P<0.05);大蓟花与主茎的特征峰7、9、12~14,以及與侧茎的特征峰7、9、12、13的峰面积差异均有统计学意义(P<0.05),这表明大蓟不同药用部位之间化学成分的含量差异较大。10批大蓟不同药用部位特征图谱共有峰峰面积的方差分析结果详见表2。
2.5.3 色谱峰的指认 取“2.2”项下混合对照品溶液,按“2.1”项下色谱条件进样测定,记录色谱图。通过与对照品图谱比对,指认了峰1为新绿原酸、峰2为绿原酸、峰3为隐绿原酸、峰10为蒙花苷、峰11为柳穿鱼叶苷。混合对照品溶液的色谱图详见图3。
2.6 化学模式识别研究
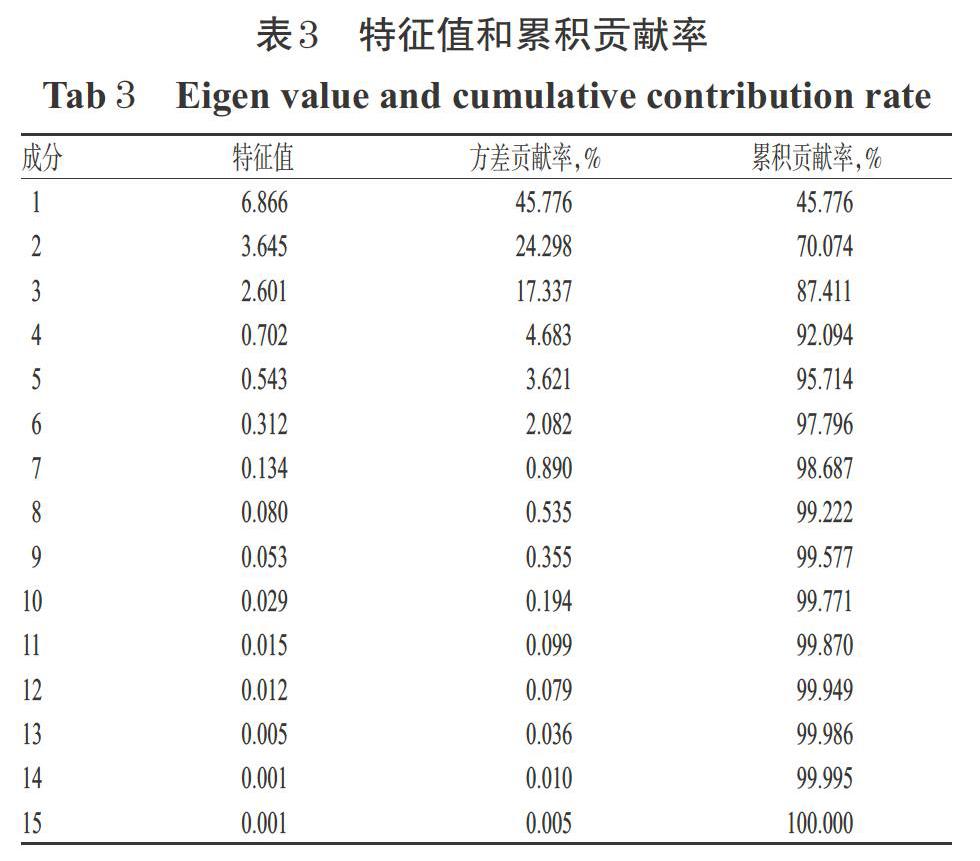
2.6.1 主成分分析 主成分分析是一种多元统计分析方法,其利用方差最大原则,可对原始数据中的多个自变量进行数据的降维,寻找少数几个由原始变量线性组合的主成分,然后采用少数综合变量来代替原始的众多变量,常被用来筛选含复杂组分的不同样本间具有显著性差异的组分,具有可信度高、灵活性强、侧重于综合评价信息的贡献影响力的特点,近年来在中药鉴定、质量评价和品种分类等方面多有应用[12-13]。本研究分别以大蓟不同药用部位(花、主茎、侧茎和叶)的15个特征峰峰面积作为变量(缺失特征峰面积记为0),使用SPSS 20.0软件进行主成分分析。以特征值大于1为判断标准,共提取出3个主成分,这3个主成分对总方差的累积贡献率达87.411%(主成分1、2、3的特征值分别为6.866、3.645、2.601,累积贡献率分别为45.776%、70.074%、87.411%),说明其可较好地反映大蓟不同药用部位的总体成分信息。三维得分散点图显示,大蓟花与主茎、侧茎、叶之间区分界线较为清晰,没有互相重叠的区域,可单独聚为一类,表明大蓟花与大蓟叶、主茎、侧茎差异明显;大蓟主茎和侧茎的样本聚集在一起,无法区分,表明主茎和侧茎之间无明显差异;大蓟叶样本较为分散,无法较好地聚类,且部分样本与主茎和侧茎样本聚集在一起,表明大蓟叶的批间差异较大。特征值和累积贡献率结果详见表3,大蓟不同药用部位样品主成分分析三维得分散点图详见图4。
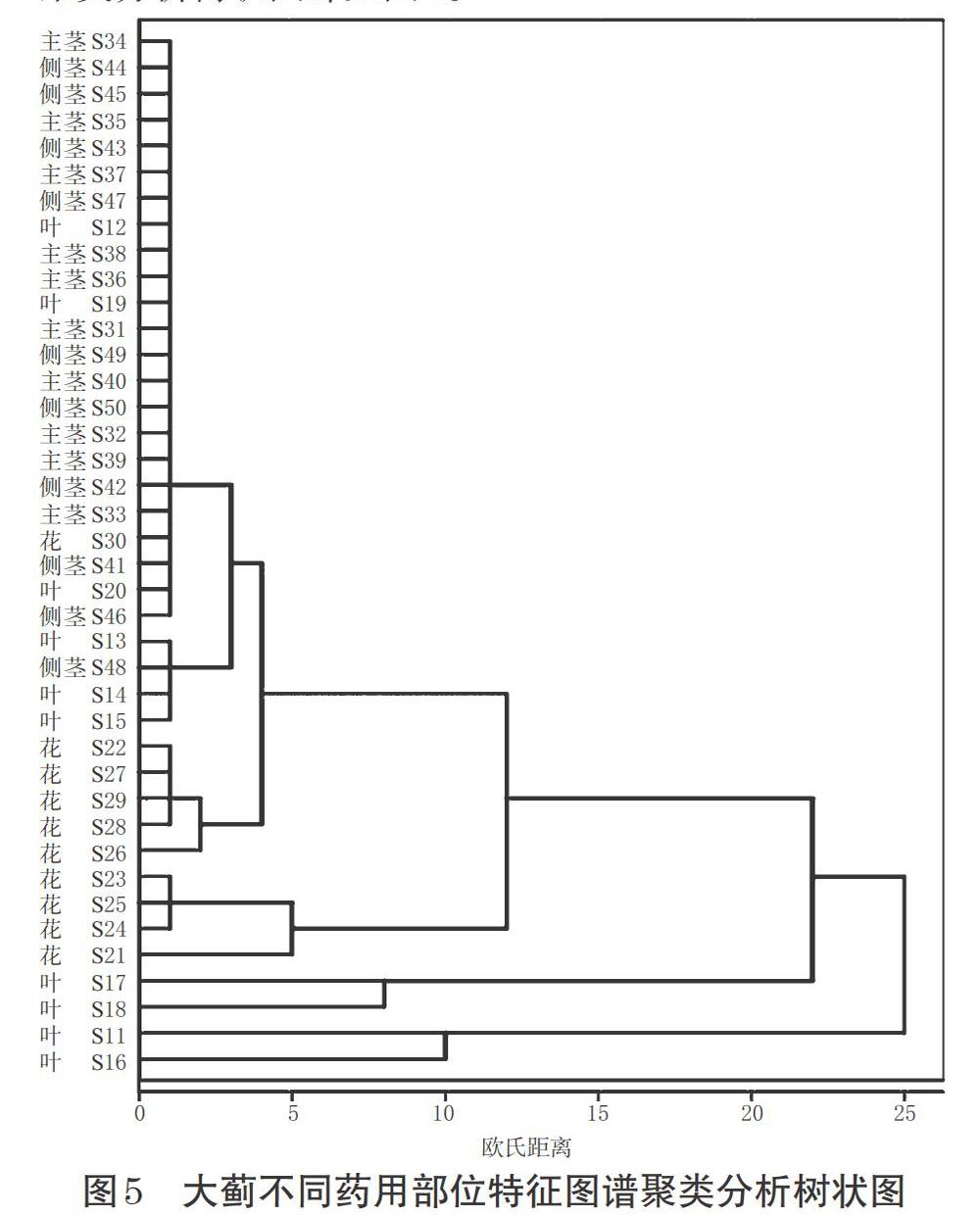
2.6.2 聚类分析 聚类分析是一种无监督模式识别方法,将样本数据在没有先验知识的前提下,基于样品所表现的变量特征,按照相似度进行归类,可直观地得到样本分类结果[14]。本研究以10批药材的4个药用部位,即大蓟叶、花、主茎、侧茎的峰面积为原始数据,使用SPSS 20.0软件进行聚类分析。采用组间平均数联接法,以Euclidean平方距离为度量标准。结果显示,大蓟花可聚为一类;主茎与侧茎可聚为一类;部分批次的叶可单独聚为一类,但也有部分批次分散在主茎和侧茎类别之中,无法较好地聚类。大蓟不同药用部位特征图谱聚类分析树状图详见图5。
3 讨论
3.1 提取溶剂和提取时间的优化
本研究考察了不同提取溶剂(50%甲醇、70%甲醇、甲醇、70%乙醇、乙醇)、不同提取方式(回流、超声)及不同提取时间(0.5、1、1.5 h)对大蓟药材特征图谱的影响。结果,当提取溶剂为70%甲醇、加热回流1 h时,样品提取完全,得到的样品色谱峰峰形较好,色谱峰信息较丰富,故确定样品提取条件为70%甲醇加热回流1 h。
3.2 大蓟不同药用部位化学化成分的差异分析
研究发现,大蓟不同药用部位化学成分含量有较大差异[2,11],笔者推断其不同部位的具体应用与某些成分的含量差异具有一定相关性。本研究通过对大蓟不同药用部位特征图谱与混合对照品特征图谱比较,指认了峰1为新绿原酸、峰2为绿原酸、峰3为隐绿原酸、峰10为蒙花苷、峰11为柳穿鱼叶苷。大蓟不同部位化学成分组成和含量均存在显著差异,其中大蓟花、叶和茎(主茎、侧茎)差异性较为明显,主茎和侧茎中缺失的共有峰(峰7、9、12、13)虽然均存在花和叶中,但叶中含量偏低,而花中的含量较高,表明大蓟药材中此4种成分主要来自花。相关研究表明,蒙花苷和柳穿鱼叶苷具有明显的止血功效,止血机制可能是通过增加机体纤维蛋白原含量,影响抗凝系统发挥作用[15]。本研究比较了不同药用部位中蒙花苷和柳穿鱼叶苷成分分布情况,结果大蓟叶中以上2种成分含量显著高于其他部位,与文献中大蓟植株的蒙花苷和柳穿鱼叶苷主要分布在茎叶中的报道结果[10]较为一致,根据这一特点,可考虑以大蓟叶作为原料开发止血药物。结合以上研究结果,建议大蓟采收时应在叶子茂盛的夏季,且采收过程尽可能保证花朵的完整性,确保药材整体的质量和药效。另外,因大蓟药材包括了花、叶、主茎及侧茎等部位,共同分析时无法较好地找到分类规律,故未对地上部分进行模式分析。主成分分析和聚类分析结果均显示,不同批次的大蓟叶分布较为分散,难以很好地聚为一类,分析原因可能是叶的生长周期较长,不同采收时期、不同生长环境均会影响成分的积累,后期将对影响叶片成分积累的主要因素进行研究。
综上,本研究分别建立了大蓟药材及其不同药用部位的HPLC特征图谱,并结合主成分分析及聚类分析等化学模式识别方法和方差分析方法,可较全面地反映大蓟不同药用部位成分的差异。但不同药用部位化学成分的差异及所占药材比例的不同是否会影响其临床疗效,尚需进一步结合药理学实验深入研究。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:25.
[ 2 ] 赵彧,邱明阳,刘玉婷,等.大蓟化学成分及药理活性研究进展[J].中草药,2017,48(21):4584-4590.
[ 3 ] 侯坤,许浚,张铁军.蓟属药用植物的化学成分和药理作用研究進展[J].中草药,2010,41(3):506-509.
[ 4 ] 蒋秀蕾,范春林,叶文才.大蓟化学成分的研究[J]. 中草药,2006,37(4):510-512.
[ 5 ] 顾玉诚,屠呦呦.大蓟化学成分的研究[J].中国中药杂志,1992,17(8):489-490、512.
[ 6 ] 李敏,苗明三.大蓟的化学、药理及临床应用特点[J].中医学报,2016,31(2):262-265.
[ 7 ] 陈海芳,陈凯云,袁金斌,等.大蓟的止血活性药效初步研究[J].中华中医药学刊,2010,28(7):1458-1459.
[ 8 ] 石铸.中国菊科菜蓟族植物研究:三[J].植物研究,1984,4(2):59-66.
[ 9 ] 吴蜀星,李治昊,宋良科,等.大蓟的基源调查与鉴定[J].现代中药研究与实践,2013,27(1):21-23.
[10] 张丹,周洁.大蓟临床应用浅析[J].云南中医中药杂志,2004,25(3):19-21.
[11] 伍敏生,曹维生,周启仲.大蓟药用部位成分分析[J].中医学报,2016,31(12):1947-1949.
[12] 甄亚钦,冯玉,田伟,等.忍冬不同部位UPLC指纹图谱及化学模式识别研究[J].中草药,2019,50(18):4449-4454.
[13] 孙立丽,王萌,任晓亮.化学模式识别方法在中药质量控制研究中的应用进展[J].中草药,2017,48(20):4339- 4345.
[14] 邱新华,唐铁鑫,刘燕,等.几种模式识别方法用于中药挥发油红外光谱法鉴别的比较研究[J].中国药房,2015,26(21):2986-2988.
[15] 龚千锋,钟凌云,张的凤,等.大蓟饮片、大蓟炭的炮制及质量标准研究[C]//中华中医药学会第四届中药炮制分会学术会议论文集.北京:中华中医药学会中药炮制分会,2004:170-172.
(收稿日期:2019-11-13 修回日期:2020-01-10)
(编辑:林 静)
