蒲黄不同药用部位的质量比较
2020-04-20严华魏锋马双成
严华 魏锋 马双成


摘 要 目的:比较草蒲黃和蒲黄花粉的质量差异,为蒲黄质量标准的完善提供科学依据。方法:收集15批次草蒲黄,按照2015年版《中国药典》中蒲黄相关方法筛分出筛下蒲黄花粉和筛上杂质(花丝、花药),通过杂质百分比、性状、显微镜鉴别、薄层色谱鉴别确证草蒲黄和蒲黄花粉、花丝、花药的特征和成分,采用高效液相色谱法测定草蒲黄、蒲黄花粉、筛上杂质(花丝、花药)中异鼠李素-3-O-新橙皮苷、香蒲新苷的含量。结果:草蒲黄为蒲黄花粉、花药及花丝的混合物,呈棕黄色絮状;蒲黄花粉呈黄色粉末,手感细腻,气微,味淡,细胞表面略呈条状;花丝和花药呈丝状、短线状,手感粗涩,表面观细胞呈长条形。草蒲黄、蒲黄花粉及蒲黄杂质的薄层色谱鉴别结果具有一致的色谱斑点;含量测定结果显示,异鼠李素-3-O-新橙皮苷、香蒲新苷及其二者总含量在蒲黄花粉中均最高(分别为0.42%、0.24%、0.64%),草蒲黄其次(0.22%、0.17%、0.39%),筛上杂质中含量最低(0.19%、0.14%、0.33%);草蒲黄与筛上杂质中异鼠李素-3-O-新橙皮苷和香蒲新苷的总含量均未达到2015年版《中国药典》规定含量限度(不得少于0.50%)。结论:蒲黄的药用成分主要存在于花粉中。建议草蒲黄应作为获取花粉的原料,而不宜直接药用。
关键词 蒲黄;草蒲黄;药用部位;异鼠李素-3-O-新橙皮苷;香蒲新苷;质量标准
ABSTRACT OBJECTIVE: To compare the quality between Stamen typhae and pollen of T. angustifolia, and provide scientific evidence for the improvement of quality standard of T. angustifolia. METHODS: Fifteen batches of S. typhae were collected. Pollen minus sieve, impurity plus sieve (filament and anther) were sift out from S. typhae according to the identification method of T. angustifolia in Chinese Pharmacopoeia (2015 edition). The characteristics and components of S. typhae and pollen, filament and anther of T. angustifolia were comfirmed by impurity, character examination and microscope, TLC. The contents of isorhamnetin-3-O-neohesperidoside and typhaneoside in S. typhae and pollen, impurities plus sieve (filament and anther) of T. angustifolia were determined by HPLC. RESULTS: S. typhae was a mixture of pollen, anther and filament of T. angustifolia, in the form of brownish yellow flocculent. The pollen of S. typhae was yellow powder with delicate hand feel, slight smell and light taste; the surface of cells was slightly striped. The filaments and anthers were filiform and short-term, rough and astringent, and the cell surface were long strip. TLC chromatogram of S. typhae, pollen and impurity of T. angustifolia had the same color spots at the same location. The contents of isorhamnetin-3-O-neohesperidoside, typhaneoside and their aggregate were the highest in pollen (0.42%, 0.24%, 0.64%); the second in S. typhae (0.22%, 0.17%, 0.39%); the lowest in the impurities plus sieve (0.19%, 0.14%, 0.33%). The total contents of isorhamnetin-3-O-neohesperidoside and typhaneoside in S. typhae and in impurities plus sieve did not reach the content limit stipulated in Chinese Pharmacopoeia (not less than 0.50%). CONCLUSIONS: The medicinal components of T. angustifolia mainly exist in pollen. It is suggested that S. typhae should be used as the raw material to obtain pollen, and should not be used directly.
KEYWORDS Typha angustifolia; Stamen typhae; Medicinal part; Isorhamnetin-3-O-neohesperidoside;
中藥蒲黄在2015年版《中国药典》(一部)中的记载为:“蒲黄为香蒲科植物水烛香蒲(Typha angustifolia L.)、东方香蒲(Typha orientalis Presl)或同属植物的干燥花粉。夏季采收蒲棒上部的黄色雄花序,晒干后碾轧,筛取花粉。剪取雄花后,晒干,成为带有雄花的花粉,即为草蒲黄”[1]。由此可见,蒲黄既可以是纯花粉,也可以是包含雄花或雄花序的花粉(下文分别以“蒲黄花粉”和“草蒲黄”描述),蒲黄为蒲黄花粉与草蒲黄的统称。但有研究表明,蒲黄花粉与草蒲黄的质量差异显著,蒲黄花粉的质量明显优于草蒲黄[2]。而《中国药典》记载的蒲黄的检验项目均未明确说明是否适用于蒲黄花粉和草蒲黄[1]。这为蒲黄的质量控制带来一定的困扰。
2017-2018年市场和流通领域抽验结果显示,市场常依据蒲黄中蒲黄花粉的纯度对其进行等级划分[3-4],但由于掺杂的蒲黄花粉和草蒲黄的外观不易分辨,使得草蒲黄常作为蒲黄主流商品销售[5-8]。为此,笔者深入蒲黄主产区内蒙古实地调研了其生产、加工过程,并结合药材市场考察,获取不同环节(包括生产采收、晾晒加工、流通销售等)的代表性样品,通过杂质检查、薄层色谱分析及含量测定等方法,分析比较草蒲黄及其筛下蒲黄花粉和筛上杂质(含雄蕊、花丝等)中主要化学成分异鼠李素-3-O-新橙皮苷和香蒲新苷的含量差异,旨为完善蒲黄质量标准提供科学依据。
1 材料
1.1 仪器
2695-2996系列高效液相色谱(HPLC)仪(美国Waters公司);SZX16型体视显微镜、BX53型生物显微镜(日本Olympus公司);CAMAG型薄层色谱系列仪器,配有全自动点样仪、薄层双槽展开缸、Reprostar 3型薄层成像系统、Wincat薄层色谱软件(瑞士Camag公司);FED-115型热循环干燥箱(德国Binder公司);XSE 205型分析天平[赛多利斯科学仪器(北京)有限公司];KQ-300DAG型数控超声波清洗器(昆山市超声仪器有限公司);DK-98-Ⅰ型电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.2 药材与试剂
草蒲黄于2018年6-7月采自或购自内蒙古、山东、广东、湖北等地区,均为野生品,经中国食品药品检定研究院张南平主任药师鉴定均为香蒲科植物水烛香蒲(T. angustifolia L.)的雄花,样品阴干后备用。蒲黄对照药材(蒲黄花粉,批号:121225-201804)、异鼠李素-3-O-新橙皮苷对照品(批号:111571-201806,纯度:93.0%)、香蒲新苷对照品(批号:111573-201806,纯度:96.5%)均由中国食品药品检定研究院提供;乙腈为色谱纯,其余试剂均为分析纯,水为自制超纯水。草蒲黄样品来源信息详见表1。
1.3 其他
聚酰胺薄膜(台州市路桥四甲生化塑料厂,规格:20 cm×10 cm)。
2 方法与结果
2.1 杂质检查
依照《中国药典》蒲黄标准中“检查”项方法[1]操作:取各批草蒲黄药材样品10 g,未经碾压处理,称定质量,置于七号筛中,保持水平状态过筛,左右往返,边筛边轻叩2 min。获取筛下蒲黄花粉样品和筛上杂质样品两部分,称定杂质的质量,计算杂质质量在草蒲黄中所占百分比(%),平行操作2次,取平均值。结果,序号1~15草蒲黄样品中杂质质量百分比分别为94.7%、93.6%、92.7%、94.1%、24.1%、50.3%、86.9%、64.8%、68.1%、41.0%、80.0%、74.8%、34.8%、26.8%、24.6%(n=2)。由此可见,草蒲黄中杂质质量百分比差异较大,部分草蒲黄中杂质所占比例极高,远高于《中国药典》规定的蒲黄杂质检查限度(≤10.0%)[1]。
2.2 性状检查
2.2.1 肉眼 取各批草蒲黄样品及其筛下蒲黄花粉和筛上杂质部分(再过四号筛)各适量,于光线充足条件下肉眼观察其性状。结果显示,草蒲黄为花粉、花药及花丝的混合物,呈棕黄色絮状。筛上杂质主要为花丝和花药,花丝呈丝状,不规则弯曲或缠绕成团,显棕黄色至棕色,手捻易成团,手感粗涩;花药呈短线状,长0.2~0.3 cm,显棕黄色,手捻易碎,手感粗糙。筛下蒲黄花粉呈粉末状,显黄色,手捻有光滑感,易附着于手指上,手感细腻,气微,味淡。草蒲黄、杂质、蒲黄花粉的图片详见图1。
2.2.2 体视显微镜 在50倍体视显微镜下观察蒲黄花粉、花药及花丝的形状。结果显示,蒲黄花药具有四棱,棱槽明显,顶端呈褐色至黑褐色;花丝呈细线状;花粉为细小颗粒,详见图2。
2.2.3生物显微镜 取各批草蒲黄样品及其筛下蒲黄花粉、筛上花丝(再过四号筛)各适量,分别置于水合氯醛-甘油(1 ∶ 1,V/V)溶液中,加热透化装片,置于100倍和400倍生物显微镜下检视。结果显示,草蒲黄显黄色。蒲黄花粉呈类圆形或椭圆形,直径17~29 μm,表面有网状雕纹,周边轮廓线光滑,呈波状或齿轮状,具单孔,但不甚明显,花粉囊壁细胞表面略呈条状,细胞界限不明显,有不规则螺状纹理。蒲黄花丝碎片显无色或淡棕黄色,表面观细胞呈长条形,排列紧密,呈草酸钙针晶束状,长50~70 μm,散在或存在于薄壁细胞中。草蒲黄、蒲黄花粉和花丝的生物显微图详见图3。
2.3 薄层色谱鉴别
2.3.1 供试品溶液制备 取草蒲黄或其筛下蒲黄花粉、筛上杂质样品粉末各2 g,加80%乙醇50 mL,冷浸24 h,滤过,滤液蒸干,残渣加水5 mL使溶解,滤过;滤液加水饱和的正丁醇振摇提取2次,每次5 mL;合并正丁醇萃取液,蒸干,残渣加乙酸乙酯2 mL使溶解,即得。
2.3.2 对照药材溶液制备 取蒲黄对照药材2 g,按“2.3.1”项下方法制成对照药材溶液。
2.3.3 对照品溶液制备 取异鼠李素-3-O-新橙皮苷对照品、香蒲新苷对照品各适量,加乙醇分别制成每1 mL含上述成分均为0.5 mg的溶液,即得。
2.3.4 阴性对照溶液制备 按“2.3.1”项下方法取除药材样品外的试剂,制成阴性对照溶液。
2.3.5 展开预检视 吸取不同批次草蒲黄供试品溶液及其筛上杂质供试品溶液、筛下蒲黄花粉供试品溶液,以及对照药材溶液、对照品溶液和阴性对照溶液各2 μL,分别点于同一聚酰胺薄膜上,以丙酮-水(1 ∶ 2,V/V)为展开剂,展开。取出,晾干,喷以三氯化铝试液,于紫外光灯(365 nm波长)下检视,部分薄层色谱图详见图4。
由图4显示,草蒲黄及其筛下蒲黄花粉和筛上杂质具有一致的色谱斑点,且在与对照药材和对照品色谱相应位置均分别显一致的斑点,杂质的斑点与草蒲黄的斑点大小基本一致,均较蒲黄花粉的斑点稍小,说明杂质中成分与花粉的成分类别一致。
2.4 含量测定
2.4.1 色谱条件 色谱柱:Perkin Elmer C18(250 mm×4.6 mm,5 μm);流动相:乙腈-0.05%磷酸溶液(15 ∶ 85, V/V);检测波长:254 nm;流速:1 mL/min;柱温:35 ℃;进样量:5~20 μL(视峰面积的大小适当调整)。
2.4.2 供试品溶液制备 取同一批次的草蒲黄及其筛下蒲黄花粉、筛上杂质样品粉末(批号:PHGM-1)各约0.5 g,精密称定,置于具塞锥形瓶中,分别精密加入甲醇50 mL,称定质量,冷浸12 h,超声(功率:250 W,频率:50 kHz)提取30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.4.3 混合对照品溶液制备 取异鼠李素-3-O-新橙皮苷对照品、香蒲新苷对照品各适量,精密称定,分别置于10 mL量瓶中,加甲醇溶解,并稀释至刻度,摇匀,制成异鼠李素-3-O-新橙皮苷质量浓度为0.530 mg/mL、香蒲新苷质量浓度为0.517 mg/mL的对照品母液。再分别精密吸取上述对照品母液各1 mL,置于同一10 mL量瓶中,加甲醇稀释至刻度,摇匀,制成异鼠李素-3-O-新橙皮苷、香蒲新苷质量浓度分别为53.0、51.7 μg/mL的混合对照品溶液。
2.4.4 阴性对照溶液制备 按“2.4.2”项下方法,取除样品外的试剂,制成阴性对照溶液。
2.4.5 系统适用性试验 取供试品溶液、混合对照品溶液、阴性对照溶液各适量,按“2.4.1”项下色谱条件进样分析,记录色谱图,详见图5。
由图5显示,异鼠李素-3-O-新橙皮苷和香蒲新苷分离度大于1.5,理论板数按异鼠李素-3-O-新橙皮糖苷峰计为1.57×104;阴性对照不影响异鼠李素-3-O-新橙皮苷和香蒲新苷的测定。
2.4.6 线性关系考察 精密吸取“2.4.3”项下混合对照品溶液1、5、10、15、20 μL,按“2.4.1”项下色谱条件进样测定,记录峰面积。以待测物进样量为横坐标(x,μg)、其峰面积为纵坐标(y)进行线性回归分析,得异鼠李素-3-O-新橙皮苷的回归方程为y=300 000x-228 992(r=0.998 8),香蒲新苷的回归方程为y=121 260x+73 388(r=0.998 4)。结果,异鼠李素-3-O-新橙皮苷、香蒲新苷进样量的线性范围分别为0.053~1.060、0.052~1.034 μg。
2.4.7 检测限与定量限考察 精密吸取“2.4.3”项下混合对照品溶液适量,置于10 mL量瓶中,加甲醇逐级稀释后,按“2.4.1”项下色谱条件进样测定,记录峰面积。当异鼠李素-3-O-新橙皮苷和香蒲新苷对照品峰面积与基线信噪比达到3 ∶ 1时即为检测限,信噪比达到10 ∶ 1时即为定量限。结果,异鼠李素-3-O-新橙皮苷和香蒲新苷的檢测限、定量限均分别为0.005、0.025 μg。
2.4.8 精密度试验 精密吸取“2.4.3”项下混合对照品溶液适量,按“2.4.1”项下色谱条件连续测定6次,记录峰面积。结果,异鼠李素-3-O-新橙皮苷、香蒲新苷峰面积的RSD分别为1.5%、2.0%(n=6),表明本方法精密度良好。
2.4.9 稳定性试验 精密吸取同一批次的草蒲黄供试品溶液(批号:PHGM-1)适量,分别于室温放置0、4、8、12、20、24 h时,按“2.4.1”项下色谱条件进样测定,记录峰面积。结果,异鼠李素-3-O-新橙皮苷、香蒲新苷峰面积的RSD分别为1.5%、1.8%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
2.4.10 重复性试验 精密称取同一批次的草蒲黄样品粉末(批号:PHGM-1),共6份,分别按“2.4.2”项下方法制成供试品溶液,再精密吸取上述供试品溶液适量,按“2.4.1”项下色谱条件进样测定,记录峰面积,按外标法计算异鼠李素-3-O-新橙皮苷和香蒲新苷的含量。结果,各样品中异鼠李素-3-O-新橙皮苷的含量分别为0.23%、0.22%、0.23%、0.24%、0.23%、0.22%(RSD=3.0%,n=6),香蒲新苷的含量分别为0.15%、0.15%、0.14%、0.15%、0.15%、0.14%(RSD=3.0%,n=6),表明本方法重复性良好。
2.4.11 加样回收率试验 精密称取同一批次的草蒲黄样品粉末(批号:PHGM-1),共6份,每份约0.25 g,精密加入等量的异鼠李素-3-O-新橙皮苷对照品和香蒲新苷对照品,按“2.4.2”项下方法制成供试品溶液,分别精密吸取20 μL,按“2.4.1”项下色谱条件进样分析,记录峰面积,按外标法计算含量,再计算加样回收率。结果,异鼠李素-3-O-新橙皮苷的平均回收率分别为97.9%、96.1%、98.6%、99.4%、97.8%、102.8%(RSD=2.3%,n=6),香蒲新苷的平均回收率分别为98.5%、96.5%、101.2%、100.4%、98.8%、99.2%(RSD=1.6%,n=6),表明本方法准确度良好。
2.4.12 样品含量测定 分别取表1中各批样品及其筛下蒲黄花粉和筛上杂质适量,按“2.4.2”项下方法制成供试品溶液,按“2.4.1”项下色谱条件进样分析,记录峰面积,采用外标法计算异鼠李素-3-O-新橙皮苷和香蒲新苷的含量以及二者的总量。结果,蒲黄花粉中异鼠李素-3-O-新橙皮苷、香蒲新苷的平均含量及其总量分别为0.42%、0.24%、0.66%;草蒲黄中分别为0.22%、0.17%、0.39%;杂质中分别为0.19%、0.14%、0.33%。其中,仅蒲黄花粉中异鼠李素-3-O-新橙皮苷、香蒲新苷的总量达到药典规定限度(不得少于0.50%)。样品含量测定结果详见表2。
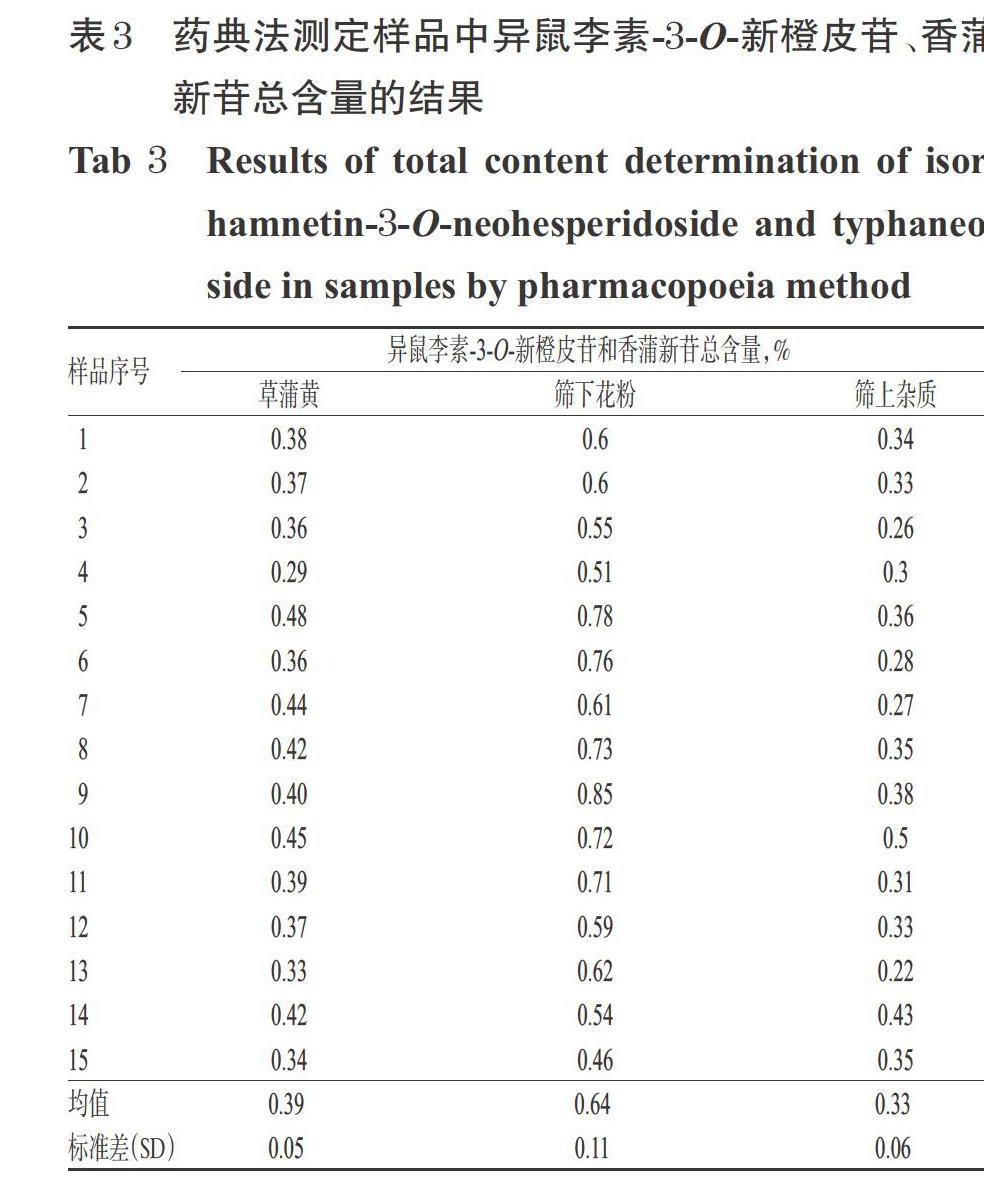
2.4.13 《中国药典》方法测定 分别取表1中各批样品及其筛下蒲黄花粉和筛上杂质适量,采用《中国药典》中记载的蒲黄含量测定方法[1]制成供试品溶液:取样品粉末0.5 g,精密称定,置于具塞锥形瓶中,精密加入甲醇50 mL,称定质量,冷浸12 h后加热回流1 h,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。按“含量测定”中色谱条件进样测定,记录峰面积,采用外标法计算异鼠李素-3-O-新橙皮苷和香蒲新苷的总含量,结果详见表3。
表3结果显示,仅蒲黄花粉中异鼠李素3-O-新橙皮苷和香蒲新苷的总含量达到《中国药典》规定限度(≥0.50%)。比较表2和表3结果发现,采用本文提取方法的测定结果与《中国药典》方法结果基本一致,均是蒲黄花粉中异鼠李素-3-O-新橙皮苷和香蒲新苷的总含量最高,但不同产地的样品中总含量有一定差异。
3 讨论
笔者通过实地考察及农户走访后发现,天然蒲黄花粉的含量受气候因素影响较大,蒲黄的花期仅1周时间,开花后,随成熟时间延长,花粉成熟度增加,极易从花药的花粉囊中破囊而出,在风吹草叶互碰时有花粉散失。已有研究显示,花粉量对草蒲黄质量影响显著[9]。因此,为防止花粉损失,宜选择蒲黄花开1~4 d内进行采收,此时花粉大部分存在于花药囊中,花粉散失少,相应的质量更好。
蒲黄中的黄酮类化学成分主要分为黄酮醇、黄酮、二氢黄酮和黄烷类,以香蒲新苷、异鼠李素-3-O-新橙皮苷为主,二者既是蒲黄的主要活性物质,也是其质量控制指标性成分[10]。从本研究杂质检查结果可见,草蒲黄中蒲黄花粉的质量百分比最低仅约为6%,杂质占比可高达90%以上。虽然薄层色谱图显示,草蒲黄杂质与蒲黄花粉的成分基本一致,但异鼠李素-3-O-新橙皮苷、香蒲新苷的含量测定结果均显示,草蒲黄杂质中二者的总含量达不到《中国药典》规定的含量限度。
虽然《中国药典》中对蒲黄供试品溶液的制备有具体的方法,即采用加热回流的方法进行提取,但是该方法操作时间长,加之本研究样本量大,所以不便于采用《中国药典》方法进行操作。为了节约时间,本研究采用超声进行提取。通过比较本研究方法与《中国药典》方法测定异鼠李素-3-O-新橙皮苷和香蒲新苷总含量结果显示,本研究方法结果与《中国药典》方法结果基本一致。
4 结语
本研究将草蒲黄按蒲黄花粉和花丝、花药分离后进行成分分析,结果发现,蒲黄花粉中香蒲新苷、异鼠李素-3-O-新橙皮苷含量最高;草蒲黄因其含有大量的花丝、花药,使其中香蒲新苷、异鼠李素-3-O-新橙皮苷总含量达不到《中国药典》规定的含量限度。笔者建议草蒲黄应作为获取蒲黄花粉的原料,而不宜直接药用。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中國医药科技出版社,2015:353-354.
[ 2 ] 李维维,余红芳,佟立今,等.蒲黄与草蒲黄的质量分析[J].沈阳药科大学学报,2007,24(12):768-772.
[ 3 ] 林春燕,董媛,张赟华,等.蒲黄药材及其饮片的质量分析[J].中国药事,2017,31(7):789-794.
[ 4 ] 严华,李韦,程显隆,等.影响蒲黄质量的主要问题及其质量标准的研究探讨[J].中国药事,2018,32(4):463-468.
[ 5 ] 张航,Chayanis Sutcharitchan,吴婉莹,等.商品中药材蒲黄的真伪优劣鉴别研究[J].上海中医药大学学报,2019,33(3):81-87.
[ 6 ] 刘一兵,王晶晶. 蒲黄饮片质量研究调查[J].山西中医,2018,34(1):55-56.
[ 7 ] 马海春.山东省市售蒲黄饮片质量分析[J].山东中医药大学学报,2017,41(4):377-379.
[ 8 ] 朱伟堃,马海春,沙启营,等.40批次蒲黄的质量分析[J].海峡药学,2017,29(11):74-76.
[ 9 ] 吕紫璇,杜云,唐瑜,等.不同成熟度蒲黄中异鼠李素- 3-O-新橙皮苷、香蒲新苷的含量研究[J].临床医药文献杂志,2018,5(11):172-174.
[10] 陈瑾,郝二伟,冯旭,等.蒲黄化学成分、药理作用及质量标志物(Q-marker)的预测分析[J].中草药,2019,50(19):4729-4740.
(收稿日期:2019-09-10 修回日期:2020-01-07)
(编辑:邹丽娟)
Typhaneoside; Quality standard
