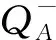重金属Mn对苦楝叶片光系统性能的影响
2020-04-20王仁杰梁惠子黄鑫浩王旭旭楚晶晶
王仁杰,朱 凡,,*,梁惠子,黄鑫浩,王旭旭,楚晶晶
1 中南林业科技大学生命科学与技术学院, 长沙 410004 2 南方林业生态应用技术国家工程实验室, 长沙 410004
Mn是植物生长所必需的微量元素,参与植物光合电子传递链的氧化还原过程和光系统Ⅱ(PSⅡ)中水的光解,并且对维持叶绿体的正常结构具有重要作用[1],但是过量的Mn对植物具有毒害作用,抑制植物生长[2]。特别是Mn胁迫对光合系统有显著影响。重金属Mn胁迫会引起叶绿体结构改变,使叶绿素含量降低,从而捕获和传递到光系统反应中心的光能减少,抑制光系统的原初反应,导致光合电子传递链受阻,净光合速率降低[3- 5]。在高Mn胁迫下,大量积累的活性氧不能及时清除,会导致光合系统PSⅡ反应中心D1蛋白的降解[6],蛋白组和转录组学研究证明,Mn胁迫下,与CO2同化和光合作用相关的叶绿体核蛋白表达下调[7]。湖南Mn矿区土壤可溶性Mn含量过高对当地土壤已造成严重污染。湖南湘潭Mn矿矿渣废弃地土壤可溶性Mn含量最高达湖南省背景值的66倍[8];湘南5个Mn矿恢复区污染严重,尾砂坝下游旱地也受到不同程度污染[9]。重金属严重污染下,原有的森林群落被破坏,随后在植被自然演替恢复过程中,形成以多年生草本植物为主的植被群落[10- 11]。因此,研究Mn对木本植物的胁迫机制对Mn污染区的森林群落重建和适应苗木的筛选具有重要意义。
光合作用是植物生长发育的基础,光系统I (PSI)和光系统Ⅱ (PSⅡ)是光合氧化还原的重要位点。快速叶绿素荧光诱导动力学和820 nm光吸收曲线技术能够快速、灵敏、无损伤地反映两个光系统对光能的吸收、传递及耗散等生理状况[12- 14]。近年来,上述技术被较好地应用在逆境条件下植物光合机构变化的相关研究中。如利用快速叶绿素荧光技术研究发现Fe2+对玉米(Zeamays)和大豆(Glycinemax)PSⅡ的电子供体侧和受体侧产生抑制作用[15];Cd对铜绿微囊藻(Microcystisaeruginosa)的毒性效应主要表现为抑制PSⅡ的反应中心和电子传递,对 PSⅡ供体侧的电子供体和受体侧的电子受体都产生了毒害,进而抑制了光合作用[16];Al对柑橘类两种植物叶片的PSⅡ的性能有影响[17];Li 等[5]发现过量Mn会抑制雪柚叶片从PSⅡ供体侧到PSI受体侧的整个电子传递,并伴随着PSⅡ反应中心通量发生变化。此外,利用该技术发现木本植物西府海棠(Malusmicromalus)的叶扩展过程中PSⅡ和PSI光合活性增加,且PSⅡ活性增加快于PSI[18],低温胁迫首先导致杏树(Armeniacavulgaris)和黄瓜(Cucumissativus) PSI发生光抑制[19- 20],盐胁迫导致金银花(Lonicerajaponica)PSI氧化受阻,受抑制程度大于PSⅡ[21]。但是重金属胁迫下植物叶片PSⅡ和PSI的活性变化的研究还很少。
苦楝(Meliaazedarach)是湖南常见的抗逆性强的乡土木本植物[22]。目前,国内外对苦楝的研究主要包括驱虫[23]、抗病毒[24- 25]、抗盐[26]、抗旱[27]、抗寒[28]等。因此,本文选择苦楝作为研究对象,通过快速叶绿素荧光诱导动力学、820 nm光吸收曲线和光合气体交换参数技术,分析Mn胁迫下,苦楝光系统(PSⅡ和PSI)的性能、Mn在光合传递链的作用位点以及苦楝的光合能力,为深入研究苦楝光合机构对重金属Mn胁迫的生理适应性,也为Mn污染地区的生态治理提供理论支撑。
1 材料与方法
1.1 试验材料
本试验采用室内单株盆栽方法,于2016年8月至9月在湖南长沙中南林业科技大学温室进行。供试土壤采自于中南林业科技大学校园内10—20 cm土,无重金属污染历史,土壤pH为5.05,土壤全C、全N及Mn的含量分别为12.18 g/kg、0.36 g/kg和463.53 mg/kg。土壤过5 mm×5 mm的筛,去除石头等杂物后装入塑料花盆(内径25.4 cm,高17.8 cm),每盆装风干土7 kg。选取苗高、地径和生长状态基本一致的1年生苦楝苗(容器苗)栽植在盆中,每盆栽种1株树苗,在温室培养3个月,定期浇水松土,以保证供试苗木的生长稳定性。
1.2 试验设计
根据重金属污染场地土壤修复标准和湖南Mn矿污染现状[8- 9],设置Mn的2个污染浓度水平,即10 g和30 g的MnCl2(分析纯)溶于纯水中配成L1和L2污染水平。具体步骤是将MnCl2分多次溶于纯水中掺入到盆栽土中,每次掺入时以植株为中心围绕土壤四周均匀掺入,避免溶液直接接触到植物任何部位,确保溶液不渗出。经分析测定,土壤L1、L2水平下Mn含量分别为1220.58 mg/kg、3743.27 mg/kg,根据土壤重金属污染等级划分标准[8],分别为中度污染和重度污染。同时设置对照 (CK),即掺入等量的纯水。
Mn污染处理结束后第7天开始第1次的测定,此后每隔7天测定1次,共测定5次;每种处理下3个重复,每个重复选取5片完全展开叶进行相关测定。试验期间,温室光照为自然光,最大光照强度处在900—1100 μmol m-3s-1范围内,温度保持在25—27℃,所有供试苗木用纯水浇灌,并适当松土,避免土壤板结。
1.3 测定方法
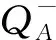
光合气体交换参数和RuBP羧化效率的测定:采用Li-6400便携式光合测定系统(Li-Cor Inc.,USA),测定时光强设定为1000 μmol m-3s-1,CO2浓度为360、300、250、200、150、100、50 μmol/mol,叶室空气温度控制在25℃,叶室空气湿度控制在45%—65%,大气CO2浓度为((360±10) μmol/mol),测定其最大净光合速率(Pn)、胞间CO2浓度(Ci)、并计算气孔限制值(Ls)和RuBP羧化效率[31]。
1.4 数据统计分析
试验数据采用Microsoft Excel 2003进行计算,SPSS 20.0进行ANOVA单因素方差分析和Duncan多重比较检验,并采用SigmaPlot 12.0进行作图。
2 结果
2.1 Mn对苦楝PSⅡ性能的影响
2.1.1Mn对苦楝PSⅡ反应中心的影响

图1 不同浓度Mn对苦楝叶片PIABS的影响 Fig.1 Effects of different Mn concentrations on PIABS in M. azedarach leaves CK:对照组the control; L1: 土壤中Mn浓度为1220.58 mg/kg,the soil contained 1220.58 mg/kg of Mn per pot; L2:土壤中Mn浓度为3743.27 mg/kg,the soil contained 3743.27 mg/kg of Mn per pot;不同小写字母表示同一天不同处理间差异达5%显著水平
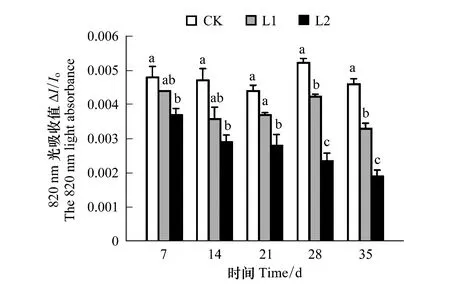
以吸收光能为基础的性能指数(PIABS)主要用于衡量PSⅡ整体性能。由图1可知,相对于对照来说,两组Mn污染水平下,苦楝叶片的PIABS随着时间的推移都呈现出下降趋势,即L2 2.1.2Mn对PSⅡ供体侧/受体侧的影响 K点的可变荧光Fk占振幅F0—Fj的比例(Wk)和J点的可变荧光Fj占振幅F0—Fp的比例(Vj),分别表示PSⅡ供体侧放氧复合体和受体侧QA之后电子传递链的受损程度,其值越大表明受损伤越严重。由图2可知,相对于对照来说,两组Mn污染水平下,苦楝叶片的Wk和Vj随着时间的推移都呈现出上升趋势,在L1污染水平下,Wk和Vj在前28天与对照相比均无明显变化,仅第35天显著上升(P<0.05);在L2污染水平下,Wk从第7天起与对照相比出现显著上升(P<0.05),Vj从第21天起与对照相比出现显著上升(P<0.05),总体来说,L2污染下的Wk和Vj上升幅度明显大于L1污染水平(P<0.05);与CK处理相比,L1、L2污染水平下,Wk增幅均在第35天最大,增幅分别为17.51%和71.36%,Vj增幅同样在第35天最大,分别为7.72%,24.67%。表明两种Mn污染水平导致苦楝PSⅡ供体侧和受体侧均受损,且L1污染水平下,受损较小。 图2 不同浓度Mn对苦楝叶绿素可变荧光Wk与Vj的影响Fig.2 Effects of different Mn concentrations on ratio of a variable fluorescence Wk and Vj in M. azedarach leaves 图3 不同浓度Mn对苦楝叶片Ψ(Ro)、Ψ(Eo)、δ(Ro)的影响Fig.3 Effects of different Mn concentrations on Ψ(Ro),Ψ(Eo),δ(Ro) in M. azedarach leaves 820 nm光吸收的相对振幅(ΔI/I0)作为衡量PSI的最大氧化还原活性,是对PS I性能的综合评价[32]。由图4可知,相对于对照来说,两组Mn污染水平下,苦楝叶片的ΔI/I0随着时间的推移呈现出下降的趋势。在L1污染水平下,ΔI/I0在前21天与对照相比无明显变化,从第28天显著下降(P<0.05);在L2污染水平下,ΔI/I0在第7天与对照相比显著下降(P<0.05),从28天起,L2污染下的ΔI/I0显著低于L1污染水平(P<0.05),表明两种Mn处理都造成苦楝ΔI/I0下降,且污染浓度越高,性能下降越早、下降程度越大。 Ψ(Eo)和ΔI/I0之间的协同关系可以表明两个光系统之间的协调性Φ(PSI/PSⅡ)[33]。由图5可知,与对照相比,在L1和L2污染水平下,苦楝叶片的Φ(PSI/PSⅡ)在各个时间点均小于对照(CK)。在L1污染水平下,Φ(PSI/PSⅡ)从一开始下降,仅第14天呈现显著差异性(P<0.05),但随后Φ(PSI/PSⅡ)在逐渐上升,与对照相比无显著差异性;在L2污染水平下,Φ(PSI/PSⅡ)除第21天外,与对照相比均显著下降(P<0.05),且下降幅度大于L1污染水平,差异性显著(P<0.05),表明L1污染水平下,两个光系统之间的协调性受到抑制后又逐渐恢复,L2污染水平下,两个光系统之间的协调性一直处在抑制状态。 由图6可知,两组Mn污染水平下,净光合作用(Pn)、气孔限制值(Ls)和RuBP羧化效率都随着时间的推移呈现出下降的趋势,胞间CO2浓度(Ci)随着时间的推移呈现上升的趋势。相对于对照来说,在L1和L2污染水平下,净光合作用(Pn)从第7天均显著下降(P<0.05),L1和L2污染水平之间从第21天呈显著性变化(P<0.05);胞间CO2浓度(Ci)从第7天均显著上升(P<0.05),仅在第21天时CK和L1之间差异性不明显。相对于对照来说,在L1污染水平下,气孔限制值(Ls)从28天显著下降(P<0.05),在L2污染水平下,气孔限制值(Ls)从第7天显著下降(P<0.05);在L2污染水平下,RuBP羧化效率从第7天显著下降(P<0.05),在L1污染水平下,RuBP羧化效率从第14天显著下降(P<0.05),且CK、L1、L2之间也从第14天开始呈现显著性变化(P<0.05)。 图4 不同浓度Mn对苦楝玉米叶片ΔI/I0的影响 Fig.4 Effects of different Mn concentrations on ΔI/I0 in M. azedarach leaves 图5 不同浓度Mn对苦楝叶片Φ(PSI/PSⅡ)的影响 Fig.5 Effects of different Mn concentrations on Φ(PSI/PSⅡ) in M. azedarach leaves 图6 不同浓度Mn对苦楝叶片气体交换参数和RuBP羧化酶效率的影响Fig.6 Effects of different Mn concentrations on gas exchange parameters and RuBP carboxylase efficiency in M. azedarach leaves 快速叶绿素荧光OJIP曲线中K点的上升作为PSⅡ供体侧(OEC)伤害程度的指标已被广泛接受,并用Wk反映K点的变化[34- 36]。K相的产生是由于放氧复合体从Mn-复合体上解离,导致PSⅡ供体侧流向反应中心的电子与从反应中心流向PSⅡ受体侧的电子不平衡,次级电子供体酪氨酸残基Z(Yz)的氧化态(Z+)不断积累。因此,Wk反应了Z+积累量的变化,Wk的上升表示PSⅡ供体侧受伤[37],近期研究还表明,Vj上升仅反映PSⅡ受体侧受伤,Wk的上升不仅反映PSⅡ供体侧受伤,同时也反映PSⅡ供体侧受伤程度大于PSⅡ受体侧的受伤程度[38]。在本试验中,Mn胁迫造成PIABS明显下降,Wk、Vj上升,说明Mn胁迫下苦楝叶片PSⅡ的整体性能下降[39],苦楝PSⅡ供体侧和受体侧同时受到伤害,特别是Wk最大上升幅度大于Vj,表明供体侧受伤导致从PSⅡ供体侧流向反应中心的电子减少幅度小于PSⅡ受体侧受伤导致反应中心流向受体侧的电子减少幅度,次级电子供体酪氨酸残基Z(Yz)的氧化态(Z+)仍然不断积累,最终导致PSⅡ供体侧受伤程度大于受体侧。 研究表明,PSⅡ和PSI性能降低或PSⅡ和PSI之间电子传递协调性下降,最终都会导致植物光合能力下降,净光合作用降低,不利于植物生长[45],当PSⅡ和PSI性能下降,协调性也降低,就说明光系统遭到严重破坏,光合作用仍会持续降低,最终导致植物死亡[46]。在本试验结果还发现,不同Mn污染水平下,苦楝净光合作用(Pn)明显下降,RuBP羧化效率显著下降,而胞间CO2浓度上升,根据Farquhar等[31]测定气孔限制值(Ls)的方法,当净光合作用(Pn)下降,植物叶片胞间CO2(Ci)减小,Ls增大时,光合作用下降的主要原因是气孔限制造成的,而植物叶片胞间CO2(Ci)增大,Ls减小时,光合作用下降的主要原因则是非气孔限制造成的。本试验研究结果表明,Mn污染胁迫下,苦楝光合作用下降的主要原因是非气孔限制造成的,说明Mn污染造成苦楝叶片PSⅡ和PSI受损,光合能力下降。但是该试验并不能很好阐述受损的机理,只有结合光系统反应中心的蛋白及其基因编码的表达才能充分说明光系统受损现象。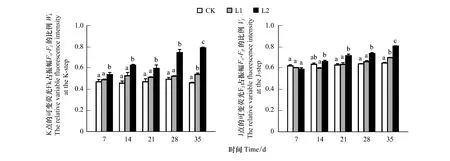
2.2 Mn对苦楝光合电子传递链的影响
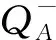

2.3 Mn对苦楝光系统I性能的影响
2.4 Mn对苦楝光系统I与光系统Ⅱ协调性的影响
2.5 Mn对苦楝叶片光合气体交换参数及RuBP羧化酶活性的影响


3 讨论
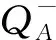
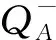
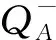
4 结论