安罗替尼联合放疗治疗复发难治小细胞肺癌1例报告及文献复习
2020-04-20马云飞刘百龙
刘 慧,马云飞,刘百龙,刘 敏
(吉林大学第一医院放疗科,吉林 长春 130021)
肺癌已经成为世界范围内死亡率最高的恶性肿瘤[1-2],其中小细胞肺癌(small cell lung cancer,SCLC)占14%[3]。SCLC倍增速度快,早期即可出现远处转移。绝大多数SCLC初诊时有血行转移,仅1/3患者就诊时为局限期。SCLC虽然对放化疗高度敏感,但易复发转移[4]。广泛期SCLC患者5年生存率<10%。对于多线化疗失败或无法耐受化疗的患者,亟待寻求新的治疗策略。安罗替尼作为国产自主研发的高选择性多靶点酪氨酸激酶抑制剂,主要通过抑制血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)、纤维母细胞生长因子受体(fibroblast growth factor receptor,FGFR)和原癌基因c-Kit发挥抗肿瘤作用。安罗替尼联合放疗应用于SCLC治疗少有报道。本文作者报道1例3线化疗后进展迅速且耐受性差的广泛期SCLC,肿瘤快速进展导致患者严重呼吸困难,无法平卧实施放疗,应用安罗替尼联合胸部放疗达到了理想的肿瘤控制效果,患者生活质量提高。本文作者结合相关文献复习,探讨安罗替尼应用于SCLC的临床疗效,为不能耐受化疗或化疗失败晚期SCLC患者的治疗提供新思路。
1 临床资料
1.1 一般资料患者,女性,70岁,既往高血压病史20年,最高血压达190/110 mmHg,口服缬沙坦降压治疗,血压控制在140/90 mmHg。2型糖尿病4年,应用诺和灵30R,早18 U,晚12 U,空腹血糖控制在6.0 mmol·L-1,餐后血糖控制在10.0 mmol·L-1。2018年1月因“咳嗽、气短1个月”行肺部CT检查示:左肺门占位性病变及左肺上叶舌段、下叶阻塞性炎症。后就诊于某医院,行穿刺取病理提示左肺小细胞癌,免疫组织化学:CD56(+), P63(-),Syn(+), TTF-1(+), Ki-67(+90%)。
1.2 放射性粒子植入2018年1月13日患者于当地医院行放射性粒子植入治疗(125I)(左肺门肿瘤处,55粒)。
1.3 化 疗2018年1月16日患者就诊于吉林大学第一医院肿瘤中心,肺部CT检查示:左肺门区占位性病变,侵及左主支气管及左肺各叶支气管,继发阻塞性肺不张及炎症,其内极高密度影,左侧液气胸;左侧胸膜多发结节影,考虑转移。诊断为左肺小细胞癌(T2N1M1a)、胸膜转移。因左侧液气胸给予胸腔闭式引流,其后给予1个疗程EP方案化疗(2018年1月19日结束)。患者依从性差,未按时返院继续化疗。2018年8月因“进行性呼吸困难1周”再次就诊于本院肿瘤中心,行肺部CT检查提示左侧胸腔积液量增加,给予胸腔穿刺引流,胸水脱落细胞检测发现高度可疑未分化小细胞癌细胞。2018年8月19日给予EP化疗1个疗程,患者呼吸困难明显减轻。因患者化疗耐受性和依从性差,后化疗方案更换为单药伊立替康1个疗程(2018年10月19日结束)。间歇期反复粒细胞及血小板降低,不能按时完成化疗,并出现疾病进展,咳嗽及呼吸困难加重,遂更换化疗方案为单药白蛋白紫杉醇,并完成5个疗程用药,5个疗程后呼吸困难消失。末次化疗结束时间为2019年3月6日。
1.4 胸部放疗联合安罗替尼2019年3月21日患者转入放疗科第2天即出现喘息,经抗炎解痉等对症支持治疗未见明显缓解,全身PET-CT检查示:左肺门见多发高密度粒子植入影,其边缘放射性摄取略增高,标准摄取值(standardized uptake value,SUV)最大值2.9。左肺上叶支气管开口见放射性摄取增高结节,范围为2.9 cm×2.1 cm,SUV最大值为6.6,远端部分肺组织体积缩小、密度增高,放射性摄取不高。双肺门及纵膈(2R、3、4R、4L、5、7、8和9L组)见放射性摄取增高淋巴结,较大者为4.3 cm×2.5 cm,SUV最大值为6.7,部分病灶与相邻血管分界欠清(图1,见插页六)。双侧胸腔内见液体密度影。心包腔内见液体密度影。诊断意见为肺癌化疗及粒子植入术后:①左肺门符合粒子植入术后改变,边缘代谢略增高,考虑肿瘤活性残留;左肺上叶支气管开口高代谢结节,为中心型肺癌,远端阻塞性部分肺不张;②双侧肺门及纵膈多发淋巴结转移癌,部分病灶与相邻血管分界欠清;③双侧胸腔积液,心包积液。计划尽快给予胸部放疗,靶区包括大体肿瘤体积(gross tumor volume,GTV):左肺病灶、双侧肺门和纵膈内肿大淋巴结。考虑摆位误差及呼吸运动,GTV适当外扩形成计划大体肿瘤体积(planning gross tumor volume,PGTV),拟给予60 Gy/2 Gy/30 f放疗。患者喘憋严重,放疗期间随时存在窒息风险,充分告知患者家属,征得家属知情同意后在TrueBeam下放疗(因病情凶险,定位时已确定治疗等中心,暂不予以复位,直接放疗以求尽快缓解症状)。携带氧气瓶吸氧,治疗前予以5 mg地塞米松静脉注射。放疗4 Gy/2 f后患者呼吸困难无好转,加用安罗替尼12 mg,每日1次口服。靶区剂量6 Gy/3 f、口服安罗替尼3 d后患者喘息明显好转,可平卧。患者诉头晕,血压168/80 mmHg,考虑与安罗替尼有关,且患者呼吸困难明显缓解,可平卧保证放疗安全实施,故停用安罗替尼,继续放疗,放疗前无需再静脉注射地塞米松。放疗12 Gy/6 f,重新定位,重新制定放疗计划。放疗38 Gy/19 f时呼吸困难消失,复查肺CT示左肺原发灶及转移淋巴结明显缩小(图2)。考虑患者转入时突发呼吸困难,病情紧急,当时立即给予放疗,无法行体膜固定,脊髓受量可能偏高,目前放疗效果较好,结合年纪较大,体质较弱,基础疾病较多,故在放疗剂量50 Gy/25 f时终止放疗。治疗中除2度放射性食管炎外,无明显不良反应。放疗后40 d复查肺部CT提示病灶进一步缩小(图3)。
1.5 随 访放疗后1个月余于本院肿瘤中心继续全身治疗。
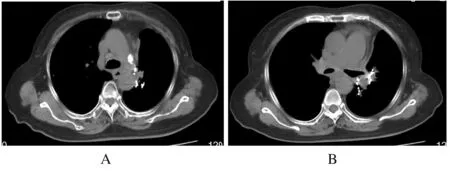
A:Aortic pulmonic window;B:Hilar level.
图2 复发难治SCLC患者应用安罗替尼3 d和外照射38 Gy/19 f后肺部CT影像
Fig.2 Images of thoracic CT of patient with recurrent and refractory SCLC after treated with anlotinib for 3 d and thoracic radiotherapy of 38 Gy/19 f
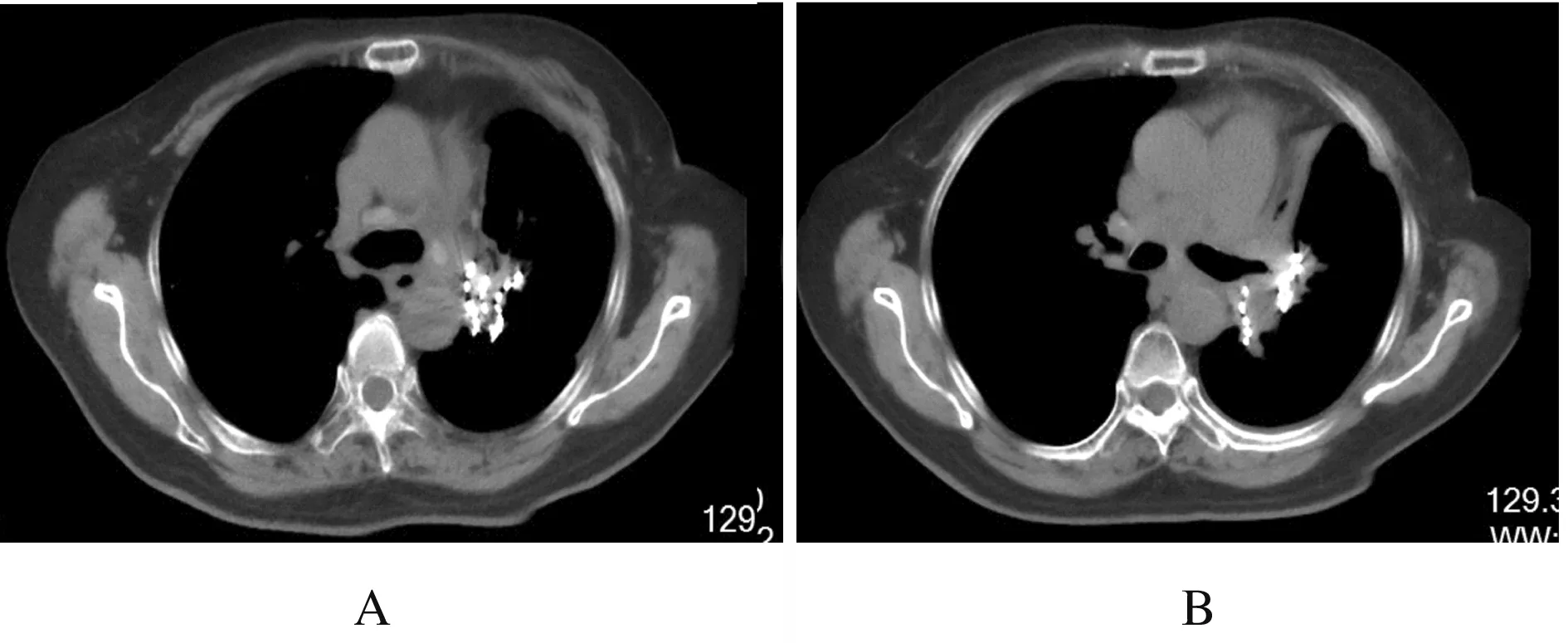
A: Aortic pulmonic window;B: Hilar level.
Fig.3 Images of thoracic CT of patient with recurrent and refractory SCLC at 40 d after radiotherapy
2 讨 论
SCLC是高度恶性肿瘤,易早期转移,约70%患者在确诊时肿瘤已是局部晚期或有扩散,早期行手术治疗的患者很少,局限期标准治疗模式是放化疗综合治疗,而广泛期常采用全身化疗,对化疗敏感者,如果远处转移病灶得以控制,可以给予胸部放疗。 JEREMIC等[5]将广泛期SCLC 经3周期EP方案化疗、远处转移病灶获得完全缓解后的患者分为2组:一组继续行EP方案化疗,另一组行加速超分割胸部放疗(54 Gy/36 f/18 d)联合依托泊苷及卡铂化疗,结果显示:加入胸部放疗提高了中位总生存期(17个月vs11个月)。本研究中患者因恶性胸腔积液分期为广泛期,在胸水控制和多线化疗耐受性差的情况下,给予积极的胸部放疗是一种适合的选择。该患者初治时即2018年1月13日于当地医院行放射性粒子植入治疗(碘125)(左肺门肿瘤处,55粒),现间隔14个月,行外照射安全。
有效治疗的前提是准确的诊断和分期。由于SCLC是高代谢的肿瘤,PET-CT检查较单纯的CT检查能提高SCLC分期的准确性[6-8]。行PET-CT检查后,19%的SCLC患者分期由原来的局限期上升为广泛期,仅8%的SCLC患者分期由原来的广泛期降期为局限期[9]。但PET-CT检查不能替代核磁平扫及增强对于颅内情况的评估。该患者放疗前行全身PET-CT检查,提示肺内原发灶及双侧肺门、多发纵膈淋巴结肿大,已造成双侧主气道的压迫,需要快速控制肿瘤缓解症状。
尽管目前放化综合治疗较以往治疗提高了SCLC患者的生存率,但SCLC的预后仍较差,尤其是对于广泛期或复发患者。近年来,靶向治疗的进展引领了Ⅳ期非小细胞肺癌治疗策略的重大变革。但SCLC的主要驱动基因并不明确,尚未取得突破性进展,治疗策略相对局限。晚期复发的SCLC治疗非常困难,3线治疗的客观反应率(objective response rate,ORR)不足30%,中位生存期仅为4.0~5.0个月,亟待寻求新的治疗策略。SCLC患者血管内皮生长因子(vascular endothelial growth factor,VEGF)水平高,VEGF与VEGFR通路介导了肿瘤的血管生成,且与疾病进展、治疗抵抗及预后不良密切相关[10-11]。盐酸安罗替尼是一种多靶点酪氨酸激酶抑制剂,可抑制VEGFR1(IC50:26.9 nmol·L-1)、VEGFR2(IC50:0.2 nmol·L-1)、VEGFR3(IC50:0.7 nmol·L-1)、c-Kit(IC50:14.8 nmol·L-1)和PDGFR的激酶活性,抑制肿瘤血管生成。2018年5月盐酸安罗替尼在我国获批上市,基于ALTER0303的研究结果,其适应证已获批为2线及以上化疗后失败的局部晚期或转移性非小细胞肺癌[12]。在复发难治SCLC的治疗中,安罗替尼也展现了很好的疗效。ALTER1202是评价安罗替尼用于复发性SCLC 3线及以上治疗的随机、双盲和多中心Ⅱ期研究,其纳入了全国11个中心的120例患者,均为病理学确诊的、复发的SCLC 患者,既往至少接受过2种系统性化疗方案治疗的3线及以上患者,美国东部肿瘤协作组 (Eastern Cooperative Oncology Group,ECOG)体力状况(performance status,PS)评分0~2。治疗组给予安罗替尼12 mg,每日1次口服,连续口服2周停1周为1周期,直至疾病进展或出现不可耐受的不良反应,结果显示:与安慰剂比较,安罗替尼延长了患者无进展生存期(progression-free survival,PFS)(4.1个月vs0.7个月,P<0.01)。进一步分层分析,无论患者年龄、ECOG评分、疾病分期(局限期或广泛期)、1线治疗后复发类型、既往化疗疗效、脑转移存在与否、安罗替尼是3线还是3线以上治疗,安罗替尼组疗效均明显优于安慰剂组,且疾病控制率(disease control rate,DCR)明显提高。安全性可耐受,实验组中有96.3%的患者安罗替尼未减量[13]。因此,安罗替尼给复发难治的SCLC 患者带来了新的希望。而抗血管生成药物联合放疗能发挥1+1>2的作用。抗血管生成药物能够提高肿瘤细胞的放疗敏感性,其机制主要包括以下2个方面:①抗血管生成药物可以使肿瘤内异常、无功能的血管“正常化”,使得肿瘤内氧饱和度增加[14-18],提高放疗敏感性;②VEGF促进内皮细胞增殖和生存,抗血管生成治疗可以促进内皮细胞死亡[19]。放疗后残存的内皮细胞是肿瘤复发的根源之一,因此促进内皮细胞死亡,可进一步减少放疗后的局部复发,提高放疗局控率[20]。安罗替尼作为高效的抗血管生成药物,与放疗联合可发挥更好的疗效。本例患者由于肿瘤进展迅速,压迫主气道造成患者呼吸困难,无法平卧,放疗无法安全进行,安罗替尼发挥了很好的作用,肿瘤有所退缩,症状减轻,患者可以平卧保证放疗安全实施,给放疗赢得了时机,从而达到了最佳的肿瘤控制。
关于药物安全性方面,安罗替尼作为一种小分子靶向药物,口服生物利用度高,半衰期长,血药浓度稳定,21 d方案出现的毒性患者可耐受。在ALTER0303研究中最常见的不良反应包括高血压、乏力、厌食、甘油三酯和胆固醇升高以及手足综合征。安罗替尼组3级及以上的不良反应中最常见的有高血压(13.6%)、低钠血症(8.2%)和γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)升高(5.4%),有3例患者因为出现不能耐受的高血压而减量至10 mg·d-1或8 mg·d-1[5]。本例患者有高血压和糖尿病多年,血管基础条件差,平时血压控制尚可,口服安罗替尼3 d后出现头晕,血压升高至168/80 mmHg,口服降压药已无法平稳降压,考虑到患者70岁,年龄较大,体质弱,经过多线化疗后机体抵抗力下降,自我调节能力差,且患者目前呼吸困难基本消失,可平卧,影像学检查见肺部病灶缩小、对气道的压迫解除,已为放疗的安全实施创造了最佳条件,故停用安罗替尼,继续放疗。尽管安罗替尼应用的时间短,但放疗过程中安罗替尼的加入改善了疗效,患者原发病灶得到控制,气道压迫症状得以快速缓解。
综上所述,对于多线化疗失败或无法耐受化疗的广泛期SCLC患者,安罗替尼联合放疗取得了较好的疗效,为晚期SCLC提供了新的治疗机会,在未来,期待更多的临床研究来探索安罗替尼与放疗联合的疗效及安全性,以期获得良好的肿瘤控制并转化为生存获益。
