龙胆生品及龙胆酒制品给药后龙胆苦苷在大鼠主要器官组织中的浓度分布
2020-04-20吴晓燕孙紫薇侯晓琳姜雨昕翁丽丽
吴晓燕,孙紫薇,侯晓琳,宿 莹,刘 战,孙 金,姜雨昕,翁丽丽
(长春中医药大学药学院中药鉴定教研室,吉林 长春 130117)
龙胆为龙胆科植物条叶龙胆(GentianamanshuricKitag.)、龙胆(GentianascabraBge.)、三花龙胆(GenianatrifloraPall.)或坚龙胆(GentianarigescerasFranch.)的干燥根及根茎[1]。龙胆为传统常用大宗药材,性味苦、寒;归肝、胆经;龙胆主要化学成分为环烯醚萜类化合物,如龙胆苦苷、獐牙菜苦苷、马钱苷酸和獐牙菜苷等[2-4],具有清火燥湿、泻肝胆火、清热健胃、改善脾胃消化功能、保护神经中枢系统、抗炎和抗氧化等作用,可用于肝胆类疾病及高血压等疾病的防治[5-7],疗效显著,也是常用中成药的原料药。目前对于中药龙胆的研究主要集中在其化学成分、临床应用和药理作用等方面,近年对龙胆中的化学成分及炮制后有机成分的含量变化有一些研究[8-10]报道,但对其炮制前后主要化学成分在动物主要器官组织中分布情况比较分析的研究少见报道。炮制是中药加工过程中常用的传统方法,适当的炮制方法具有改变或缓和药物性能,削弱或消除药物不良反应,增强药物疗效等作用[9]。龙胆的炮制品包括酒制、甘草汁制、胆汁制、蜜制和生姜汁制等,目前临床上广泛应用龙胆生品和龙胆酒制品[11-14]。龙胆酒制品在现代研究中多以增加有效成分提取率、提高生物利用度和制定相关质量控制标准为目的[15]。本实验采用液相色谱-质谱联用(high-performance liquid chromatography-mass spectrometry, HPLC-MS)法对龙胆生品及龙胆酒制品灌胃给药后其主要药效成分龙胆苦苷在大鼠主要器官组织中的分布进行测定,探讨其酒制前后龙胆苦苷在大鼠体内分布的规律。
1 材料与方法
1.1 实验动物、药物、主要试剂和仪器
Wistar大鼠,雄性,体质量180~220 g,购自吉林省长春市亿斯实验动物技术有限责任公司,动物合格证号:SCXK(吉)2016-0003。甲酸为色谱级,乙腈为色谱级,均购自西陇科学股份有限公司;龙胆苦苷对照品(规格:20 mg,纯度97.6%,批号:110770-201716,中国食品检定研究院)。三重四级杆液相色谱质谱联用仪LC-MC-8040[岛津企业管理(中国)有限公司],AUW120D分析天平(西安精大检测设备有限公司),FA1004B电子天平(上海佑科仪器仪表有限公司),JA2603B电子天平(上海天美天平仪器有限公司),TDL80-2B台式离心机(上海安亭科学仪器厂)。
1.2 HPLC-MS法测定大鼠器官组织中龙胆苦苷
1.2.1 色谱条件 液相色谱条件:采用Agilent ZORBAX Eclipse XDB-C18(4.6×250 mm,5-Micron)色谱柱,流动相:乙腈(A)-0.1%甲酸水(B);梯度洗脱(0~15.00 min,7%~40% A;15.00~15.01 min,40%~100% A;15.01~27.00 min,100% A;27.00~27.01 min,100%~7%A;27.01~30.00 min,7%A);体积流量:1 mL·min-1;柱温:35℃,进样量:10 μL。质谱条件:采用负离子多反应检测(MRM)模式下设定的离子对条件;电喷雾电离(ESI)Nebulizing Gas:3.0 L·min-1;Drying Gas Flow:15.0 L·min-1;DL Temperature:250℃;Heat Block Temp:400℃;CID Gas:230 kPa;MRM(-)龙胆苦苷m/z:401→59。
1.2.2 对照品溶液配制 取龙胆苦苷对照品适量,精密称定,加甲醇制成每1 mL含0.2 mg的对照品溶液。
1.2.3 水提液制备 样品加水煎煮2次,每次1 h,过滤,合并2次滤液,浓缩至含生药量0.1 g·mL-1的药液,4℃保存备用。
1.2.4 给药和组织样品制备 将雄性SD大鼠随机分为龙胆生品组和龙胆酒制品组,实验前12 h禁食不禁水,按0.63 g·kg-1体质量灌胃给药,给药后分别于15、30、60、120、240和360 min处死大鼠(每时间点10只大鼠,每组各5只),迅速取出心、肝、脾、肺、肾和脑,用生理盐水冲洗表面,吸干水分,称质量,加入2倍量冰生理盐水,用组织匀浆器匀浆,即得组织匀浆液,-80℃保存,备用。
1.2.5 组织样品处理 精密吸取大鼠组织匀浆液1.5 mL,置于10 mL离心管中,加入等体积甲醇,涡旋5 min,于2 000 r·min-1离心30 min,取出上清液备用,沉淀部分再次加入3 mL甲醇,涡旋5 min,于2 000 r·min-1离心30 min,合并2次滤液,于40℃水浴蒸干,残留物用甲醇溶解,定容至1 mL,0.22 μm滤膜滤过,HPLC-MS法测定,进样量10 μL,记录色谱图和龙胆苦苷峰面积。
1.3 HPLC-MS方法学考察
1.3.1 专属性 分别吸取空白组织和灌胃给药后15 min时的肝组织样品,在上述色谱和质谱条件下测定,考察方法的专属性。
1.3.2 标准曲线和线性范围 取空白组织匀浆1 mL,加入龙胆苦苷混合溶液,分别配制成浓度为50、150、2 500、5 000、10 000和20 000 μg·L-1的溶液,按“1.2.5”方法操作,进行分析测定,以峰面积为纵坐标,浓度为横坐标,绘制标准曲线,计算回归方程,以线性范围最低浓度定为定量限。
1.3.3 精密度 精密度实验中,精密吸取1 mL空白肝脏组织匀浆,配制低、中和高3个浓度样品(50、500和12 500 μg·L-1龙胆苦苷)的含药组织样品,按“1.2.5”操作,进行分析测定,每日内3组浓度各测6次,计算日内精密度;3组浓度各6份,连续测定3 d,计算日间精密度。
1.3.4 提取回收率 精密吸取1 mL空白肝脏组织匀浆,配制低、中和高3个浓度的3组质量控制样品(50、500和12 500 μg·L-1龙胆苦苷),每个浓度进行6样本分析,按“1.2.5”操作,计算每组平均回收率。
1.3.5 稳定性 吸取1 mL空白肝脏组织匀浆,精密加入龙胆苦苷对照品溶液,配制低、中和高3个浓度的3组质量控制样品(50、500和12 500 μg·L-1龙胆苦苷),每个浓度平行处理5份,室温下放置24 h、3次冻融循环和-80℃存放30 d后,按“1.2.5”操作,进行分析测定,考察室温、-80℃和反复冻融条件对组织样品的影响。
1.4 龙胆生品及酒制品中龙胆苦苷在大鼠主要器官组织中质量浓度检测
将灌胃后15、30、60、120、240和360 min分离的各种组织制成匀浆,按“1.2.5”方法处理,测定大鼠组织样品中质量浓度,以外标法计算不同时间点大鼠主要器官组织中龙胆苦苷的质量浓度。
1.5 统计学分析

2 结 果
2.1 HPLC-MS法的专属性
专属性考察结果显示:大鼠组织中内源性物质及其他成分均不干扰龙胆苦苷的测定。组织样品以肝组织为例。见图1~3。
2.2 标准曲线和线性范围
龙胆苦苷在50~20 000 μg·L-1范围内呈良好线性关系,相关系数(r)均大于0.99。见表1。

图1 龙胆苦苷色谱图

图2 灌胃给药15 min后肝组织样品色谱图
Fig.2 Chromatogram of liver tissue sample after intragastric administration for 15 min
图3 空白肝组织样品色谱图

表1 龙胆苦苷在大鼠主要器官组织中的线性范围和定量限
2.3 HPLC-MS法的精密度
测得日内精密度的RSD分别为2.7%、2.9%和3.2%,日间精密度的RSD分别为9.4%、10.7%和10.6%。结果表明:该方法精密度良好,符合生物样品分析精密度要求。
2.4 HPLC-MS法的提取回收率
各组平均回收率分别为87.2%、77.4%和80.1%,RSD分别为9.4%、10.7%和10.6%。结果表明:该方法提取回收率符合生物样本分析的质量控制要求。
2.5 HPLC-MS法的稳定性
3个浓度质量控制样品测得的平均RSD值分别为7.93%、8.61%和8.06%,均小于10.00%。结果表明:龙胆苦苷在室温、-80℃和反复冻融3个条件下较为稳定。
2.6 龙胆生品及酒制品给药后龙胆苦苷在大鼠主要器官组织中质量浓度分布
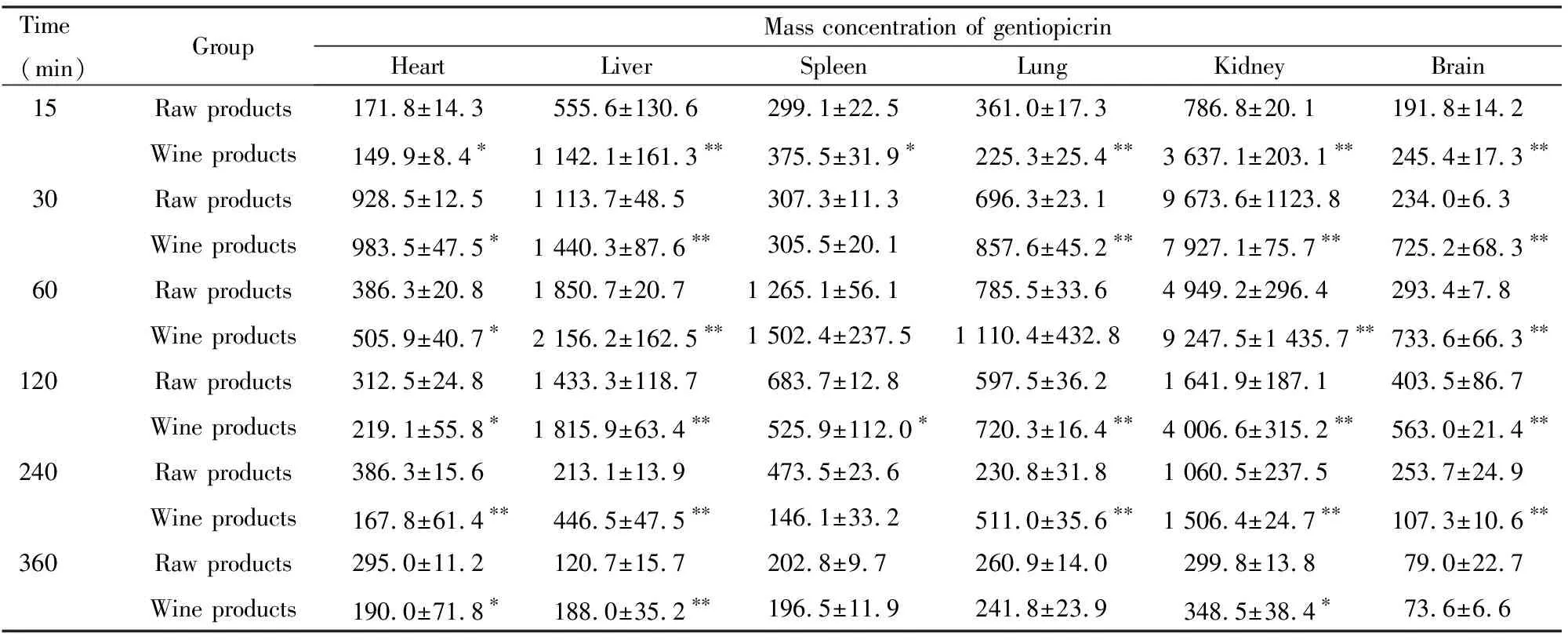
大鼠灌胃给予龙胆生品及龙胆酒制品后,待测成分龙胆苦苷在大鼠体内不同时间点(15、30、60、120、240和360 min) 各组织中的质量浓度见表2。根据表2中各时间点龙胆苦苷在各组织中质量浓度分布,计算其在不同器官组织中的药-时曲线下面积(AUC0→360min),结果见图4。结果表明:龙胆酒制前后其化学成分龙胆苦苷在大鼠心、肝、脾、肺、肾和脑组织中均有分布,在肝和肾组织中质量浓度均明显高于其他器官组织,且酒制后龙胆苦苷在大鼠肝、肺和肾组织中质量浓度明显升高(P<0.01)。
3 讨 论
将龙胆生品及龙胆酒制品对大鼠进行灌胃给药后,药物在大鼠体内迅速分布。给药30 min后,在体内即可检测到较高的药物浓度,在心、肝、脾、肺、肾和脑等组织中均检测出龙胆苦苷,说明龙胆苦苷可以透过血脑屏障[16]。龙胆苦苷在肝和肾组织中分布明显多于其他器官组织,这与《雷公炮制药性解》中龙胆归肝经和肾经的结论相一致。其中,龙胆苦苷含量在肾脏中达到最高,推测龙胆苦苷可能主要从肾脏排泄。《神农本草经》中曾记载:“龙胆若复以酒炮制之,则酒性走窜,无所不至,可助龙胆清除游走之肝火”。酒制能明显改变龙胆苦苷在大鼠主要器官组织中的浓度分布情况,酒制后,龙胆苦苷在大鼠主要器官组织的质量浓度分布整体呈增加趋势,在肝、肺和肾组织中的分布明显增加,在脑组织中有小幅度增加;在心和脾组织中龙胆苦苷的分布有较小幅度降低,但变化不大。这些结果表明酒制能够增加龙胆苦苷的溶出度[17-21],增加龙胆苦苷含量,促进龙胆苦苷的吸收利用,为临床合理用药提供了参考依据。
表2 龙胆生品及酒制品给药不同时间后龙胆苦苷在大鼠主要器官组织中的质量浓度

Time(min)GroupMass concentration of gentiopicrinHeartLiverSpleenLungKidneyBrain15Raw products 171.8±14.3555.6±130.6299.1±22.5361.0±17.3786.8±20.1191.8±14.2Wine products149.9±8.4∗1 142.1±161.3∗∗375.5±31.9∗225.3±25.4∗∗3 637.1±203.1∗∗245.4±17.3∗∗30 Raw products928.5±12.51 113.7±48.5307.3±11.3696.3±23.19 673.6±1123.8234.0±6.3Wine products983.5±47.5∗1 440.3±87.6∗∗305.5±20.1857.6±45.2∗∗7 927.1±75.7∗∗725.2±68.3∗∗60 Raw products386.3±20.81 850.7±20.71 265.1±56.1785.5±33.64 949.2±296.4293.4±7.8Wine products505.9±40.7∗2 156.2±162.5∗∗1 502.4±237.5 1 110.4±432.89 247.5±1 435.7∗∗733.6±66.3∗∗120Raw products312.5±24.81 433.3±118.7683.7±12.8597.5±36.21 641.9±187.1403.5±86.7Wine products219.1±55.8∗1 815.9±63.4∗∗525.9±112.0∗720.3±16.4∗∗4 006.6±315.2∗∗563.0±21.4∗∗240Raw products386.3±15.6213.1±13.9473.5±23.6230.8±31.81 060.5±237.5253.7±24.9Wine products167.8±61.4∗∗446.5±47.5∗∗146.1±33.2 511.0±35.6∗∗1 506.4±24.7∗∗107.3±10.6∗∗360Raw products295.0±11.2120.7±15.7202.8±9.7260.9±14.0299.8±13.879.0±22.7Wine products190.0±71.8∗188.0±35.2∗∗196.5±11.9241.8±23.9 348.5±38.4∗73.6±6.6
*P<0.05,**P<0.01vsgentian raw products group.

*P<0.05,**P<0.01 compared with gentian raw products group.
图4 龙胆生品及酒制品灌胃给药后龙胆苦苷在大鼠不同器官组织中平均AUC
Fig.4 Average AUC of gentiopicrin in different organs and tissues of rats after intragastric administration of gentian raw products and wine products
本实验建立了测定龙胆苦苷在大鼠组织中含量的HPLC-MS法,并比较了龙胆生品及酒制品中龙胆苦苷在大鼠主要器官组织中分布的差异。HPLC-MS法简便、快速、准确,本研究为临床应用龙胆酒制品泻肝胆火等疾病提供了科学依据,此外,更有助于进一步探讨龙胆药材的炮制方法与其功效的相关性,提高龙胆药材及其炮制品的有效利用率。
