青砖茶水提物对HepG2细胞脂肪变性的干预作用
2020-04-18婕闫梦真陈桂婷周婷婷李世刚
余 婕闫梦真陈桂婷周婷婷李世刚,2
(1.三峡大学 医学院,湖北 宜昌443002;2.湖北省长盛川青砖茶研究所,湖北 宜昌443000)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是指除酒精和其他明确的肝损伤因素引起,以肝细胞内脂肪聚积和脂肪变性为主要特征的临床病理综合症.NAFLD 已成为世界上最常见的慢性肝病,影响了我国约15%~20%的普通人群,在西方国家的患病率高达30%以上,且近年来有年轻化的趋势[1-2].它包括一系列肝脏表现,从非酒精性脂肪肝(也称为脂肪变性)到非酒精性脂肪性肝炎,肝纤维化和肝硬化,最终可能发展为肝细胞癌[3-4],严重威胁着人类的健康.但是,目前各种抗NAFLD 药物正处于临床前开发阶段,尚未有用于治疗NAFLD 的特效药物.因此,探索新颖高效且具有最小毒副作用的药物,对防治NAFLD 具有理论及临床应用价值.
茶叶是我国常见的的饮品.其中,黑茶作为中国六大茶类之一,通常归属于后发酵茶,主产于湖南、湖北、四川、广西等省地[5].黑茶含有较多有益的特有成分,能够改善人体健康,并且具有良好的降脂减肥作用[6].青砖茶是我国黑茶中的一种,其保健功效显著而深受人们喜爱,是西北高脂饮食地区少数民族的生活必需品[7].近年来研究表明,青砖茶具有明显的抗氧化和降脂作用[8-9],但大多是宏观水平的研究,其具体作用机理不明.NAFLD的重要特征是甘油三酯(Triglyceride,TG)的堆积,因此可通过建立体外脂肪变性模型来研究NAFLD.本研究旨在探讨青砖茶水提物(green brick tea water extract,GBT-WE)对Hep G2细胞脂肪变性的影响,以期对其机制有进一步的了解,为NAFLD 的治疗提供一定的实验依据.
1 材料与方法
1.1 材料与试剂
青砖茶(湖北省长盛川青砖茶研究所提供);Hep G2细胞(上海赛百慷生物技术股份有限公司);胎牛血清(fetal bovine serum,FBS)(浙江天杭生物科技有限公司);MEM培养基(上海源培生物科技股份有限公司);胰蛋白酶(吉诺生物医药技术有限公司);青链霉素混合液(HyClone公司,美国);辛伐他汀(>99%,细胞培养级)(大连美仑生物技术有限公司);CCK-8 活力检测试剂盒(Dojindo公司,日本);油红O 染液(南京建成科技有限公司);TG 酶法测定试剂盒、总胆固醇(Total cholesterol,TC)酶法测定试剂盒、BCA 蛋白浓度测定试剂盒(均北京普利莱基因技术有限公司);β-actin抗体(武汉谷歌生物科技有限公司);固醇调节元件结合蛋白1c(Sterolregulatory element binding proteins 1c,SREBP1c)抗体(Santa Cruz Biotechnology公司,美国);脂肪酸合成酶(Fatty acid synthase,FAS)抗体(Cell Signaling Technology公司,美国);HRP标记羊抗兔二抗和HRP标记羊抗鼠二抗(均武汉赛维尔科技有限公司);ECL显影液(碧云天生物技术有限公司).
1.2 实验方法
1.2.1 青砖茶水提物的制备
将青砖茶敲碎,按照1∶15的质量比,将青砖茶在100℃沸水中熬煮40 min,将煮好的茶汤通过液体浓缩分离罐浓缩至原浓度的16倍,最后将浓缩后的茶汤-80℃过夜,次日进行冷冻干燥,得到青砖茶水提物粉末,并将其置于4℃冰箱保存待用.
1.2.2 细胞的培养
用含10%FBS 的MEM培养基培养HepG2 细胞,置于CO2体积分数为5%、37℃培养箱中,3~5 d传代,取对数生长期细胞用于后续实验.
1.2.3 Hep G2细胞脂肪变性模型的建立
设置正常对照组和模型组,模型组分别利用含有30%、50%、70%的FBS培养液培养,采用CCK-8法、ELISA 法(测定TG、TC)以及油红O染色来确定造模剂量.
1.2.4 CCK-8法检测细胞的增殖
Hep G2细胞以每孔4 000 个细胞接种于96 孔板,待细胞过夜贴壁后加药.将GBT-WE设置4个质量浓度,分别为120μg/m L、240μg/m L、360μg/m L、480μg/m L,每个质量浓度设5个平行孔,2个空白对照孔,24 h后依照CCK-8试剂盒说明书每100μL 完全培养基加10μL CCK-8试剂,于CO2体积分数为5%、37℃培养箱中作用2h 后,用酶标仪测定A450 nm 值.以对照组为基础,计算实验组细胞增殖率.
1.2.5 GBT-WE干预Hep G2细胞脂肪变性
干预实验分为5组:1)空白对照组(Control);2)模型组(Model);3)GBT-WE 低剂 量 组;4)GBT-WE高剂量组;5)Simvastatin组.Simvastatin是一种降脂药,临床上常用来治疗NAFLD,主要用来观察GBTWE的降脂能力是否与常规药物效果一致[10].且质量浓度设置为5μg/m L[11].除正常对照组外,其余各组均利用高质量浓度FBS造模(浓度依据1.2.3所确定的剂量)48 h;除正常对照组和模型组外,其余各组造模成功后分别加入不同质量浓度的药物(依照1.2.4节CCK-8结果确定的对细胞无明显毒性的药物质量浓度)干预24 h(正常对照组和模型组则加入含有10%FBS的培养基).
1.2.6 油红O 染色
将HepG2细胞以密度为2×105个/m L 接种于6孔板中,待细胞过夜贴壁后,造模孵育,加药24 h时终止培养,弃上清培养液,无磷酸钙的PBS洗3遍.而后用4%的多聚甲醛固定40 min,加入油红O 染色1 h,水性封固剂封片,显微镜下观察拍照,用Image Pro Plus分析平均光密度值.
1.2.7 TG、TC含量的测定
弃去培养基加入PBS 洗涤细胞3 次,加入0.2 m L裂解液进行裂解,混匀后室温静置10 min,以2 000 g的转速离心5 min取适量上清,用TG、TC 测定试剂盒分别测定TG、TC含量.余下上清用于BCA法蛋白定量试剂盒进行蛋白定量,最后以每克蛋白浓度校正TG、TC含量,单位为mmol/gprot.
1.2.8 Western blot检测相关蛋白SREBP1c、FAS的表达
用预冷PBS洗涤细胞3次,最后一次彻底吸干残留液,加入细胞裂解液(使用前数分钟内加入蛋白酶抑制剂),迅速将细胞刮下收集细胞.冰浴30 min,期间用移液器反复吹打,确保细胞完全裂解,12 000 rpm,4℃,离心10 min,收集上清,即得到总蛋白溶液.采用BCA 法测定细胞裂解后的蛋白浓度.将蛋白溶液按照4∶1的比例加入蛋白上样缓冲液,100℃变性5 min.每组取50μg蛋白样品进行SDS-PAGE 电泳,转至PVDF 膜上,常温下用5%的脱脂奶粉摇床上封闭1 h,按照1∶1 000的稀释比例分别加入β-actin、SREBP1c、FAS一抗,4℃孵育过夜,TBST 洗膜3次.而后加入相应的二抗稀释液(1∶5000),室温孵育1 h,TBST 洗膜3次.ECL 发光显影,用β-actin作内对照标化来表示各组中SREBP1c和FAS的相对表达量.
1.3统计学方法
采用SPSS19.0软件进行统计分析,计量资料用均值±标准差±s)表示,两组间的比较采用t 检验,多组间的比较采用单因素方差分析,以α=0.05为检验水准.
2 结果
2.1 HepG2细胞脂肪变性模型的建立
为了研究不同浓度的FBS对细胞脂肪变性程度的影响,对不同组细胞进行油红O染色,结果观察到,对照组细胞内可见少许红色脂滴.随着血清浓度的上升,细胞内聚积的脂滴逐渐增多,与对照组相比,差异具有统计学意义(P<0.05).其中,30%FBS组红色脂滴数量增多,但脂滴大小较对照组无明显差异;而50%FBS 组则出现数量多,面积大的脂滴堆积,呈泡状性;70%FBS组脂滴数量也较多,但是存在部分细胞凋亡的现象.证明50%的FBS可致Hep G2细胞脂肪变性,如图1所示.
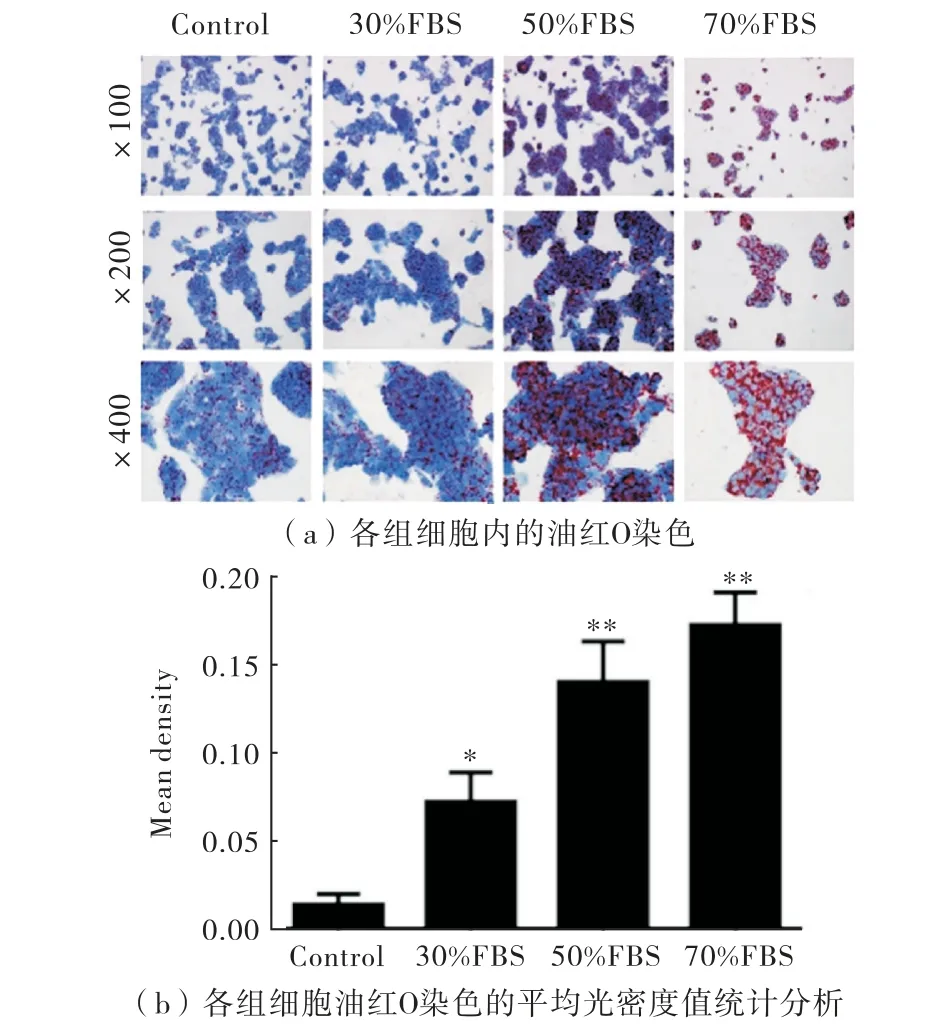
图1不同浓度的FBS处理细胞后的油红O 染色
同时,随着FBS浓度的逐渐增加,HepG2细胞中的TG 和TC 含量也在不断增加,当FBS 浓度达到50%以上时,与对照组相比表现出明显的差异性(P<0.05),且TG 的增长相对于TC 更为显著(P<0.01).另外,根据CCK-8实验,当胎牛血清浓度达到70%时,细胞增殖受到抑制,可能归因于高浓度的胎牛血清中游离脂肪酸含量过高对细胞造成了毒性作用,与油红O 染色观察到的现象一致.而50%的FBS就足以造成细胞脂肪变性,确定50%的FBS浓度为造模剂量.且根据前期实验发现,24 h不足以使脂质 积聚,确定造模时间为48 h,见表1.
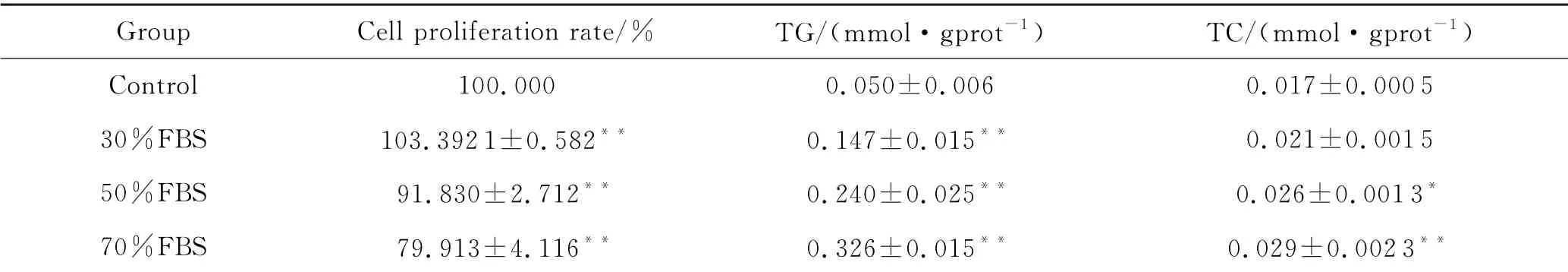
表1不同浓度的FBS对细胞增殖率和TG、TC的影响
2.2 GBT-WE对HepG2细胞增殖的影响
高浓度的GBT-WE 会抑制细胞生长,对细胞产生一定的毒性作用.因此需要通过CCK-8实验选取无毒性的药物浓度进行后续干预细胞脂肪变性模型的实验.药物作用24 h后可观察到,随着GBT-WE质量浓度的上升,细胞的存活率下降,当质量浓度超过240μg/m L时,GBT-WE对细胞的抑制作用明显.因此,为了实现各组之间的差异性,通过前期预实验确定后续用于干预实验的GBT-WE低剂量组为60μg/m L,GBT-WE高剂量组为240μg/m L.

图2 GBT-WE对HepG2细胞增殖能力的影响
2.3 GBT-WE改善HepG2细胞脂肪变性
2.3.1 GBT-WE干预Hep G2细胞脂肪变性后的油红O 染色
油红染色显示,与对照组相比,模型组细胞发生脂肪变性,细胞内聚集了大量的红色脂滴(P<0.01),并存在脂滴融合现象,说明脂肪变性模型建立成功;经GBT-WE 干预后,与模型组相比,GBT-WE与Simvastatin处理后细胞中的红色脂滴均有所降低(P<0.01),说明GBT-WE 可以有效地改善细胞内的脂质积累,如图3所示.
2.3.2 GBT-WE 抑制Hep G2细胞脂肪变性后TG和TC含量的增加
与正常对照组相比,模型组的TG、TC显著升高.而加入不同质量浓度的GBT-WE处理24 h之后,随着茶浓度的增加,Hep G2细胞内的TG、TC值相较于模型组都在逐渐下降,且剂量依赖性下降(P <0.01).特别地,240μg/m L 的GBT-WE 干预模型后细胞内TG、TC水平与阳性药物Simvastatin效果相似,相较于对照组无明显差异性(P>0.05),见表2.
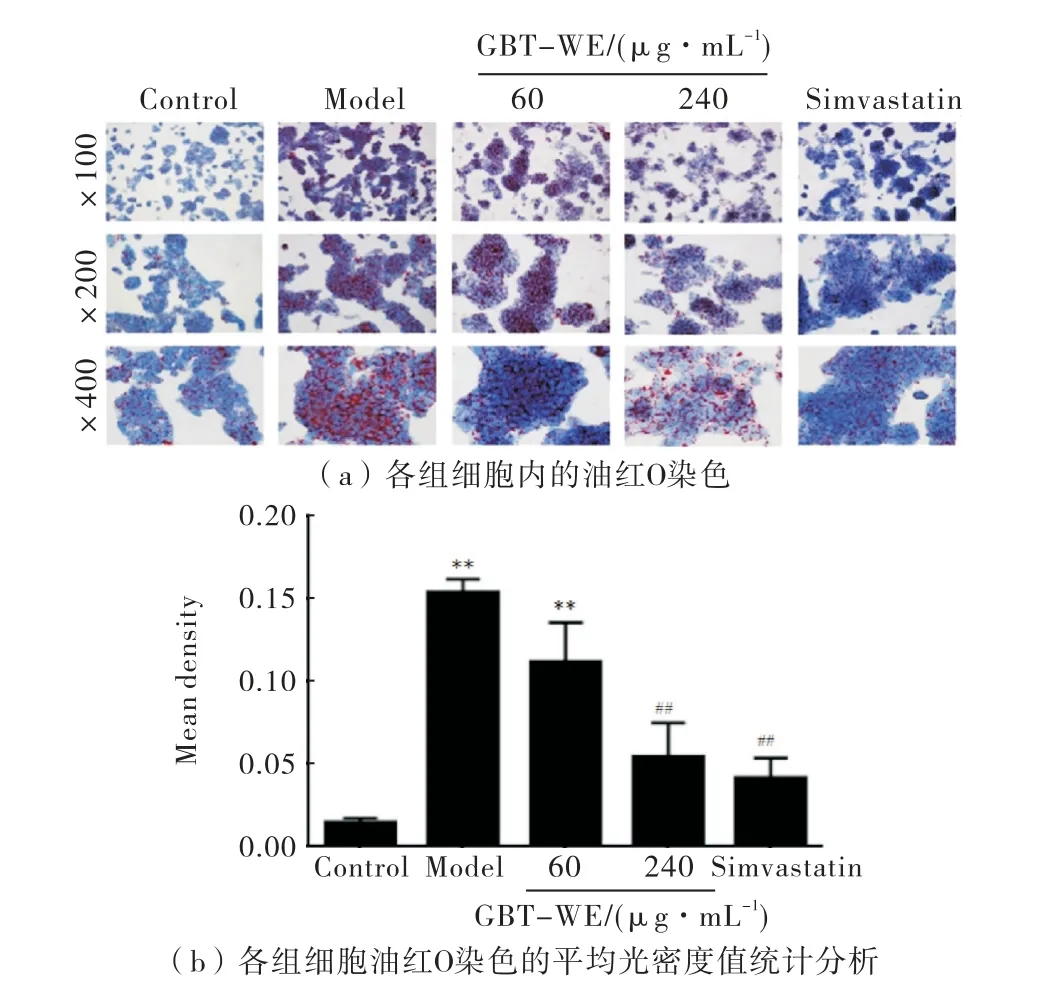
图3 GBT-WE干预后各组细胞的油红O 染色
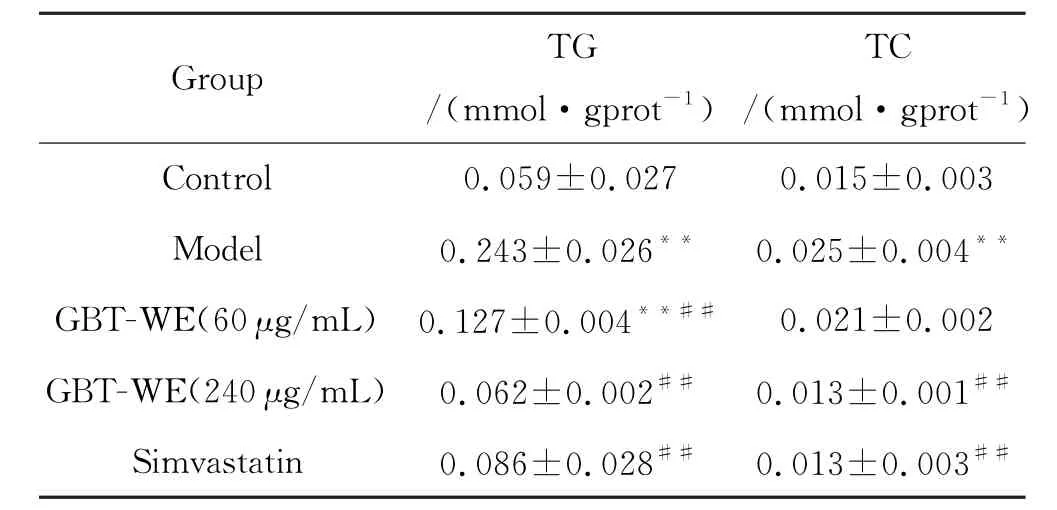
表2 GBT-WE对各组细胞TG、TC表达的影响
2.3.3 GBT-WE抑制脂质代谢相关蛋白SREBP1c、FAS的表达
SREBP1c是脂肪生成过程中的关键转录因子,其下游目标FAS主要调控脂肪酸的生物合成,在脂质代谢中起到重要作用.Western blot法测定结果发现:与对照组相比,模型组SREBP1c和FAS呈高表达(P<0.01);GBT-WE干预后,与模型组相比,SREBP1c和FAS的蛋白表达量降低,并且随着GBT-WE的质量浓度增加,其表达量逐渐降低,呈现药物剂量-效应关系.表明GBT-WE 改善细胞脂肪变性可能是通过SREBP1c/FAS信号通路实现的.如图4所示.

图4 GBT-WE对各组细胞SREBP1c、FAS蛋白表达的影响
3 讨论
肝脏是脂质代谢的重要器官[12].通过4 种主要途径调节:循环脂质的摄取,从头脂肪生成(De novo lipogenesis,DNL),脂肪酸氧化以及极低密度脂蛋白的脂质输出[13].NAFLD 的发生是由脂质获取和脂质处理之间的不平衡引起的,一种或多种途径的破坏都可能导致肝脏内脂肪的聚集.研究表明,NAFLD患者的重要特征是DNL异常升高[14].在NAFLD 肥胖患者中,大约26%的肝甘油三酯来自DNL,这进一步证实了DNL在NAFLD 中的重要性,表明DNL是潜在的治疗靶标[15].
DNL作为脂质代谢的重要途径,主要调节糖酵解,饱和脂肪酸以及TG的合成[16].SREBP1c 是DNL的转录调控关键因子,主要参与调控脂肪酸、TG 合成相关酶基因(乙酰辅酶A 羧化酶,FAS和硬脂酰辅酶A 去饱和酶等)的表达[17].其中,FAS是脂肪酸生物合成的限速酶,SREBP1c可与FAS的启动子结合以启动TG合成[18].这些肝脏脂肪生成转录因子的高表达可激活脂肪酸链合成,导致TG 过量合成和肝脏脂质积聚.有研究发现SREBP1c表达在NAFLD 患者和动物模型中增高,升高的SREBP1c促进FAS 表达增加[19-20],而SREBP1c敲除小鼠中FAS则表达下降[21-22],也就是说SREBP1c/FAS 系统在NAFLD 的发生与发展中起到关键作用.因此,阻断SREBP1c/FAS的高表达将降低肝脏中TG的合成.
在周红宇,阳学风[23]的实验中,用含有50%FBS的RPMI-1640培养基培养人肝L-O2细胞24 h后建立肝细胞脂肪变性模型,提示血清蛋白的过量使用能增加细胞内TG的含量.所以在本实验中选择Hep G2细胞为研究对象[24],用加入含有50%FBS的MEM培养基来处理Hep G2 细胞48 h,结果显示细胞中的脂质积累和TG 含量显著增加,与脂肪肝细胞的形态学具有相似性,证实FBS诱导的Hep G2细胞脂肪变性模型适合于体外评估NAFLD.
尽管黑茶都具有一定的降脂减肥效果,但由于不同黑茶之间功能物质组成及比例的差异,降脂减肥的作用效果也必定存在一定的差异.黑茶主要包括普洱茶、青砖茶、茯砖茶、千两茶、黑砖茶、六堡茶等数十个品种.其中,大量关于普洱茶的研究显示,普洱茶能够降低PPAR-γ和SREBP-1c及其下游基因FAS、ACC的表达,抑制肝脏脂肪酸吸收和脂肪合成,改善大鼠NAFLD 脂肪变性[25].傅冬和等对茯砖茶各部分萃取,发现对PPAR-γ、PPAR-δ均有激活作用,对FXR有抑制作用,从而实现降脂减肥功效[26].TG在肝细胞的细胞质中的积累是NAFLD 的标志[22].在以前的研究中同样发现青砖茶的降脂作用显著[9,27],但具体机制不明.在本研究中将青砖茶GBT-WE 用于干预肝脂肪变性模型从而评价GBT-WE青砖茶对体外NAFLD 的影响.同时,使用Simvastatin作为抗脂质积累的阳性对照,已知Simvastatin不仅降低胆固醇,还可降低甘油三酯.在临床研究中,Simvastatin可有效降低血清甘油三酯水平[28].研究结果显示高浓度的FBS可刺激SREBP1c高表达并增强下游FAS表达导致脂肪过量合成.而GBT-WE则显著减少了Hep G2细胞中脂质的过度积累,降低了细胞内TG、TC水平,极大地抑制了脂质代谢相关蛋白SREBP1c及其下游目标FAS 的表达.由此可见,GBT-WE可通过SREBP1c/FASBS 信号通路减少从头脂肪生成,从而抑制TG 的合成,最终对NAFLD 的发展起到保护作用,GBT-WE有望开发成为治疗NAFLD的有效药物.因此,后续还需进行相关体内实验来进一步阐述其机制.
