不同生活型植物吸收凝结水后水分及荧光生理差异
2020-04-17李周康吕光辉龚雪伟
李周康 吕光辉 龚雪伟
摘要:为明确干旱区荒漠典型不同生活型植物对凝结水的吸收,以梭梭(Haloxylon ammodendron)、沙拐枣(Calligonum mongolicum)和对节刺(Horaninowia ulicina)为研究对象,通过野外原位凝结水模拟试验,综合分析不同生活型植物光合器官的水分变化及荧光生理响应。结果表明,梭梭、沙拐枣和对节刺这3种植物都具有吸收凝结水的能力,逆向水势梯度正是其吸收凝结水的物质基础。对于利用深层土壤水或地下水的中深根系植物梭梭、沙拐枣与利用浅层土壤水的浅根系植物对节刺而言,吸收冠层凝结水的现象证明部分荒漠植物已经进化出了“多面下注”的水分利用策略。CK处理下,3种植物在暗适应下沙拐枣与对节刺初始的荧光(Fo)差异显著(P<0.05);ZG1处理下,光适应与暗适应下3种植物的Fo′、Fm′、Fs差异性一致,且具体表现为梭梭分别与对节刺、沙拐枣差异显著(P<0.05);ZG2处理下,梭梭的Fo′与沙拐枣、对节刺均有显著差异,而对于Fm′与Fs值,3种植物并无显著差异。梭梭ZG1处理下植株的Fo和Fm较CK植株降低,而ZG2植株则显著提高(P<0.05),沙拐枣ZG2植株的ΦPSⅡ显著低于CK植株(P<0.05),对节刺在光适应下各荧光参数如Fo′、Fm′、Fs差异性变化规律一致,具体表现为CK植株与ZG1和ZG2均有显著差异(P<0.05)。
关键词:荒漠植物;生活型植物;凝结水;荧光参数;水势
中图分类号: Q945;S184
文献标志码: A
文章编号:1002-1302(2020)02-0123-08
收稿日期:2018-10-16
作者简介:李周康(1994—),男,河南周口人,硕士研究生,主要从事植物生理学方面的研究。E-mail:1256172657@qq.com。
通信作者:白志强,高级工程师,主要从事森林生态学方面的研究。E-mail:13999829959@163.com。
干旱荒漠最显著的特征是降水极端稀少而输入又不确定,这使得生活在此环境中的生物长期处于干旱胁迫之中[1]。水作为荒漠生态系统中的主要限制因子,任何补充性的水资源,如凝结水、土壤吸附水、雾等都可能对干旱区生态系统产生积极的作用[2-3]。在降水量充沛的地区,水汽凝结量与降水量相比是微不足道的,但在干旱、半干旱区,凝结水却是非常重要的水资源[4]。
过去人们认为高等植物吸收水分主要依靠根系,不能到达植物根区的水分输入就不可能被利用,凝结水不能作为植物的水源[5-6]。因此对于一些草本或者木本植物生长所需水分来源的认识还依旧停留在土壤水或深层地下水阶段。然而随着研究的不断深入,发现自然界中部分植物在进化过程中产生了叶片吸收利用凝结水的生长策略,这使得凝结水成为这些植物的另一项水分来源。随后有学者发现,加利福尼亚北部红树林的植株叶片不仅吸收凝结水而且对凝结水的吸收比例达到34%,并且可以通过叶片气孔捕获叶片周围的大气水汽[7-8];热带山地云雾森林中紫茉莉(Myrsine umbellata)能够通过叶片角质层或毛状体吸收凝结水,但不同物种间水分吸收略有差异[9-10]。对植物凝结水吸收方面的研究最早主要集中在热带和暖温带地区的乔木或一年生草本,随后国内部分学者对温带荒漠干旱区中的草本植物展开了研究。庄艳丽等通过人工模拟凝结水梯度证明,温带荒漠区一年生草本雾冰藜(叶片被毛)能够吸收冠层凝结水,主要用于地上部分的生长,而无毛植物沙米在不同的凝结水梯度下未表现出明显差异[11]。刘志东等对艾比湖地区的研究表明,凝结水可以显著提高短命植物狭果鹤虱披毛叶片的水势及净光合速率[12]。国内外学者对植物叶片吸收凝结水的研究说明在一定条件下凝结水可被草本或木本植物利用。
对于干旱区植物而言,不同生活型植物不同的根系生长对策使得其对水分的利用也不尽相同,它们的水分利用情况不仅可以反映荒漠植物水分吸收的来源,还能反映基于水分吸收而进化出的生长策略。Boucher等发现,人工模拟凝结水显著增加了白松(Pinus strobus L.)幼苗水势、气孔导度,促进了幼苗根系生长[13]。Wang等研究发现,超旱生植物琵琶柴叶片表皮在低湿条件下水分吸收鳞片的中空管是收缩的,中央开口很小,而在高湿条件下水分吸收鳞片中间的倒置圆锥孔逐渐扩大,形成一个中央开口,基底细胞升起水分吸收鳞片的盖子,促使水分以毛细管流的形式覆盖角质层[14]。上述研究说明凝结水对植物的影响不仅体现的在形态上还有生理上,过去人们常常通过植物叶片气体交换参数来反映植物的光合生理状况,却鲜有探讨植物凝结水吸收后的叶片内光量子的传递机理,而叶绿素荧光技术能更直观地反映植物光合有效辐射量、光化学量子效率等,这些指标有助于了解可能会对光合作用产生抑制的某些环境条件以及植物吸收凝结水过程中水分及熒光参数之间的联系。
上述研究中荒漠植物叶片对凝结水的吸收为本研究提供了思路。在干旱区,植被为了生存对水分具有较高的依赖性,为了获取生长所需的水分,大部分荒漠植物将根部深深扎入土壤。目前,对植物吸收凝结水的研究多集中在单一物种的层次上,而通过野外原位控制试验研究不同生活型植物对凝结水的利用却较为稀少。基于此,本研究在艾比湖湿地国家级自然保护区温带荒漠区内,针对3种不同生活型植物——梭梭(Haloxylon ammodendron)、沙拐枣(Calligonum mongolicum)、对节刺(Horaninowia ulicina),研究其光合器官吸收凝结水的能力以及吸收凝结水后叶片光量子传递及荧光生理特点,旨在探究凝结水在不同生活型荒漠植物体中的动态变化特征及光化学生理过程,这有助于加深对荒漠植物干旱胁迫适应的理解。
1 材料与方法
1.1 研究区概况
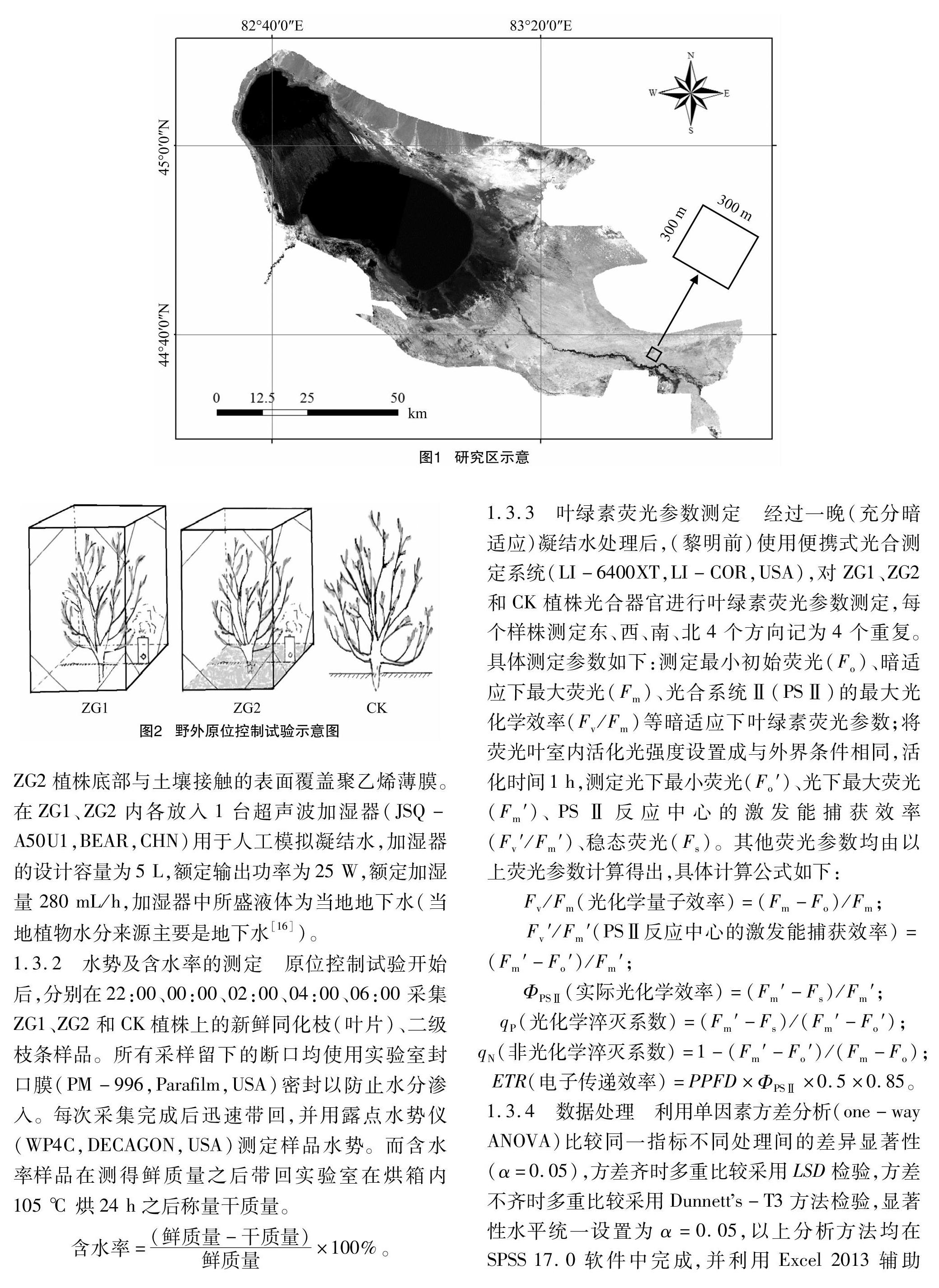
艾比湖湿地国家级自然保护区(82°36′E~83°50′E,44°30′N~45°09′N)位于新疆维吾尔自治区境内(图1),是准噶尔盆地西部最低洼地和水盐汇集中心[15],总面积2 670.85 km2。年均气温 5 ℃,多年平均降水量为107 mm,潜在蒸发量为 1 315 mm,降水量年内分配不均,夏多冬少,气候极端干燥,属典型温带大陆性干旱气候。区内典型地带性土壤为灰漠土、灰棕漠土和风沙土,隐域性土壤为盐(盐渍化)土、草甸土和沼泽土。不同的土地类型影响着旱生、超旱生、沙生、盐生、湿生、水生等植物群落的形成。艾比湖湿地自然保护区植物区系属古北界蒙新区北疆荒漠区准噶尔荒漠小区。区内植被可分为5个植被类型、8个植被亚型、17种群系。典型群落为胡杨(Populus euphratica)群落、盐爪爪(Kalidium foliatum)群落、白麻(Poacynum pictum)群落、梭梭群落、沙拐枣以及对节刺群落。
1.2 样方设置及植物选取
2017年8月在艾比湖湿地国家级自然保护区东大桥管护站以北2 km处设置1个300 m×300 m样方,并在其中选取生境相似的梭梭、沙拐枣以及对节刺群落,在3种群落中选取成熟健康、个体大小相同的梭梭、沙拐枣、对节刺植株各3株作为供试植株,并进行标记。其中梭梭、沙拐枣、对节刺分别为乔木、灌木、一年生草本。
1.3 试验方法
1.3.1 野外原位控制试验 为了降低土壤养分、盐碱度和质地等差异对原位试验造成的影响,在供试植株选取时,利用土壤温湿度测定仪和土壤pH(IQ150)原位测定仪显示的数据作为参考,选择生长环境较为接近的植株作为样株,每种植物分别选取3株。利用铁条和螺丝拼装成一个便携式、可拆卸的金属结构框架,在试验开始前,用聚乙烯塑料薄膜覆被包裹成一个底部开口的控制箱并拼装2个控制箱。由于3种植株生活型的差异,金属框架设置为2种规格,即适用于梭梭和沙拐枣的1.2 m×1.2 m×1.8 m(长×宽×高)大型控制箱和适用于对节刺的1.2 m×0.6 m×0.6 m(长×宽×高)小型控制箱。
在植物的生长季内于2017年8月2—5日,每日 22:00(京时)至次日06:00,每隔2 h对梭梭、沙拐枣、对节刺分别进行野外原位控制试验。具体操作如下:使用控制箱将每种植物当中的2棵植株在遮盖后进行凝结水处理并记为ZG1、ZG2,而未进行遮盖及凝结水处理的植物作为对照植株并记为CK(图2)。但是为了排除植物可能吸收利用加湿沉降的凝结水和冠下土壤空气间的地气水热交换,在ZG2植株底部与土壤接触的表面覆盖聚乙烯薄膜。在ZG1、ZG2内各放入1台超声波加湿器(JSQ-A50U1,BEAR,CHN)用于人工模拟凝结水,加湿器的设计容量为5 L,额定输出功率为25 W,额定加湿量 280 mL/h,加湿器中所盛液体为当地地下水(当地植物水分來源主要是地下水[16])。
1.3.2 水势及含水率的测定 原位控制试验开始后,分别在22:00、00:00、02:00、04:00、06:00采集ZG1、ZG2和CK植株上的新鲜同化枝(叶片)、二级枝条样品。所有采样留下的断口均使用实验室封口膜(PM-996,Parafilm,USA)密封以防止水分渗入。每次采集完成后迅速带回,并用露点水势仪(WP4C,DECAGON,USA)测定样品水势。而含水率样品在测得鲜质量之后带回实验室在烘箱内 105 ℃ 烘24 h之后称量干质量。
含水率=(鲜质量-干质量)鲜质量×100%。
1.3.3 叶绿素荧光参数测定 经过一晚(充分暗适应)凝结水处理后,(黎明前)使用便携式光合测定系统(LI-6400XT,LI-COR,USA),对ZG1、ZG2和CK植株光合器官进行叶绿素荧光参数测定,每个样株测定东、西、南、北4个方向记为4个重复。具体测定参数如下:测定最小初始荧光(Fo)、暗适应下最大荧光(Fm)、光合系统Ⅱ(PSⅡ)的最大光化学效率(Fv/Fm)等暗适应下叶绿素荧光参数;将荧光叶室内活化光强度设置成与外界条件相同,活化时间1 h,测定光下最小荧光(Fo′)、光下最大荧光(Fm′)、PSⅡ反应中心的激发能捕获效率(Fv′/Fm′)、稳态荧光(Fs)。其他荧光参数均由以上荧光参数计算得出,具体计算公式如下:
1.3.4 数据处理 利用单因素方差分析(one-way ANOVA)比较同一指标不同处理间的差异显著性(α=0.05),方差齐时多重比较采用LSD检验,方差不齐时多重比较采用Dunnetts-T3方法检验,显著性水平统一设置为α=0.05,以上分析方法均在SPSS 17.0软件中完成,并利用Excel 2013辅助作图。
2 结果与分析
2.1 凝结水处理下不同生活型植物光合器官水势变化
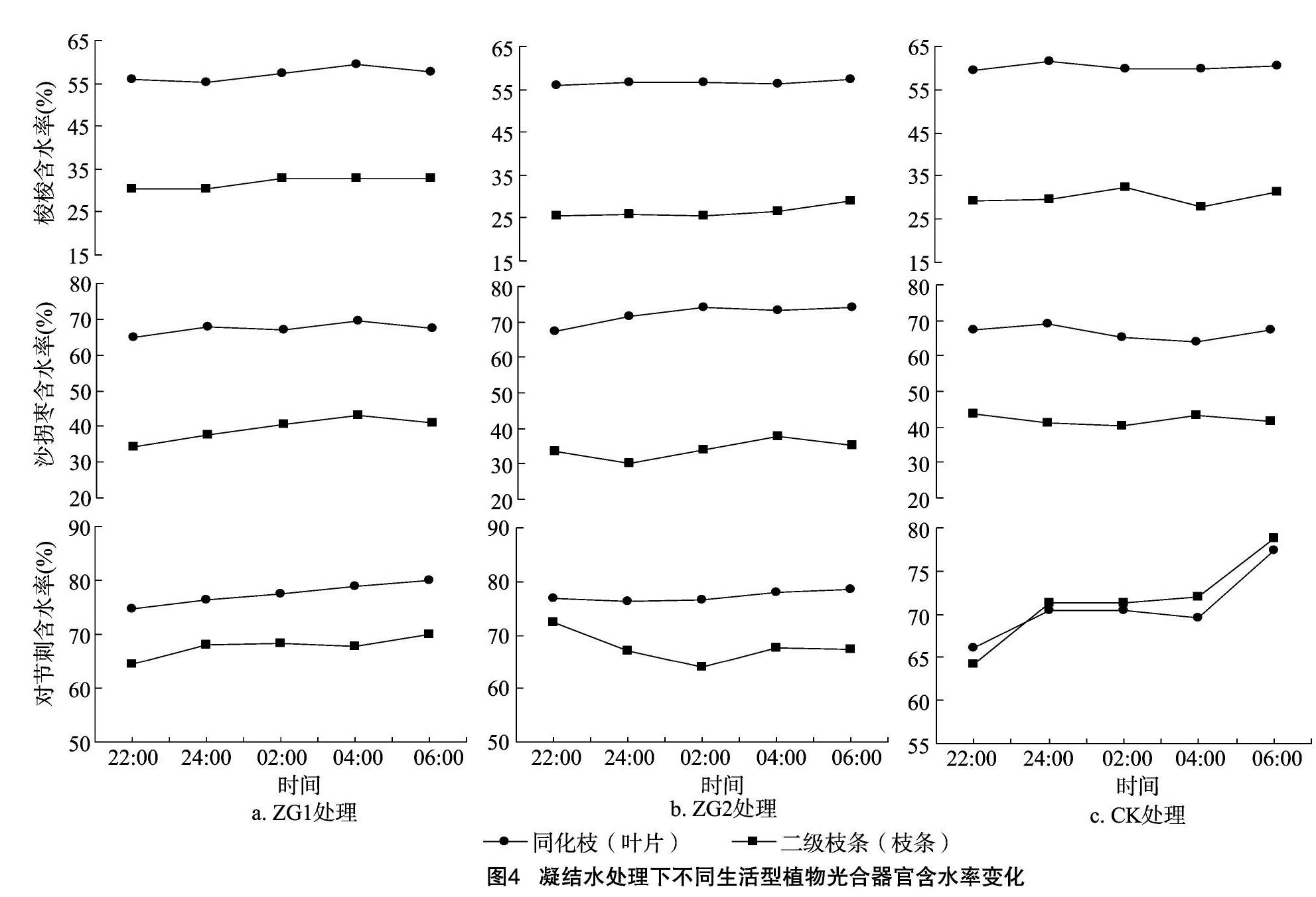
从图3可以看出,在模拟冠层凝结水的2种处理方式下,梭梭同化枝的水势在22:00—06:00期间总体变化表现为先降低后增加的趋势,而二级枝条的水势变化则表现为先增加后降低的趋势。在试验期间,ZG1处理下二级枝条水势极大值和同化枝极小值比ZG2处理中水势值提前2 h(24:00)达到。ZG1梭梭在22:00时同化枝水势大于二级枝条水势,出现逆向水势梯度;ZG2梭梭在22:00—24:00和 06:00 这2段时期内同化枝水势大于二级枝条水势;CK梭梭的二级枝条水势变化在22:00—06:00期间总体表现为先增加后降低再增加的趋势。
ZG1沙拐枣的同化枝与二级枝条的水势总体呈现出“N”形的变化趋势。ZG2沙拐枣同化枝水势变化趋势为先降低再增加然后再下降,二级枝条水势变化呈现出了“M”形的变化趋势。试验期间,ZG1沙拐枣在22:00—02:00期间同化枝水势大于二级枝条水势,出现逆向水势梯度;ZG2沙拐枣在 22:00 和02:00—06:00这2段时期内同化枝水势大于二级枝条水势,出现逆向水势梯度;CK沙拐枣在 22:00—02:00这一时期内,二级枝条水势整体都大于同化枝水势,并未出现逆向水势梯度。
ZG1对节刺叶片水势的在22:00—06:00呈现出“N”形的变化趋势。ZG2对节刺叶片与枝条水势变化在22:00—06:00都呈现先增加后降低的趋势。叶片水势极小值 -6.43 MPa 出现在22:00,极大值-3.16 MPa出现在04:00;枝条水势极小值 -4.97 MPa 出现在22:00,极大值 -3.97 MPa 出现在02:00。ZG1对节刺在22:00—23:00时叶片水势大于枝条水势;ZG2对节刺在04:00—06:00这一时间段,叶片水势大于枝条水势;CK对节刺叶片与枝条水势变化在22:00—06:00都呈“W”形的变化规律,且任意时刻叶片水势都小于枝条水势。
2.2 在凝结水处理下不同生活型植物光合器官含水率变化从图4可以看出,在2种凝结水处理方式下的梭梭含水率在22:00—06:00期间总体变化呈现增加趋势,但增长幅度较为平缓。ZG1梭梭的同化枝与二级枝条含水率在22:0—04:00都呈现增加的趋势,然而同化枝含水率在04:00以后开始降低且含水率整体变化稳定在55%左右,二级枝条含水率整体变化稳定在30%左右。ZG2梭梭同化枝与二级枝条含水率在22:00—06:00期间偶有波动,但二者含水率整体变化分别稳定在55%和25%左右。ZG1、ZG2和CK植株同化枝含水率在任意时刻都明显高于二级枝条含水率。
ZG1沙拐枣同化枝与二级枝条含水率在 22:00—04:00期间都呈现出增加的趋势,并在 04:00 同时达到峰值,在之后的2 h二者同时降低。ZG1沙拐枣同化枝含水率整体变化稳定在65%左右,二级枝条含水率整体变化稳定在40%左右。ZG2沙拐枣同化枝含水率在22:00—06:00期间总体呈现增长趋势,含水率整体变化稳定在70%左右,二级枝条含水率在22:00—06:00期间偶有波动且最终稳定在30%左右。在22:00—06:00期间ZG1、ZG2和CK的同化枝含水率在任意时刻都高于二级枝条含水率。
ZG1对节刺叶片与枝条含水率在22:00—04:00 期间总体呈现增长趋势,二者含水率整体变化分别稳定在78%和65%左右,可知叶片含水率显著高于枝条含水率。ZG2对节刺叶片在22:00—06:00期间总体呈现增加的趋势,含水率整体变化稳定在77%左右;枝条含水率在22:00—02:00开始下降并在02:00达到最低点,02:00—04:00开始增加,04:00—06:00有轻微的下降趋势。CK对节刺叶片与枝条在22:00—06:00总体呈现增长的趋势,只是在24:00—04:00 这一时期增长趋势趋于平缓。
2.3 在凝结水处理下不同生活型植物叶绿素荧光差异
CK处理中,沙拐枣、对节刺在暗适应下初始荧光(Fo)有显著差异(P<0.05),对节刺最大荧光(Fm)值显著高于沙拐枣,在光适应下3种植物的最小荧光(Fo′)、稳态荧光(Fs)、最大光化学量子产量(Fv/Fm)、有效光化學量子产量(Fv′/Fm′)、实际光化学效率(ΦPSⅡ)、光化学淬灭系数(qP)、非光化学淬灭系数(qN)、电子传递效率(ETR)等荧光参数的差异性具体表现为沙拐枣分别与梭梭、对节刺呈显著差异(P<0.05),且梭梭与对节刺彼此间无显著差异,而最大荧光(Fm′)则无显著差异。ZG1处理中,梭梭、沙拐枣和对节刺在暗适应下的Fo与Fm值均无显著差异, 而在光适应与暗适应下3种植物的Fo′、Fm′、Fs差异性一致,且具体表现为梭梭分别与对节刺、沙拐枣呈显著差异(P<0.05)。3种植物的Fv′/Fm′、ΦPSⅡ、ETR彼此间都存在显著差异(P<0.05)。ZG2处理中,在暗适应下3种植物的Fo与Fm值差异性规律一致,梭梭的Fo与Fm值显著高于沙拐枣(P<0.05);在光适应下梭梭的Fo′与沙拐枣、对节刺均有显著差异,而对于Fm′与Fs值,3种植物并无显著差异(表1)。
2.4 在凝结水处理下不同生活型植物光合荧光差异
从表1及表2中可知,对梭梭而言,ZG1凝结水处理下植株的Fo和Fm较之CK植株其值降低,而ZG2植株则显著提高(P<0.05),此外,ZG1植株的Fm′较之CK植株显著增长,但ZG2与ZG1和CK并无显著差异。沙拐枣ZG1植株较之CK植株,Fo和Fm显著提高,而Fv/Fm值显著小于CK植株,ZG2植株的ΦPSⅡ显著低于CK植株(P<0.05)。不论处理如何,在暗适应下对节刺的Fo和Fm都无显著差异,在光适应下各荧光参数如Fo′、Fm′、Fs差异性变化规律一致,具体表现为对节刺CK植株与ZG1和ZG2均有显著差异。对节刺有无凝结水处理,其Fv/Fm、Fv′/Fm′、qP、qN等参数均无显著性差异。
3 讨论
3.1 凝结水对不同生活型植物水势及含水率的影响
3.1.1 同种植物不同处理间水势及含水率的影响 植物水势是反映植物水分亏缺的敏感指标[17]。凝结水处理方式下同种植物的水势变化有所不同。ZG1梭梭植株的二级枝条比ZG2植株的二级枝条要提前2 h达到最大值,其水势的增加规律与占东霞等的研究结果[18]一致。梭梭在3种处理下都出现同化枝水势大于二级枝条水势,呈现逆向水势梯度,这证明了梭梭具有吸收冠层凝结水的能力[19]。梭梭同化枝不断的通过气孔吸收水分,经由逆向水势梯度将适度的水分运输至二级枝条,在这一过程中,二级枝条水势不断增加而同化枝水势不断降低,此时,光合器官保持一定的水分亏缺用来维持一定的吸水能力。但是,ZG2梭梭水势提高的进程与ZG1梭梭比较为缓慢,原因可能是由于ZG2处理中聚乙烯薄膜阻隔了梭梭冠下土壤与空气间的地热水汽交换使得凝结水积累,ZG2箱中空气湿度会比ZG1更早达到饱和,ZG2箱内空气湿度较早的饱和及叶片胞间渗透势的变化间接影响到了植株的气孔导度[11],气孔导度受到抑制降低又会使得梭梭同化枝吸收及运输至二级枝条的水分含量降低。梭梭ZG1和ZG2在二级枝条水势达到最大值后,会继续通过二级枝条来补给植株的茎,甚至可能是根,在这个过程中,二级枝条的水势由于水分的补给输出开始降低,而同化枝水势则继续保持对冠层凝结水的吸收来满足植物体内逆向水势梯度中的水分供给。
植物光合器官对冠层凝结水的吸收一般与光合器官表面的微形态结构与化学特性有关[20]。龚雪伟研究发现,梭梭同化枝表面覆有角质层,可以帮助植物吸收凝结水[19],而且黏液细胞[21]和吸湿性的大气沉降[22]可以激活气孔,进而允许水分通过气孔进入叶肉细胞,而沙拐枣同化枝在适应荒漠环境的过程中进化出角质层、栅栏组织、黏液细胞、含晶细胞、薄壁细胞等解剖学特征[23]。因此,可以推断沙拐枣ZG1与ZG2植株在凝结水处理后均出现逆向水势梯度现象,原因可能要基于一定的解剖学基础。
研究认为,艾比湖湿地自然保护区内黎科和蓼科等一年生浅根系植物,为提高生存能力,保证水分持续供应,采取了多頭下注的策略,即利用不同来源的水分[16],而在人工模拟冠层凝结水试验下,对节刺ZG1和ZG2植株表现出的吸收冠层凝结水这一现象进一步验证了上述观点。由于夜晚荒漠气温降低,ZG1箱内的凝结水会凝结沉降在土壤表面成为土壤水的组成部分[24],而浅根植物则会通过根压吸收根系周围的水分,因此,在22:00—06:00的大部分时间内对节刺的二级枝条水势大于叶片水势的原因可能是由于根系吸收水分,经由木质部导管运输至枝条所致。
3.1.2 同一处理下不同生活型植物水势及含水率的影响 凝结水处理过的3种植物在06:00这一时刻,无论是同化枝(叶片)还是二级枝条(枝条),其水势值都逐渐趋于相同,这可能是因为临近日出,植物体内的各项生理活动开始恢复以响应不断增强的光合辐射,光合作用开始复苏,蒸腾拉力逐渐增大,水分通过根部经由木质部不断输送至叶片。梭梭、沙拐枣与对节刺在凝结水处理后均出现了逆向水势梯度,植株表现出了吸收冠层凝结水的现象,而未进行凝结水处理的沙拐枣和对节刺则未出现逆向水势梯度。植物本身的遗传与植物易获得水分的空间分布位置决定了植物根系的构型及生长方式。对于利用深层土壤水或地下水的中深根系植物梭梭、沙拐枣与利用浅层土壤水的浅根系植物对节刺而言,吸收冠层凝结水的现象证明部分荒漠植物已经进化出了“多面下注”的水分利用策略来应对复杂恶劣的荒漠环境,因此推断干旱区不同生活型荒漠植物可能均会吸收利用凝结水。
3.2 不同生活型植物对凝结水的荧光生理响应
Fo、Fm分别表示PSⅡ反应中心完全张开与完全关闭时的荧光产量。Fo上升表明PSⅡ反应中心受到破坏或失活。ZG1梭梭Fo上升,但Fv/Fm并未下降,推测其并未受到光抑制。Fv/Fm反映了植物潜在最大光能转化效率,在健康生理状态下,绝大多数高等植物的Fv/Fm在0.80~0.85,本研究3种植物在不同处理下Fv/Fm值都小于0.80。而当 Fv/Fm 下降时,代表植物受到了胁迫,同一植物不同凝结水处理下,ZG1处理沙拐枣的Fv/Fm较CK显著降低了38.20%,而在ZG2处理下3种植物 Fv/Fm 值与CK均无显著差异(P<0.05),因此推断覆膜处理后,遮盖箱内地气之间水热交换对3种植物的光合机构并未造成破坏,但这3种植物的胁迫状态也并未因凝结水处理就迅速改变,ZG1沙拐枣受胁迫程度甚至在加剧,3种植物受胁迫状态可能是干旱区部分植物的常态,即便是经过了8 h的夜间凝结水供应也并未改变,而3种植物体内水势及含水量变化说明植物可能在通过吸收凝结水不断缓解受胁迫程度[25],植物通过叶片吸收的凝结水的确可以改善自身受胁迫程度,但如何使根系获取足够的水分来供应植株生长可能才是有效缓解干旱胁迫的关键所在。
ΦPSⅡ反映了光合机构目前的实际光能转换效率,即电子在PSⅡ与PSⅠ之间的传递情况。ZG1梭梭在凝结水处理后其ΦPSⅡ显著升高(P<0.05),说明凝结水对梭梭植株的光合及生长有着重要作用,而在这个过程中ZG2梭梭的ΦPSⅡ则无显著增长,说明此时ZG2梭梭可能受到了一定的光抑制。但ZG2梭梭qP值较CK、ZG1大,而qP反映了PSⅡ原初电子受体QA的氧化还原状态,其值越大,说明PSⅡ电子传递活性越大,同时它也可以反映PSⅡ捕获的光子能量用于光化学反应的能力[26]。沙拐枣ZG1与ZG2的ΦPSⅡ较CK降低,且后者呈显著性降低(P<0.05),这说明ZG2沙拐枣的电子传递受到抑制,凝结水会影响到植株光合机构。
qN表示叶片捕获的光能中用于非辐射能量耗散的量,3种植物在凝结水处理后qN较CK都升高。可见凝结水处理后,光合器官吸收的光能大部分以热量的形式耗散,以保护光合机构免受过剩光能破坏。
ETR反映实际光强条件下的表观电子传递效率,被认为与内在光合能力有相关性[27],本试验仅有沙拐枣ZG2凝结水处理ETR值较CK显著降低,可能是由于ZG2较高的饱和含水率抑制了光电子传递,使实际光能转换效率较低,导致PSⅡ开放反应中心数目减少,引起有效光量子产量的下降,从而导致光合电子传递效率的显著降低[28]。
参考文献:
[1]Schwinning S,Sala O E,Loik M E,et al. Thresholds,memory,and seasonality:understanding pulse dynamics in arid/semi-arid ecosystems[J]. Oecologia,2004,141(2):191-193.
[2]Zangvil A. Six years of dew observations in the Negev Desert,Israel[J]. Journal of Arid Environments,1996,32(4):361-371.
[3]秦 璐. 不同盐生境下盐穗木群落凝结水形成机制及其生态效应[D]. 乌鲁木齐:新疆大学,2014.
[4]蒋 瑾,王康富,张维静. 沙地凝结水及在水分平衡中作用的研究[J]. 干旱区研究,1993(2):1-9.
[5]Malek E,Mccurdy G,Giles B. Dew contribution to the annual water balances in semi-arid desert valleys[J]. Journal of Arid Environments,1999,42(2):71-80.
[6]Munne-Bosch S. Direct foliar absorption of rainfall water and its biological significance in dryland ecosystems[J]. Journal of Arid Environments,2010,74(3):417-418.
[7]Dawson T E. Fog in the California redwood forest:ecosystem inputs and use by plants[J]. Oecologia,1998,117(4):476-485.
[8]Limm E B,Dawson T E. Polystichum Munitum (Dryopteridaceae) varies geographically in its capacity to absorb fog water by foliar uptake within the redwood forest ecosystem[J]. American Journal of Botany,2010,97(7):1121-1128.
[9]Eller C B,Lima A L,Oliveira R S. Foliar uptake of fog water and transport belowground alleviates drought effects in the cloud forest tree species,Drimys brasiliensis (Winteraceae)[J]. New Phytologist,2013,199(1):151-162.
[10]Eller C B,Lima A L,Oliveira R S. Cloud forest trees with higher foliar water uptake capacity and anisohydric behavior are more vulnerable to drought and climate change[J]. New Phytologist,2016,211(2):489-501.
[11]莊艳丽,赵文智. 荒漠植物雾冰藜和沙米叶片对凝结水响应的模拟实验[J]. 中国沙漠,2010,30(5):1068-1074.
[12]刘志东,吕光辉,张雪妮,等. 叶片被毛对干旱区短命植物狭果鹤虱生理生态特征的影响[J]. 干旱区研究,2017,34(5):1101-1108.
[13]Boucher J F,Munson A D,Bernier P Y. Foliar absorption of dew influences shoot water potential and root growth in Pinus strobus seedlings[J]. Tree Physiology,1995,15(12):819-823.
[14]Wang X H,Xiao H L,Cheng Y B,et al. Leaf epidermal water-absorbing scales and their absorption of unsaturated atmospheric water in Reaumuria soongorica,a desert plant from the northwest arid region of China[J]. Journal of Arid Environments,2016,128:17-29.
[15]陈蜀江,侯 平,李文华,等. 新疆艾比湖湿地自然保护区综合科学考察[M]. 乌鲁木齐:新疆科学技术出版社,2006.
[16]马辉英,杨晓东,吕光辉,等. 新疆艾比湖湿地自然保护区荒漠优势种体内的水分来源[J]. 生态学报,2017,37(3):829-840.
[17]付爱红,李卫红,陈亚宁. 极端干旱区多枝柽柳茎水势变化影响因子分析[J]. 中国沙漠,2012,32(3):730-736.
[18]占东霞,庄 丽,王仲科,等. 准噶尔盆地南缘干旱条件下胡杨、梭梭和柽柳水势对比研究[J]. 新疆农业科学,2011,48(3):544-550.
[19]龚雪伟.荒漠木本植物光合器官吸收冠层凝结水机理探究:基于分子、细胞和生理视角[D]. 乌鲁木齐:新疆大学,2017.
[20]Wang X H,Xiao H L,Ren J,et al. An ultrasonic humidification fluorescent tracing method for detecting unsaturated atmospheric water absorption by the aerial parts of desert plants[J]. Journal of Arid Land,2016,8(2):272-283.
[21]Zimmermann D,Westhoff M,Zimmermann G,et al. Foliar water supply of tall trees:evidence for mucilage-facilitated moisture uptake from the atmosphere and the impact on pressure bomb measurements[J]. Protoplasma,2007,232(1/2):11-34.
[22]Burkhardt J. Hygroscopic particles on leaves:nutrients or desiccants?[J]. Ecological Monographs,2010,80(3):369-399.
[23]齐 月,潘伯荣. 沙拐枣属植物同化枝和子叶的解剖学研究[J]. 西北植物学报,2010,30(3):512-518.
[24]Hill A J,Dawson T E,Shelef O,et al. The role of dew in Negev Desert plants[J]. Oecologia,2015,178(2):317-327.
[25]Limm E B,Simonin K A,Bothman A G,et al. Foliar water uptake:a common water acquisition strategy for plants of the redwood forest[J]. Oecologia,2009,161(3):449-459.
[26]Richardson A D,Berlyn G P. Spectral reflectance and photosynthetic properties of Betula papyrifera (Betulaceae) leaves along an elevational gradient on Mt. Mansfield,Vermont,USA[J]. American Journal of Botany,2002,89(1):88-94.
[27]许大全. 光合作用学[M]. 北京:科学出版社,2013.
[28]王恒方,周耀治,秦 璐,等. 凝结水对盐穗木(Halostachys caspica)叶绿素荧光参数及水分利用效率的影响[J]. 干旱区研究,2017,34(5):1124-1132.魏 跃,陈景景,郑宏伟,等. 矮牵牛同源三倍体种质创制及减数分裂观察[J]. 江苏农业科学,2020,48(2):131-136.
