EB病毒相关性噬血细胞综合征一例报道并文献复习
2020-04-17王江娅孙萌郑有宁
王江娅,孙萌,郑有宁
噬血细胞综合征(hemophagocytic syndrome,HLH)是一类由于淋巴细胞和巨噬细胞系统异常激活、增殖引起的大量炎性细胞因子分泌而导致多器官炎性反应的临床综合征[1]。此类疾病是一种高致死性疾病,我国儿童HLH多继发于EB病毒(EBV)感染,本文通过对1例患儿的临床资料以及治疗、随访情况进行总结并进行文献复习,以期提高临床对该病的认识,从而提高患儿的生存率。
1 病例简介
患儿,女,8岁,主因“发热3 d,发现茶色尿0.5 d”于2018-01-27入住河北省人民医院。入院前3 d患儿出现发热,体温最高39.3 ℃,无寒战、抽搐,无恶心、呕吐等伴随症状,院外自行口服抗生素治疗2 d,仍有间断发热,入院前半天发现茶色尿,有泡沫,无腰痛,无尿频、尿急、尿痛等症状,仍有发热,就诊于本院门诊,查尿常规尿胆原+++,胆红素+++,隐血-,蛋白质+++,血常规:白细胞计数(WBC)3.80×109/L〔参考范围:(3.50~9.50)×109/L〕,中性粒细胞分数(NE)0.31(参考范围:0.40~0.75),淋巴细胞分数(LY)0.62(参考范围:0.20~0.50),红细胞计数(RBC)4.7×1012/L〔参考范围:(3.8~5.1)×1012/L〕,血红蛋白(Hb)119 g/L(参考范围:115~150 g/L),血小板计数(PLT)83×109/L〔参考范围:(125~350)×109/L〕,为求进一步诊治收入院。入院查体:体温39.6 ℃,脉搏90次/min,心率24次/min,血压103/69 mm Hg(1 mm Hg=0.133 kPa),皮肤红润,未见黄染、皮疹或出血点,颜面部无水肿,颈部可触及数个肿大淋巴结,最大2 cm×3 cm,咽充血,扁桃体Ⅱ°肿大,腹软,全腹无压痛,肝右肋下3 cm可触及,质韧,边界清楚,脾左肋下3 cm可触及,质硬,边界清楚,双肾区无叩击痛,双下肢无水肿,余查体未见明显异常。否认特殊药物、毒物接触史,否认特殊患病史,否认异常出生史、异常家族史,弟弟体健。初步诊断:急性扁桃体炎;血小板减少症;蛋白尿;肝脾大;溶血尿毒综合征?入院后给予抗感染治疗,入院第1天查血常规(2018-01-28 8:00):WBC 3.76×109/L,RBC 4.0×1012/L,Hb 111 g/L,PLT 28×109/L,接到血小板危急值报告,复测血常规(2018-01-28 12:14):WBC 1.96×109/L,RBC 4.0×1012/L,Hb 107 g/L,PLT 19×109/L,WBC、PLT明显减低,当天下午再次复查血常规(2018-01-28 15:00):WBC 1.75×109/L,RBC 3.6×1012/L,Hb 95 g/L,PLT 15×109/L, 仅 半 天 时 间全血细胞呈极速下降;纤维蛋白原1.29 g/L(参考范围:2.00~4.00 g/L),C反应蛋白(CRP)88 mg/L(参考范围:0~10 mg/L),降钙素原(PCT)1.01 μg/L(参考范围:<0.05 μg/L),生化全项:总蛋白57 g/L(参考范围:65~85 g/L),白蛋白32 g/L(参考范围:40~55 g/L),天冬氨酸氨基转移酶(AST)274 U/L(参考范围:13~35 U/L),丙氨酸氨基转移酶(ALT)236 U/L(参考范围:7~40 U/L),总胆红素 80 μmol/L(参考范围:6~25 μmol/L),直接胆红素 51 μmol/L(参考范围:0~15 μmol/L),尿素氮(BUN)5.9 mmol/L(参考范围:2.5~7.1 mmol/L),血肌酐(Scr)56.7 μmol/L(参考范围:53.0~132.0 mmol/L),乳酸脱氢酶(LDH)1 021 U/L(参考范围:120~250 U/L),三酰甘油4.10 mmol/L(参考范围:0.56~1.70 mmol/L),血培养、呼吸道病原体谱(呼吸道合胞病毒、腺病毒、流感病毒、副流感病毒、肺炎衣原体、嗜肺军团菌)均阴性。抗核抗体、抗双链DNA均阴性,抗人球蛋白:间接、直接均阴性;腹部超声:肝大,肝右叶最大斜径130 mm,脾大(130 mm×37 mm),脾静脉增宽,双肾增大,胆囊壁水肿;胸部X线片提示肺内渗出性病变,结合患儿有全血细胞减少、纤维蛋白原减低、高三酰甘油血症,考虑HLH,进一步完善相关检查:铁蛋白>2 000 μg/L(参考范围:13~150 μg/L),自然杀伤(NK)细胞活性减低,可溶性白介素-2受体(sCD25)>7 500 U/ml(参考范围:223~710 U/ml)。骨髓涂片:骨髓增生活跃,粒系比例减低,可见数个噬血细胞。根据国际组织细胞协会颁布的HLH-2004诊断标准[2]:(1)发热:体温>38.5 ℃,持续>7 d;(2)脾大;(3)血细胞减少(累及外周血两系或三系):Hb<90 g/L,PLT<100×109/L,中性粒细胞计数<1.0×109/L,且非骨髓造血功能减低所致;(4)高三酰甘油血症和/或低纤维蛋白原血症:三酰甘油>3 mmol/L,纤维蛋白原<1.5 g/L;(5)在脾脏、肝脏、淋巴结或骨髓里找到噬血细胞;(6)血清铁蛋白升高:铁蛋白≥500 μg/L;(7)NK细胞活性降低或缺如;(8)sCD25升高,本患儿临床表现符合以上诊断标准,故修正诊断为HLH。
1.1 治疗方案 根据HLH-94治疗方案[1]和HLH-2004治疗方案[2]的前瞻性临床研究结果和中华医学会儿科学分会血液学组的最新共识[3]推荐在HLH诱导治疗期使用HLH-94方案,本患儿应用HLH-94方案治疗,给予依托泊苷、地塞米松联合化疗(见表1),总疗程8周。初期因患儿PLT、纤维蛋白原明显减低,病情危重,给予甲泼尼龙冲击、人免疫球蛋白、新鲜血浆、纤维蛋白原等治疗,入院第4天患儿因肺内严重炎性渗出导致肺水肿,出现呼吸衰竭,给予呼吸机辅助呼吸治疗。
1.2 明确类型 治疗期间查EBV定量聚合酶链式反应(PCR):1.22×106copies/ml(参考范围:<500 copies/ml),EBV抗体检测:EB-EA-IgG阳性;EB-VCA-IgG阳性,提示患儿既往EBV现症感染;完善HLH相关基因检测[4]:穿孔素基因(RF1):2个外显子;UNC13同源蛋白4基因(UNC13D):32个外显子;突触融合蛋白11基因(STX11):1个外显子;突触融合蛋白结合蛋白2基因(STXBP2):19个外显子;X连锁凋亡抑制蛋白基因(XIAP):6个外显子;SH2结构域1A基因(SH2D1A):4个外显子;Rab蛋白基因(RAB27A):5个外显子;衔接蛋白-3的β3A亚基基因(AP3B1):27个外显子;溶酶体运输调节因子基因(LYST):53个外显子;IL-2介导的T细胞激酶基因(ITK):17个外显子(见表2),均未见致病性突变,最终诊断为EBV相关性噬血细胞综合征(EBV-HLH)。
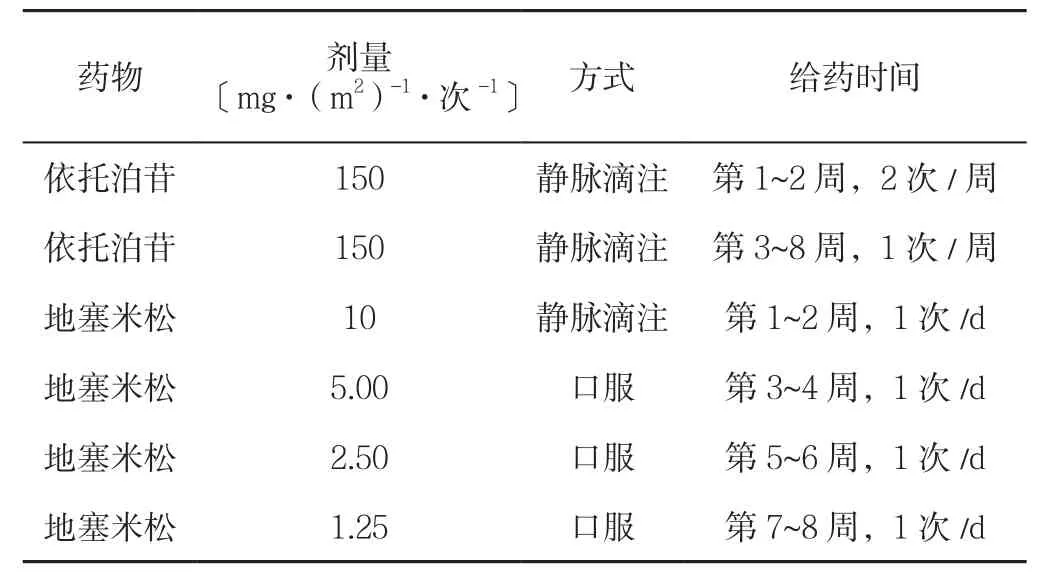
表1 HLH患儿治疗方法Table 1 Treatment for the child with EBV-associated hemophagocytic syndrome
1.3 治疗效果 规律化疗期间定期复查患儿血常规、生化全项、凝血功能等,指标逐渐好转。在治疗8周后复查血常规:WBC 4.69×109/L,NE 0.26,LY 0.70,RBC 3.6×1012/L,Hb 113 g/L,PLT 301×109/L;纤维蛋白原2.54 g/L,铁蛋白396 μg/L,EBV 定量 PCR:1.22×105copies/ml,sCD25:526 U/ml,NK细胞活性:正常;EB-EA-IgG阴性;EB-VCA-IgG阳性;但复查骨髓细胞学仍有噬血现象。根据MARSH等[5]制定的HLH治疗指南中提出的疗效评价方法,该患儿为部分应答,家长要求转入首都医科大学附属北京友谊医院进一步治疗。
1.4 随访 患儿于首都医科大学附属北京友谊医院行利妥昔单抗靶向治疗,EBV DNA检测阴性,现在已经终止化疗,近期能正常上学。并于首都医科大学附属北京友谊医院定期门诊随诊。
2 讨论
HLH是一种临床少见的可引起多脏器功能损害的炎性反应性疾病。根据触发因素的不同,分为原发性和继发性HLH[1-3]。根据致病原因的不同分为感染相关,恶性肿瘤相关,巨噬细胞活化综合征,妊娠、药物、器官和造血干细胞移植继发的HLH等[3],其中EBV感染是HLH最常见的诱因[6],也是儿童继发性HLH中最重要的类型,尤其多见于亚洲儿童,该病发病凶险,进展迅速,预后不良,病死率高,国内数据显示其总病死率高达56.7%[7],且年龄越小,预后越差。EBV-HLH的发病机制尚不明确,COHEN[8]研究认为,EBV感染B淋巴细胞后触发细胞毒性T淋巴细胞的多克隆增殖,然后再激活巨噬细胞、免疫系统,进而产生高细胞因子瀑布。而KASAHARA等[9]研究认为,EBV感染CD8+T淋巴细胞和NK细胞后表达CD21抗体,迅速触发大量的细胞因子释放,通过这种方式,组织细胞被广泛激活。EBV-HLH患儿可表现为持续高热、肝脾淋巴结大、全血细胞减少、凝血功能障碍、中枢神经系统并发症(如惊厥、颅压升高、昏迷)和多器官功能受损,其临床表现难以与原发性HLH及其他继发性HLH鉴别,研究发现,EBV-HLH更容易累及中枢神经系统[10]。所以对于早期出现中枢神经系统症状的患儿需考虑EBV感染的可能,及时完善影像学检查及脑脊液检查,早期给予相应治疗。对于EBV-HLH的诊断需要满足2个条件,一是符合HLH的诊断标准,二是需要有EBV感染的证据[11]。本例患儿临床表现全部符合HLH诊断标准,且EBV载量异常增高,早期抗原IgG阳性,支持EBV现症感染,基因检测未发现致病基因,最终诊断为EBV-HLH。对于EBV-HLH的首要治疗目前仍是根据HLH-94治疗方案和HLH-2004治疗方案给予诱导缓解治疗,从而抑制过度炎性反应。研究发现,早期应用依托泊苷化疗可极大降低EBV-HLH的病死率[12-13]。本例患儿入院第3天即给予依托泊苷联合地塞米松化疗,预后良好。除应用化疗药物治疗外,应给予积极支持治疗,如输注血小板、新鲜血浆、凝血酶原复合物等降低患儿的出血风险。本例患儿在前期因为PLT、纤维蛋白原明显减低,多次输注血小板、血浆、纤维蛋白原、冷沉淀等,减轻患儿的出血倾向。对于EBV-HLH另一方面的治疗是病因治疗,EBV-HLH是由EBV原发感染或既往感染再激活引起[14],原则上应给予抗EBV治疗,阿昔洛韦、更昔洛韦对疱疹病毒有效,对于EBV感染引起的传染性单核细胞增多症效果好,但目前对于应用阿昔洛韦用于EBV-HLH抗病毒治疗存在争议,在本例患儿的治疗过程中曾应用阿昔洛韦抗病毒治疗2周,EBV载量未见明显改善。目前研究发现,对于难治性EBV-HLH患儿,经化疗药物治疗后EBV载量仍持续增高,则可采用利妥昔单抗(抗人CD20抗体)进行靶向治疗,其机制可能是利妥昔单抗能减少EBV-HLH患儿的EBV负荷,减轻炎性反应及症状,从而改善预后[15]。本例患儿转入首都医科大学附属北京友谊医院接受利妥昔单抗靶向治疗后EBV DNA检测呈阴性,与上述研究结果相一致。有研究发现早期应用甲泼尼龙、丙种球蛋白治疗能为后期的诱导治疗争取机会,分析可能与降低辅助性T淋巴细胞的活性、促进抑制性T淋巴细胞激活、降低炎性递质分泌有关,也可能因组织细胞Fc受体受阻而进一步减弱了其噬血活性[16]。这也与HLH-2004中推荐“大剂量甲泼尼龙联合静脉免疫球蛋白的治疗方案可能有一定作用”相吻合。EBV-HLH是极其凶险的、严重危及患儿生命的一类疾病,且可能存在遗传学异常,故对常规化疗效果欠佳的难治复发患者,可进行造血干细胞移植。
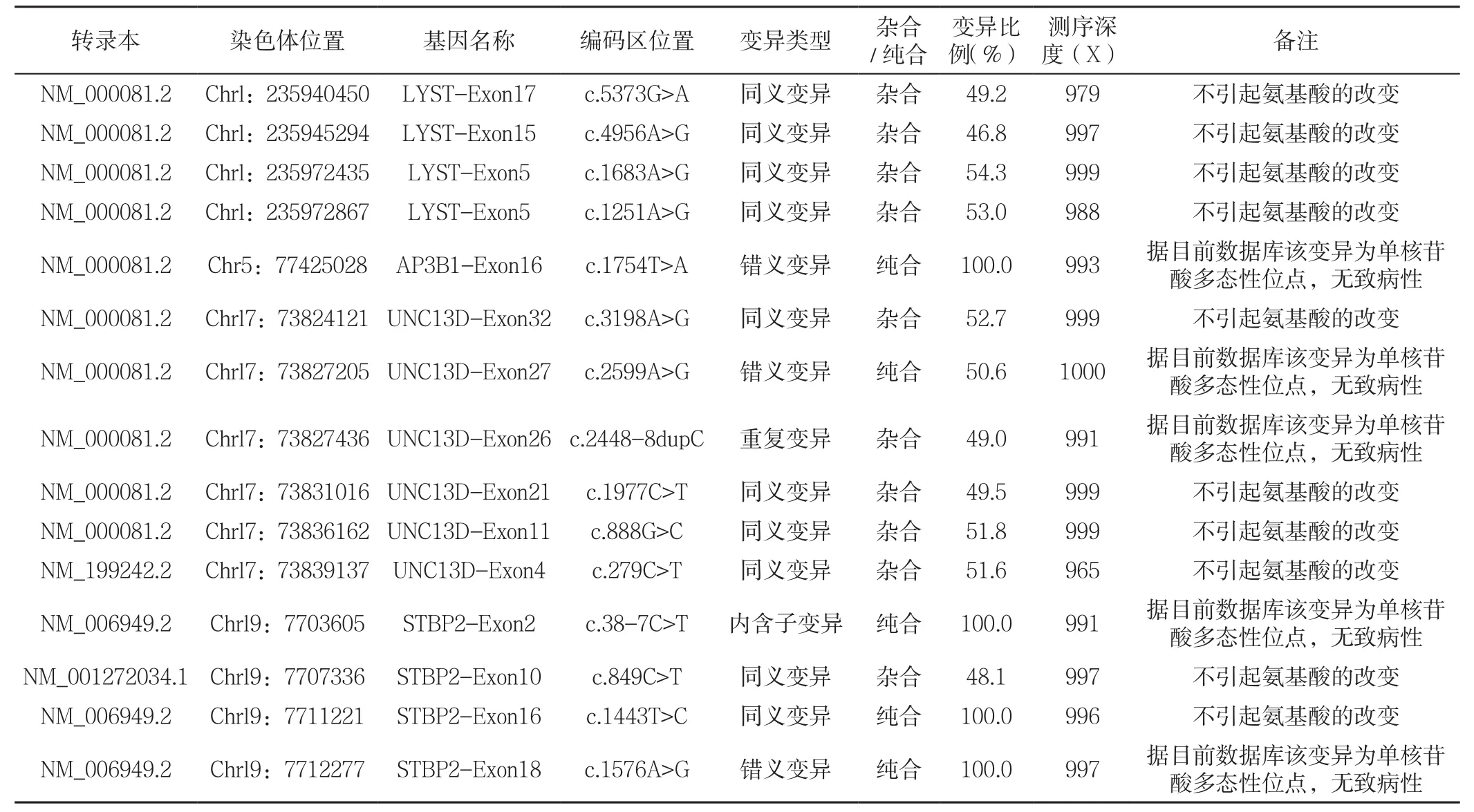
表2 患儿HLH相关基因检测结果Table 2 EBV-associated hemophagocytic syndrome-related gene detection results of the child patient
EBV-HLH是一种进展迅速、致死性高的疾病,在临床工作中,该病易被误诊,延误治疗时机。需要在临床工作中早期诊断,极早启动治疗方案,可极大提高成活率,改善预后。而且目前该病的发病机制尚不明确,需要进行更深入的研究以及多中心前瞻性大样本的临床对照试验,以达到早期诊断、有效治疗的目的,最终提高患儿生存率。
作者贡献:王江娅进行文章的构思与设计,撰写论文,进行论文的修订,负责文章的质量控制及审校,对文章整体负责,监督管理;孙萌、郑有宁进行文章的可行性分析,文献/资料收集;王江娅、孙萌、郑有宁进行文献/资料整理。
本文无利益冲突。
