我国丙型肝炎肝硬化患者DAA治疗现状及短期预后的研究
2020-04-16庄焱卢捷谢青林兰意
庄焱 卢捷 谢青 林兰意
目前,我国大约有1000万的慢性丙型肝炎患者,其中约20%最终会进展为肝硬化[1]。对于丙型肝炎肝硬化患者而言,既往标准的聚乙二醇干扰素联合利巴韦林(pegylated interferon with ribavirin, PR)方案治疗难度大、疗效差,不良反应多,失代偿期肝硬化更是PR治疗的禁区。直接抗病毒药物(direct acting antiviral agents,DAA)是一类小分子化合物,能直接作用HCV复制的重要环节,达到有效抑制病毒的作用。自2013年6月FDA批准索磷布韦(sofosbuvir,SOF)上市以来,抗HCV治疗全面进入无干扰素时代。大量DAA用于抗HCV的资料证明,以索磷布韦/维帕他韦(sofosbuvir/velpasvir,SOF/VEL)等不含蛋白酶抑制剂的全口服DAA方案在各级肝硬化,即使失代偿期肝硬化患者的持续病毒学应答(sustained virologic response,SVR)率也可达到90%以上[2-6]。2018年EASL HCV指南[7]中,DAA已被列入代偿及失代偿期肝硬化患者的一线治疗。
目前尚无DAA治疗中国丙型肝炎肝硬化患者的真实世界研究的报道。本研究通过收集丙型肝炎肝硬化患者的DAA治疗意愿、方案选择、疗效及短期预后的数据,分析DAA治疗与各因素之间的相关性,更好地帮助临床医生根据我国丙型肝炎肝硬化患者的疾病特点选择最合适的治疗方案。
资料与方法
一、一般资料
选取2015年1月1日至2019年11月30日上海交通大学附属瑞金医院感染科门诊就诊或住院治疗的丙型肝炎肝硬化患者161例,男性61例,女性100例,年龄34~84岁,平均(58.4±9.4)岁。12例患者至今仍未接受DAA治疗,其中代偿期9例,失代偿期3例,均纳入临床观察队列。其余149例患者已接受完整疗程的DAA治疗,其中代偿期122例,失代偿期27例。CHC诊断依据《丙型肝炎防治指南(2019年版)》[1]。入选标准:①年龄≥18岁;②经血清学检测确诊为丙型肝炎;③基线HCV RNA阳性;④自愿参加本次调查者签署知情同意书。排除标准:合并其他肝脏疾病(其他病毒性肝炎、酒精性肝病、自身免疫性肝病、肝豆状核变性等),合并肿瘤、合并HIV感染。肝硬化的诊断标准参考中华医学会肝病学分会2019年发布的《肝硬化的诊断标准》[8]。
二、随访分组及数据采集
收集患者治疗前后的临床资料和治疗数据,包括年龄、性别、病史和病毒基因型等;接受DAA治疗者以开始DAA治疗前为基线,未接受DAA治疗者以入组临床观察队列研究时间为基线。按HCV基因型、肝硬化代偿或失代偿期对患者进行分层,分析疗效的影响因素。所有完成DAA治疗的患者进入临床观察队列,主要终点事件(疾病进展)定义为新的肝失代偿事件、肝细胞癌、死亡或肝移植。以DAA治疗结束开始至2019年9月1日到11月30日间末次随访时间计算治疗后随访时间;2019年9月1日以后无随访记录者判为失访。
三、统计学方法

结 果
一、患者基线特征
患者的基线特征如性别、年龄、基因型、既往IFN治疗史以及是否接受DAA治疗的数据见表1。

表1 所有患者的基线临床特征
二、 DAA治疗方案及其疗效与安全性
149例DAA治疗者中HCV基因1b型87例,非1b型45例,17例基因型数据缺失。各组患者的基线特征、DAA治疗方案、疗效指标及治疗后随访时间见表2。结果发现,除基因1b型中女性的比例明显高于非1b型(73.56% 比48.89%,P<0.01)以外,其余基线特征包括年龄、基线肝硬化代偿/失代偿期两组差异均无统计学意义(均P>0.05)。不同基因型组的DAA治疗方案显著不同(P>0.05)。

表2 不同基因型患者的DAA方案分布及疗效比较
注: ASV:阿舒瑞韦;DCV:达卡他韦;EBR:艾尔巴韦;GZR:格拉瑞韦;3D:奥比他韦/帕立瑞韦/利托那韦+达塞布韦;G/P:格卡瑞韦/哌仑他韦;SOF:索磷布韦;RBV:利巴韦林;LDV:来迪帕韦;VEL:维帕他韦;PR:聚乙二醇干扰素联合利巴韦林;SVR:持续病毒学应答
146例患者治疗结束后随访12周,144例(98.6%)达到SVR12;142例患者治疗结束后随访24周,138例(95.8%)达到SVR24; 3例失访。SVR12率在基因型1b型与非1b型患者间差异无统计学意义(100% 比95.56%,P=0.118);而SVR24率在基因型1b型组中明显高于非1b型组,差异有统计学意义(100% 比90.47%,P=0.002)。
在DAA治疗安全性方面,除1例基线肝硬化失代偿期患者(基因型不详)在SOF/VEL(仿制品)治疗过程间发生了肝功能衰竭最终死亡以外,其余患者均未发生DAA相关的严重不良反应。
三、DAA治疗后短期预后的影响因素
完成DAA治疗的149例患者中,基线肝硬化代偿期120例,失代偿期26例, 3例失访。分析结果发现,基线代偿组与失代偿组的DAA方案分布(P=0.055)、SVR12率(99.17%比96.25%,P=0.325)和SVR24率(96.64%比92.0%,P=0.614)均差异无统计学意义。基线失代偿期患者DAA治疗后的随访时间(23.95±3.16)个月明显短于基线代偿期患者(30.96 ±1.24)个月(P<0.05)。
120例基线代偿期患者中11例发生了肝细胞癌(hepatocellular carcinoma, HCC),26例基线失代偿期患者中8例发生了HCC,1例在服药过程中发生了肝衰竭而死亡,2例死于治疗后肝病相关并发症。为进一步分析DAA治疗后短期预后的影响因素,按是否发生终点事件对患者进行分层,不同临床转归组患者的基线特征、疗效及治疗后随访数据见表3。结果显示,基线肝硬化失代偿期患者DAA治疗后发生肝病进展的比例明显高于基线代偿期患者(50%比13.75%,P<0.01)。性别、年龄、基因型1b型/非1b型、既往IFN治疗史、SVR12和SVR24,在不同临床转归组之间均差异无统计学意义(均P>0.05)。
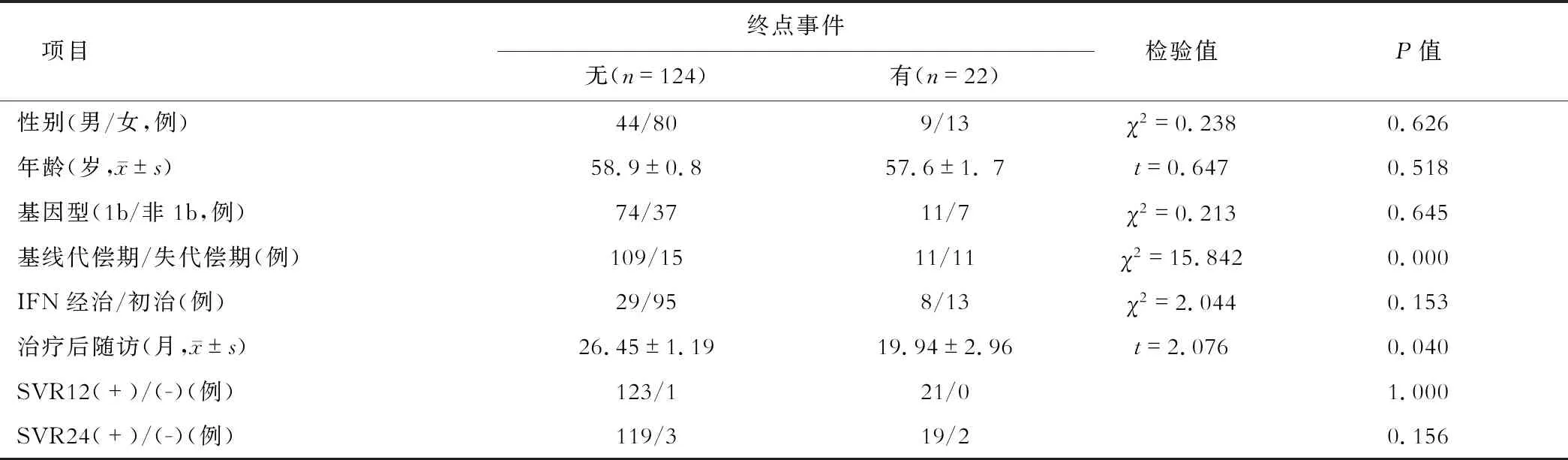
表3 DAA治疗后短期预后的危险因素
COX回归分析结果显示,基线肝硬化失代偿是DAA治疗后短期预后进展的唯一独立危险因素(HR6.765, 95%Cl:2.866~15.969,P<0.01)。
讨 论
资料显示,DAA治疗肝硬化患者的SVR12率及SVR24率与无肝硬化患者相似[9-13]。本研究结果发现,SVR12在基因型1b型与非1b型患者之间无差异,而SVR24在基因型1b型患者中略优于非1b型患者,提示DAA疗效可能与HCV基因型有关,与基线肝硬化状态无明显相关性;DAA联合治疗对各级肝硬化均具有同样良好的疗效。
而安全性方面,本研究中仅1例基线失代偿期患者在服用SOF/VEL(仿制品)期间发生了肝衰竭最终死亡,该事件尚不能确定是否与治疗药物有关,其余患者均未发生DAA相关的严重不良事件,与文献报道的结果一致[14]。总体而言,以SOF/VEL为主的无蛋白酶抑制剂方案对各级肝硬化患者的安全性均较好。
本研究中,尽管基线肝硬化状态与疗效无关,但肝硬化失代偿是DAA治疗后肝病进展的独立危险因素。在2019年美国肝病年会上一项前瞻性多中心研究中[15],1667例接受DAA治疗后达到SVR的患者随访22.5个月。结果发现,与临床疾病进展相关的3个独立危险因素分别为肝纤维化F3-F4、白蛋白<3.5 g/dL和门脉高压,提示仅无或轻度肝纤维化患者DAA治疗后获得SVR可显著降低慢性肝病相关新并发症的风险;反之,进展期肝纤维化患者,即使达到了SVR,短期预后仍无法改善。国内外也有类似研究证实了相同的结论[16-18],其原因可能与肝脏病变较严重,即使达到了HCV病毒学抑制,但肝脏生化学与组织学好转并不明显有关,由此发生HCC的风险也明显高于肝病进展程度较轻者。
本研究入组的患者中,有12例未开始DAA治疗,价格是目前影响中国CHC患者抗病毒治疗选择的关键[19, 20]。随着新一轮医保谈判的深入,以SOF/VEL为首的泛基因型DAA治疗方案的大幅降价,将有助于极大提高包含基因型1-6型的HCV肝硬化患者的治疗意愿。CHC重在早发现早治疗,对于符合抗病毒治疗适应症的患者,即使已进展至肝硬化失代偿期,也有治疗的需求,有条件者仍应尽快治疗。
