嵌合新抗原Adpgk的乙肝病毒核心抗原病毒样颗粒的构建及表达
2020-04-16赵振伯杨怡姝马洪涛盛望
赵振伯,杨怡姝,马洪涛,盛望
北京工业大学 生命科学与生物工程学院,北京 100124
据报道2018 年全球结肠癌新发病例超过109万例,死亡病例超过55 万例[1],结肠癌对人类健康的威胁不容忽视。目前,对于结肠癌的治疗手段仍局限于手术切除、放疗和化疗。近年来,免疫治疗尤其是以新抗原为靶点的免疫治疗在癌症治疗中备受关注[2]。Adpgk 是从MC-38 小鼠结肠癌模型中分离并鉴定得到的新抗原[3],其氨基酸序列由ASMTNRELM 突变为ASMTNMELM,可以被MHC-Ⅰ分子递呈。研究表明,靶向Adpgk 新抗原的癌症疫苗可以诱导特异性CD8+T 细胞,减缓MC-38 肿瘤细胞的生长[3-4]。病毒样颗粒(vi⁃rus-like particles,VLPs)是一类与重组抗原不同的亚单位疫苗,因其可自组装成高度有序的重复结构,模拟病原体的天然形态而具有较强的免疫原性[5-9]。乙肝病毒核心抗原(hepatitis B virus core antigen,HBcAg)VLPs 具有 30 nm 的粒径,容易富集至淋巴结,从而提高抗原提呈细胞的摄取效率;病毒样结构赋予其较高的免疫原性和稳定性;可以通过大肠杆菌、酵母等多种宿主进行量产从而降低生产成本[10-11]。研究表明,以HBcAg为载体构建的嵌合抗原表位的VLPs 能够在小鼠体内诱导出较强的肿瘤特异性的适应性免疫应答[9,12-13]。本研究中,我们将结肠癌新抗原Adpgk插入截短型HBcAg 78/79 位残基之间,构建可以融合表达Adpgk 的HBcAg VLPs,为结肠癌病毒样颗粒疫苗的临床前研究奠定基础。
1 材料与方法
1.1 材料
大肠杆菌感受态细胞 DH5α、BL21(DE3)购于擎科生物技术有限公司;截短型HBcAg cDNA与pET-22b(+)质粒由本实验室保存;Pfu高保真聚合酶、琼脂糖凝胶回收DNA 产物纯化与质粒快速小提试剂盒购于天根生化科技有限公司;限制性内切酶、T4DNA 连接酶购于 NEB 公司;Ni 琼脂糖凝胶购于康为世纪生物科技有限公司;100 kD超滤柱购于密理博公司;鼠源His 标签单抗购于北京中杉金桥生物技术有限公司;羊抗鼠荧光标记二抗购于KPL 公司。
1.2 融合基因扩增与重组表达载体构建
将结肠癌新抗原Adpgk 直接或通过RD 连接片段插入截短型HBcAg 78/79 位残基之间。采用重叠PCR 技术扩增这2 种Adpgk-HBcAg 融合基因(无 RD 序列与有 RD 序列)。有 RD 序列组的 4 条引物序列分别为 F1(5′-GGGAATTCCATATGGAC ATCGACCCGTACAAA-3′,下划线处为NdeⅠ酶切位 点)、R1(5′-GTCACGCATCAGTTCCATGTTGGT CATAGAAGCGTCTTCCAGGTTAG-3′,下划线处为重叠序列)、F2(5′-GCTTCTATGACCAACATGGAA CTGATGCGTGACCCGGCTTCTCGTGAACT-3′,下划线处为重叠序列)、R2(5′-CCGCTCGAGAACAAC GGTGGTTTCCGGCAG-3′,下划线处为XhoⅠ酶切位点)。无RD 序列组的4 条引物序列分别为F1(同上)、R1′(5′-CATCAGTTCCATGTTGGTCATAG AAGCGTCTTCCAGGTTAG-3′,下划线处为重叠序列)、F2′(5′-GCTTCTATGACCAACATGGAACTGA TGCCGGCTTCTCGTGAACT-3′,下划线处为重叠序列)、R2(同上)。以截短型HBcAg 基因为模板,通过2 轮PCR 扩增,分别得到无RD 序列与有RD 序列的嵌合Adpgk 的HBcAg 融合基因,1%琼脂糖凝胶电泳鉴定并对PCR 产物进行纯化。NdeⅠ与XhoⅠ双酶切后的2 种Adpgk-HBcAg 融合基因或pET-22b(+)载体片段经过纯化后,在 T4DNA 连接酶作用下于4℃过夜连接,连接产物转化大肠杆菌感受态细胞DH5α菌株,涂布于LB 平板(含Amp)并于37℃培养过夜,各挑取10 个单菌落于2 mL LB 培养基(含Amp)中37℃过夜振荡培养,次日将菌液送北京睿博兴科公司测序,测序结果比对正确的质粒保存于-20℃备用,2 种载体分别命名为Adpgk-HBcAg pET-22b(+)与 Adpgk-RDHBcAg pET-22b(+)。
1.3 嵌合VLPs的诱导表达
测序正确的2 种重组表达载体分别转化大肠杆菌感受态细胞BL21(DE3)后涂布于LB 平板(含Amp),37℃过夜培养;挑取单菌落至2 mL LB 液体培养基(含 Amp),37℃、180 r/min 振荡过夜培养作为种子液;次日,取种子液以1∶100 的比例接种至5 mL LB 液体培养基(含Amp,20 mmol/L 葡萄糖),37℃、200 r/min 振荡培养至菌液D600nm为 0.8~1.0(培养约 3.5 h);加入 1 mmol/L IPTG 于 30℃、180 r/min 诱导培养 5 h(阴性对照组:Adpgk-HBcAg 菌体未诱导,并于4℃保存5 h);13 000 r/min 离心 1 min 收集菌体,用等体积的 PBS 洗涤菌体 2 次,加入 800 μL PBS 重悬,冰浴条件下200 W、1 s/1 s 超声波破碎菌体2 min;13 000 r/min 离心15 min 后收集上清与沉淀,向沉淀中加入800 μL PBS,取适量上清和沉淀加入 10× SDS-PAGE 上样缓冲液煮沸 10 min,SDSPAGE 后考马斯亮蓝染色,观察目的蛋白的表达情况。
1.4 Western印迹
上一步所得未诱导菌体上清与表达Adpgk-RD-HBcAg 的菌体诱导上清,加入10× SDS-PAGE上样缓冲液煮沸10 min,SDS-PAGE 后转至PVDF膜,用 5% BSA 室温封闭1 h,TBST 润洗后加入一抗稀释液稀释的His 标签小鼠单抗,4℃孵育过夜,次日经 TBST 润洗 3 次后加入 1∶10 000 稀释的羊抗鼠荧光标记二抗,室温孵育2 h,TBST 润洗后采用Odyssey 双色红外荧光成像系统扫描分析目的蛋白的表达情况。
1.5 嵌合VLPs的大量表达、纯化与浓缩
取可成功表达目的蛋白Adpgk-RD-HBcAg 的大肠杆菌BL21 甘油菌至20 mL LB 液体培养基(含Amp),37℃、180 r/min 过夜培养,次日取种子液以1∶100 的比例接种至1 L LB 液体培养基(含Amp,20 mmol/L 葡萄糖),37℃、200 r/min 培养至菌液D600nm达 0.8~1.0(约 3.5 h),加入 1 mmol/L IPTG 于 30℃、180 r/min 诱导 5 h,6000 r/min 离心5 min 收集菌体至50 mL 离心管中,加入20 mL PBS 洗涤菌体2 次,加入20 mL PBS,冰浴下330 W、5 s/5 s 超声波破碎菌体10 min,13 000 r/min离心30 min,收集上清用于后续纯化。取4 mL混匀的Ni 琼脂糖凝胶组装重力亲和层析柱,加入10 倍柱体积的缓冲液(10 mmol/L PBS,20 mmol/L 咪唑)平衡层析柱,向层析柱中加入上一步收集的上清并重复过柱3 次以提高目的蛋白结合效率,加入20 倍柱体积的洗杂缓冲液(10 mmol/L PBS,40 mmol/L 咪唑)洗去杂蛋白,加入 5 倍柱体积的洗脱缓冲液(10 mmol/L PBS,500 mmol/L 咪唑)洗脱目的蛋白。洗脱后的目的蛋白用100 kD超滤柱重复浓缩5 次,将洗脱缓冲液置换为1×PBS 缓冲液,进行SDS-PAGE 分析,并将蛋白浓缩液分装保存于-80℃冰箱。
1.6 透射电镜成像
取适量嵌合病毒样颗粒浓缩液滴于200 目铜网碳支持膜上吸附1 min,吸去多余样品后用2%磷钨酸染色1 min,吸去染色液,在JEM-2100 透射电子显微镜下成像。
2 结果
2.1 融合基因的获得及重组表达载体的构建
图1 的泳道 1 和 2 分别是第 1 轮 PCR 扩增得到的Adpgk-HBcAg 融合基因上半段(5′段)及下半段(3′段),均为250 bp 左右,与预期相符;第 2 轮PCR 扩增产物(图1 泳道 5)大小约 500 bp,与预期的全长Adpgk-HBcAg 融合基因相符。类似的,泳道3 和4 分别是第1 轮PCR 得到的Adpgk-RDHBcAg 融合基因上半段(5′段)及下半段(3′段),均为 250 bp 左右,与预期相符;第 2 轮 PCR 扩增产物(图1 泳道6)大小约500 bp,与预期的全长Adpgk-RD-HBcAg 融合基因相符。PCR 产物纯化后经NdeⅠ/XhoⅠ双酶切,连接至pET-22b(+)载体,重组载体的酶切及测序鉴定结果与预期一致(结果未显示)。
2.2 2种嵌合VLPs的诱导表达

图1 重叠PCR 产物
经 IPTG 诱导后,Adpgk-HBcAg pET-22b(+)菌体裂解沉淀中相对分子质量15×103偏上位置处出现特征条带;在Adpgk-RD-HBcAg pET-22b(+)菌体裂解上清的同样位置出现了特征条带,而其沉淀中未出现该特征条带,说明RD 的引入增加了目的蛋白的水溶性。未诱导的菌体在该位置出现较浅的特征条带,应为本底表达。见图2。
2.3 Western印迹检测Adpgk-RD-HBcAg重组蛋白的表达
采用Western 印迹可在未诱导的菌体裂解上清中检测到相对分子质量大于15×103的蛋白条带(图3 泳道 1),与预期 Adpgk-RD-HBcAg 重组蛋白大小相符;经IPTG 诱导后,重组蛋白表达量明显升高(图3 泳道2)。
2.4 嵌合VLPs的诱导表达、纯化与浓缩

图2 融合蛋白的SDS-PAGE
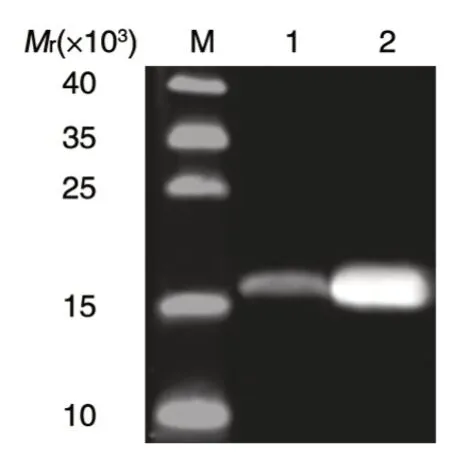
图3 Western 印迹检测Adpgk-RD-HBcAg 重组蛋白的表达
Adpgk-RD-HBcAg pET-22b(+)重组表达载体转入大肠杆菌BL21(DE3)感受态细胞,1 mmol/L IPTG、30℃诱导5 h,菌体超声波裂解、离心后,通过Ni+亲和层析柱纯化并超滤浓缩,取菌体裂解上清与蛋白浓缩样品进行SDS-PAGE 分析。图4 泳道1 为未经IPTG 诱导的菌体裂解、离心后的上清检测结果,条带致密是因菌体内杂蛋白所致,而在预估位置未出现明显条带,表明未经IPTG 诱导时目的蛋白表达量较低。泳道2 为经IPTG 诱导后的结果,由于蛋白未经纯化,所以条带依然非常致密,但在目的蛋白位置15×103偏上处可见一条明显的粗条带,表明IPTG 诱导表达的即为目的蛋白Adpgk-RD-HBcAg,且诱导表达量较高。泳道3 为诱导表达的目的蛋白经Ni+柱纯化与超滤后的结果,可见条带致密现象有明显改善,而且在预估位置有明显条带出现,说明蛋白诱导表达成功且纯化效果较好。但在泳道3 中也略微可见一些其他蛋白条带,这是因为在天然菌体中也会有一些Ni+亲和的蛋白。
2.5 VLPs粒径检测与透射电镜成像
取纯化浓缩后的蛋白样品做透射电镜成像。透射电镜下可见密集的大小均一、空心的球形病毒样颗粒结构(图5),直径在30 nm 左右。这一结果表明Adpgk-RD-HBcAg 通过大肠杆菌表达后,可自组装形成与天然病毒结构类似的嵌合病毒样颗粒。

图4 目的蛋白的亲和层析纯化及超滤浓缩

图5 透射电镜成像
3 讨论
由于肿瘤相关性抗原(tumor associated anti⁃gens,TAAs)在肿瘤细胞中过表达,并且这种过表达在同种癌症患者中具有相似性,所以传统上的癌症疫苗主要以TAAs 作为靶点进行设计[14]。但TAAs 在正常细胞中也有表达,因此,受中枢耐受与外周耐受的影响,靶向TAAs 疫苗的免疫效果较差,同时也有一定程度的不良反应[15-16]。随着测序技术与计算分析技术的飞速发展,新抗原概念的出现为癌症患者带来了福音。新抗原是一种肿瘤特异性抗原,由肿瘤细胞的基因突变产生,在正常细胞中无表达[17-18]。与自身性抗原不同,新抗原作为一种“非我”的抗原被机体免疫系统识别,进而激发免疫系统产生特异性、高效且安全的免疫应答[14]。很多研究表明,靶向新抗原的细胞毒性T 淋巴细胞(cytotoxic T lymphocytes,CTLs)是杀伤肿瘤细胞的主要T 细胞群体[19-22]。然而,正常情况下,可能由于新抗原在癌细胞中的表达水平较低或抗原提呈效率较低,病人体内靶向新抗原的特异性CTLs 数量很少[23-24]。因此,通过设计以新抗原为靶点的癌症疫苗来增强机体对新抗原的免疫应答是很有必要的。
VLPs 作为一种外源性抗原的载体,表现出其独特的优势。与野生病毒相似,高度重复有序的结构赋予了其较高的免疫原性,被抗原提呈细胞(尤其是树突细胞)摄取加工后,其表位通过交叉提呈机制提呈至树突细胞表面,进而诱导产生强烈的细胞免疫应答[25-27]。因此,通过基因融合,嵌合表达外源蛋白(或多肽)的VLPs 作为一种纳米颗粒形式的疫苗具有较好的应用前景。外源性多肽和VLPs 的物理性质如电荷、等电点与疏水性都会对嵌合VLPs 的组装与稳定性产生较大影响。Abidin 等发现,在多瘤病毒衣壳蛋白VP1 中插入疏水性表位后,在原核表达过程中会形成难溶性聚集体,并在插入位点侧翼各引入2 个天冬氨酸提高了溶解度,消除了聚集现象[28]。另一项研究中,Bendahmane 等发现烟草花叶病毒的衣壳蛋白对插入的短肽序列特别敏感,衣壳蛋白正电荷的增多与等电点的升高会导致VLPs 组装受抑制与功能受损[29]。
本研究中,我们在截短的HBcAg 免疫优势区插入结肠癌新抗原Adpgk 后,用大肠杆菌诱导表达时出现了聚集现象。但在Adpgk 的C′端加入1个精氨酸与1 个天冬氨酸后可以解决该聚集问题,并通过亲和层析与超滤浓缩制备出了可溶性嵌合VLPs。有趣的是,我们还尝试在插入位点C′端加入10 个精氨酸,虽然同样为可溶性表达,但在纯化过程中发现目的蛋白与亲和层析柱的结合率为0(结果未展示)。我们推测可能由于嵌合VLPs 表面丰富的正电荷导致其吸附了大量宿主蛋白与核酸,从而包埋了组氨酸标签。因此插入外源序列后,应尽量不改变原有VLPs 的电荷、等电点与疏水性。在重组表达载体诱导过程中发现,未加入IPTG 诱导的菌体有少量的本底表达,可能由于LB 培养基中存在的乳糖被细菌摄取利用,生成的半乳糖启动了质粒的转录和翻译。大肠杆菌中存在一些与Ni+亲和层析柱亲和的杂蛋白,所以在保证目的蛋白浓度的情况下很难通过洗杂过程将杂蛋白完全除去,若想进一步提高目的蛋白纯度,可以在VLPs 超滤浓缩后追加分子筛,并且,这些杂蛋白理论上不会影响树突细胞对VLPs 的摄取与抗原提呈过程,即不会影响其免疫效果。另外,亲和层析与超滤法都是去除细菌内毒素的方法,所以理论上内毒素不会超标。为了验证嵌合Adpgk-RD-HBcAg VLPs 的免疫效果,我们之后会在C57BL/6 小鼠体内研究其对MC38结肠癌模型肿瘤细胞的杀伤效果。
