低强度恒定磁场对肿瘤细胞铁死亡的作用▲
2020-04-16胡金翠许建文胡榜利朱庭沛黄潇潇
胡金翠 许建文 胡榜利 朱庭沛 黄潇潇
(广西医科大学第一附属医院康复医学科,南宁市 530021)
肿瘤康复是康复医学新近发展起来的一个分支,日益受到重视。肿瘤康复在肿瘤疾病的急性期、亚急性期、门诊和家庭康复等多方面同步发展。磁疗作为一种理疗措施,已广泛应用于临床康复。有文献[1]报道磁场可以引起细胞铁代谢紊乱。铁死亡是一种细胞死亡方式,与凋亡不同,其是由细胞内铁依赖性的脂质过氧化物蓄积导致的,生化显示铁含量、脂质过氧化物-丙二醛(malonaldehyde,MDA)含量增加,谷胱甘肽(glutathione,GSH)含量降低,谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)的表达减少和活性降低[2]。铁死亡可被诱导剂Erastin诱导,被抑制剂Ferrostatin-1抑制。据报道[3]调控铁死亡可干扰肿瘤的病理进程,因此,本文研究低强度恒定磁场对肿瘤细胞铁死亡的作用,为肿瘤康复提供更多的思路。
1 材料和方法
1.1 细胞培养 培养对象:人直结肠癌细胞(HCT116,购于中国科学院上海生命科学研究院)。培养条件:细胞培养箱内,37℃,5%CO2。培养基:1640基础培养基(Gibco公司)加10%胎牛血清,加1%青霉素-链霉素溶液。
1.2 药品与试剂 磁铁长5.0 cm,宽2.5 cm,高0.5 cm。磁场强度测试仪(特斯拉计,购自泰仕电子工业股份有限公司)测得磁场强度0.5 μT。脂质过氧化物产物丙二醛(MDA)试剂盒购自Sigma公司,谷胱甘肽(GSH)试剂盒购自Solarbio公司,谷胱甘肽过氧化物酶(GPX)试剂盒购自雷根生物公司,铁检测试剂盒(亚铁嗪微板法)购自北京百奥莱博科技有限公司,BCA蛋白浓度测定试剂盒购自Boster Bio,Erastin购自Selleck公司,Ferrostatin-1购自TargetMol公司。
1.3 细胞铁死亡指标及检测方法 铁死亡检测指标:细胞内GSH含量、GPX活性、铁含量、脂质过氧化物产物MDA含量。检测具体步骤参照试剂公司提供的说明书,并探索优化试剂用量。
1.4 药品配制方法
1.4.1 Erastin配制方法 50 mg Erastin粉末加9.14 mL二甲基亚砜制成浓度10 mmol/L试剂,取1 mL(10 mmol/L)试剂加9 mL双蒸水制成浓度1 mmol/L试剂,取1 mL(1 mmol/L)试剂加9 mL双蒸水制成浓度100 μmol/L试剂,再取400 μL(100 μmol/L)试剂加1 600 μL培养基制成20 μmol/L终浓度试剂。
1.4.2 Ferrostatin-1配制方法 10 mg Ferrostatin-1粉末加38.117 mL双蒸水制成浓度1 mmol/L试剂,取5 μL(1 mmol/L)试剂加入49.995 mL Erastin终浓度试剂制成0.1 μmol/L Ferrostatin-1终浓度试剂。
1.5 建立细胞模型 设置4个组:空白对照组、Erastin组、Erastin+磁场组、抑制剂组。将细胞接种于6孔板中,细胞长到50%融合度时,空白对照组正常培养,Erastin组换成配制好的Erastin试剂,抑制剂组换成配置好的Ferrostatin-1试剂,Erastin+磁场组换成配制好的Erastin试剂并在该组孔板的上下面放置磁铁。继续培养48 h后,终止培养检查各项指标。
1.6 划痕实验 预先在6孔板背面,每个孔用黑色笔画3条横线,每个孔接种106个细胞,培养细胞长到100%时,用10 μL的无菌枪头在每个孔里画3条竖线,与预先画好的3条横线垂直,磷酸缓冲盐溶液洗3次,洗掉脱落的细胞,换2 mL无血清培养基,显微镜下观察,找到横线与竖线交叉点拍照记录,给予不同的干预,48 h后在相同的地方拍照记录。划痕修复率(%)=(0 h划痕距离-48 h划痕距离)/0 h划痕距离×100%。
1.7 统计学方法 采用SPSS 17.0统计学软件进行数据分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 肿瘤细胞生化指标比较 Erastin组、Erastin+磁场组的铁含量高于空白对照组,且Erastin+磁场组高于Erastin组,差异均有统计学意义(均P<0.05),而抑制剂组的铁含量与空白对照组比较差异无统计学意义(P>0.05);Erastin组、Erastin+磁场组、抑制剂组的MDA含量均高于空白对照组,且Erastin+磁场组高于Erastin组,差异均有统计学意义(均P<0.05);Erastin组、Erastin+磁场组、抑制剂组的GSH含量、GPX活性均低于空白对照组,且Erastin+磁场组低于Erastin组,差异均有统计学意义(均P<0.05)。见表1。
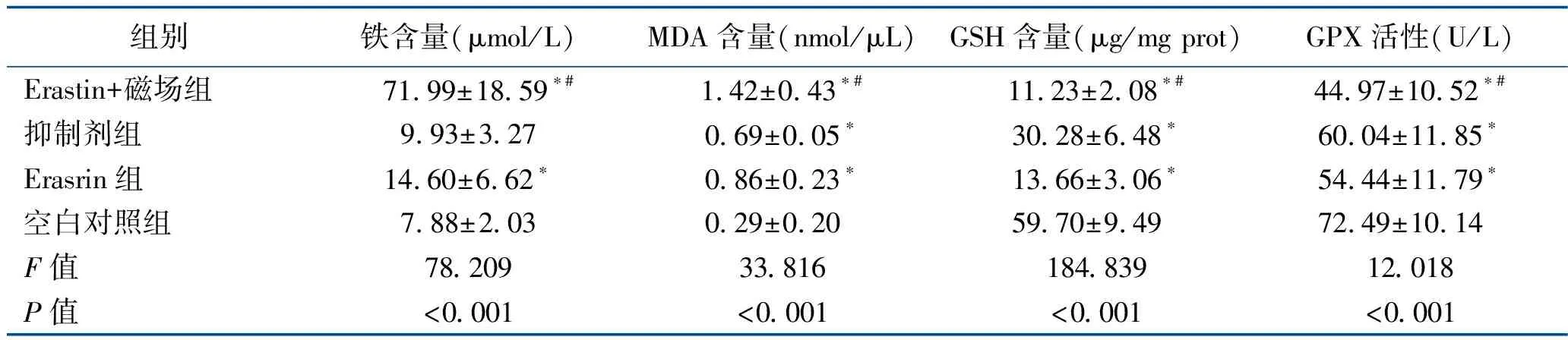
表1 各组肿瘤细胞中生化指标比较 (x±s)
注:与空白组比较,*P<0.05;与Erasrin组比较,#P<0.05。空白对照组、Erastrin组、抑制剂组、Erastin+磁场组的铁含量样本量(n=4、9、13、8),MDA含量(n=11、15、7、16),GSH含量(n=11、14、9、14),GPX含量(n=9、14、7、15)。
2.2 细胞迁移能力的比较 Erastin+磁场组、Erasrin组的划痕修复率低于空白对照组,且Erastin+磁场组低于Erasrin组,差异有统计学意义(均P<0.05);而抑制剂组与空白对照组比较差异无统计学意义(P>0.05)。见表2。
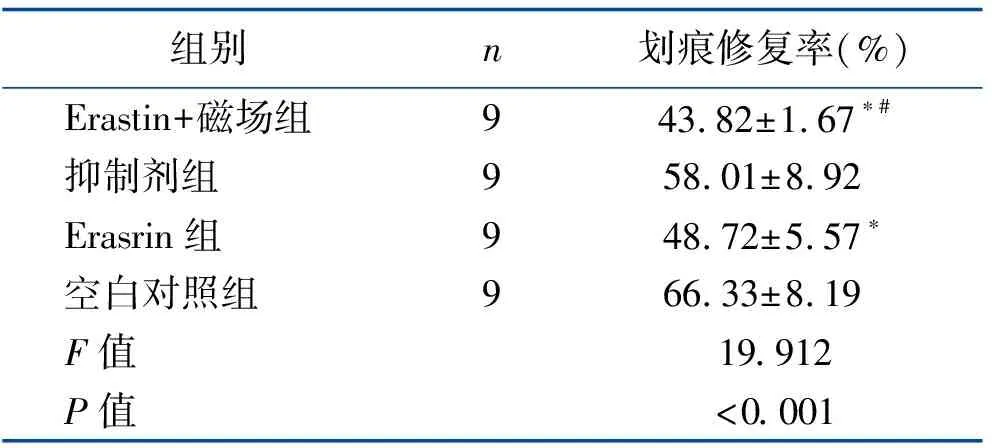
表2 各组细胞划痕修复率比较 (x±s)
注:与空白组比较,*P<0.05;与Erasrin组比较,#P<0.05。
3 讨 论
国内外已有许多关于磁场抑制和治疗肿瘤的研究,并取得了很大进展[4-9]。Sabo等[4]将HL-60癌细胞置于磁场72 h后发现癌细胞的生长受到了抑制。Omote等[5]发现脉冲磁场对癌细胞KDH-8和KMT-17有抑制作用。Tofani等[6]将带有LLC或B16癌细胞的白鼠注射顺铂和环磷酰胺,再将他们置于磁场中,结果表明,使用磁场与这两种药物结合治疗几乎没有毒副作用。磁场通过抑制肿瘤组织供血和代谢、抑制DNA复制、诱导肿瘤细胞凋亡、增强免疫细胞活性、抑制肿瘤的选择性、抑制肿瘤异形增长,从而发挥抗肿瘤作用[7-9]。
研究显示通过诱导肿瘤细胞铁死亡来杀死肿瘤细胞,能抑制肿瘤的生长[10]。Erastin、索拉非尼、柳氮磺胺吡啶等是铁死亡的诱导剂[11-13]。除此之外,Erastin可以提高顺铂、阿糖胞苷和阿霉素等在特定肿瘤上的化疗作用[14-16]。Ferrostatin-1是铁死亡抑制剂,能阻断铁死亡通路。本研究发现,Erastin组与空白对照组相比,肿瘤细胞迁移能力降低,铁含量、脂质过氧化物-MDA增加,GSH含量减少和GPX酶活性降低,而这种趋势在加入抑制剂后部分逆转了,说明上述指标的变化是因Erastin激活铁死亡通路引起,而Ferrostatin-1阻断了铁死亡通路。Erastin+磁场组与Erastin组相比,肿瘤细胞迁移能力降低,铁含量、脂质过氧化物-MDA增加,GSH含量减少和GPX酶活性降低,尤其是铁含量升高非常显著。研究表明,使用铁螯合剂可以抑制Erastin诱导的铁死亡,而补充外源性的铁可以增加Erastin诱导的铁死亡[17]。磁场干预后细胞内铁含量明显增加,提示磁场增强Erastin诱导细胞铁死亡的机制可能是磁场引起细胞内铁离子与铁蛋白代谢紊乱,铁离子储存能力降低,铁超载加重细胞发生脂质过氧化,进而引起细胞铁死亡。
本研究表明Erastin可诱导细胞铁死亡,低强度恒定磁场可以增强Erastin诱导的肿瘤细胞的铁死亡作用,但没有研究低强度恒定磁场影响细胞铁死亡的机制,低强度恒定磁场是否通过其他因素影响铁死亡还需进一步研究。
