玉米矮秆突变体K125d的遗传鉴定
2020-04-16石海春李开兵余学杰袁继超曲比伍合柯永培
石海春,陈 立,李开兵,余学杰,袁继超,曲比伍合,柯永培
(1.四川农业大学 农学院, 四川 温江 611130; 2.四川农大正红生物技术有限责任公司, 四川 双流 610213;3.雅安市科学技术和知识产权局, 四川 雅安 625000;4.毕节市农业农村局,贵州 毕节 551700)
矮秆紧凑型玉米具有抗倒伏、耐密和适宜机械化生产等特点[1-4],但目前可供利用的玉米矮秆基因资源比较单一,遗传基础狭窄,主要集中在br2[5-7]。进一步发掘新的玉米矮秆资源、加强矮化基因的鉴定与利用,为矮秆、紧凑、耐密优良玉米杂交种的选育提供物质和技术储备,对玉米矮化育种具有十分重要的意义[8-13]。根据MaizeGDB数据库资料,控制玉米株高的有近250个QTLs,分布在10 条染色体上;已报道玉米矮秆单基因如br、br-2、bv和D8等60多个,大部分为隐性基因,但基因D8、D9、D(t)[14]、D*-10[15]、D11[16]等为显性单基因,基因br-2[17]、an1[18]、D8[19]、D9[20]、d3[21]和D(t)[22]等已成功克隆。本研究以矮秆突变体K125d为主要研究材料,从主要性状表现、矮秆性状的遗传模式、控制该矮秆性状的基因定位与克隆等方面,进行系统的遗传评价,以期明确该突变体在玉米矮化育种方向的应用价值,为其应用研究提供参考依据。
1 材料和方法
1.1 供试材料
矮秆突变体K125d(P1),7个测验种(P2),以及构建的正反交F1、B1、B2和F2共6个世代群体。7个测验种名称及主要特征为,K211(K125d同源高秆)、K123d和626(矮秆)、K365和K363(中秆)、K305和K236(高秆)。以上材料均由四川农大正红生物技术有限责任公司(以下简称公司)提供。
1.2 试验设计
1.2.1 K125d与K211形态差异比较 在公司四川双流育种基地种植K125d和K211,选取有代表性的30个单株考察株高等主要农艺性状;成熟时,在各材料小区中间收获有代表性的30个果穗晒干,于室内考查主要经济性状;对植株进行拍照对比。
1.2.2 K125d矮秆性状遗传模式分析 试验在四川双流和雅安2个生态点进行。其中,每个点种植P1和P2群体各36株,正反交F1群体各84株;将籽粒最多的B1和B2果穗平均分成2份,在2个点全播;F2群体每试验点均播种336粒。对分离群体进行株高鉴定,用χ2检验株高分离比例适合性,确定其遗传模式。
1.2.3 K125d矮化基因定位 定位群体为(K236×K125d)F2,在公司四川双流育种基地播种1 400粒,为扩大定位群体规模,将上述用于遗传模式分析的群体也用于定位使用。单株编号挂牌,分别判定高、矮株类型并登记。采用集团分离分析法(Bulked segregation analysis,BSA)[23]进行基因定位,在定位群体中各选取10株极高和极矮单株提取DNA并等量混合,构建高秆和矮秆基因池。选取由上海生工生物工程股份有限公司合成的458对SSR引物(查自Maize Genetics and Genomics Database,http://www.maizegdb.org),用于亲本K236和K125d间的多态性引物筛选;然后在高秆和矮秆基因池间,进一步筛选多态性标记,筛选出可能与矮秆连锁的分子标记;再用定位群体中的典型高秆和典型矮秆植株各10株进行验证;最后用定位群体中的255个矮秆单株进行扩增。用2×CTAB法提取DNA并纯化,PCR反应体系用25 μL,PCR扩增产物用3% 琼脂糖凝胶进行电泳,用凝胶成像系统成像后观察统计带型,用MAPMAKER 3.0软件进行连锁分析,用MAPDraw V2.1[24]绘制遗传连锁图谱。
2 结果与分析
2.1 K125d与K211主要性状比较
K125d与K211的植株对比见图1,可见K125d植株叶片密集重叠,节间短、株高和穗位高较矮。考种结果表明,它们的果穗均为筒型、白轴、籽粒半马齿型,K211籽粒黄色,K125d籽粒白色。将它们主要农艺和经济性状比较结果列于表1,可见,与K211相比,K125d生育期极显著变长;株高、穗位高和叶夹角分别降低53.07%,71.46%和21.81%,均达极显著水平;但叶片数和叶宽均极显著增加,其增加比例分别为22.75%和15.15%,其余农艺性状差异不显著;就主要经济性状来看,K125d虽然穗长、穗粗和穗行数差异不显著,但行粒数和百粒质量却显著或极显著降低,造成单株产量极显著降低34.41%。

A.植株;B.茎秆;h.K211;d.K125d;标尺为10 cm。

表1 K125d与K211形态差异比较
注:±.标准误; 2 组处理数据后的英文字母不同,则表示这2 组处理间的数据差异显著,小写字母代表P=0.05水平差异显著;大写字母代表P=0.01水平差异显著。
Note:±.SE; If the English letters of the two groups were different,the difference between the two groups was significant difference, lowercase letters means significantly different atP=0.05;Capital letters means significantly different atP=0.01.
2.2 突变体K125d株高的遗传分析
2.2.1 F1正反交群体株高表现 将K125d配制的7个F1正反交群体株高表现列于表2。可见,所有正反交F1群体在2个试验点均表现为高秆,且正、反交群体平均株高无显著差异,说明K125d株高遗传表现无细胞质效应,即该矮秆性状可能由核基因调控。另外,除用测验种K211配制的组合K125d×K211外,测验种株高越高,其相应的F1群体株高也有增高趋势,即用高秆测验种配制的组合其平均株高高于中秆、中秆高于矮秆;雅安点F1株高比双流点有增高的趋势,表明F1株高由双亲遗传背景共同控制,并受生态环境影响。
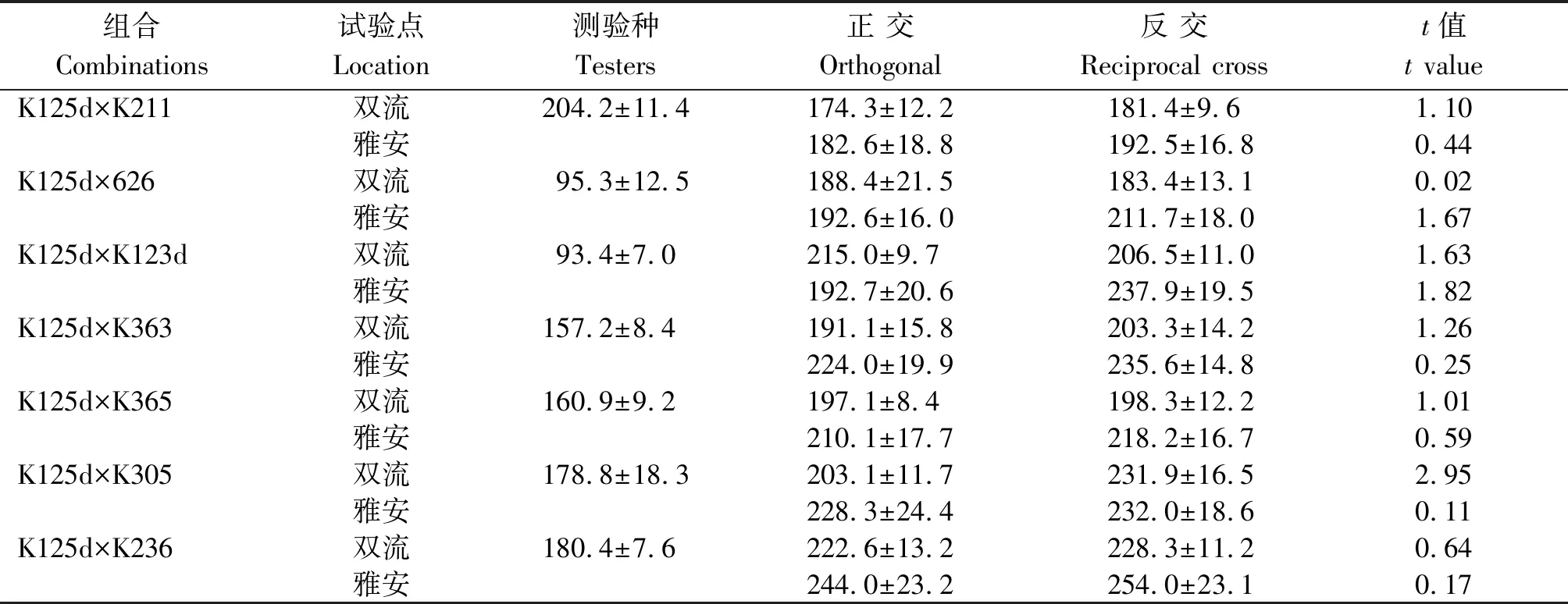
表2 正反交F1群体的株高表现
2.2.2 F2和回交群体的株高频次分析 将F2和回交群体的植株高度作分布频次分析,结果为用K125d回交的所有B1和F2群体的植株高度均表现为双峰分布;B2群体(用K123d回交的B2除外)均表现高秆,表明K125d矮秆性状由多基因控制的可能性不大。
2.2.3 回交群体的株高分离比例分析 将用K125d构建的7个B1回交群体和用K123d构建的B2回交群体的株高分离比例结果列于表3。可见,在四川双流和雅安,7个B1回交群体均出现高矮分离,分离比例符合1∶1;用626、K211、K236、K305、K363和K365等测验种构建的6个B2回交群体在2个生态点均表现为高秆,表明可能由1对隐性核基因控制K125d的矮秆性状。至于用K123d构建的B2回交群体出现高矮分离,分离比例符合1∶1,其原因可能是控制K125d和K123d矮秆性状的基因不等位。
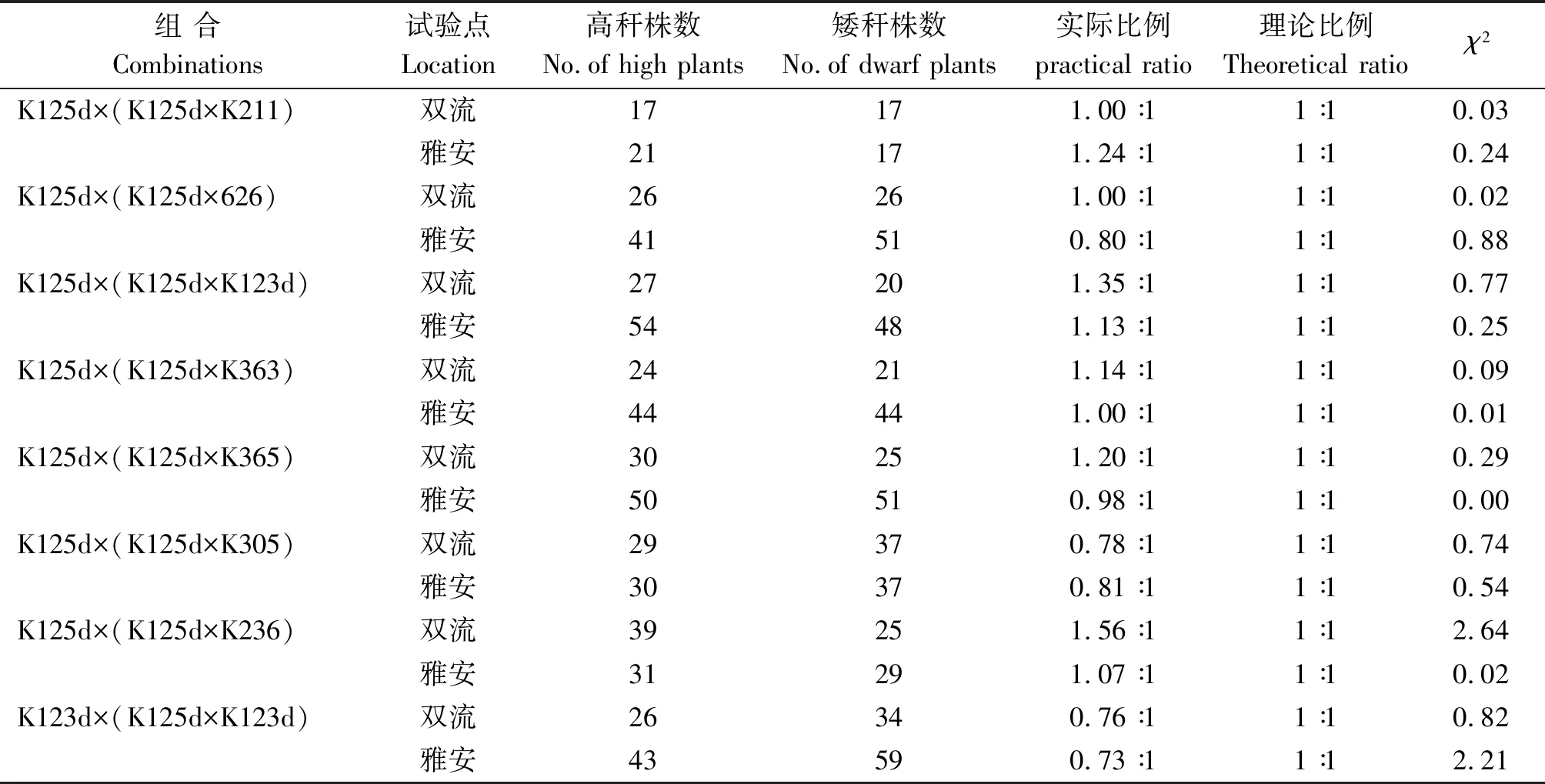
表3 回交群体的株高表现χ2检验
注:临界t值,χ20.05(1)=3.84,χ20.01(1)=6.63。表4同。
Note: The criticaltvalue,χ20.05(1)=3.84,χ20.01(1)=6.63.The same as Tab.4.
2.2.4 F2群体的株高分离比例分析 将用K125d构建的7个F2群体的株高分离结果列于表4。可见,所有F2群体在雅安和双流2个生态点株高分离规律表现一致,除(K125d×K123d)F2群体外,其余6个F2群体植株高矮分离符合3∶1,进一步表明由1对隐性核基因控制K125d的矮秆性状。而(K125d×K123d)F2群体植株高矮分离比例为9∶7,符合2对隐性单基因控制同一性状分离比例,表明控制K125d和K123d矮秆性状的隐性单基因不等位。
综合分析表明,K125d与7个不同株高自交系配制的F1正反交群体,在2个试验点均表现为高秆,其对应正、反交群体间的株高差异不明显,证明控制K125d矮秆性状的基因无胞质效应;除K123d外(br2类型)[11],与其余6个不同株高自交系配制的B1回交群体,高、矮秆分离比例为1∶1,B2回交群体全为高秆,F2群体高、矮秆分离比例为3∶1,充分证明K125d的矮秆性状受1对隐性核基因控制,暂命名为d125。用K125d和K123d构建的回交群体B1、B2及自交F2群体,其群体植株高矮分离,比例分别为1∶1、1∶1和9∶7,符合由2对互补隐性基因控制株高遗传表现的分离比例规律,表明基因d125与br2可能不等位。
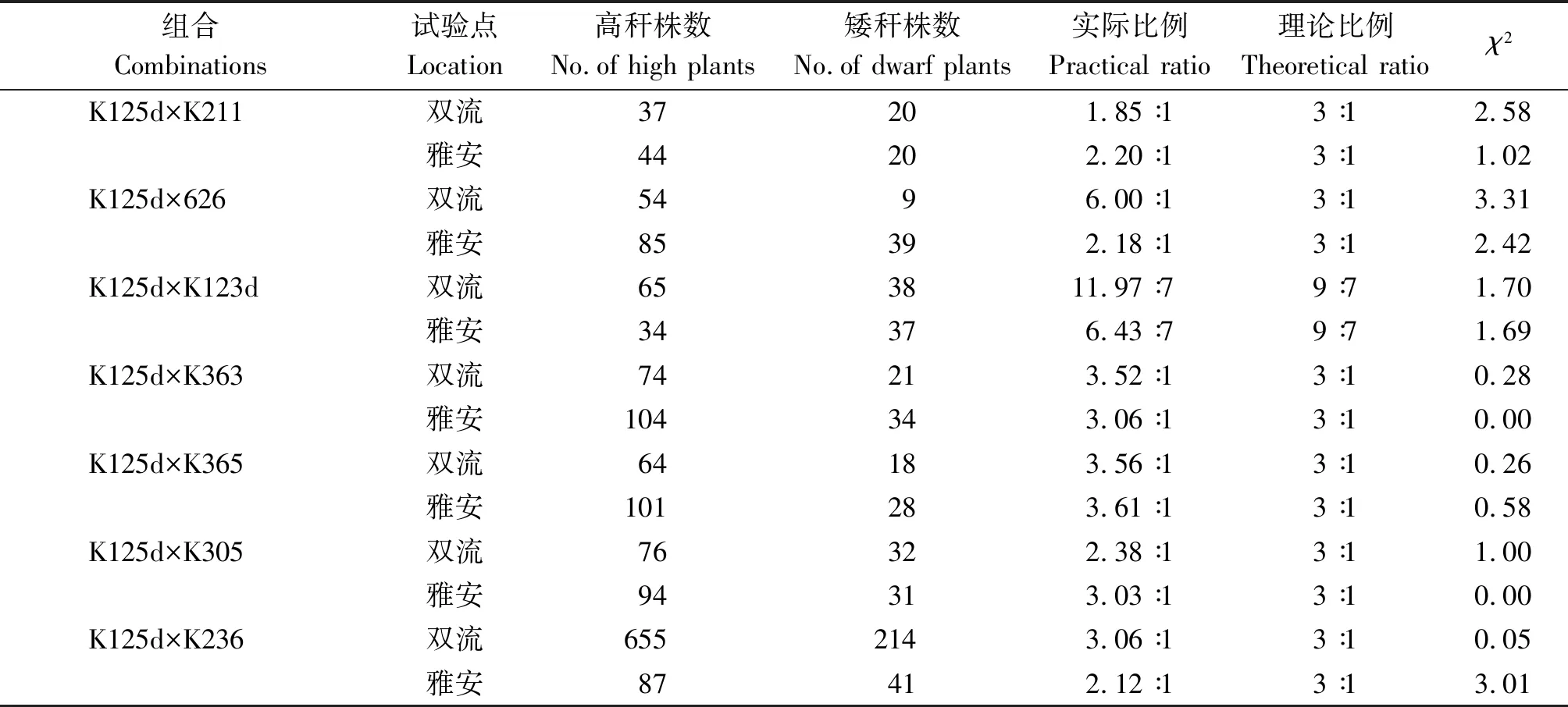
表4 F2群体株高表现的χ2检验
2.3 矮秆基因d125的定位
基因定位群体为(K125d×K236)F2,选取均匀覆盖10条玉米染色体上的SSR引物458对,筛选出在双亲间多态性较好的引物109对;进一步在高、矮秆基因池间对这109对引物进行多态性筛选,其中多态性表现较好的引物为umc2235。以引物umc2235分布的位置为参考,选择并合成位于玉米第一条染色体1.05~1.09位置区间的SSR引物153对继续进行多态性筛选,结果发现bnlg1619、umc1085、umc1278、umc1601、umc1689、umc1035、umc2560、umc2569和umc2387等9对引物在高、矮秆基因池间均表现出多态性,至此,共筛选出在高、矮基因池间具有多态性的SSR引物10对。
用上述10对SSR引物,对255个矮秆单株DNA,分别进行PCR扩增,用琼脂糖凝胶电泳检测扩增产物,用凝胶成像系统对电泳结果照相,统计10对引物对定位群体中所有矮秆单株DNA扩增带型。扩增结果连锁分析用作图软件MAPMAKER 3.0,将重组率转化为遗传距离用Kosambi函数转化,引物与矮秆基因d125的连锁关系用“Group”命令(LOD值大于3.0,重组率小于50%)判断,各标记间的图距用MAP命令计算,用MAPDraw V2.1 构建遗传连锁图谱。结果为,矮秆基因d125,初步定位于1号染色体上,介于umc2569和umc1278 2个SSR分子标记之间,其遗传距离分别为6.6,5.1 cM(图2)。
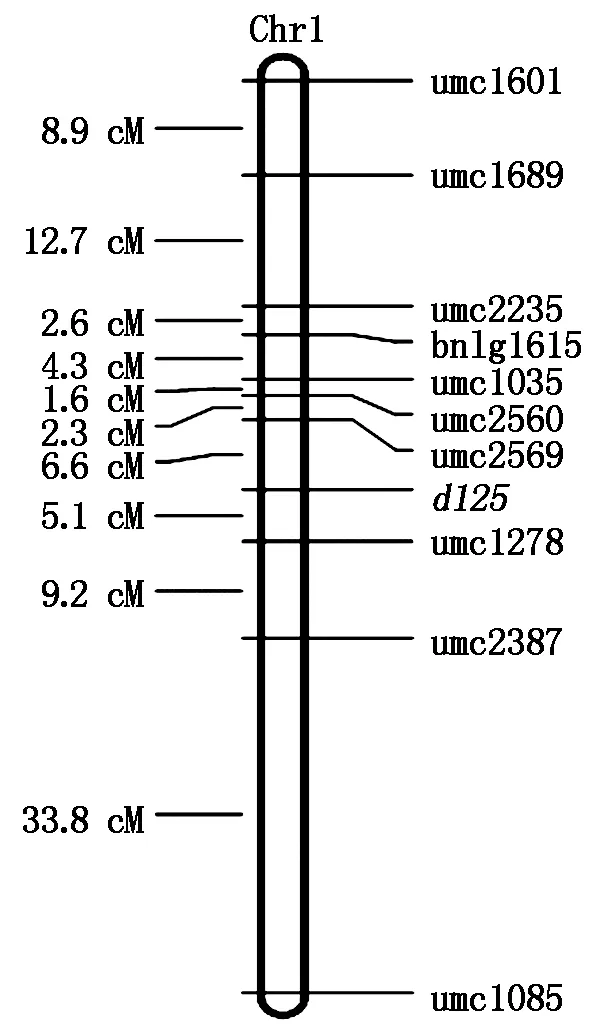
图2 矮秆基因d125的遗传连锁图谱
2.4 矮秆基因d125的克隆
根据定位结果,位于标记umc2569和umc1278附近的已知矮秆基因有5个,br2(bin 1.06)、br1(bin 1.07)、d*-N1352B(bin 1.06)、smp*-N706A(bin 1.06)和d*-N454A(bin 1.06),在MaizeGDB中搜索相关信息发现仅有br2关联有基因模型,因此以br2作为候选基因进行克隆。
根据br2基因模型GRMZM2G315375设计了8对重叠引物(图3-A),用于扩增br2的5个外显子区域。克隆结果如图3-B所示,可见引物d125-8从K125d中扩增产物比K211约小250 bp(图3-B中的箭头所示);对扩增产物的测序结果如图3-C所示,可见d125在第1 651个碱基处有一个9 bp片段的插入,在第6 438碱基处有一个232 bp片段的缺失。通过DNAMAN对编码序列进行翻译显示,d125插入的9个碱基编码谷氨酸(E)、天冬氨酸(D)和甘氨酸(G),该位置不在功能结构域内(图3-D中三角形所示);而缺失导致从第1 288个氨基酸后产生移码突变(如图3-D的箭头所示),该突变区域在SMART(http://smart.embl-heidelberg.de)的注释为与各种细胞活动有关的ATP酶,而在P-糖蛋白(P-glycoprotein,PGP)中为核酸结合域(Nucleotide binding domain,NBD),该功能域功能主要是为PGP转运提供能量。
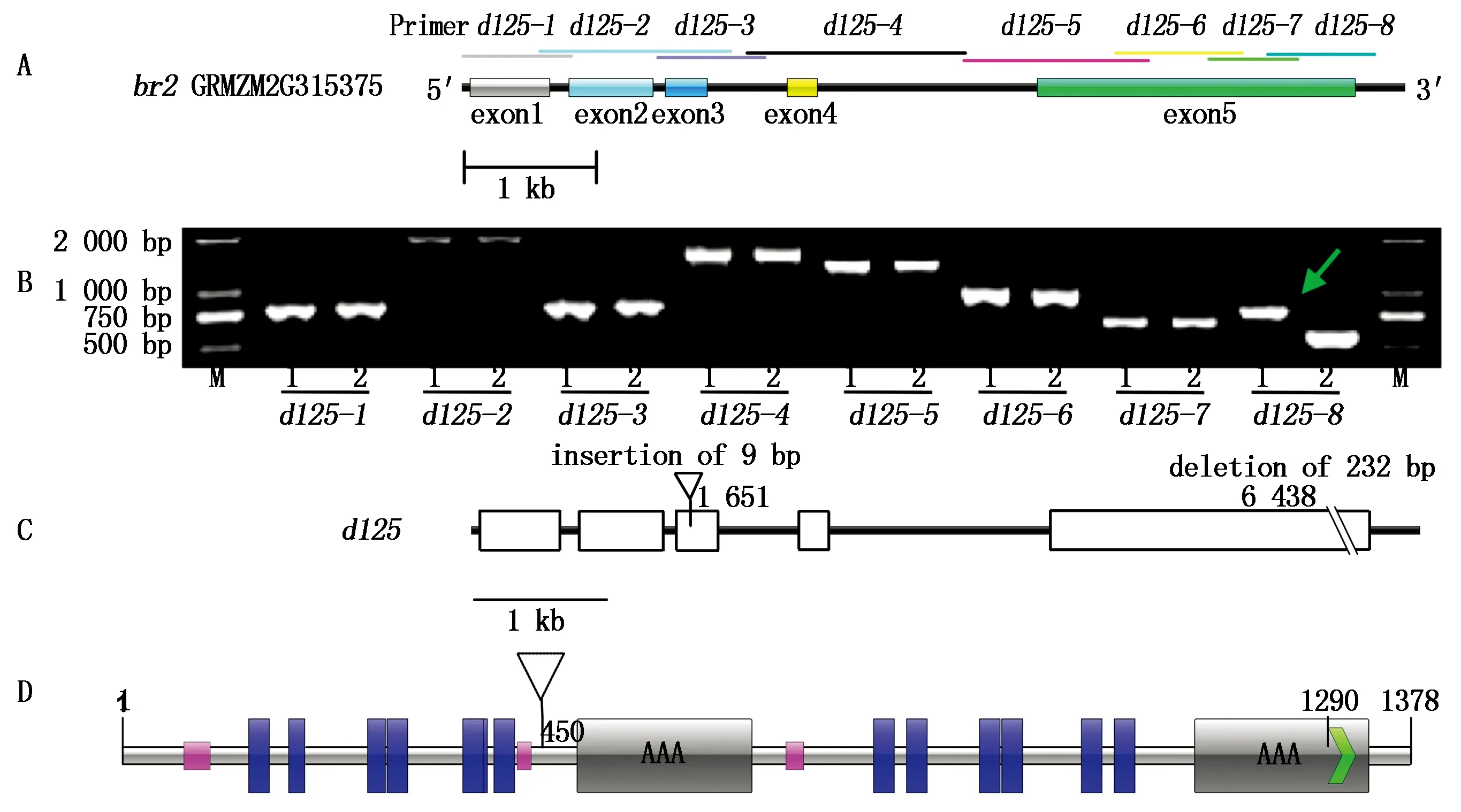
图3 矮秆基因d125克隆结果
3 讨论与结论
3.1 矮秆突变体K125d株高的遗传模式
玉米矮秆基因的遗传一般分为单基因和多基因2种遗传模式[25-26],针对一个新的矮秆资源,常用与其他自交系构建的F1、B1、B2和F2群体的株高分离表现情况,来分析判断其遗传模式,如张素梅等[14]于2007年就做过类似研究。本研究用矮秆突变体K125d与同源自交系K211以及2个矮秆、中秆和高秆自交系,构建的正反交F1,回交B1、B2和自交F2群体分析其遗传模式,结果为K125d矮秆性状受1对隐性核基因控制,命名为d125。
3.2 矮秆基因d125初步定位结果
MaizeGDB已收录矮秆基因60多个,定位在玉米1号染色体上的有11个。基因br2是发现较早且研究较多的玉米矮秆基因,该基因与生长素的合成相关,已被成功克隆[17]。笔者将矮秆基因d125初步定位在1号染色体umc2569和umc1278 SSR分子标记之间,其距离分别为6.6,5.1 cM,在染色体上的位置与矮秆基因br2(bin 1.06)和br1(bin 1.07)等相近。
3.3 矮秆基因d125序列及功能预测
br2是目前应用较多的玉米矮秆基因,编码1个PGP蛋白,由两部分组成,各部分均包含了6个假定的跨膜结构域和一个细胞内的ATP结合域,并具有各自的功能[27]。已克隆得到的br2等位基因中,br2-6、br2-7和br2-9均在外显子1有插入,br2-3在内含子4中有插入[17],br2-23在第6 667个碱基处有8 bp缺失[28],株高QTL-qph1中SNP5259(T)编码的氨基酸带点性质改变可能使蛋白与底物结合能力下降[29],高粱中与br2同源的dw3,其在外显子5上有一个882 bp单元的直接重复,使得该基因功能缺失[17],致使编码蛋白功能散失。d125在第6 438碱基处缺失232 bp,包含了br2-23中的缺失部分,缺失产生移码突变,这部分位于PGP蛋白和ABC转运蛋白中的NBD内。NBD的功能主要是为PGP转运提供充足的能量,而保守的结构域保证ATP结合与水解[30],2个Walker结构中任一个突变导致功能完全丧失[31],而D125蛋白中也具有这个保守结构。此外,NBD含有约215个氨基酸构成的核心区,核心区内的部分氨基酸是保守的,对整个蛋白质的功能具有极其重要的作用[32]。Walker B附近的小片段可能直接或间接地参与底物相互作用和NBD到跨膜域间的信号转导,是PGP蛋白中底物结合的主要位点[17]。d125在Walker B后移码,造成的功能位点缺失可能是导致转运功能丧失的主要原因。
