我国不同地区番茄主要病毒病种类的分子检测与分析
2020-04-16陈利达石延霞谢学文曹金强柴阿丽李宝聚
陈利达,石延霞,谢学文,曹金强,柴阿丽,李宝聚
(1.中国农业科学院 蔬菜花卉研究所,北京 100081;2.甘肃农业大学 园艺学院,甘肃 兰州 730070)
番茄(Solanumlycopersicum)作为世界范围内栽培最为普遍的蔬菜之一,不仅产量高、适应性广,且营养价值高。据联合国粮农组织(FAO)统计,2012年全球番茄总产量高达1.62亿t,产值超过550亿美元[1]。2015年经农业部市场与经济信息司发布的信息显示:我国番茄年产量达5 594万t,占全国蔬菜总产量的7.1%[2]。随着我国番茄种植面积日益扩大,番茄病毒病也逐渐加重,成为影响番茄产量和品质的重要因素,给农户造成巨大的经济损失。因此,明确我国不同地区番茄主要病毒种类,对于番茄病毒病的防控具有重要意义。
番茄病毒病在全球普遍存在,自1909年于美国番茄植株上发现烟草花叶病毒(Tobaccomosaicvirus,TMV)后,世界各地先后报道了主要病毒种类。目前,国际上已报道危害番茄病毒的种类有40余种[3],我国现已发现侵染番茄的病毒种类25种,包括黄瓜花叶病毒(Cucumbermosaicvirus,CMV)、马铃薯S病毒(PotatovirusS,PVS)[4]、番茄褪绿病毒(Tomatochlorosisvirus,ToCV)[5]、番茄斑萎病毒(Tomatospottedwiltvirus,TSWV)[6]、番茄花叶病毒(Tomatomosaicvirus,ToMV)[7]、烟草花叶病毒(Tobaccomosaicvirus,TMV)、马铃薯 X 病毒(PotatovirusX,PVX)、马铃薯 Y 病毒(PotatovirusY,PVY)、蚕豆萎蔫病毒(Broadbeanwiltvirus,BBWV)等RNA病毒和中国番木瓜曲叶病毒(PapayaleafcurlChinavirus,PaLCuCNV)[8]和番茄黄化曲叶病毒(Tomatoyellowleafcurlvirus,TYLCV)等DNA病毒。通常番茄病毒病受当地的环境、品种、栽培管理因素较大,因此,导致不同地区的番茄病毒病种类不同。王勇等[9]对天津5个区县的255份番茄样品进行鉴定,结果表明,CMV和TYLCV是天津地区病毒病的主要毒源之一;刘永光等[10]在山东省寿光地区进行番茄病毒病调查,发现ToCV的发病率高达20%~100%,造成减产10%~40%,成为该地区主要毒源。
我国是蔬菜生产与出口第一大国,设施和露地番茄栽培面积逐渐加大,若田间管理不当可增大病毒侵染机率,导致病毒病暴发,对其产量与品质具有重大影响。针对番茄病毒病危害不断加重,目前番茄病毒复合侵染情况的相关报道较少,缺少对我国不同地区番茄主要病毒种类进行系统研究的报道。因此,明确我国不同地区番茄病毒病种类主次关系,以及是否存在病毒复合侵染现象,为田间针对性地预警和防控提供理论依据。
1 材料和方法
试验于2015-2018年在中国农业科学院蔬菜花卉研究所菜病综防组完成。
1.1 试验材料
2015-2018年,在我国的北京、山东、四川、河南、天津、江苏、甘肃、辽宁、宁夏、西藏、贵州、河北、新疆、黑龙江、浙江、广西、山西、陕西、海南、内蒙古等地共采集花叶、斑驳、坏死、畸形等疑似病毒病感染的番茄样本431份,于-80 ℃冰箱中备用。
植物RNA提取试剂TRIzol(上海英潍捷基贸易有限公司)、TaqDNA 聚合酶;反转录试剂盒FastQuant RT Kit(北京天根生物科技有限公司);2×TaqMix(北京博迈德科技有限公司)。
1.2 供试引物信息
试验所使用番茄病毒引物共12种,引物信息见表1。其中特异性引物TYLCV-1/TYLCV-2和TSWV-1/TSWV-2根据外壳蛋白(Coat protein,CP)基因自行设计,其他引物引自文献。引物特异性检测供试菌株信息见表2。
1.3 植物总RNA提取及反转录
采用TRIzol法[19]将超低温冻结的番茄叶片迅速转移至用液氮预冷的研钵中研磨成粉末状,装入预冷的离心管(1.5 mL)。加入1 mL TRIzol试剂,充分振荡均匀,室温静止5 min;12 000 r/min离心10 min(恒温4 ℃);将上清液转入新的离心管(1.5 mL),加入总体积的1/5氯仿,混匀后室温静止5 min;12 000 r/min离心10 min(恒温4 ℃);取水相(约400 μL)加入等体积的异丙醇,温室内静止10 min;12 000 r/min离心10 min(恒温4 ℃);去上清液后加入1 mL 75%乙醇洗涤沉淀2次,12 000 r/min离心5 min(恒温4 ℃);室温自然晾干,使用RNase-Free ddH2O(50 μL)溶解,于-80 ℃冰箱保存。番茄样品总DNA提取参照TIANGEN公司植物基因组DNA提取系统说明进行,阴性对照为健康的番茄叶片。
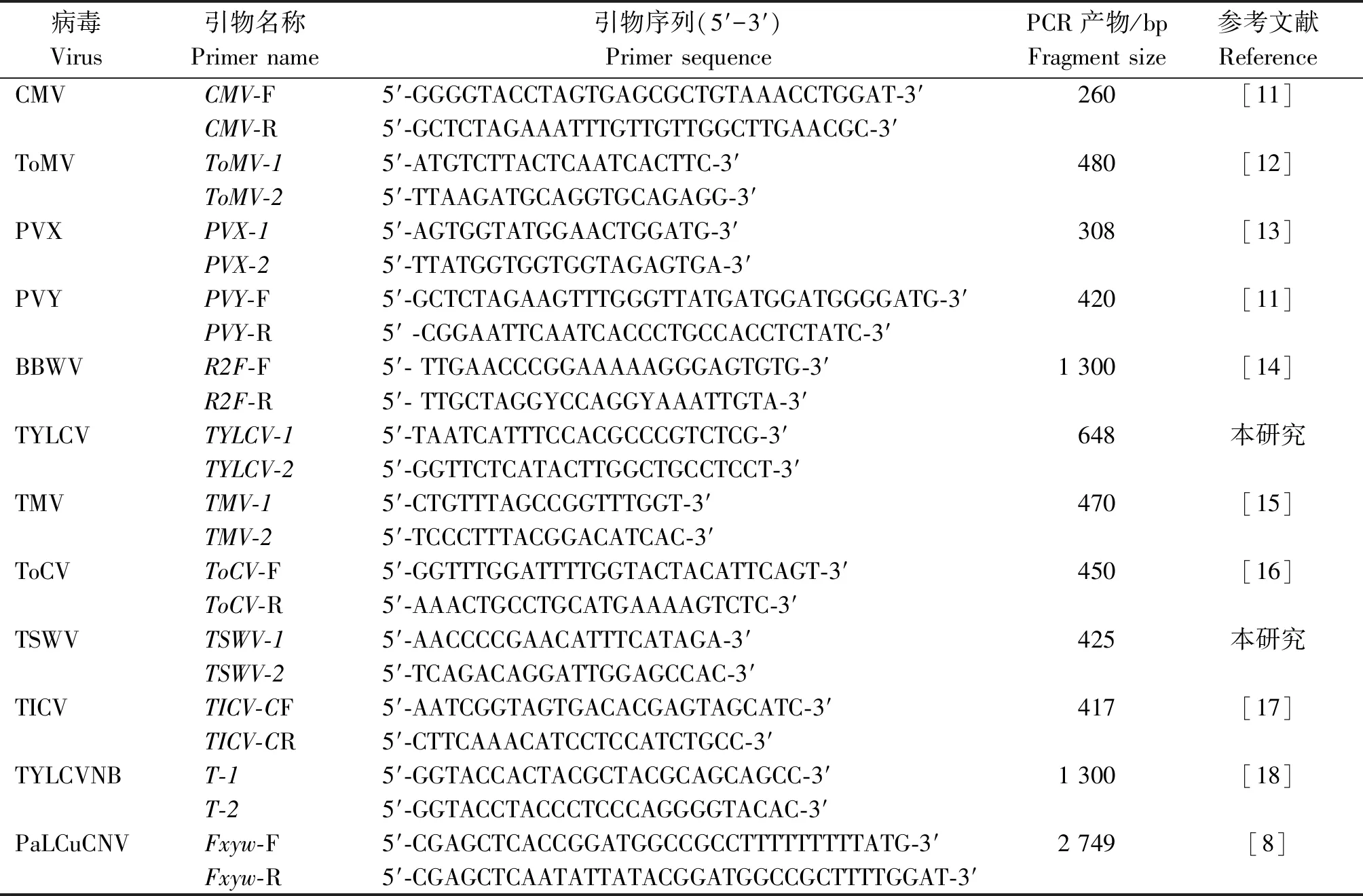
表1 番茄病毒病分子检测的引物信息
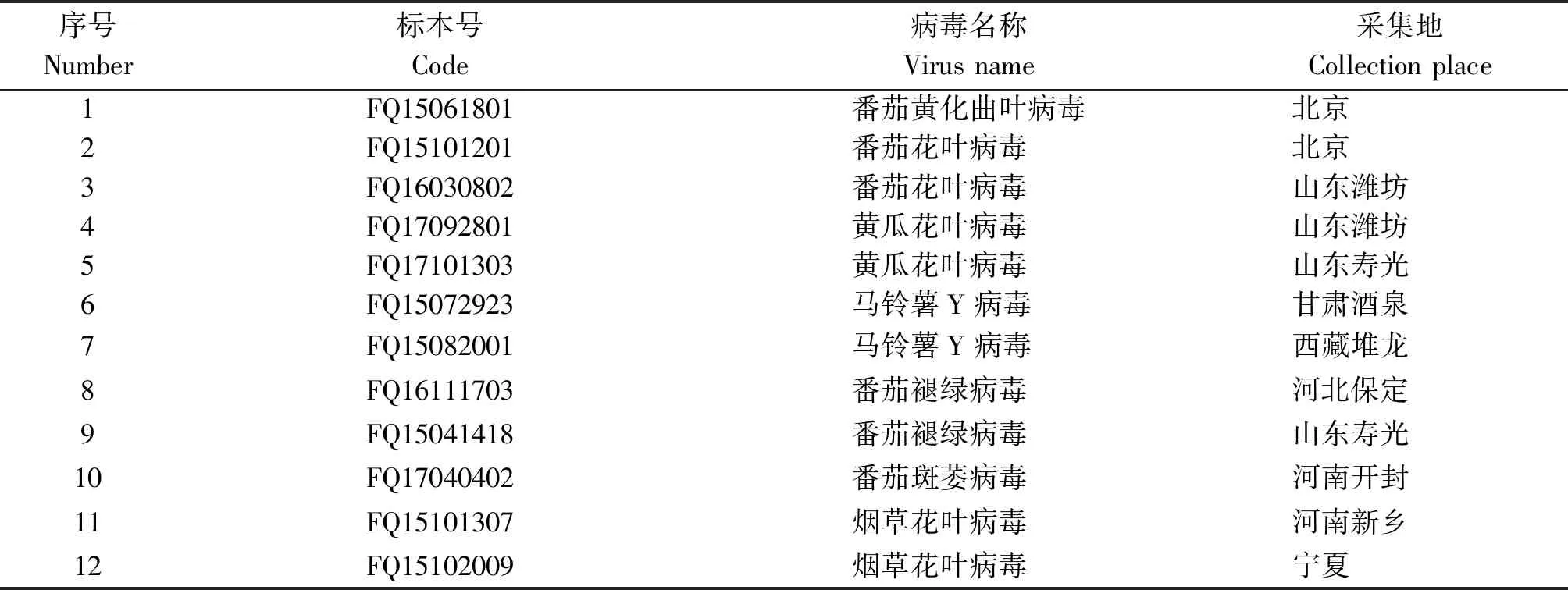
表2 供试病毒信息
注:以上病毒由中国农业科学院蔬菜花卉所提供。
Note: The above viruses are provided by the the Institute of Vegetable and Flowers, Chinese Academy Agricultural Sciences.
以番茄感病叶片总RNA为模板,使用反转录试剂盒合成病毒cDNA。反转录反应体系(10 μL):RNA模板2 μL,5×gDNA Buffer 2 μL,Rnase-Free H2O 6 μL,42 ℃变性3 min,立即放置冰上2 min,再加入以下试剂:10×Fast RT-Buffer 2 μL,Primer Mix 2 μL,RT-Enzyme Mix 1 μL,RNase-Free H2O 5 μL,总体积为20 μL。42 ℃保温15 min,再 95 ℃保温3 min,放置冰上进行保存。
1.4 番茄病样RT-PCR检测
以病样提取总RNA为模板,用反转录试剂盒FastQuant RT Kit合成病毒cDNA第1条链。使用文献已报道特异性引物CMV-F/CMV-R、ToMV-1/ToMV-2、PVX-1/PVX-2、PVY-F/PVY-R、TMV-1/TMV-2、ToCV-F/ToCV-R、R2F-F/R2F-R、TICV-CF/TICV-CR、T-1/T-2、Fxyw-F/Fxyw-R对不同样本模板进行RT-PCR扩增,该引物序列由北京博迈德科技有限公司合成,详细信息见表1。
PCR扩增体系:2×TaqPCR Master Mix 10 μL,引物各0.5 μL,cDNA模板1 μL,ddH2O 9 μL。PCR扩增条件:95 ℃预变性4 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共35个循环;72 ℃补充延伸10 min。扩增结束后,取5 μL PCR产物于1.5%琼脂糖凝胶电泳检测,使用全自动凝胶成像系统拍照并进行结果分析。此外,将配制的PCR产物(50 μL)送至博迈德科技(北京)有限公司进行基因测序;并利用NCBI在线分析服务器软件Blast(http://blast.ncbi.nlm.nih.gov/)程序进行核酸序列同源性比对,以此确定检测病毒种类。
1.5 病毒的测序及序列分析
从采集的番茄病毒样本中选用TYLCV和TSWV进行阳性克隆,送至博迈德科技(北京)有限公司测序,通过NCBI网站在线将测序结果与基因库已有的序列进行Blast比对,利用MEGA 5.0软件将反馈的序列与GenBank中已上传的代表性系列进行同源性比对,并使用邻接法(Neighbor-Joining,NJ)构建系统发育进化树。
2 结果与分析
2.1 引物特异性检测
利用所设计的引物TYLCV-1/TYLCV-2和TSWV-1/TSWV-2对12种不同的番茄病毒病进行普通PCR扩增,结果显示:只有番茄黄化曲叶病毒和番茄斑萎病毒特异性引物分别在648,425 bp处扩增出特异目的条带,其他菌株和阴性对照均无扩增产物(图1-A、B)。
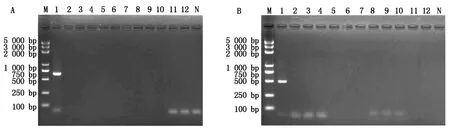
A: M.分子质量标准BM5000 DNA Marker; 1.番茄黄化曲叶病毒; 2-3.番茄花叶病毒; 4-5.黄瓜花叶病毒; 6-7.马铃薯Y病毒; 8-9. 番茄褪绿病毒; 10.番茄斑萎病毒; 11-12.烟草花叶病毒;N. 阴性对照。B: M.分子质量标准BM5000 DNA Marker; 1. 番茄斑萎病毒; 2-3.番茄花叶病毒; 4-5.黄瓜花叶病毒; 6-7.马铃薯Y病毒; 8-9. 番茄褪绿病毒; 10. 番茄黄化曲叶病毒; 11-12.烟草花叶病毒;N. 阴性对照。
A: M. Molecular weight BM5000 DNA Marker; 1.Tomatoyellowleafcurlvirus; 2-3.Tomatomosaicvirus; 4-5.Cucumbermosaicvirus; 6-7.PotatovirusY; 8-9.Tomatochlorosisvirus; 10.Tomatospottedwiltvirus; 11-12.Tobaccomosaicvirus;N.ddH2O. B: M. Molecular weight BM5000 DNA Marker; 1.Tomatospottedwiltvirus; 2-3.Tomatomosaicvirus; 4-5.Cucumbermosaicvirus; 6-7.PotatovirusY; 8-9.Tomatochlorosisvirus; 10.Tomatoyellowleafcurlvirus; 11-12.Tobaccomosaicvirus;N.ddH2O.
图1 TYLCV与TSWV引物特异性检测结果
Fig.1 The specificity of the selected primes to TYLCV or TSWV
对431份番茄病毒样本进行总RNA/DNA提取,并利用试验中特异性引物对其进行RT-PCR检测,结果显示(图2):待测番茄病毒样品中特异性引物TYLCV-1/TYLCV-2、TSWV-1/TSWV-2、ToCV-F/ToCV-R、ToMV-1/ToMV-2、CMV-F/CMV-R、TMV-1/TMV-2和PVY-F/PVY-R分别可扩增出大小648,425,450,480,260,470,420 bp的相应条带;而阴性对照未扩增;表明在待检样品中能分别测出TYLCV、TSWV、ToCV、ToMV、CMV、TMV和PVY,但未检测出其他病毒种类。
2.2 侵染我国不同地区番茄的主要病毒种类及检测结果
通过对431份番茄样品提取总RNA/DNA,利用不同特异性引物对其进行RT-PCR扩增,结果表明(表 3):检出的病毒种类共7种,分别为TYLCV、TSWV、ToCV、ToMV、CMV、TMV和PVY。其中,425份病样均检出病毒,有 6个样品未检测到病毒,病毒检出率高达 98.61%。
根据我国20个(省/自治区)地区的番茄病毒发生及危害程度(表3、图3-4),表明北京地区番茄病毒病发生最为严重,共检出7种病毒,与其他地区相比有显著差异(P<0. 05);其次是山东地区检测出5种病毒,未检出TSWV和PVY病毒,且TYLCV为北京和山东地区优势病毒种类;河南、甘肃和宁夏等地区检测到4种病毒,西藏、河北、浙江、陕西和海南地区检测到3种病毒,四川、天津、黑龙江、山西、内蒙古等检测到2种病毒,其他地区只检测到单一番茄病毒种类。
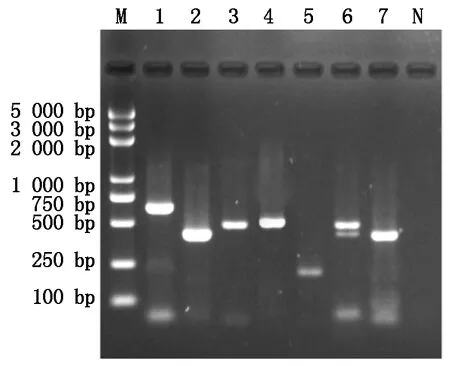
M.分子质量标准BM5000 DNA Marker; 1.番茄黄化曲叶病毒; 2. 番茄斑萎病毒; 3. 番茄褪绿病毒; 4. 番茄花叶病毒; 5. 黄瓜花叶病毒; 6. 烟草花叶病毒; 7. 马铃薯Y病毒;N. 阴性对照。
M. Molecular weight BM5000 DNA Marker; 1.Tomatoyellowleafcurlvirus; 2.Tomatospottedwiltvirus; 3.Tomatochlorosisvirus; 4.Tomatomosaicvirus; 5.Cucumbermosaicvirus; 6.Tobaccomosaicvirus; 7.PotatovirusY;N.ddH2O.
图2 我国番茄上检出的病毒电泳结果
Fig.2 Electrophoresis results of virus detectedon tomatoes in China
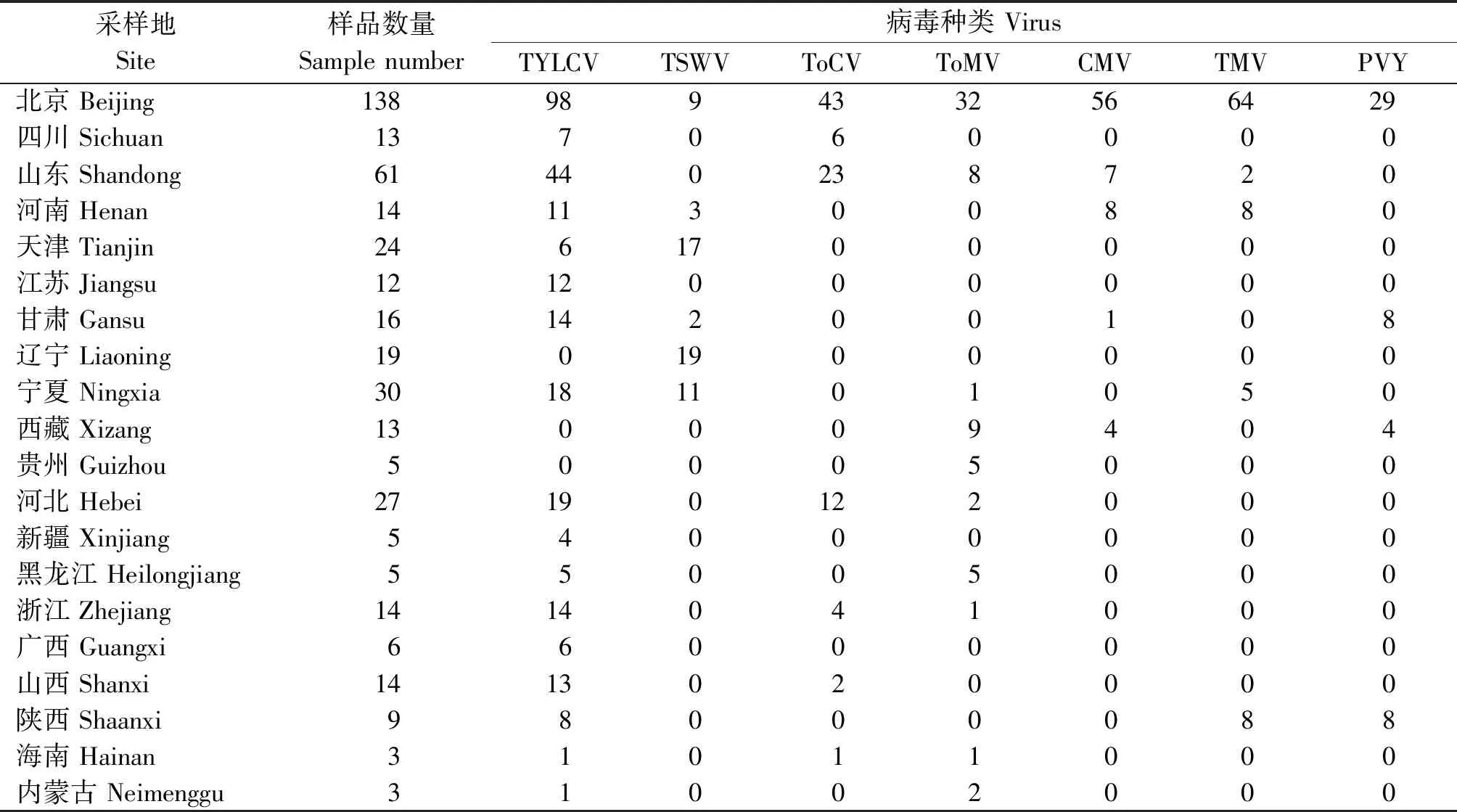
表3 我国番茄病毒病种类及分布
对番茄病毒种类整理并进行数据分析(图3),TYLCV的检出率最高,可达65.20%,与其他病毒种类相比有显著差异(P<0. 05),是危害我国番茄的主要病毒;其次为ToCV和TMV,检出率分别为 21.11%,20.19%;TSWV、ToMV、CMV和PVY总检出率略低,各种类间无差异显著性,分别为14.15%,15.31%,17.63%,11.37%。
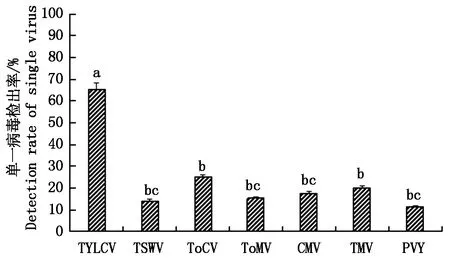
不同小写字母表示在 0.05 水平上差异显著(P<0.05)。图4同。
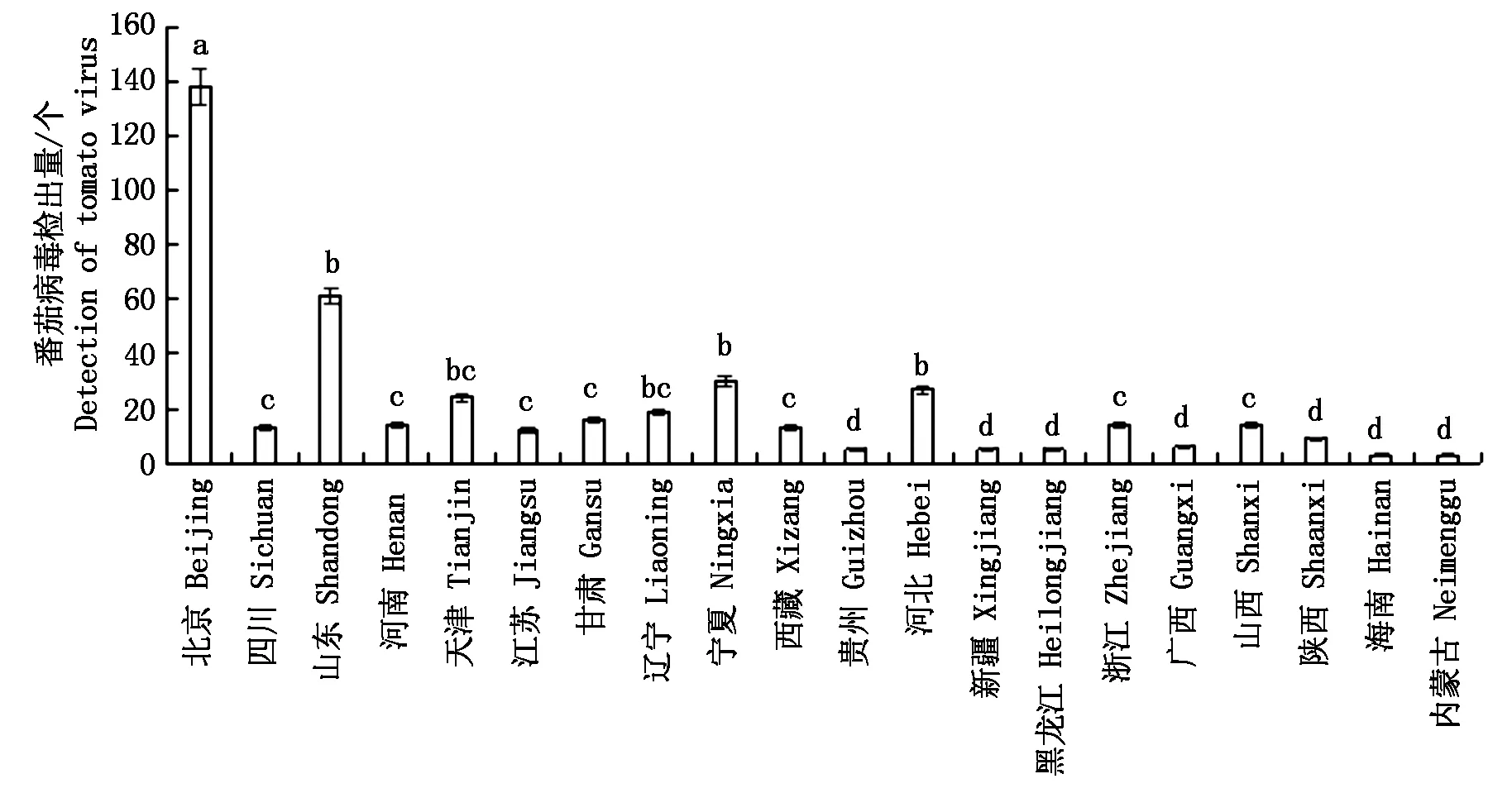
图4 我国不同地区番茄病毒病检出量
2.3 我国不同地区番茄病毒的复合侵染分析
在 431份阳性样品中(表4),发现 271 份番茄病样为单一病毒侵染,2种及2种以上病毒复合侵染样品为154份,占总量的 35.73%,其中 2种病毒复合侵染所占比例最高,检出率占复合侵染总比的 52.60%,且2种病毒复合侵染类型主要是TYLCV+TMV、TYLCV+CMV、TYLCV+ToCV、CMV+PVY、TYLCV+PVY和TYLCV+ToMV,而TYLCV+ToCV为复合侵染优势种;3种病毒复合侵染率为 27.92%,侵染类型为TYLCV+ToCV+CMV、TYLCV+TMV+PVY、TYLCV+PVY+CMV、TYLCV+CMV+TMV及CMV+ ToMV+TMV;4种及5种病毒复合侵染类型较为复杂,主要是CMV+ ToMV+TMV+TYLCV和TYLCV+ToCV+TMV+CMV+PVY,未检测出6种及6种以上病毒复合侵染现象。
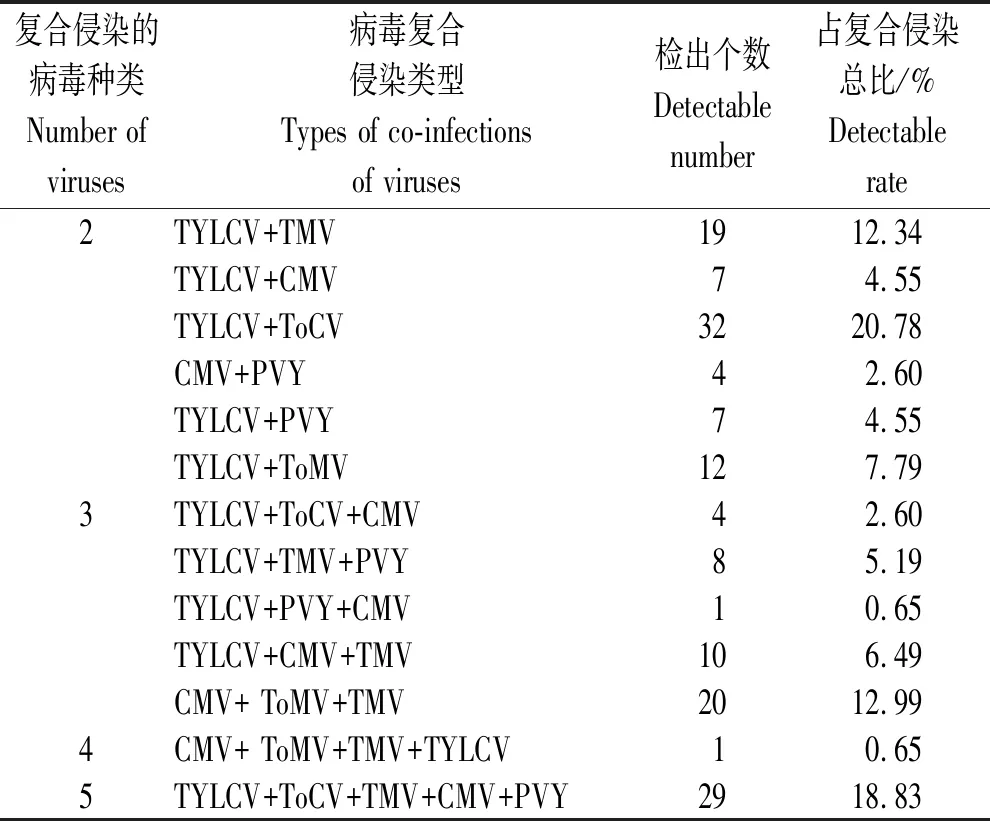
表4 我国番茄主要病毒病复合侵染率
2.4 TYLCV和TSWV系统进化树分析
将分离得到的TYLCV-BJ 与已报道的10个TYLCV分离物基因组进行同源性比较,结果表明:所得到的分离物与其他序列相似性为95%~99%。如图5显示,其中TYLCV-BJ分离物(MK336782)与中国湖南在番茄上得到分离物(KY783940.1)、中国山西在番茄得到的分离物(KY491005.1)聚在同一进化分支中,其中与中国湖南在番茄上得到分离物(KY783940.1)相似度最高且亲缘关系最近,高达99%。
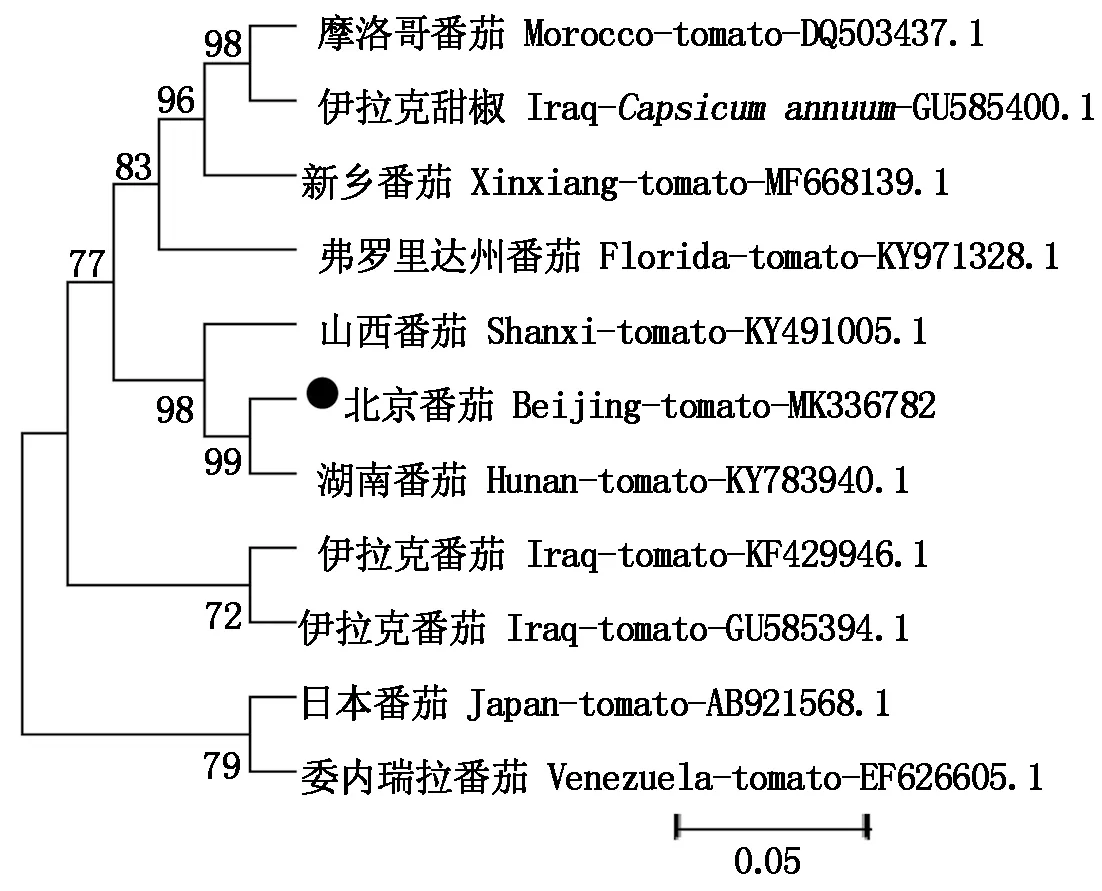
图5 基于TYLCV基因组部分核酸序列构建的系统进化树
此外,用系统进化树分析番茄的TSWV-HN分离物(MK318839)与其他14种TSWV分离物之间的亲缘关系(图6)。14种分离物序列共分为两大分支,其中塞尔维亚的烟草分离物(GQ373173.1),反枝苋分离物(JX262136.1)和番茄分离物(KF184652.1),波黑地区的甜椒分离物(KX710199.1、KY437080.1),委内瑞拉的非洲菊分离物(KF146702.1),菊花属分离物(KF146701.1),土耳其地区的辣椒分离物(KY973679.1),山东地区的南瓜分离物(KX185153.1)与河南番茄分离物(MK318839)在一大类,表明这几种分离物与番茄的TSWV-HN亲缘关系较其他分离物更近,其中番茄的TSWV-HN分离物与山东分离物(KX185153.1)的亲缘关系最近,与核苷酸序列对比结果一致,因此,明确该分离物为TSWV种类。
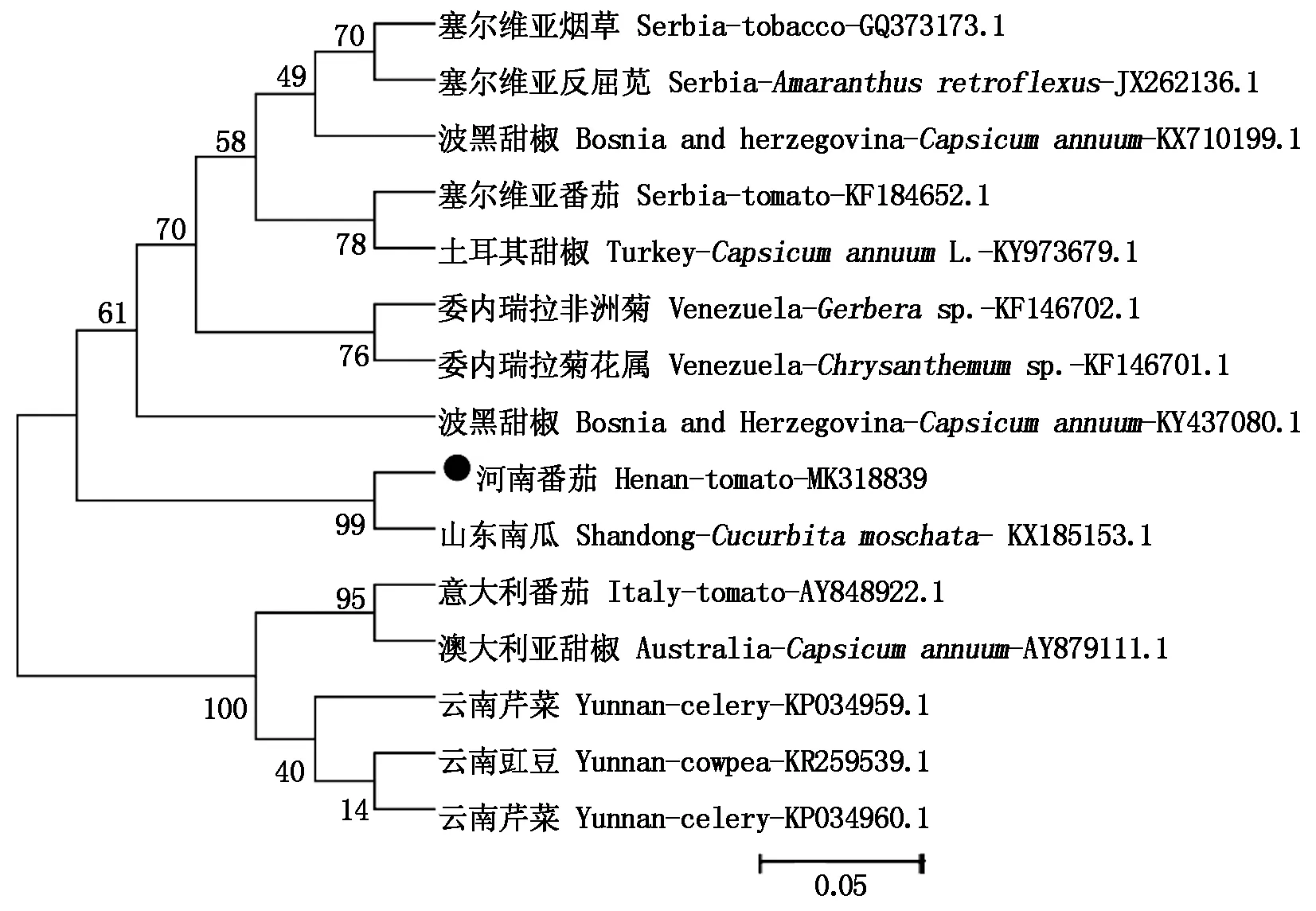
图6 基于TSWV基因组部分核酸序列构建的系统进化树
3 结论与讨论
现如今,番茄已成为我国重要的蔬菜主导产业之一。随着我国番茄栽培面积不断加大,病毒病的危害愈发严重,从而影响了番茄品种与产量,给生产者带来重大的经济损失。不同地区的番茄病毒种类不尽相同,如河南[20]、江苏部分地区[21]、南京部分地区[22]等地均对番茄上的病毒种类进行过系统的研究。前人对不同地区的番茄病毒病种类有所鉴定与分析,但缺乏对我国不同(省/自治区)番茄上的病毒进行全面系统的调查研究。
本研究自2015-2018年从我国20个省(自治区)采集431疑似病毒感染番茄植株,利用CMV、ToMV、PVY、PVX、TMV、BBWV、TYLCV、ToCV、TSWV、TICV、TYLCVNB和PaLCuCNV共12种番茄常见病毒特异性引物,对其番茄样品进行病毒RT-PCR分子检测,结果显示,98.61%的样品都被病毒所感染,初步确定侵染番茄的病毒种类有7种(TYLCV、ToCV、TMV、CMV、ToMV、TSWV、PVY),不同地区的病毒优势种不同,在本次检测样品中TYLCV为我国主要病毒毒原,其检出率高达65.20%,可能由于TYLCV的传播范围较广。TYLCV在热带、亚热带40多个国家大面积暴发,为世界性病害[23-25]。随着频繁的国际贸易活动,TYLCV传入我国。现如今,河北[26]、福建[27]、江苏[28]、北京[29]等地区相继发生。再加上TYLCV可通过烟粉風以持久方式进行传播,据报道,烟粉虱能够传播111种双生病毒[30],烟粉虱在感病番茄上取食1 h,在其肠道内可检测出TYLCV,取食8 h后能够将病毒成功传染给其他健康植株,而且一旦获毒可终身传毒[31-32]。因此成为我国番茄病毒病优势毒源。
通过对番茄病毒复合侵染现象进行分析发现,其中2种及3种病毒复合侵染现象最为普遍,主要以TYLCV与ToCV、ToMV、CMV、TMV、PVY等病毒发生复合侵染,同时主要以2种病毒复合侵染为主,番茄样品最多被5种病毒同时侵染。这可能与病毒的传播方式以及多种茄科蔬菜的大面积种植、土壤带毒等有关。尤其是昆虫传毒,如 CMV、ToCV、ToMV、TSWV等病毒均能通过蚜虫、粉虱或蓟马等昆虫进行病毒传播[33-34],部分害虫体内携带多种病毒,对植株进行刺吸传毒后导致同一种植株上出现多种病毒侵染现象。再加上农事栽培管理不当、品种栽培模式单一化及机械器具携带病毒等原因,成为番茄病毒病大规模暴发及存在交叉感染的重要因素之一。
此外,该试验对我国不同地区进行采集样本431份,病毒检出率高达98.61%,仅有6份疑似感染番茄病毒病症状,但在该样本内未检测到病毒,可能是由于番茄的一些生理性病害、虫害或是药害所致。
番茄病毒交叉侵染现象与田间杂草的互作关系息息相关,近年来已报道在我国多种杂草上存在双生病毒的侵染[35-36]。部分学者对贵州省853份杂草样本进行检测,结果得出:共有179份杂草可携带病毒[37]。此外,葎草是病毒PVY、PVX、TMV、CMV、ToMV等初侵染源,据了解,在农田周围葎草上可存在7种病毒,且复合侵染的比例高达80%[38]。
本研究所检测到的7种番茄病毒,大部分是可以通过介体昆虫或杂草进行直接或间接性侵染传播,而杂草常生于路边、农田中,极有可能成为蔬菜作物潜在的传播源。因此,要做好番茄病毒病的相关调查,及时对番茄作物做好预防措施,并对番茄病毒病进行有效控制,减少因该病造成的经济损失。
