拟南芥核酸酶基因AtCaN2克隆及功能分析
2020-04-16郭坤元张欣欣
郭坤元,张欣欣
(1.湖北省农业科学院 中药材研究所,国家中药材产业技术体系恩施综合试验站,湖北 恩施 445000;2.湖北省农业科技创新中心中药材分中心,湖北 恩施 445000;3.东北林业大学,盐碱地生物资源环境研究中心,黑龙江 哈尔滨 150040)
核酸酶存在于大多数生命体内,是一种特异性作用于磷酸二酯键的酶,它能够水解核酸链,生成低聚核苷酸或者是单核苷酸[1],它在遗传物质的重组、碱基错配识别和切割异源DNA等多个途径中起着重要的作用[2-6],同时有的核酸酶活性还依赖于钙离子、镁离子、锰离子等各种各样的金属离子[7]。
核酸酶在细菌和微生物里面研究的比较早,一些研究发现,核酸酶可以用于DNA探针进行简单快速的细菌检测,探针荧光信号与革兰氏阴性大肠杆菌和革兰氏阳性金黄色葡萄球菌的数量相关,该方法对活菌具有特异性,较短时间即可得到样本信号[8];在绿脓杆菌若虫中的研究发现,中肠M1区域的DNA和RNA降解率高于中肠M3区域,而中肠各区域成体核酸酶活性均较低,结果表明,不同的消化道区域都具有独特的消化特性[9];在链球菌中的研究发现,核酸酶Cas9的变异体xCas9具有较高的DNA保真度,这为进一步研究和开发高保真聚合酶提供了一定的研究基础[10];在古细菌中,一种纳米核糖核酸酶Ape0124被发现和报道,这种核酸酶是一种3′外切酶,特异性降解小于5个核苷酸的纳米核糖核酸,生化特征研究表明,在锰离子存在条件下,Ape0124可以从3′端开始降解ssDNA和ssRNA[11]。在昆虫方面,一些核酸酶也被发现和报道,比如在非洲象甲虫的转录组中发现了一些假定的dsRNA酶,其中有2种dsRNA酶在昆虫的肠道组织中可以特异表达,RNAi试验证明这2 种dsRNA酶影响了dsRNA在象甲虫肠道中的稳定性[12];在东亚飞蝗中,2种核酸酶LmdsRNase1和LmdsRNase4被发现,其活性试验结果表明,不同生理的pH值可以影响LmdsRNase的酶活性从而改变dsRNA的稳定性[13];有的研究对斜纹夜蛾、东亚飞蝗、美洲大蠊和无斑飞蝗4种昆虫的dsRNA酶活性进行了研究,结果表明,在适宜的镁离子浓度和高温下,所有昆虫的dsRNA酶活性在碱性环境中均表现出较高的活性,同时所有被测昆虫肠道的dsRNA酶活性都比其他组织高几百倍,这些结果有助于更全面地了解dsRNA酶的特性,并有助于在昆虫中开发RNAi技术[14]。一些植物中的核酸酶也被发现并报道,比如利用基因芯片技术在水稻中发现了一种OsNAC4编码的参与核DNA降解的核酸酶[15-16];在小麦里发现了一种可以凋亡细胞并降解和碎裂细胞核DNA的核酸酶[17];在花椰菜中,利用DNA-SDS-PAGE的试验技术,通过对花椰菜种子,幼苗和花头不同部位研究,发现了5种核酸酶[18]。这些研究进一步表明核酸酶基因在植物应对自身细胞凋亡、遗传物质降解及生长发育中起着非常重要的作用。
本研究以模式植物拟南芥为研究对象,通过PCR扩增和克隆测序方法克隆拟南芥核酸酶AtCaN2基因全序列,分析其序列特征,构建其蛋白表达载体并进行蛋白诱导纯化及活性分析,以期更全面了解AtCaN2基因,为更详尽探索其参与调控的分子机制提供一定的理论参考。
1 材料和方法
1.1 试验材料
野生型拟南芥(哥伦比亚型)、大肠杆菌 JM109、M15菌株及原核表达载体pQE-30由湖北省农业科学院中药材研究所资源与育种实验室保存,T4DNA连接酶、限制性内切酶等购自TaKaRa公司,RNA提取试剂盒、琼脂糖凝胶回收试剂盒、反转录试剂盒和质粒提取试剂盒等购自天根生化科技有限公司,Ni-NTA agarose和尼龙膜等购自生工生物工程股份有限公司,检测His标签蛋白的一抗和二抗购自碧云天生物技术研究所,其余试剂为国产分析纯。
1.2 试验方法
1.2.1 基因序列克隆 取培养14 d大小的拟南芥材料,在液氮下研磨均匀后,按照RNA提取试剂盒说明书的方法进行RNA提取,然后以提取的RNA为模板,按照反转录试剂盒说明书进行反转录试验。根据GenBank数据库中AtCaN2基因序列(序列号:NC_003071.7),以拟南芥cDNA为模版,利用上游引物F:5′-ATGGGTAACGCTCTTACGTT-3′,下游引物R:5′-CCCCTATTTCCTTAGTCTAA-3′进行PCR扩增,退火温度为53 ℃,同时以水为模板作为空白对照。
1.2.2 序列生物信息学分析 将获得的AtCaN2氨基酸序列在GenBank数据库中进行Blast比对分析,利用DNAMAN等软件对其与水稻(NP_001042112.1)、玉米(NP_001147648.1)、谷子(XP_004968301.1)、高粱(XP_002457283.1)、二穗短柄草(XP_003569116.1)、绒毛烟草(XP_009587089.1)、亚麻荠(XP_010508866.1)、大豆(NP_001242780.1)、荠菜(XP_006291485.1)等进行同源性分析,并利用MEGA 5软件构建系统进化树。在线网站包括:预测相对分子质量及等电点(http://web.expasy.org/protparam/),疏水性分析(http://web.expasy.org/protscale/),利用TMHMM进行跨膜结构域分析(http://www.cbs.dtu.dk/services/TMHMM/),信号肽分析(http://www.cbs.dtu.dk/services/SignalP),亚细胞定位分析(http://psort.hgc.jp/form.html),利用SWISS-MODEL(http://swissmodel.expasy.org/)进行结构域的三维同源建模。
1.2.3 AtCaN2-GFP蛋白的亚细胞定位 将AtCaN2-GFP瞬时表达载体利用聚乙二醇诱导法[19],转化拟南芥叶片细胞原生质体,原生质体先在黑暗条件过夜培养,然后在激光共聚焦显微镜下观察GFP荧光信号位置。
1.2.4 pQE-30-AtCaN2融合表达载体的构建 根据目的序列利用引物进行扩增,上游引物F:5′-GGTACCATGGGTAACGCTCT-3′,下游引物R:5′-GTCGACCTTTCCTTAGTCTA-3′,退火温度为55 ℃。将PCR产物用SalⅠ和KpnⅠ与载体pQE-30连接,构建pQE-30-AtCaN2表达载体,然后将构建好的融合表达载体转化M15菌株。
1.2.5 pQE-30-AtCaN2点突变载体的构建 利用重叠PCR的方法对AtCaN2氨基酸序列保守区域中的天冬氨酸位点进行点突变扩增。第1对引物的上游引物 F:5′-ATGGGTAACGCTCTTACGTT-3′,下游引物R:5′-ATGGTGTGTCCATGTGCCAC-3′,第2对引物的上游引物F:5′-GTGGCACATGGACACACCAT-3′,下游引物R:5′-CCCCTATTTCCTTAGTCTAA-3′,然后以扩增结果为模板,利用上一步骤1.2.4的引物进行扩增,后续载体构建同1.2.4步骤。
1.2.6 融合蛋白的诱导、纯化及Western Blot分析 小量诱导:挑取含有pQE-30-AtCaN2质粒的单克隆于LB液体培养基中振荡培养,待菌液的OD600达到对数中期时开始进行融合蛋白的诱导,诱导时间分别为0,15,30,60,120,210 min,诱导结束后收集每个时间点的大肠杆菌进行SDS-PAGE电泳;大量诱导及纯化:根据小量诱导结果,利用三角瓶进行大量诱导,然后利用溶菌酶裂解菌液,菌液上清过Ni-NTA 树脂进行His-AtCaN2融合蛋白的纯化,最后进行SDS-PAGE电泳及 Western Blot分析。点突变融合蛋白的诱导及纯化参照大量诱导进行,纯化的融合蛋白用His-AtCaN2(M)表示。
1.2.7 融合蛋白酶活性分析 以λDNA为底物,向反应缓冲液(100 mmol/L Tris-HCl pH值 7.0,10 mmol/L CaCl2)中加入1.0 μg His-AtCaN2或者His-AtCaN2(M)融合蛋白和0.5 μg λDNA,37 ℃孵育30 min,同时准备对照试验,反应缓冲液里面只加入0.5 μg λDNA,37 ℃孵育30 min。孵育结束后,向反应缓冲液里加入金属螯合剂EDTA使反应终止,然后进行琼脂糖凝胶电泳检测。另外,将λDNA用HindⅢ酶切反应后,进行上面相同的试验,然后利用琼脂糖凝胶电泳检测结果。
2 结果与分析
2.1 基因序列克隆
利用设计的引物对AtCaN2目的条带进行扩增,扩增结果如图1所示,AtCaN2基因片段的大小约为685 bp,证明扩增结果正确。
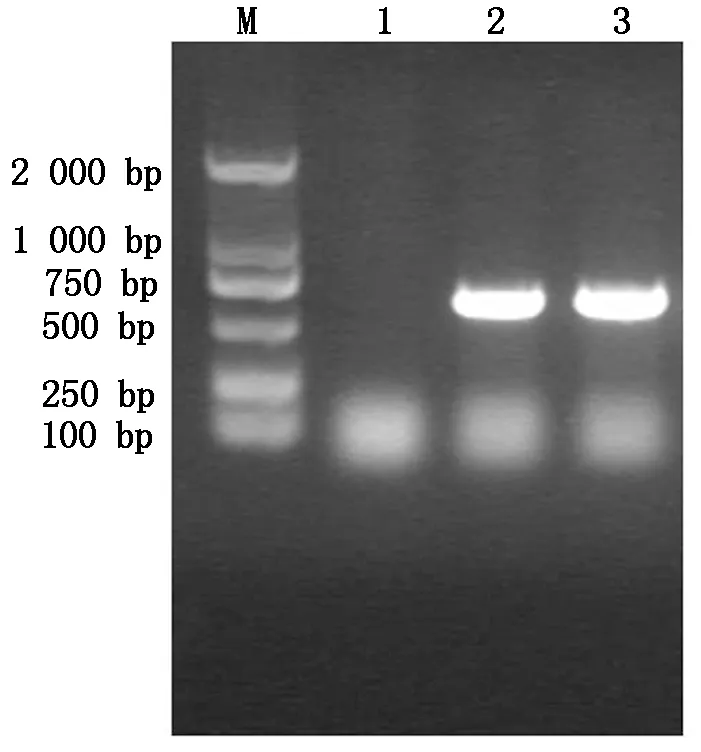
M.DNA Marker;1.空白对照;2,3.目的基因PCR扩增。
2.2 序列生物信息学分析
利用在线网站(http://web.expasy.org/protparam/)预测AtCaN2蛋白的等电点为8.45,化学式为C1116H1788N310O335S3,共含有3 552个原子数。蛋白亲/疏水性预测结果显示,约在第40个氨基酸位置,疏水性较大,峰值为1.725,在第180个氨基酸位置,亲水性较大,峰值为-2.735,整个分布区域亲水性氨基酸区域多于疏水性氨基酸区域,可认为AtCaN2为亲水性蛋白(图2-A)。SignalP 4.1 Server分析结果显示,C值为0.143,Y值为0.124,S值为0.146,得分较低,表明AtCaN2蛋白酶没有信号肽(图2-B)。TMHMM跨膜结构分析表明,AtCaN2不含跨膜结构域(图2-C)。亚细胞定位分析表明,AtCaN2蛋白定位于细胞质的概率为0.45,微体的概率为0.3,线粒体基质和溶酶体中的概率为0.1,其他细胞器的概率较低。在其整个氨基酸序列中,丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu)的含量最高,均超过了9%,半胱氨酸(Cys)、甲硫氨酸(Met)、色氨酸(Trp)的含量较少,不到1%,其中甲硫氨酸(Met)的含量最少,不到0.5%。蛋白质三级结构预测显示它由2个连在一起的α-螺旋中心组成(图2-D)。
2.3 氨基酸序列比对及系统进化树分析
本研究将AtCaN2与其他物种中的核酸酶氨基酸序列进行了比对,结果如图3所示,AtCaN2与亚麻荠(Camelinasativa)的同源性较高,为87.89%,与谷子(Setariaitalic)、高粱(Sorghumbicolor)和玉米(Zeamays)的同源性较低,分别是56.42%,57.35%和56.47%,且序列中间区域含有一个高度保守的天冬氨酸D-X-D功能位点序列。
本研究通过BioEdit、Clustal W和Mega 5等生物软件对AtCaN2和其他物种的核酸酶进行了系统进化树分析,如图4所示:可以发现AtCaN2与亚麻荠的亲缘性最近,与谷子、玉米等禾本科植物的亲缘性比较远,这些结果也同氨基酸序列比对的结果表现出一致性。
2.4 AtCaN2-GFP蛋白的亚细胞定位
将AtCaN2-GFP融合蛋白表达载体转化拟南芥叶片原生质体,在视野下观察GFP荧光信号情况,如图5所示,AtCaN2-GFP在整个细胞质均有表达,亚细胞定位情况与预测结果比较符合。
2.5 融合蛋白的诱导、纯化及Western Blot分析
为了检测融合蛋白在大肠杆菌中的表达情况,本研究首先进行了小量诱导表达。经过不同时间诱导之后,用SDS-PAGE凝胶电泳进行检测,检测结果如图6所示:在IPTG诱导下,融合蛋白开始表达,并且随着诱导时间的延长,融合蛋白的表达量也逐渐增加,同时结果还发现诱导120,210 min融合蛋白的表达量差别不大,这表明pQE-30-AtCaN2载体构建成功,可以成功地进行融合蛋白的诱导表达。
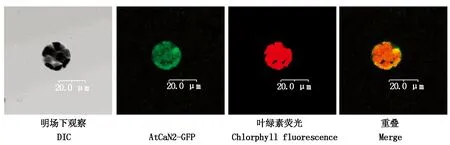
图5 AtCaN2-GFP亚细胞定位
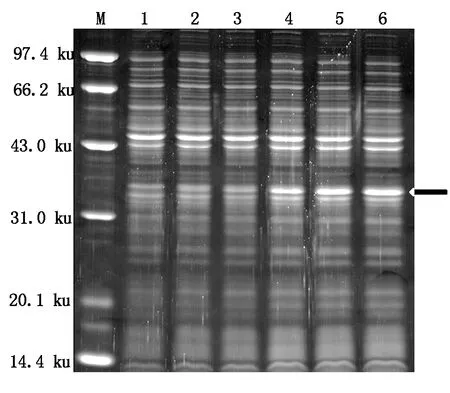
M.蛋白质Marker;1-6.诱导0,15,30,60,120,210 min。
根据小量诱导表达结果,本研究对融合蛋白进行大量诱导表达及纯化,结果如图7-A所示:得到了大小约为35 ku的纯化的His-AtCaN2融合蛋白(泳道2),本研究进一步对His-AtCaN2融合蛋白进行了Western Blot分析,如图7-B所示:检测到信号(泳道4),这些结果说明His-AtCaN2融合蛋白正确翻译表达,另外纯化出来的蛋白也没有出现结构上的断裂或者降解的情况。

A:M.蛋白质Marker;1.未诱导的His-AtCaN2蛋白;2.纯化的His-AtCaN2蛋白;B:3,4.Western Blot分析。
2.6 点突变融合蛋白的诱导和纯化
本研究对保守区域天冬氨酸位点突变后的His-AtCaN2融合蛋白进行诱导和纯化,结果如图8所示:小量诱导和大量诱导均有点突变后的His-AtCaN2(M)融合蛋白表达,且纯化后得到了点突变His-AtCaN2(M)较单一的条带(箭头所指位置)。
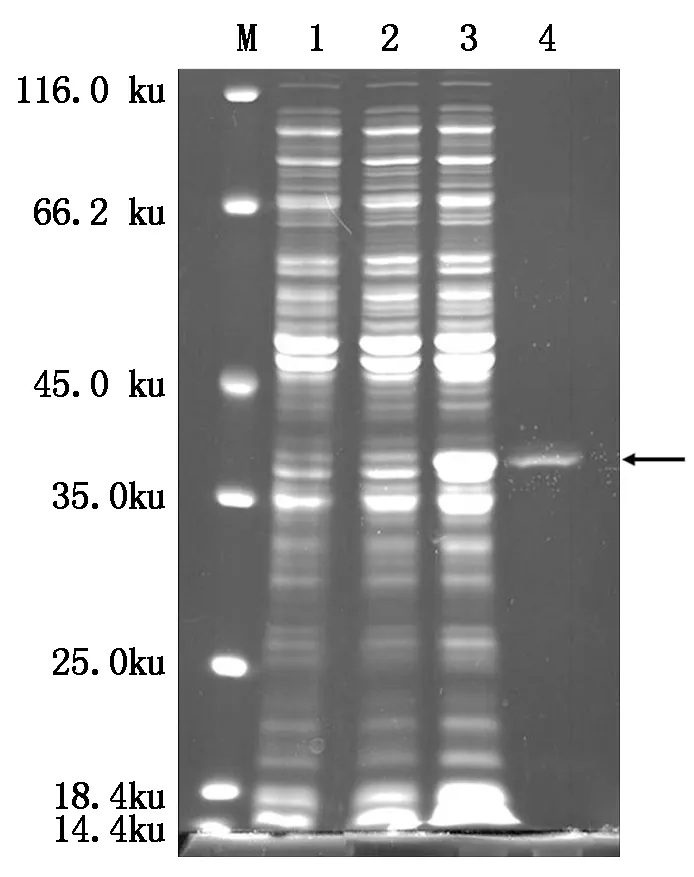
M.蛋白质Marker;1.未诱导的蛋白;2.His-AtCaN2(M)融合蛋白小量诱导;3.His-AtCaN2(M)融合蛋白大量诱导;4.His-AtCaN2(M)融合蛋白纯化。
M.Protein Marker;1.Uninduced protein;2.His-AtCaN2(M)fusion protein small quantity induction; 3.His-AtCaN2(M)fusion protein large quantity induction; 4.His-AtCaN2(M)fusion protein purification.
图8 点突变融合蛋白的诱导和纯化
Fig.8 Induction and purification of pointmutation fusion protein
2.7 融合蛋白酶活性分析
本研究以λDNA为底物,对核酸酶His-AtCaN2的活性进行检测,由图9可以看出,在孵育30 min后,添加His-AtCaN2融合蛋白的泳道,底物λDNA大部分降解,核酸酶表现出较高的活性,而添加His-AtCaN2(M)融合蛋白的泳道,底物λDNA基本上未降解,核酸酶表现出没有活性(图9-A);同样以HindⅢ酶切后的λDNA为底物时,添加His-AtCaN2融合蛋白的泳道,底物大部分降解,核酸酶同样表现出较高的活性,而添加His-AtCaN2(M)融合蛋白的泳道,底物λDNA基本上未降解(图9-B)。
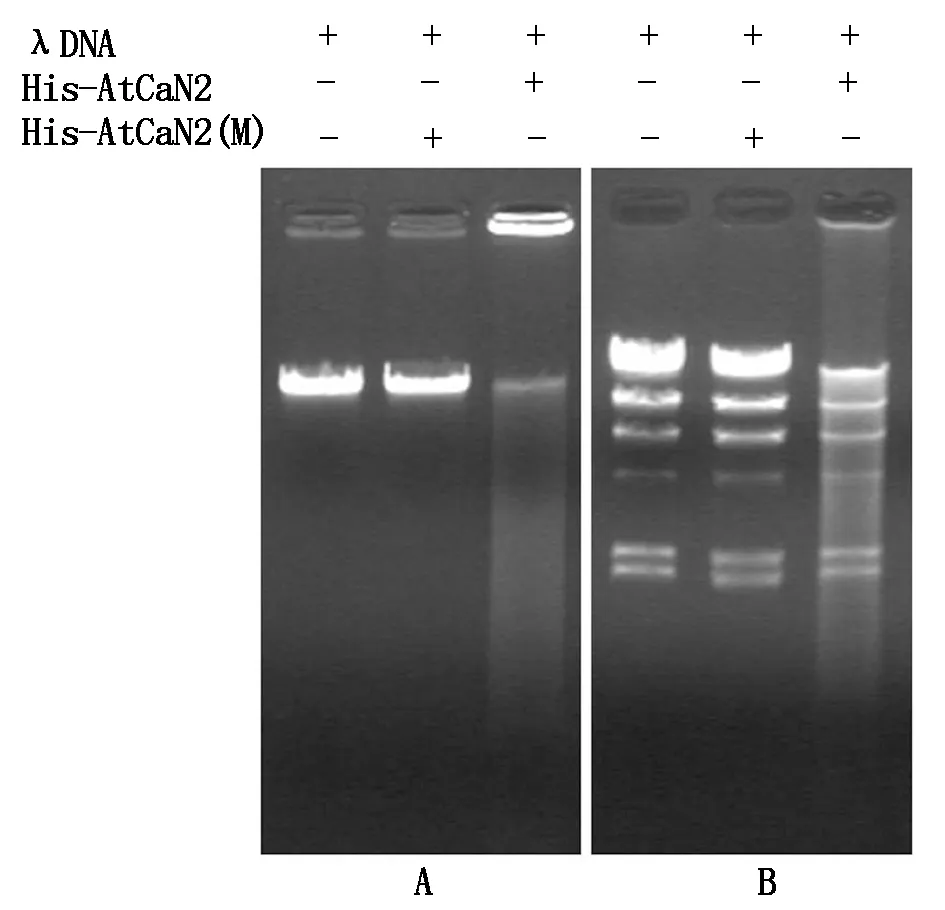
A.底物λDNA;B.HindⅢ酶切反应后的λDNA为底物。
3 讨论
核酸酶存在于大多数生命体内,它在遗传物质修饰、碱基识别和异源DNA降解等生命过程中起着非常重要的作用[1-6],同时一些核酸酶还依靠外源二价金属离子来表现它们的酶活性[7,11,14]。本研究从拟南芥中克隆了一种核酸酶AtCaN2,序列比对结果表明,它与亚麻荠的同源性较高,为87.89%,与谷子、高粱和玉米的同源性较低,分别是56.42%,57.35%和56.47%,且序列中间区域含有一个高度保守的天冬氨酸D-X-D功能位点序列;预测AtCaN2的等电点为8.45,没有跨膜结构域,不含信号肽,是一个亲水性蛋白;蛋白质三维结构显示它是由2个连在一起的α-螺旋中心组成;进化树分析表明,AtCaN2与亚麻荠的亲缘性最近,与谷子、玉米等禾本科植物的亲缘性比较远;亚细胞定位结果表明,其定位于细胞质,与预测结果相符合;蛋白诱导和纯化得到大小约为35 ku的His-AtCaN2融合蛋白,Western Blot分析表明融合蛋白正确翻译表达,且没有出现结构上的断裂或者降解的情况;酶活性分析表明,AtCaN2同一些报道一样,对核酸底物具有降解作用[11,15,17,20],且保守的天冬氨酸D-X-D序列是重要的功能位点。总之,AtCaN2在植物中具有重要的功能和调控作用,本研究结果为下一步在植物体内研究该基因的相关机理作用提供了基础。
