草鱼重组瘦蛋白的制备及其对JAK2-STAT3信号通路的作用研究
2020-04-15罗文婕蒋国民赵大芳瞿符发曹申平徐文倩李建中印遇龙
罗文婕,蒋国民,赵大芳,熊 鼎,瞿符发,曹申平,徐文倩,刘 臻*,李建中,印遇龙
(1.长沙学院生物与环境工程学院水生动物营养与品质调控湖南省重点实验室,中国湖南 长沙 410022; 2.湖南省水产科学研究所,中国湖南 长沙 410153; 3.湖南师范大学淡水鱼发育生物学国家重点实验室湖南省动物肠道生态与健康国际联合实验室动物肠道功能调控湖南省重点实验室,中国湖南 长沙 410081)
瘦素(leptin)是肥胖基因编码,主要由脂肪细胞分泌的一类激素样蛋白质[1]。瘦素的作用部位主要在中枢神经系统,其通过与中枢神经系统及外周组织的瘦蛋白受体结合,形成二聚体,继而激活下游一系列信号转导通路,影响机体的代谢[2]。瘦素基因在调节食物摄入、能量代谢和生殖方面具有重要作用,目前已经在草鱼[3]、虹鳟[4]、黄颡鱼[5]、红鳍东方鲀[6]、大西洋鲑[7]、日本青鳉[8]、大黄鱼[9]、大马哈鱼[10]、罗非鱼[11]、斑马鱼[12]、石斑鱼[13]和鲤[14]等鱼类中被广泛研究。注射试验表明,重组瘦蛋白会诱导短期的强烈厌食行为[3,15~17],引起肝糖原、肌糖原以及循环激素水平的变化[15~16];在分子水平上显著上调糖原性和糖酵解能力、葡萄糖激酶活性以及葡萄糖转染反应相关基因mRNA 水平[17],同时也可显著上调解偶联蛋白2、瘦素和脂肪酸结合蛋白基因的mRNA 表达[3,18],而脂蛋白脂肪酶基因的表达受到抑制[3]。有意思的是,在长期实验中,厌食行为消失[3]。以上信息提示,瘦素在调节食物摄入、能量代谢和脂质代谢上具有急性作用。此外,鼠重组瘦蛋白对雄性欧洲鲈鱼促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)诱导的促黄体生成激素(luteinizing hormone,LH)的释放具有累加或抑制作用,表明瘦蛋白是鱼类生殖系统的调节剂[19~20]; 人类重组瘦素可以在雌性虹鳟离体脑垂体促性腺激素分泌中发挥作用[21]。异源重组瘦蛋白的注射试验表明,瘦素在进化上可能具有高度保守性,在生物体内均能发挥其调节能量代谢的作用,这为瘦素应用与人类疾病的治疗提供了参考。
在哺乳动物中,瘦素参与复杂的信号转导,主要包括JAK-STAT 信号传送途径、磷酸肌醇3-激酶-蛋白激酶B (phosphatidylinositol 3-kinaseprotein kinase B,PI3K/PKB)途径和丝裂原激活蛋白激酶-胞外信号调节激酶1/2 (mitogen-activated protein kinase-extracellular signal-regulated protein kinase 1/2,MAPK-ERK1/2)途径[22]。瘦素 β 受体大量存在于下丘脑中,可激活JAK2 依赖和非依赖途径[23],而JAK2 参与许多激素信号的转导,包括瘦素[23]、生长激素和钠离子偶联的营养物质转运[24]。研究表明,在大鼠中瘦素可通过质子依赖性寡肽转运蛋白1 (oligopeptide transporter 1,PepT1)增加小肽穿过小肠上皮屏障的转运效率[25]。小肽吸收进入小肠细胞这一过程依赖于小肽转运载体PepT1 和PepT2。膳食中添加赖氨酰-甘氨酸二肽可显著增加虹鳟中PepT1 和瘦素的mRNA 表达[26];同时,瘦素可通过JAK2-STAT3 信号途径参与调控非洲爪蟾肠道PepT1 的表达,从而介导甘氨酸-甘氨酸二肽的转运[22,24],提示JAK2 广泛参与小肽的转运。然而JAK2-STAT3 信号途径是否介导了草鱼的小肽转运,尚不明晰。
草鱼是我国淡水养殖的四大家鱼之一,因其食性简单、饲料来源广泛、养殖方便、产量高并且生长迅速,所以具有较高的经济价值[27],已成为我国主要精养对象之一。目前,关于重组瘦蛋白对草鱼脂质代谢和摄食的影响已有报道[3]。然而有关草鱼摄食因子瘦素信号通路对小肽转运的研究还很少,本研究通过构建草鱼瘦素基因的重组质粒,获得草鱼瘦素原核表达蛋白质,并通过体内注射草鱼重组瘦蛋白研究瘦蛋白对草鱼瘦素受体及JAK2、STAT3 mRNA 水平的影响,为进一步研究草鱼瘦素及其对JAK2-STAT3 信号通路的调控机制奠定基础。
1 材料与方法
1.1 实验材料
本实验所用草鱼购于湖南省水产科学研究所(45±5 g)。原核表达载体 pGEX4T-1、E.coli DH5α感受态细胞和E.coli BL21 感受态细胞购自北京天根生化科技有限公司。
1.2 目的片段的获取
利用Trizol 法提取草鱼脑垂体组织总RNA,并利用PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit (大连宝生物工程有限公司)将其反转录成cDNA。基于草鱼瘦素基因(GenBank 登录号:EU-719623.1) cDNA 序列,克隆出草鱼瘦素的开放阅读框(open reading frame,ORF),利用Premier 5.0设计引物Leptin-F/Leptin-R(表1)。以反转录获得的草鱼cDNA 为模板,通过PCR 扩增得到含有瘦素ORF 序列的目的片段。以此序列作为模板,用SignaIP-5.0 软件(http://www.cbs.dtu.dk/services/SignalP/)预测草鱼leptin 蛋白的信号肽序列,根据瘦素基因信号肽序列位点和pGEX4T-1 质粒的酶切位点,委托上海铂尚生物技术有限公司设计1 对去除信号肽的含EcoRⅠ及XhoⅠ双酶切位点的特异性引物(LeptinEcoRⅠ-F/LeptinXhoⅠ-R)。通过PCR 扩增,获得去除信号肽的目的片段。PCR 扩增反应体系为 50 μL:cDNA 1 μL、LeptinEcoRⅠ-F 1 μL、LeptinXhoⅠ-R 1 μL、dNTP mix 8 μL、10×LATaq Plus DNA 聚合酶 buffer 5 μL、LATaq Plus DNA 聚合酶 0.5 μL、ddH2O 33.5 μL。反应条件:94 ℃ 4 min; 94 ℃ 30 s,48 ℃ 30 s,72 ℃ 3 min,32 个循环,72 ℃ 10 min; 4 ℃保存。PCR 产物用2.0%琼脂糖凝胶电泳检测。挑选条带位置正确的PCR 产物,送往上海铂尚生物技术有限公司测序,将测序结果与已知序列进行比对,如果一致,则说明获得了草鱼瘦素基因的目的片段。
1.3 原核表达载体的构建与鉴定
使用超微量核酸蛋白测定仪(IMPLEN,德国)测定目的片段与pGEX4T-1 质粒的浓度。采用限制性内切酶EcoRⅠ和XhoⅠ(大连宝生物工程有限公司)于37 ℃条件下对pGEX4T-1 质粒和目的片段进行双酶切10 min。目的片段酶切体系:10× QuickCut buffer (大连宝生物工程有限公司)9 μL、EcoRⅠ3 μL、XhoⅠ3 μL、PCR 产物≤0.2 μg,加 ddH2O 补足至 90 μL。质粒酶切体系:10×QuickCut buffer 5 μL、EcoRⅠ1 μL、XhoⅠ1 μL、质粒 DNA≤1 μg,加 ddH2O 补足至 50 μL。连接体系:目的片段酶切产物2 μL、质粒酶切产物0.5 μL、SolutionⅠ2.5 μL,4 ℃连接过夜。把连接产物转化到感受态细胞BL21 中,涂布在含有氨苄青霉素的平板上37 ℃培养24 h 后,选取阳性克隆菌株,测序(委托上海铂尚生物技术有限公司进行)成功后扩大培养。
1.4 pGEX4T-1-CiLEP的原核诱导表达
利用HiPure Plasmid EF Micro Kit 质粒提取试剂盒(广州美基生物科技有限公司)提取重组质粒。将重组质粒转入大肠杆菌感受态细胞BL21,热激后涂布在含有氨苄青霉素的平板上37 ℃培养12 h。挑取单克隆到含氨苄青霉素抗性的液体培养基(胰蛋白胨10 g、酵母浸出粉5 g、氯化钠10 g,加 ddH2O 至 1 000 mL 溶解,用氢氧化钠调pH 至7.0 后高温灭菌30 min)中扩大培养; 当OD值达到0.6 时,添加诱导剂异丙基硫代-β-D-半乳糖苷(IPTG)后继续培养。在该环节,以未添加诱导剂的样品为阴性对照,通过选择不同浓度的IPTG 及不同培养温度、时间来对诱导条件进行优化,使重组蛋白质的表达量达到较高水平。诱导培养后离心弃上清,收集菌体。用磷酸盐缓冲液(PBS,德国Magen 公司) 悬浮收集到的菌体,并使用超声破碎仪将其充分裂解; 离心后收集上清,在沉淀中加入缓冲液A (8 mol/L 尿素、50 mmol/L三羟甲基氨基甲烷盐酸盐、300 mmol/L 氯化钠,pH 8.0)重悬。分别将上清和沉淀与2×上样缓冲液(上海碧云天生物技术有限公司)1︰1 混匀,100 ℃水浴10 min 后准备SDS-PAGE 检测。
1.5 重组蛋白质的纯化
将IPTG 诱导后的细胞培养液离心去培养基,沉淀用缓冲液B [50 mmol/L 三羟甲基氨基甲烷(Tris)、300 mmol/L 氯化钠、0.2 mmol/L 苯甲基磺酰氟(PMSF)、0.1% 聚乙二醇辛基苯基醚(Triton X-100)、2 mmol/L 二硫苏糖醇(DTT)、1 mmol/L 乙二胺四乙酸(EDTA),pH 8.0]重悬。将重悬液置于冰上,经超声破碎(2 s,暂停6 s,以此为一个循环)后离心收集上清,沉淀用150 mL 缓冲液C (2 mol/L 尿素、50 mmol/L Tris、300 mmol/L 氯化钠、0.1% Triton X-100、2 mmol/L DTT、1 mmol/L EDTA,pH 8.0)重悬后,上下颠倒混匀以进一步裂解,裂解后的溶液经离心收集上清,将两次收集的上清液合并。用10倍柱床体积的缓冲液D(25 mmol/L Tris、150 mmol/L氯化钠,pH 8.0)平衡柱子(上海生工生物工程有限公司),流速5 mL/min; 将两次收集的上清液合并后与5 mL GST-NTA(上海生工生物工程有限公司)混匀,孵育2 h; 将孵育后的混合物上柱,收集粗蛋白流出液; 用25 mL 缓冲液D 清洗平衡柱子,收集洗杂流出液;用40~50 mL 缓冲液E[50 mmol/L Tris、300 mmol/L 氯化钠、50 mmol/L 谷胱甘肽(GSH),pH 8.0]洗脱,在洗脱过程中检测洗脱得到的蛋白质样品,若检测没有蛋白质则继续清洗柱子,同时停止接样,一般接下来的洗脱液体积在30 mL左右; 收集洗脱流出液。将粗蛋白流出液、洗杂流出液、洗脱流出液分别与2×上样缓冲液1︰1 混匀,100 ℃水浴处理10 min,准备SDS-PAGE 检测。将纯度较好的3 种组分透析到缓冲液F (50 mmol/L Tris、300 mmol/L 氯化钠、2 mmol/L DTT,pH 8.0)中,透析结束后用PEG20000 浓缩,0.22 μm 滤膜过滤后按每管1 mL 分装,-80 ℃保存。
1.6 重组蛋白质的检测
SDS-PAGE 检测:将纯化后的蛋白质与 2×上样缓冲液(上海碧云天生物技术有限公司) 1︰1 混匀,100 ℃水浴10 min 后取出待用;用蛋白胶试剂盒(美国Bio-Rad 公司)制作13%的蛋白胶;将样品和蛋白质分子量标准(大连宝生物工程有限公司)分别以10 μL 上样,电泳开始时恒压80 V,样品进入分离胶后恒压120 V,直至溴酚蓝走至前沿为止。
Western-blot 验证:蛋白质样品经 13% SDSPAGE 电泳后,将其置于半干电转仪(美国Bio-Rad公司)中250 mA 转膜90 min; 5%脱脂奶粉封闭摇床2 h;加入一抗(兔抗GST 标签,稀释比例1︰500,上海生工生物工程有限公司)后置于摇床上室温孵育 60 min,用 PBS 洗膜 3 次,每次 10 min,随后用二抗(羊抗兔,稀释比例1︰8 000,上海生工生物工程有限公司)室温孵育60 min,再经PBS 洗膜3 次,最后用TMB 显色试剂盒(上海生工生物工程有限公司)显色5 min,并用化学发光成像系统(美国Bio-Rad 公司)成像观察。
蛋白质浓度测定:采用非干扰型蛋白质定量试剂盒Cat.No.C503071 (上海生工生物工程有限公司)测定蛋白质浓度。
1.7 草鱼融合重组瘦蛋白的注射
在湖南省水产研究院室外养殖池对草鱼进行注射试验。两组草鱼(体重30±5 g,每组15 尾)分别注射 100 μL 含 30 μg 融合重组瘦蛋白(GST 标签蛋白和重组瘦蛋白的融合蛋白)的PBS (LEP 组)或 100 μL 含 30 μg GST 标签蛋白(上海生工生物工程有限公司)的 PBS (GST 组)。注射 4 h 后(禁食)取样,每组随机3 尾。采用Trizol 法分别提取各组脑垂体和肠道的总RNA,使用cDNA 合成试剂盒(大连宝生物工程有限公司)将其反转录成cDNA,-20 ℃保存备用。
1.8 荧光定量PCR
为了评价重组瘦蛋白注射对草鱼瘦素受体(leptin-receptor,Lep-R)基因及 JAK2-STAT3 信号通路 JAK2、STAT3 和 PepT1 基因表达的影响,以基因文库中可用序列设计Lep-R、JAK2、STAT3和PepT1 的荧光定量PCR 引物(表1),并以草鱼β-actin 基因为模板设计内参基因荧光定量特异性引物(β-actin-F/β-actin-R),进行荧光定量 PCR。根据荧光定量试剂盒(SYBR® Premix Ex TaqTMⅡ,大连宝生物工程有限公司)说明书,荧光定量PCR扩增反应(14 μL)使用 7 μL 预混酶 Ex Taq(TliRNaseH Plus,2×)、1 μL cDNA、1 μL 上下游引物(10 μmol/L)、0.4 μL Rox 和 4.6 μL ddH2O。荧光定量 PCR 反应条件:50 ℃ 5 min,在 95 ℃孵育 10 min,95 ℃变性15 s,40 个循环,60 ℃退火并延伸60 s。每个样品3 个重复,利用 2-ΔΔCt方法[3]和 CFX Manager 软件系统(美国Bio-Rad 公司)分析mRNA 相对表达量。ΔΔCt=实验组(Ct目的基因-Ct内参基因)-对照组(Ct目的基因-Ct内参基因)。
1.9 数据处理
实时荧光定量PCR 所得到的数据用Excel 2007 软件进行初步处理,采用SPSS 19.0 软件进行单因素方差分析,结果以平均值±标准差(±s)表示,以 P<0.05 为显著性判断标准。用Prism 6.0 软件制图。
2 结果
2.1 原核重组载体的构建及表达
根据草鱼瘦素基因的cDNA 序列,利用SignaIP-5.0 软件(http://www.cbs.dtu.dk/services/SignalP/)在线预测草鱼瘦蛋白的信号肽序列,该信号肽包括20 个氨基酸,则酶切位点位于第20 个氨基酸和第21 个氨基酸之间(MYSPVLLYTCFLSILGMIDG^RSIPIHQDNLKNLVKLQADTIIHRIKEHNEKLKLSPKILIGDSELYPEVPADKPIQGLGSIVDTLTTFQKILQTLPKGHVSQLHNDMSTLLEYFKDRMTFMRCTLKEPANGKSLDTFIEKNATHHITFGYMALDRLKQFMQKLIANLDQLKSC,^ 代表酶切位点)。用EcoRⅠ和XhoⅠ酶切瘦素基因序列并将产物连接到经同样酶切后的pGEX4T-1 载体,构建重组质粒pGEX4T-1-CiLEP。构建的载体经测序分析,确认插入片段的序列无移码突变。将重组质粒在大肠杆菌中原核表达,得到的重组蛋白质包含瘦素的N 端,并包含382 个氨基酸残基,其相对分子质量(MW)为44 210.9,预测的等电点(pI)为7.63。
2.2 重组蛋白质的表达、纯化及鉴定
与未经IPTG 诱导的蛋白质组分相比,在IPTG 诱导下表达的原核重组蛋白质,经SDSPAGE 电泳分析可见1 条47 kD 的特异性条带,与预期目的条带大小一致,说明pGEX4T-1-CiLEP重组质粒在大肠杆菌中正确表达。随后,通过考察IPTG 浓度及不同培养温度、时间,我们挑选了20 ℃培养16 h、37 ℃培养4 h 两种表达量较高的条件,并对其所培养菌体裂解后的上清和沉淀(分别称作 20 ℃上清、20 ℃沉淀、37 ℃上清和37 ℃沉淀)进行了蛋白质分析,结果显示重组蛋白质主要存在于37 ℃沉淀中(图1),表明在添加0.5 mmol/L诱导剂IPTG 条件下,37 ℃培养4 h 时菌体中融合重组瘦蛋白的表达量最高。在此条件下扩大培养,并对未用IPTG 诱导的GST 标签蛋白及融合重组瘦蛋白、37 ℃条件下诱导的GST 标签蛋白及融合重组瘦蛋白、纯化后的GST 标签蛋白及融合重组瘦蛋白分别进行SDS-PAGE 检测,结果表明纯化后的组分得到单一条带,表明GST 标签蛋白及融合重组瘦蛋白纯化成功(图2)。
为进一步确定纯化获得的蛋白质为融合重组瘦蛋白,按照Western-blot 步骤用TMB 显色试剂盒显色。结果显示在相应位置出现明显条带,表明该蛋白质确实是融合重组瘦蛋白(图3)。采用非干扰型蛋白质定量试剂盒Cat.No.C503071 测定第1 批蛋白质浓度为0.27 mg/mL,待测样品体积为20 μL; 第 2 批蛋白质浓度为 0.30 mg/mL,待测样品体积为20 μL,结果得到2 mg 的融合重组瘦蛋白,满足后续实验要求。

表1 引物参数Table 1 Primers used in this study
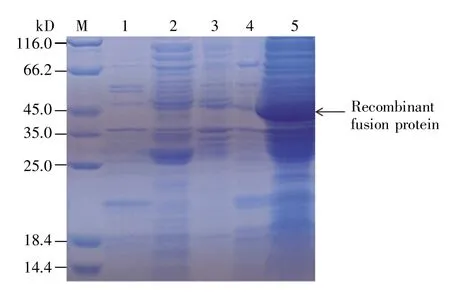
图1 IPTG 诱导表达的重组蛋白质的SDS-PAGE 分析图M:蛋白质分子量标准(Cat.No.C600525); 1:诱导前总蛋白质;2:20 ℃上清;3:20 ℃沉淀;4:37 ℃上清;5:37 ℃沉淀。Fig.1 SDS-PAGE analysis of recombinant protein expression induced by IPTGM:Protein marker (Cat.No.C600525); 1:Total protein before induction;2:20 °C supernatant;3:20 °C precipitation;4:37 °C supernatant; 5:37 °C precipitation.
2.3 注射重组瘦蛋白对JAK2-STAT3信号通路相关基因表达的影响
以纯化得到的融合重组瘦蛋白进行注射实验(每条 30 μg)。结果显示,与 GST 对照组相比,LEP组脑垂体和肠中 Lep-R、JAK2、STAT3 及 PepT1的mRNA 表达水平上调,其中脑垂体Lep-R、JAK2、STAT3 基因和肠 Lep-R、JAK2、PepT1 基因在两组之间的表达存在显著差异(P<0.05)。此外,不同组织间基因表达存在差异,脑垂体中STAT3 表达量最高,PepT1 表达量最低,而肠道中则是PepT1 表达量最高,Lep-R 表达量最低; Lep-R 和JAK2 在脑垂体中的mRNA 表达量高于肠道,而STAT3 与PepT1 在肠道中的mRNA 表达量则高于脑垂体(图 4,图 5)。

图2 最终纯化蛋白质的SDS-PAGE 分析图M:蛋白质分子量标准; 1:未经诱导的 GST 标签蛋白; 2:37 ℃条件下经 IPTG 诱导的 GST 标签蛋白; 3:纯化后的GST 标签蛋白; 4:未经诱导的融合重组瘦蛋白; 5:37 ℃条件下经IPTG 诱导的融合重组瘦蛋白; 6:纯化后的融合重组瘦蛋白。Fig.2 SDS-PAGE analysis of the final purified proteinM:Protein marker; 1:Non-induced GST tag protein; 2:GST tag protein induced at 37 ℃; 3:Purified GST tag protein; 4:Non-induced recombinant fusion leptin protein; 5:Recombinant fusion leptin protein induced at 37 ℃ ; 6:Purified recombinant fusion leptin protein.
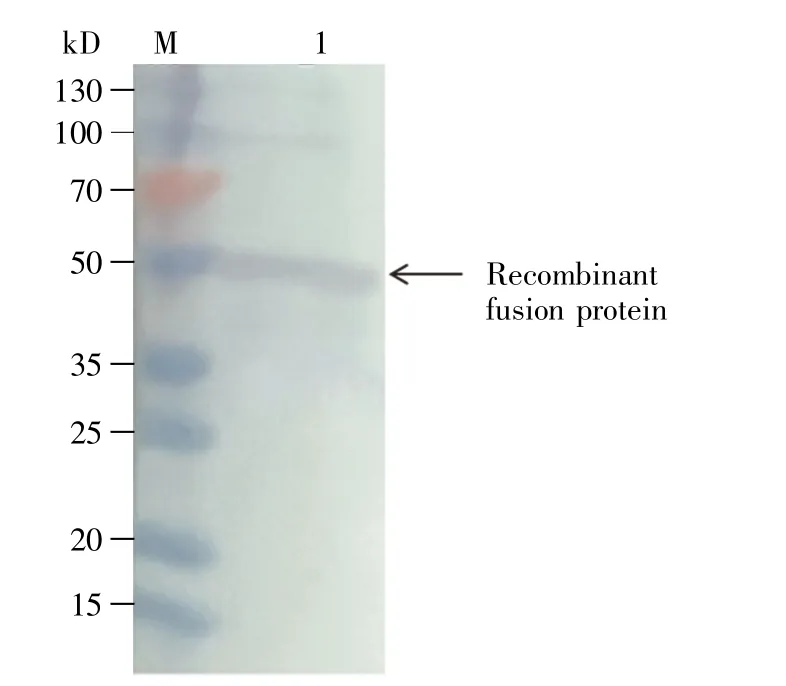
图3 最终纯化蛋白质的Western-blot 分析图M:蛋白质分子量标准(Cat.No.C610013); 1:融合重组瘦蛋白。Fig.3 Western-blot analysis of the final purified proteinM:Protein marker (Cat.No.C610013); 1:Recombinant fusion leptin protein.
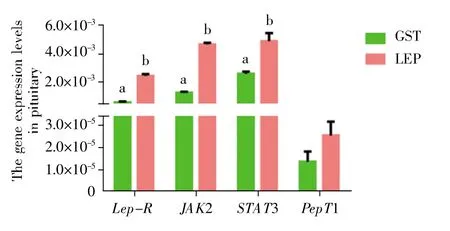
图4 重组瘦蛋白的注射对草鱼脑垂体中相关基因表达的影响a,b 字母表示差异显著。Fig.4 Effects of leptin injection on the expression of related genes in the pituitaryLetters“a”and“b”mean a significant difference.
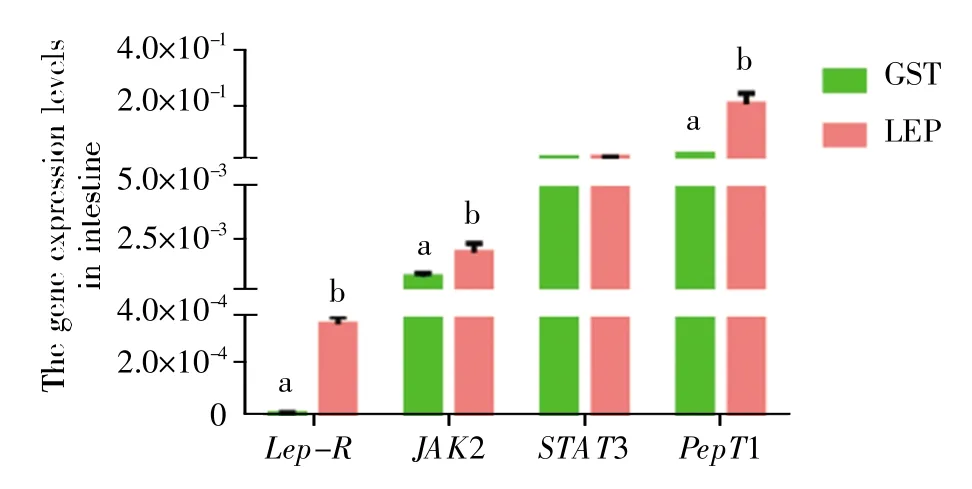
图5 重组瘦蛋白的注射对草鱼肠道相关基因表达的影响a,b 字母表示差异显著。Fig.5 Effect of leptin injection on related genes in the intestineLetters“a”and“b”mean a significant difference.
3 讨论
在鱼类研究中,人们已经在pET-3c 质粒中构建了草鱼瘦素的原核重组表达载体[3],在pET-32a 和pGEX4T-1 质粒中构建了建鲤瘦素的原核重组表达载体[28]。为了方便蛋白质的纯化回收,本文选用了含有GST 标签的原核表达载体pGEX4T-1,用于构建草鱼瘦素的重组表达载体。构建的重组质粒pGEX4T-1-CiLEP 表达重组蛋白质后,GST标签的相对分子质量大小约27.8 kD、目的蛋白的相对分子质量大小为19.2 kD、重组蛋白质总的相对分子质量约为47 kD,与图2 的结果一致,这说明本文构建的重组质粒pGEX4T-1-CiLEP 成功表达了融合重组瘦蛋白。
原核生物没有核膜,缺乏复杂的蛋白质折叠和质量控制机制。通常,原核表达不需要信号肽的定位作用,其边转录边表达,没有区域间隔。信号肽大多是疏水性,溶解性较差,在原核细胞中表达信号肽蛋白容易产生包涵体[29~30]。另外,原核生物的基因中是不存在信号肽片段的,信号肽序列中的密码子对原核生物来说可能是稀有密码子,多余的信号肽不能被细胞识别并切除,从而影响蛋白质的正确折叠。因此,我们在构建原核表达质粒时先进行了信号肽预测,通过设计不含信号肽的引物构建了不含信号肽的原核表达质粒pGEX4T-1-CiLEP。
在原核表达体系,如E.coli 大肠杆菌表达系统,外源基因的表达通常需要诱导剂的参与才能进行。目前常用的诱导剂为IPTG,其作用极强且稳定。在IPTG 存在时,诱导剂可与Lac 阻遏物(阻遏蛋白)结合,使得阻遏蛋白构象发生变化,导致阻遏物从基因上解离下来,确保RNA 聚合酶的工作不受阻碍,最终启动转录。不同的载体在诱导温度、诱导时间以及IPTG 浓度上存在差异,低温通常会减少包涵体的形成。在本研究中,采用37 ℃、0.5 mmol/L IPTG、4 h 的诱导条件能诱导出融合重组瘦蛋白,而且从重组蛋白质的表达分析上看,其主要存在于沉淀中,这为后续的蛋白质纯化以及瘦素功能研究提供了基础。
为了了解融合重组瘦蛋白在草鱼中的活性,我们通过活体注射实验,评估了Lep-R 和JAK2-STAT3 信号通路相关基因JAK2、STAT3 及PepT1的mRNA 表达水平。为了消除GST 标签蛋白的干扰,我们以注射GST 标签蛋白为对照组。瘦蛋白通过脑垂体中表达Lep-R 的细胞起作用从而控制能量平衡,瘦素与Lep-R 结合后,Lep-R 发生二聚化,导致酪氨酸磷酸化(PY-985 和PY-1138)并激活JAK2。Lep-R 的PY-1138 募集含有转录因子 STAT3 的 Src 同源 2 结构域,导致 STAT3 酪氨酸磷酸化及转录入核[31~34]。瘦素促进表达Lep-R的细胞中STAT3 的酪氨酸磷酸化,研究报道,在表达Lep-R 的神经元中缺乏STAT3 的小鼠显示出过度肥胖,表明STAT3 信号传导在瘦素作用中起关键作用[33~36]。在大鼠中,胃分泌瘦素并进入肠道直接作用于肠上皮细胞,增强PepT1 对肽的吸收[37~38]。相关研究表明,利用瘦素长期诱导结肠癌细胞能激活PepT1 基因的转录,提高PepT1 mRNA的稳定性,导致细胞内PepT1 表达量增加[39],其中JAK2 介导瘦素调控PepT1 的表达[40]; 草鱼脑中JAK2 mRNA 的相对表达量显著高于肠系膜[41],STAT3 在脑中存在较低的表达[42]。我们的研究结果显示,与对照组相比,LEP 组瘦蛋白能上调脑垂体和 肠道 Lep-R、JAK2、STAT3 及 PepT1 的mRNA 表达水平,Lep-R 与JAK2 在脑垂体中的mRNA 表达量显著高于肠道,而肠道PepT1 和STAT3 的mRNA 表达量则显著高于脑垂体。这表明我们制备的草鱼融合重组瘦蛋白具有生物学活性,为之后深入了解草鱼瘦素基因的功能及调控机制提供了理论依据。
4 结论
本研究构建了草鱼瘦素基因的原核表达载体,在0.5 mmol/L IPTG、37 ℃条件下成功诱导了融合重组瘦蛋白的表达,并利用活体注射实验发现纯化的融合重组瘦蛋白能够显著上调草鱼肠道和脑垂体中 Lep-R、JAK2、STAT3 和 PepT1 基因的表达。
