CD8+ T细胞在葡聚糖硫酸钠诱导的小鼠急性结肠炎中的致病性研究
2020-04-15曾群雄
曾群雄 ,邓 军 ,沈 南
1. 上海交通大学医学院附属仁济医院,上海市风湿病学研究所,上海200127;2.上海交通大学医学院附属仁济医院中澳个体化自身免疫病研究中心,上海200127
炎症性肠病(inflammatory bowel disease,IBD)是肠道黏膜内免疫反应的异常激活导致的。多种免疫细胞亚群参与IBD发病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD)等慢性复发性胃肠道炎症[1-3]。目前,许多研究证明CD4+T细胞、巨噬细胞、树突状细胞、嗜中性粒细胞和嗜酸性粒细胞的异常活化与IBD患者肠道黏膜内炎症反应有关[1-2,4-5]。这些促炎症细胞通过分泌趋化因子、促炎细胞因子及效应性分子参与和维持炎症反应,加重肠道破坏[1-2,6]。调节性细胞,如调节性T细胞(Treg)、分泌白介素(IL) -10的调节性B细胞抑制炎症反应,减轻肠道炎症[7-8]。即便如此,IBD的发病机制仍然不清楚,有待进一步研究[9]。
近年来,免疫检查点抑制剂(immune checkpoint inhibitors,ICI),如细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)阻断抗体(Ipilimumab)、程序性死亡蛋白1(programmed cell death protein 1,PD-1)阻断抗体(Nivolumab/Pembrolizumab)或程序性死亡受体配体1(PD-1 ligand,PD-L1)的阻断抗体对肿瘤患者的疗效显著[10]。但接受ICI治疗后,部分肿瘤患者出现严重的免疫相关不良事件(immune-related adverse events,irAEs), 自 Nivolumab、Pembrolizumab 和Atezolizumab等药物上市以来,有关ICI治疗后致死的报道不断增加。Ipilimumab单药治疗时,致死性irAEs中结肠炎/腹泻非常普遍。抗PD-1/PD-L1单药使用也可以导致严重的结肠炎,联合疗法致死数量显著增加。以上研究表明,应对接受ICI治疗的患者引起的致死性irAEs的风险进行全面评估,深入研究胃肠道免疫相关不良事件的发生机制。ICIs治疗的免疫原理是重新激活耗竭的CD8+T细胞,增强效应分子的表达以杀伤肿瘤细胞。因而,我们推测激活的CD8+T细胞参与胃肠道免疫相关不良反应。葡聚糖硫酸钠盐(dextran sodium sulfate,DSS)诱导的小鼠结肠炎模型,符合人类IBD患者肠道炎症和发病机制的主要特征,也是目前研究肠道炎症使用最广泛的实验动物模型[11-12]。因此,本研究拟使用DSS诱导的结肠炎模型,初步探讨CD8+T细胞在结肠炎中的作用及其机制。
1 材料与方法
1.1 实验动物
健康SPF级C57BL/6野生型(WT)雄性小鼠46只,鼠龄8~10周,体质量24~26 g,购自上海斯莱克实验动物公司,动物生产许可证号为SCXK(沪)2017-0005。将WT小鼠随机进行分组:未造模组(n=6)、经2%(质量浓度,下同)DSS诱导结肠炎组(n=14)、3% DSS诱导结肠炎组(n=16)和4%DSS诱导结肠炎组(n=10)。
B6.129S2-Cd8atm1Mak/J (编号002665) CD8敲除小鼠(简称CD8-/-小鼠)34只,性别、鼠龄与野生型小鼠相同,体质量25~27 g,由美国The Jackson Laboratory提供。CD8-/-小鼠分组:2% DSS诱导组(n=14)、3% DSS诱导组(n=12)和4%DSS诱导组(n=8)。
实验小鼠饲养在上海交通大学医学院附属仁济医院实验动物屏障设施内,动物使用许可证号为SYXK(沪)2016-0009。小鼠饲以60Co辐照杀菌饲料,自由进食。饲养条件:温度22~24 ℃,空气相对湿度40%~60%,光照周期为12 h/12 h。本研究的动物饲养条件符合相应实验动物等级标准,所有动物相关操作均按照上海交通大学医学院附属仁济实验动物伦理委员会的规定执行。
1.2 主要试剂和仪器
DSS(MP Biomedicals,美国),4%多聚甲醛(谷歌生物,中国),QuantStudio 7荧光定量PCR仪(ABI,美国),TRIzol试剂(Invitrogen,美国),超净工作台、CO2培养箱(Thermo Scientific,美国),光学显微镜(Nikon,日本),cDNA反转录试剂盒和SYBR荧光定量PCR试剂盒(Takara,日本),Aperio切片扫描仪(Leica,德国),EVOS FL细胞成像系统(Thermo Fisher,美国),BZX710荧光显微镜(Keyence,日本)。
1.3 实验方法
1.3.1 急性结肠炎模型的诱导 用高压灭菌的双蒸水配制质量浓度为2%~4%的DSS溶液,WT小鼠和CD8-/-小鼠连续饲喂DSS 溶液7 d,然后更换为正常饮水喂养至实验终点,监测小鼠存活情况,绘制生存曲线至诱导后第14日。每日测量小鼠体质量。疾病活动指数(diseases activity index,DAI)为以下3项参数的平均值:①粪便稠度(无腹泻为0分,粪便变软为2分,明显腹泻为4分)。②血便(无出血为0分,可疑阳性为2分,肉眼可见血便为4分)。③体质量变化(无体质量减轻为0分,体质量减轻1%~5%为1分,体质量减轻6%~10%为2分,体质量减轻11%~20%为3分,体质量减轻超过20%为4分)。
1.3.2 结肠组织病理观察和评分 2%DSS诱导小鼠急性结肠炎后第10日,收集WT小鼠和CD8-/-小鼠远端结肠,用4%多聚甲醛固定24 h后石蜡包埋,连续切片(6 μm),然后用苏木精 - 伊红(H-E)染色。小鼠组织病理学评分采用双盲方法[13],观察2%DSS处理后WT小鼠和CD8-/-小鼠肠道炎症反应程度,包括隐窝结构破坏和丧失(正常为0分,隐窝位于黏膜上为1分,严重隐窝结构异常为2分,整个隐窝丢失为3分)、炎症细胞浸润程度(正常为0分,明显炎症浸润为3分)、肌层增厚(无增厚为0分,明显的肌层增厚为2分,肌层透壁性坏死为3分)、隐窝脓肿(不存在为0分,存在为1分,中度为2分,重度为3分)和杯状细胞耗竭(不存在为0分,存在为1分,中度为2分,重度为3分)。小鼠组织病理学评分为以上3项评分的平均值。
1.3.3 实时荧光定量PCR 2%DSS诱导小鼠急性结肠炎后第10日,收集小鼠中段结肠组织,于液氮速冻后通过酚-氯仿法提取总RNA。根据反转录试剂说明书要求,取400 ng RNA反转录为cDNA。促炎症和抑炎症细胞因子mRNA表达水平用SYBR染料和实时荧光定量PCR仪检测。根据实时荧光定量PCR原始检测结果,以β-actin作为内参基因,用2-ΔΔCt方法进行定量分析。基因引物序列见表1。
1.4 免疫荧光染色观察结肠黏膜固有层中CD8+ T细胞浸润情况
2% DSS诱导后第10 日,收集小鼠远端结肠组织,用封闭液(1% BSA)封闭60 min,一抗(大鼠抗小鼠CD8,Abcam)4 ℃孵育过夜,二抗使用驴抗大鼠Alexafluor 488(Thermo Fisher)。细胞核用DAPI染色。采用EVOS FL细胞成像系统和BZ-X710荧光显微镜拍照,采用Photoshop CS4(Adobe)分析。
1.5 统计学分析
采用GraphPad Prism 8.2软件进行统计学分析,定量资料采用x—±s表示。通过对数秩检验(Log Rank)进行生存曲线分析,采用Mann-WhitneyU检验、单因素方差分析对数据进行统计分析。P<0.05表示差异具有统计学意义。
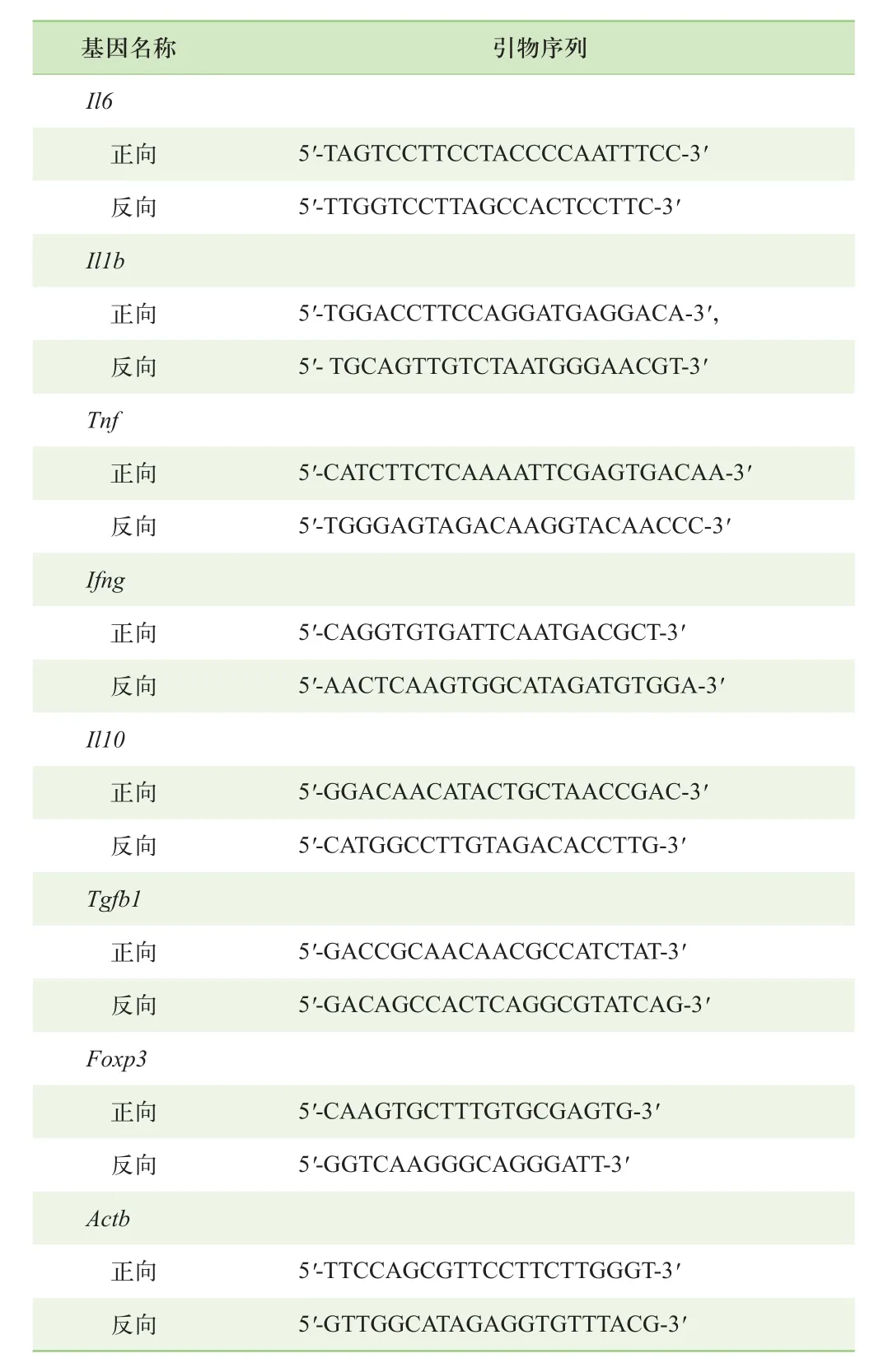
表1 PCR引物序列Tab 1 Primer sequences for PCR
2 结果
2.1 DSS诱导的小鼠结肠炎发病情况
2% DSS诱导后第3~10日,WT小鼠体质量持续急剧下降,但CD8-/-小鼠体质量在第3~8日下降速度较慢,且在第9日呈现上升趋势(图1A)。野生型小鼠在诱导急性结肠炎后表现出更为严重的结肠炎症状,包括精神不振、肛门粘连、严重的腹泻和大量血便。CD8-/-小鼠DAI较WT小鼠明显降低(图1B)。结肠长度缩短通常被视为结肠损伤的宏观参数,WT小鼠结肠长度比CD8-/-小鼠减少近30%(图1C)。H-E染色观察结果显示,WT小鼠肠道病理改变较CD8-/-小鼠严重,结肠隐窝结构几乎全部丧失、黏膜下层伴随大量淋巴细胞浸润。与WT小鼠比较,CD8-/-小鼠肠道黏膜结构较完整,组织病理学评分显著降低(图1D、1E)。
2.2 高浓度 DSS诱导急性结肠炎小鼠存活情况
WT和CD8-/-小鼠经4%DSS诱导肠炎后,均出现腹泻和血便,体质量明显下降。CD8-/-小鼠体质量下降幅度较小(图2A),结肠长度较WT小鼠长(图2B)。WT组小鼠在第7日全部死亡,CD8-/-组全部存活(图2C)。DSS诱导的结肠炎严重程度可随着DSS给药时间及浓度增加而增加,将小鼠体质量减轻超过初始体质量30%视为应激指标,此时应达到动物实验伦理终点。因此,后续实验使用3% DSS评估CD8-/-小鼠存活情况。结果显示,WT小鼠存活率仅为37.5%(6/16),而CD8-/-小鼠存活率为66.7%(8/12),约为WT小鼠存活率的2倍(图2D)。
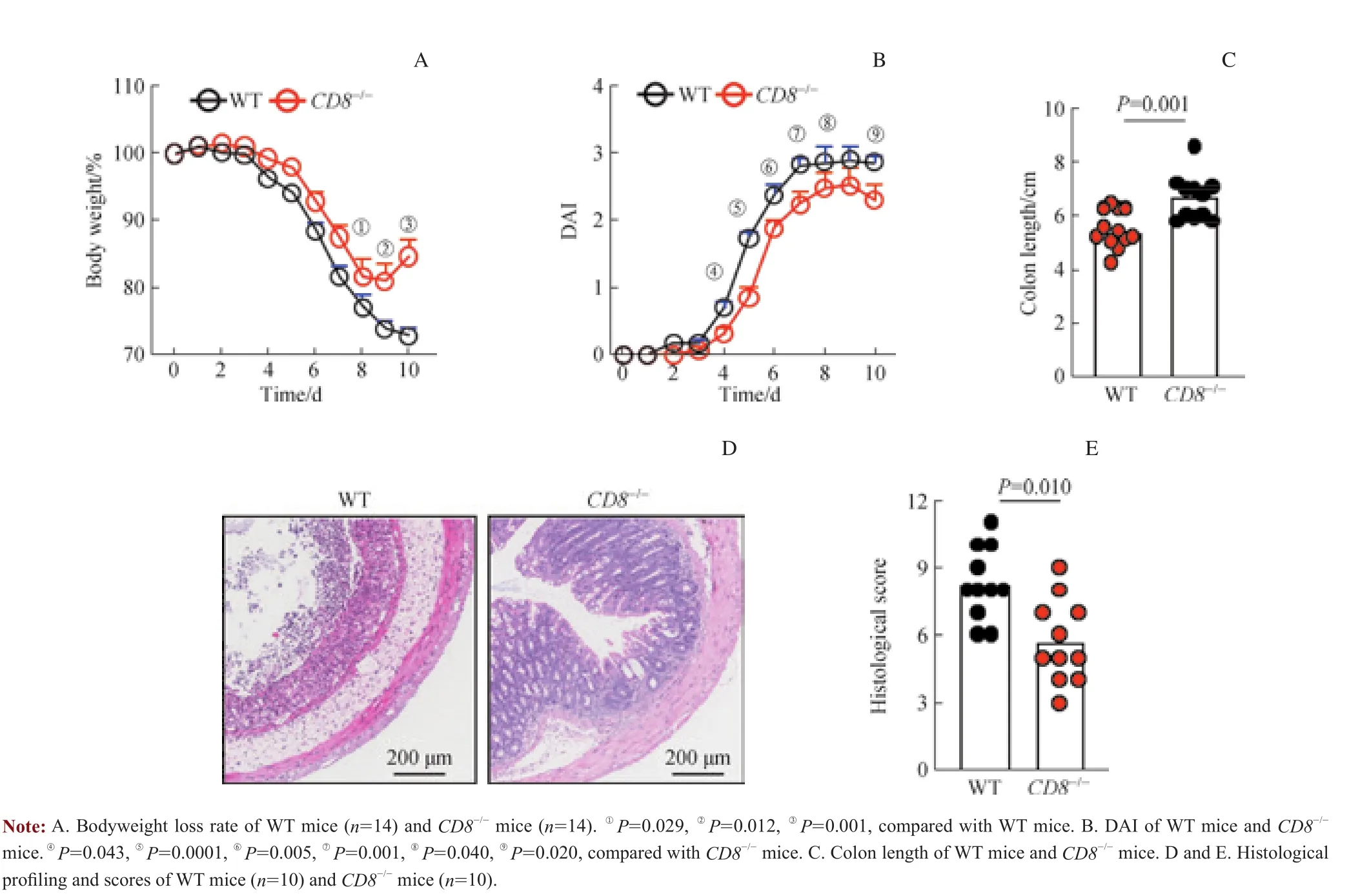
图1 2%DSS诱导后小鼠体质量、结肠长度和组织病理学变化Fig 1 Weight loss, colon shortening and histopathology changes in 2% DSS-induced mice
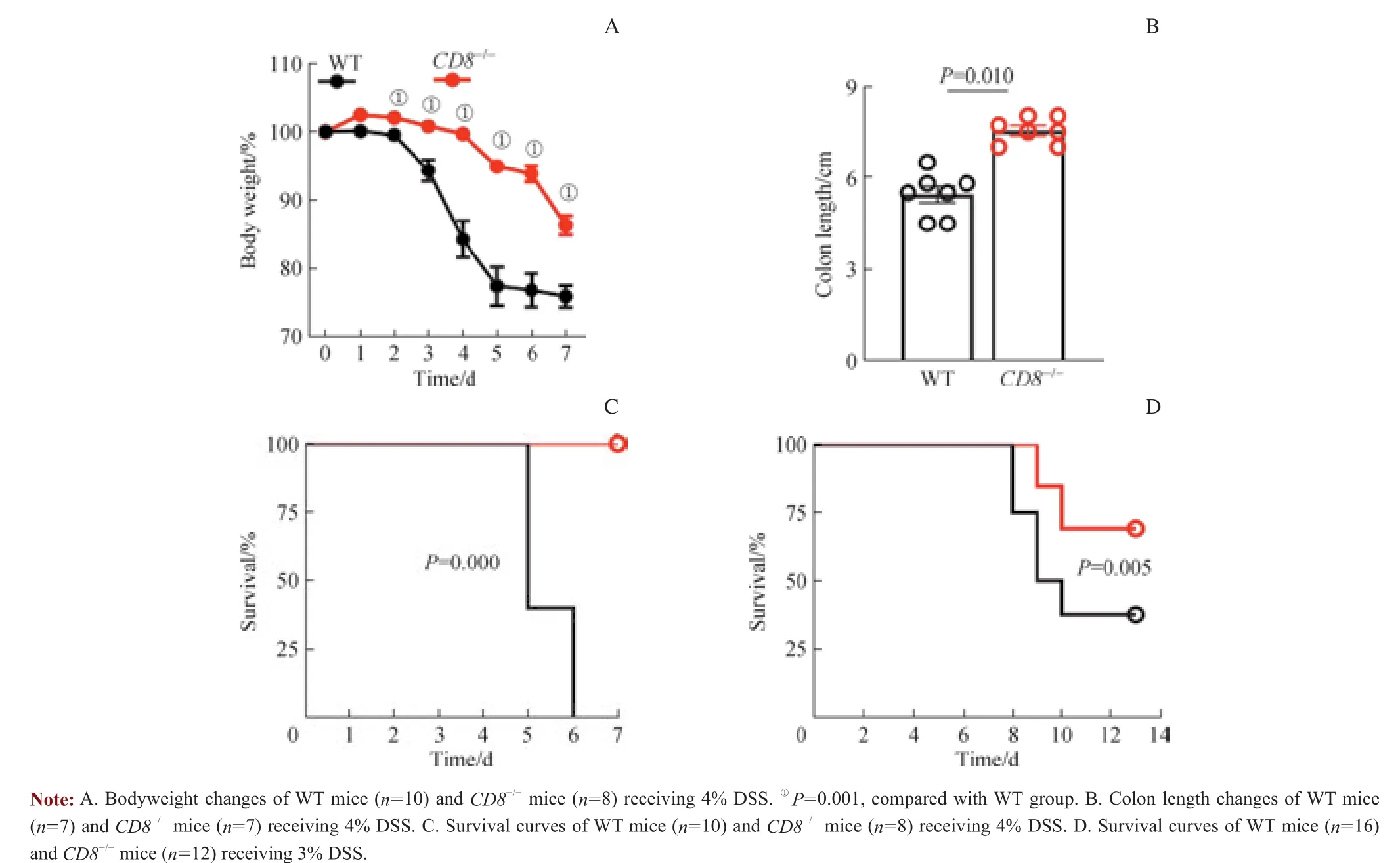
图2 高浓度DSS诱导后小鼠体质量、结肠长度变化及存活情况Fig 2 Changes of weight, colon length and survival rate of mice induced by high concentration of DSS
2.3 CD8-/-小鼠结肠炎症因子表达变化
2% DSS诱导肠炎后第10 日,RT-PCR检测结果(图3)显示:WT小鼠结肠组织中的促炎症细胞因子Il1b、Il6、Il17a、Ifng和TnfmRNA表达水平显著高于CD8-/-小鼠(均P<0.05)。2组抑炎症细胞因子Il10、Tgfb1和Foxp3mRNA表达水平的差异无统计学意义(均P>0.05)。
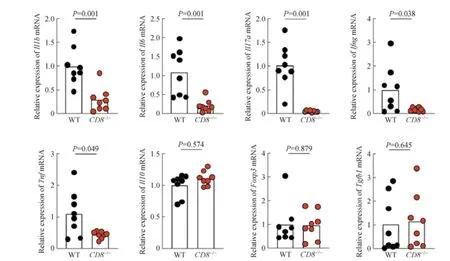
图3 CD8-/-小鼠和WT小鼠结肠组织中炎症细胞因子表达水平(n=8)Fig 3 Expression of inflammatory cytokines in colon tissues of CD8-/- mice and WT mice (n=8)
2.4 DSS诱导后结肠黏膜固有层中CD8+ T细胞浸润情况
使用2%DSS诱导结肠炎后第10日,WT小鼠免疫荧光染色检测结果显示:WT小鼠肠道固有层中可以见到浸润大量的CD8+T细胞(n=10),与未造模组(n=6)小鼠比较,差异具有统计学意义(P=0.001),见图4。

图4 DSS诱导的结肠炎小鼠结肠黏膜固有层中CD8+ T细胞浸润情况Fig 4 CD8+ T cells infiltration in colon lamina propria of mice with DSS-induced colitis
3 讨论
作为适应性免疫调节的重要组成部分,CD8+T细胞在肿瘤和慢性感染中的作用和机制被广泛研究;而对于其在慢性炎症和自身免疫性疾病中的作用关注较少,特别是CD8+T细胞在结肠炎中的作用鲜有报道[14]。IBD的发病机制尚不完全清楚,通常认为与遗传、免疫功能紊乱、肠道屏障功能破坏、组织损伤等有关[1,5]。本研究结果提示,在DSS诱导的小鼠结肠炎模型中,CD8+T细胞浸润到结肠黏膜固有层,CD8-/-小鼠存活率升高,体质量降低幅度较小。结肠组织病理学改变显示,CD8-/-小鼠肠道黏膜破坏减轻,隐窝结构相对完整,浸润到肠道中炎症细胞数量减少,炎症程度减轻。
在接受ICI治疗的肿瘤患者中,发生胃肠道免疫相关iRAEs者,经胃肠镜活检发现胃和十二指肠上皮内CD8+T细胞浸润显著增多,提示为CD8+T细胞参与PD-1阻断治疗导致的胃肠炎不良事件[15]。本研究中,通过DSS诱导小鼠急性结肠炎模型发现,WT小鼠结肠黏膜固有层中CD8+T细胞浸润数量显著增加,小鼠肠炎症状较重,而在CD8-/-小鼠急性结肠炎症状减轻。Smillie等[16]发现,与健康人群比较,IBD患者肠道黏膜中产生IL-17的CD8+T细胞会随着疾病的发生和发展而增加,而且是黏膜样本中产生肿瘤坏死因子(tumor necrosis factor,TNF)和IL-17的主要来源,提示这群CD8+T细胞可能参与并造成肠道黏膜的组织损伤和结构破坏。此外,IBD患者外周血中CD8+T细胞PD-1、CTLA-4等免疫抑制性基因模块的高表达,预示着更好的临床转归和较低的疾病复发概率[17]。并且,IBD患者外周血CD8+T细胞的转录组学特征可以作为生物标志物应用于疾病预后评估,从而指导IBD患者的临床治疗策略[18-19]。有研究发现,在IBD 患者的肠道中CD8+T细胞仍能够被T细胞信号激活并表达高水平的颗粒酶B、TNF-α和干扰素γ等效应分子,提示这些细胞可能是具有效应表征的细胞亚群[20]。可见,CD8+T细胞具有可塑性,并且在肠道黏膜稳态与炎症中的作用非常复杂,亟待进一步研究。
综上所述,在DSS诱导的小鼠急性肠炎模型中,WT小鼠造模后CD8+T细胞浸润到结肠黏固有层中并且加重结肠炎病理改变,CD8-/-小鼠存活率升高,体质量降低幅度较小,结肠破坏较轻,结肠组织中促炎症因子水平降低,证明了CD8+T细胞在急性结肠炎中的致病性。但是,其具体机制仍有待进一步研究。
