红蓝光调控茉莉开花的转录组分析
2020-04-15陈笛郭永春陈雪津王鹏杰陈桂信叶乃兴
陈笛,郭永春,陈雪津,王鹏杰,陈桂信,叶乃兴
福建农林大学 园艺学院 茶学福建省高校重点实验室,福建 福州 350002
茉莉花 (Jasminum sambac(L.)Ait.),属木樨科 (Oleaceae) 素馨属的多年生常绿灌木,是一种天然的香料及观赏植物,其根、茎、叶、花均具有药用功能,在亚热带地区广泛栽培,我国江苏省、浙江省、福建省、广东省等地有较多栽培[1]。光对植物的生长发育及形态建成是一个重要的环境因素,而光质作为重要的光环境因素,近年来受到人们日益密切的关注,有研究表明光质可调控植物开花,其中红光 (600–660 nm) 可诱导长日照植物开花,抑制短日植物开花,而蓝光与其具有相反的作用[2]。Lin等[3]的研究发现,红光和蓝光影响植物开花主要是通过调控PHY和CRY基因的表达,其中红光影响PHY基因的表达进而抑制开花,而蓝光调控CRY基因的表达来促进开花。目前,光质对植物的研究主要用于培育部分花卉,如郁金香[4]、菊花[5]等,且多是对生理生化指标的测试,如光质对叶绿素含量、氧化酶活性、可溶性糖含量及生长速率等的调控[6],鲜有从转录水平进行深入研究。
随着组学技术的快速发展及其在揭示细胞生理活动规律和代谢机理的研究中广泛应用,转录组测序技术能全面快速地获取研究对象在某一状态下基因转录信息,从中挖掘重要功能基因,揭示不同生物学性状的分子机制,且相对于传统的芯片杂交平台,转录组测序可提供更精确的数字化信号,更高的检测通量及更广泛的检测范围[7],尤其适用于还未有基因组信息的物种。目前,转录组测序技术已被广泛应用于茶树[8]、芒[9]、慈竹笋[10]等植物的研究中。
目前,关于茉莉花方面的研究主要集中在香气成分及相关合成基因的研究[11-13],而通过光质调控茉莉开花的研究尚未见报道。本研究选取双瓣茉莉花,运用Illumina Hiseq/Miseq 2000高通量测序技术,探究了以LED为光源的红光和蓝光对茉莉开花时间调控的影响,利用测序得到的大量Unigene进行比较分析不同光质处理后茉莉花的转录差异,筛选出开花调控相关的差异表达基因,研究旨在初步揭示光质调控茉莉开花的分子机制,并为茉莉开花时间的调控提供理论依据。
1 材料与方法
1.1 试材与取样
以长势一致且已过花期的3年生茉莉盆栽植株 (盆15 cm×20 cm,株高25 cm) 为试验材料,并置于昼温 (32±2)℃、夜温 (22±2)℃及相对湿度(75±5)%的植物培养箱中培养。本试验的对照组(CK) 为白色LED灯,处理组为纯红光 (Red) 和纯蓝光 (Blue),波长分别为660 nm和460 nm,光照强度均为18 μmol/(m2·s),光照周期为12 h/d,每个处理3个重复 (1盆为一个处理,每盆10株左右)。在处理过程中,观察茉莉开花情况,以现蕾时间 (处理后第7天) 最早的一组作为取样时间点,对3组分别取顶芽部位作为样品,液氮速冻后−80 ℃保存,用于后期转录组测序分析。
1.2 茉莉开花数量统计
观察并记录茉莉花经不同光质处理后茉莉花的始花期 (第一朵花蕾出现) 和花蕾数量,以及终花期 (整株花蕾不再增加) 及花蕾数量,并通过SPSS软件在P<0.05显著水平下采用LSD方法进行方差分析。
1.3 文库构建及转录组测序
参照Plant RNA Purification Reagent试剂盒(美国Invitrogen公司) 中方法提取样品总RNA,用于后续cDNA文库的构建和转录组测序;提取的RNA利用Nanodrop2000进行浓度和纯度(OD260/OD280比值) 的检测,用1%琼脂糖凝胶电泳检测其完整性,最后用Agilent 2 100测定其RIN值。
cDNA 文库的构建和转录组测序均委托上海元莘生物医药科技有限公司完成。利用带有Oligo (dT) 的磁珠从总RNA中分离出mRNA,用片段化缓冲液将其完全随机断裂成 200 bp 左右的片段序列;随后以此为模板,进行反转录实验,合成一链cDNA,随后进行二链合成,形成稳定的双链结构;加入End Repair Mix 将结构为粘性末端的双链cDNA补成平末端,随后在3′末端加上一个A碱基,用于连接Y字形的接头;最后采用TruseqTMRNA sample prep Kit试剂盒(美国Illumina公司) 进行PCR扩增富集得到 cDNA文库,并用Certified Low Range Ultra Agarose 试剂盒 (美国BIO-RAD伯乐) 回收目的条带;文库建成后,采用TBS380 Picogreen (美国Invitrogen 公司)进行定量,按数据比例混合参照cBot Truseq PE Cluster Kit v3-cBot-HS试剂盒(美国Illumina公司)进行桥式PCR扩增生成clusters,最后进行Illumina Hiseq/Miseq测序。
1.4 测序数据分析
将Illumina测序得到的原始图像数据经过Base Calling转化为序列数据 (原始数据),对原始数据进行质量控制,利用在线软件SeqPrep和Sickle进行数据过滤:将获得的读长(Reads)中接头序列剔除,以及5′端含有非AGCT的碱基和N比例达到10%的reads,测序质量值低于Q20的reads末端需要被修剪,去除长度小于25 bp的小片段,最终得到高质量的测序数据 (Clean data)。使用Trinity (http://trinityrnaseq.sourceforge.net/) 对所有clean data进行从头组装获得单一序列的转录本 (Transcript) 或基因簇 (Unigene),随后通过Blastx比对工具将这些单基因簇Unigene与蛋白质直系同源簇数据库 (COG)、基因本体数据库(GO)、京都基因和基因组百科全书 (KEGG)、蛋白质序列数据库 (Swiss-Prot) 以及NCBI非冗余蛋白库 (NR) 等蛋白数据库比对 (E值≤1e-5)并进行功能注释,并基于负二项分布模型使用edgeR (http://www.bioconductor.org/packages/2.12/bioc/html/edgeR.html) 进行差异表达分析[14-15],以差异倍数log2|FC| ≥1且P-value<0.01为筛选标准,对差异表达基因的功能、类别、代谢通路富集情况等进行注释。
1.5 实时荧光定量PCR验证
筛选出受光质影响的代谢通路差异表达基因序列设计荧光定量PCR引物 (表1),以同期茉莉花不同光质处理的叶片cDNA为模板,Actin为内参,按照Transstart®Tip Green qPCR superMix试剂盒 (北京全式金生物技术有限公司) 的操作说明进行 RT-qPCR 反应,验证转录组测序的可靠性,每个处理设置 3 个生物学重复,用2-∆∆Ct法进行定量分析。反应体系为10 µL:1 µL茉莉花叶片cDNA,0.2 µL Forward Primer,0.2 µL Reverse Primer,5 µL Transstart®Tip Green qPCR SuperMix,补3.6 µL ddH2O至10 μL。扩增程序:94 ℃预变性30 s,94 ℃变性5 s,60 ℃复性30 s (第二步至第三步重复40个循环)。
2 结果与分析
2.1 LED对茉莉开花的影响
与对照组相比较,红光处理下茉莉的始花期比对照组提前了5 d,而蓝光组延迟了3 d,且红光组相比对照组开花持续时间无显著差异,但蓝光组花期持续了9 d;茉莉植株经不同光质处理后,花蕾数量变化不同,其中红光组的花蕾数量相较于对照组有所增加,而蓝光组相较于对照组,花蕾数量减少,且各组之间花蕾数量差异显著(表2)。

表2 不同光质对茉莉开花时间及花蕾数量的影响Table 2 The effects of different light quality on jasmine flowering
2.2 茉莉花转录组测序结果质量评估及Unigene功能初步分析
根据测序产生的原始序列文件,过滤掉低质量的序列后进行统计分析。通过Trinity初步从头组装,获得2 883 742个转录本,总长度达到1 328 373 387 bp,最长序列为30 951 bp,最短序列为201 bp,平均长460.64 bp,N50长489 bp;进一步组装得到2 452 457个单基因簇Unigene,总长度为1 011 078 933 bp,最长序列为30 951 bp,最短序列为201 bp,平均长412.27 bp,N50长425 bp。对组装获得的转录本和单基因簇长度分布进行分析,结果如表3所示,所占比例最大的是100–400 bp,分别占66.026% (1 904 022条) 和68.164% (1 671 695条),其次为401–1 000 bp,分别占27.268% (786 349条) 和27.868% (683 448条)。长度大于4 000 bp的分别占0.168% (4 858条) 和0.058% (1 425条)。

表3 茉莉花转录组中转录本和单基因簇的序列大小Table 3 Sequence size (bp) of transcript and Unigene in jasmine transcriptome
将获得的2 452 457条Unigene序列通过NCBI中Blastx比对,最终结果显示 (表4),总共1 760 723条的Unigene (71.8%) 获得注释信息,其中非冗余蛋白质数据库NR比对上227 123条,蛋白质数据库Swiss-Prot比对上237 536条,蛋白质数据库Pfam比对上25 582条,STRING数据库比对上254 422条,COG数据库比对上127 517条,KOG数据库比对上284 775条,NOG数据库比对上155 211条,GO数据库比对上214 933条,KEGG数据库比对上233 624条。

表4 茉莉花转录组Unigene的功能注释统计结果Table 4 Statistics of annotation results of Unigene functional annotation in jasmine transcriptome
2.3 茉莉花转录组差异表达基因分析
以P-Value<0.05为筛选标准,且通过NR注释后的差异基因分析表明,CK vs Red产生的差异表达基因有894个,上调基因 (Up-regulated genes) 数量为727,下调基因 (Down-regulated genes) 数量为167个;CK vs Blue产生的差异表达基因有2 619个,上调基因 (Up-regulated genes)数量为1 072,下调基因 (Down-regulated genes)数量为1 681个;Red vs Blue产生了3 828个差异基因,其中2 541个上调基因,1 287个下调基因 (图1),且两两比较后,3组之间共有72个差异表达基因 (图2)。
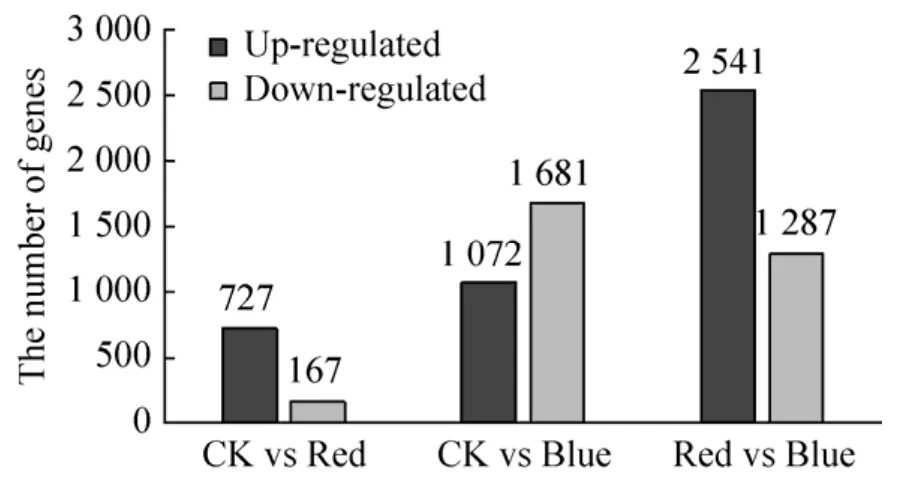
图1 茉莉花转录组两两比较之间差异表达基因分析统计Fig.1 The pattern of significantly differential expressed genes between each group in jasmine transcriptome.
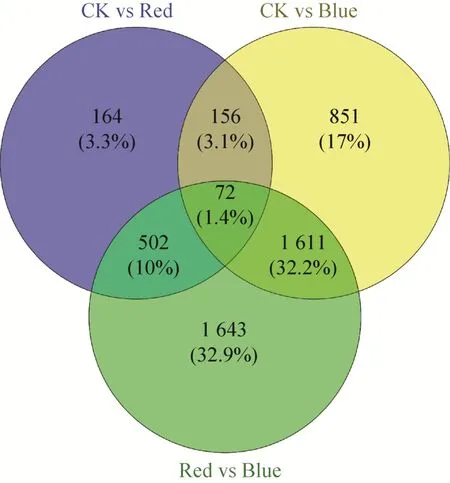
图2 茉莉花各组样本间差异表达基因Venn图Fig.2 Venn diagram of significantly differential expressed genes between each group in jasmine.
2.4 茉莉花转录组差异表达基因的GO注释分析
为探究不同组间的基因功能差异,对上述差异表达基因进行GO富集分析,通过FDR<0.001筛选出极显著的GO条目。结果显示 (图3、图4),CK vs Red有635个DEGs注释到GO数据库的生物过程、细胞组分及分子功能3大类型,其中526个上调基因,109个下调基因,其特有的显著性富集通路有71条,主要涉及碳固定(Carbon fixation)、光呼吸 (Photorespiration)、过氧化物酶体部分 (Peroxisomal part)、信使核糖核蛋白复合物 (Messenger ribonucleoprotein complex)、天冬氨酰酯酶活性 (Aspartyl esterase activity)、脱氧核糖核苷酸结合(Deoxyribonucleotide binding) 等过程;CK vs Blue有1 554个差异基因注释到GO数据库的生物过程和分子功能,其中690个上调基因,864个下调基因,其特有的显著性富集通路有65条,主要涉及花发育的负调节 (Negative regulation of flower development)、生长素生物合成过程(Auxin biosynthetic process)、细胞周期蛋白依赖性蛋白激酶活性 (Cyclin-dependent protein kinase activity)、类固醇羟化酶活性 (Steroid hydroxylase activity) 等过程;Red VS Blue有2 422个差异基因注释到GO数据库的生物过程、细胞组分及分子功能,其中1 501个上调基因、921个下调基因,其特有的显著性富集通路有157条,主要含有初级代谢过程 (Primary metabolic process)、细胞蛋白质代谢过程 (Cellular protein metabolic process)、蛋白质的复合物 (Protein-containing complex)、叶绿体外膜 (Chloroplast outer membrane)、光系统Ⅰ反应中心 (Photosystem Ⅰreaction center)、PSII相关的光捕获复合物Ⅱ(PSII associated light-harvesting complexⅡ)、花青素3ʹ-O-β-葡糖基转移酶活性 (Anthocyanin 3ʹ-O-beta-glucosyltransferase activity)、花色素还原酶活性 (Anthocyanidin reductase activity)。

图3 茉莉花转录组中上调表达DEGs的GO二级节点注释Fig.3 The GO annotation of up-regulated DEGs in jasmine transcriptome.

图4 茉莉花转录组中下调表达DEGs的GO二级节点注释Fig.4 The GO annotation of down regulated DEGs in jasmine transcriptome.
2.5 茉莉花转录组差异表达基因的KEGG富集分析
为了明确茉莉花经过不同光质处理后的差异表达代谢通路,根据上述注释结果进行KEGG富集分析。结果显示,CK vs Red有258个差异基因注释到KEGG途径166条具体分支通路,显著富集通路24条,主要包括光合生物中的碳固定(Carbon fixation in photosynthetic organisms)、植物激素信号转导 (Plant hormone signal transduction)、苯丙烷类生物合成(Phenylpropanoid biosynthesis) 等;CK vs Blue有606个差异基因注释到312条具体代谢途径,显著富集的代谢通路有32条,主要涉及植物激素信号转导(Plant hormone signal transduction)、次生代谢物的生物合成(Biosynthesis of secondary metabolites)、单萜类生物合成(Monoterpenoid biosynthesis)、苯丙烷类生物合成(Phenylpropanoid biosynthesis)等;Red VS Blue共有1 048个差异基因注释到329条代谢通路,显著富集的代谢通路36条,主要涉及核糖体(Ribosome)、植物激素信号转导 (Plant hormone signal transduction)、苯丙烷类生物合成(Phenylpropanoid biosynthesis)、光合作用-天线蛋白质 (Photosynthesis-antenna proteins)、光合作用(Photosynthesis) 等。两两比较后分别排名前5的显著KEGG富集通路见表5。
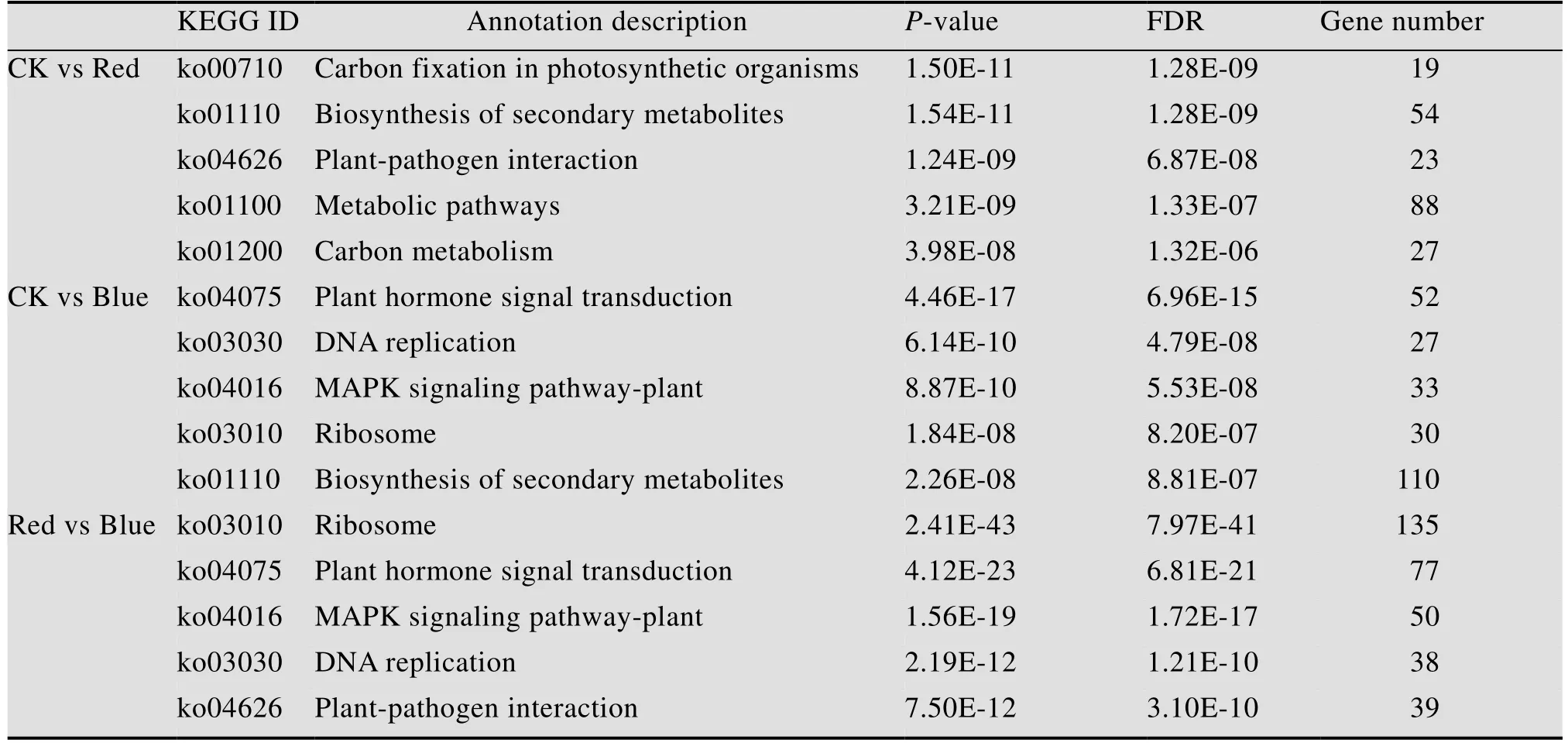
表5 茉莉花转录组中显著KEGG富集通路Table 5 The significant KEGG enrichment pathway in jasmine transcriptome
2.6 光质调控茉莉花中相关通路差异表达基因分析及荧光定量q-PCR验证
根据通路图展现的信息进一步挑选了受光质影响较大的代谢通路,主要涉及次生代谢物生物合成 (Biosynthesis of secondary metabolites)、苯丙素生物合成 (Phenylpropanoid biosynthesis)、吲哚生物碱生物合成 (Indole alkaloid biosynthesis)、光合作用 (Photosynthesis)、植物激素信号传导(Plant hormone signal transduction) 和植物-病原体相互作用 (Plant-pathogen interaction),分别从红光组和蓝光组中筛选出12条差异表达基因,采用荧光定量qPCR对24个基因的表达模式进行验证,在P<0.01水平进行显著性检验。结果表明,qPCR的相对表达量结果与转录组的结果呈极显著相关 (R2=0.763**,P=0.003),表明本次转录组测序数据及结果可靠 (图5)。
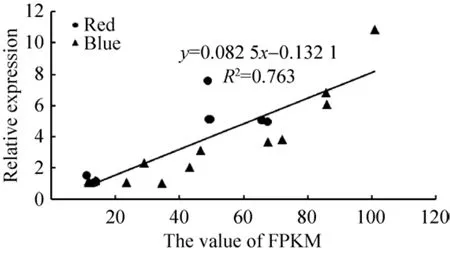
图5 实时荧光定量PCR及转录组表达水平的相关性分析Fig.5 Correlation analysis of RT-qPCR and RNA-seq.
2.7 光质调控茉莉开花相关基因的分析
光质主要通过不同光受体感应并进行信号转导,从而影响植物生长发育,本研究中为找到不同光质调控茉莉开花的相关差异基因,比较分析CK vs Red、CK vs Blue及Red vs Blue的转录组表达模式。结果显示,从该转录组数据中共找到与光周期途径相关的基因包括红光受体基因PHY、蓝光受体基因CRY1及LHY和ELF3,自主途径相关基因FPA,春化途径相关基因VIN、VRN、ELF4,开花整合因子AGL和SOC1,与成花诱导相关的bHLH、MYB及WRKY转录因子家族成员 (表6),以及IAA、ETH、GA、CTK、ABA、SA及JA相关植物激素信号转导基因(表7)。

表6 茉莉花转录组中开花调控相关基因的表达模式Table 6 The expression pattern of DEGs related to flowering regulation in jasmine transcriptome
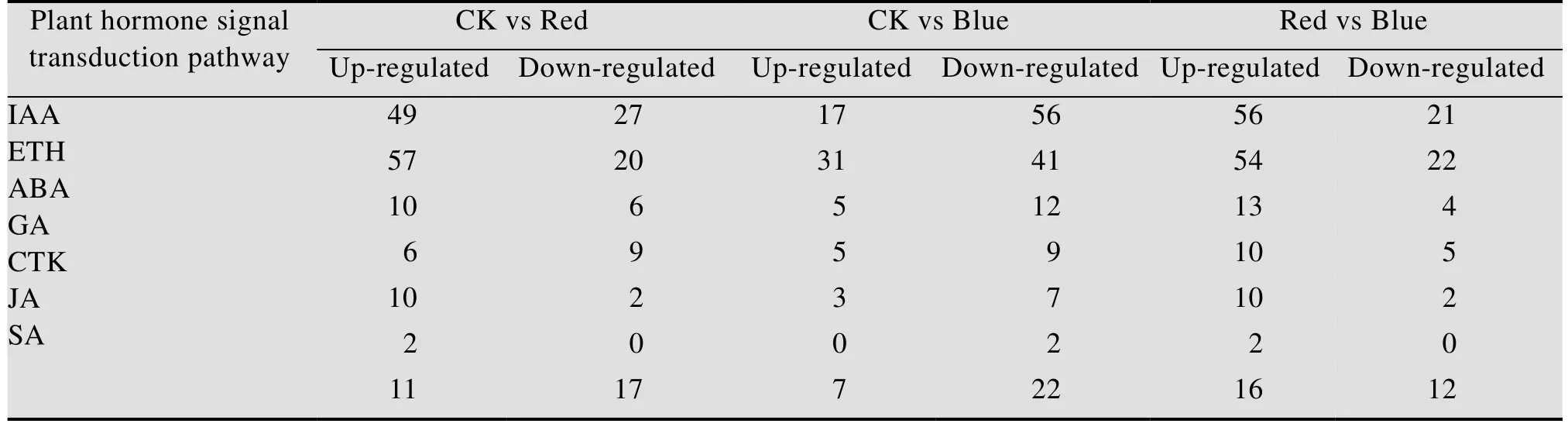
表7 茉莉花转录组中植物激素信号转导相关基因的表达模式Table 7 The expression pattern of DEGs about plant hormone signal transduction pathway in jasmine transcriptome
进一步分析表明,植物激素信号转导相关基因数量最多,共有234个,其中ETH数量最多,占总基因33.76%,其次为IAA,占总基因32.9%,在CK vs Red、CK vs Blue及Red vs Blue中差异表达基因数量分别有28个、78个、101个;开花调控相关基因在CK vs Red中基因数量最多,其次为对照组vs蓝光组,但在CK vs Red中无差异表达,CK vs Blue中仅8个基因差异表达,但下调表达基因数量多,Red vs Blue中9个基因差异表达,上调表达基因数量多;与成花整合因子相关基因SOC1和AGL各含有5个,差异表达基因下调数量多;bHLH、MYB及WRKY转录因子家族成员基因在CK vs Red中共找到115个,差异表达的基因有28个;在CK vs Blue中共找到107个bHLH、MYB及WRKY转录因子家族成员基因,差异表达的基因有25个;Red vs Blue中133个bHLH、MYB及WRKY转录因子家族成员基因,差异表达的基因有50个。CK vs Red、CK vs Blue及Red vs Blue差异表达基因模式如图6所示。


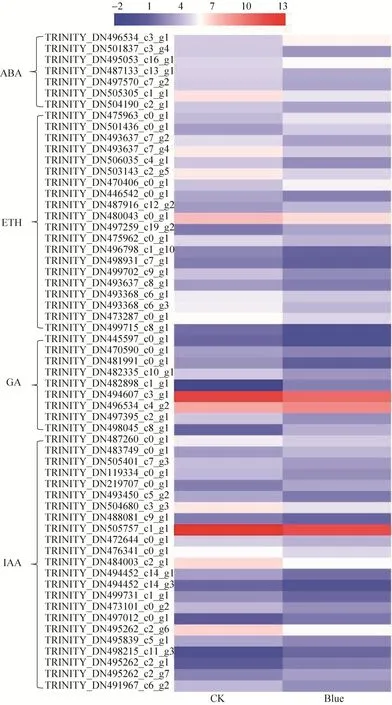



图6 茉莉花转录组中调控开花相关差异表达基因热图Fig.6 The heatmap of flowering-related differential expressed genes in jasmine transcriptome.
3 讨论
转录组技术已在园艺植物中广泛应用研究。刘之慧等[16]通过对草莓组培苗进行红蓝光处理,其转录组结果发现糖酵解/糖异生代谢通路、卟啉和叶绿素代谢通路、光合作用、植物激素信号转导通路为主要受影响通路,其差异表达基因数量随着蓝光比率的下降而减少,且下调基因数量增多,说明蓝光对草莓组培苗的生长发育影响较大。本研究发现茉莉花在不同光质下,其光合作用、植物激素信号转导途径及苯丙烷生物合成通路相关基因差异极显著,在红光处理下的差异基因数量低于蓝光组,但蓝光中下调基因数量居多,推测蓝光对茉莉花开花有较大影响;但研究表明茉莉花在红光下花期提前,而在蓝光花期相比对照组延迟,而有研究结果表明蓝光可诱导短日照植物开花,抑制长日照植物开花,而红光的作用与之相反[17-18]。
本研究从该转录组中共找到14个光敏色素PHY基因,包括PHYA、PHYB、PHYC及PHYE,3个隐花色素基因CRY1,1个LHY基因,其中差异表达的基因有3个PHY基因及2个CRY1基因,均在蓝光中下调表达,在红光中上调表达,而光敏色素基因PHY基因为光周期途径上游调控基因,隐花色素基因CRY为其下游调控基因,不同光质通过调节CRY和PHY基因的表达进而调控茉莉花开花早晚。植物开花受多种途径调控,其通过影响植物开花时间基因FT调控下游开花整合因子,进而调控开花,SOC1和AGL为成花整合因子,属于MADS-box基因,可被蓝光诱导表达促进拟南芥开花[19]。本研究中总共鉴定到5个SOC1同源基因和5个AGL同源基因,在不同光质作用下表现出不同的表达模式,在红光中上调表达基因数量多且高表达,而在蓝光中相对较低,且5个AGL同源基因中未发现与SOC1功能相似的AGL24基因,由此说明不同的植物中调控植物开花的AGL基因可能会有所不同[15]。
植物激素信号转导作为光质影响的主要通路之一,在植物成花诱导中也发挥着重要作用,如乙烯可促进雌花发育[20],而GA促进雄蕊的发育,IAA可通过诱导乙烯的合成从而促进雌花发育,JA可通过不同途径影响植株雌花的发育[21],ABA因植物种类不同而起到促进雌花或雄花的发育[17],CTK可促进植物开花结实[22]。本研究中红光不仅诱导茉莉花提前开花,且增加始花期花蕾数量,通过转录组数据分析发现,与植物激素信号转导相关的差异表达基因中数量最多的为ETH(33.76%),其次为IAA(32.9%)、SA(12.39%)、GA(7.69%)、ABA(7.26%)、CTK(5.13%),表明光质调控茉莉开花是多种植物激素协同作用,其中ETH可能起主导作用。GA途径作为植物开花途径中重要调控途径之一,在红光中高表达,而在蓝光中下调表达基因较多,茉莉花花芽中检测到的GA信号转导相关基因,在蓝光中下调表达数量居多。有研究表明红光可通过光敏色素诱导GA合成相关酶基因的表达进而提高赤霉素含量,而在PHYA和PHYB突变体中该酶基因不表达或表达量无显著变化[23];PHYA 在远红光处理下正调节 ABA 信号,而PHYB负调控ABA的积累,因此光质可能通过不同光受体调节植物激素进而调控植物花芽分化[24]。
转录因子在植物生长发育各阶段均可发挥作用,大部分研究表明转录因子在逆境胁迫中发挥重要作用,而较少研究证明其在植物开花诱导中发挥着作用[25]。bHLH家族成员光敏色素互作因子PIFs可与光信号直接作用,如PIF3可直接激活乙烯信号转导途径中EIN3转录因子[26],PIF4可以激活植物开花时间基因FT[27]。WRKY 家族中的WRKY25通过调节开花整合因子API调控植物开花[28],而WRKY20可能通过调控开花相关基因FT、SOC1、CO等从而提早开花[29]。本研究中筛选出bHLH、MYB及WRKY三大类转录因子家族基因,其中bHLH转录因子最多,包括PIF1、PIF3及PIF7,其次为WRKY转录因子,主要有WRKY40和WRKY70,MYB转录因子数量较少,主要有MYB2、MYB44及MYB52,在红光中多为上调表达,而在蓝光中均为下调表达,由此说明不同的植物中调控植物开花的相关转录因子可能会有所不同。本研究通过不同光质作用于茉莉花,经转录组测序数据分析,推测光质调控茉莉花开花与植物激素、转录因子及开花途径相关基因的表达有关,为茉莉花开花时间的研究提供了一定的理论基础,而光质调控茉莉花开花时间的机制还有待进一步深入研究。
