绵羊粒细胞集落刺激因子原核表达与提纯及用于颗粒细胞培养的效果
2020-04-15李闰婷陈龙欣张丽萌何海迎王泳杨若晨段春辉刘月琴王玉琴张英杰
李闰婷,陈龙欣,张丽萌,何海迎,王泳,杨若晨,段春辉,刘月琴,王玉琴,张英杰
1 河北农业大学 动物科技学院,河北 保定 071001
2 郑州师范学院 分子生物学实验室,河南 郑州 450044
3 河南科技大学 动物科技学院,河南 洛阳 471023
粒细胞集落刺激因子 (Granule cell stimulating factor,GCSF) 是集落刺激因子中糖蛋白生长因子中的一员,能支持造血祖细胞的增殖[1-3]。GCSF可刺激特定骨髓前体细胞增殖以及分化成粒细胞,延长中性粒细胞系各个阶段的祖细胞的存活时间,刺激多能干细胞的增殖和分化,诱导单核细胞和巨噬细胞的形成,诱导成熟中性粒细胞产生更多的中性粒细胞并提高其存活率,维持其表型,但是该蛋白的半衰期较短[1-6]。有资料显示GCSF的表达量差异可能与某些动物的抗病能力密切相关,有研究通过体外注射GCSF提高牛和狗的免疫力、提高辅助生殖率及治疗乳房炎等的报道[7-17],但尚无该蛋白用于羊的繁育方面的研究。
卵泡的生长和发育,受到来自颗粒细胞、卵泡膜细胞和卵母细胞自分泌或者旁分泌的基因、激素以及生长因子的作用和调控[18]。有研究提示细胞集落刺激因子参与了卵泡发育和排卵的生理过程,这种炎症性细胞因子可能以自分泌和旁分泌的方式参与到卵泡周期的调控当中,在发育的卵泡周围存在着巨噬细胞,这些细胞通过分泌内皮生长因子和其他细胞因子起到促进颗粒细胞增殖的作用[18]。研究发现磷脂酰肌醇3激酶(Phosphoinositide 3-kinase,PI3K)/蛋白激酶B(Protein kinase B,PKB/AKT) 和肝激酶B1 (Liver kinase B1,LKB1)/AMP活化蛋白激酶 (AMPactivated protein kinase,AMPK) 信号通路相关因子共同参与调控卵泡颗粒细胞增殖、卵泡直径变化、成熟和周期性排卵等过程[19]。有报道显示GCSF在PI3K/AKT通路中起到重要作用[20-21]。
本研究通过分子克隆的方法,原核表达羊GCSF蛋白,并将纯化的GCSF蛋白添加到体外培养的绵羊颗粒细胞中,通过细胞活力试验、细胞周期试验和凋亡试验,研究GCSF对颗粒细胞增殖和凋亡的影响,为GCSF作为分子靶点用于提高绵羊免疫力的分子遗传育种研究奠定基础。
1 材料与方法
1.1 材料
宿主菌大肠杆菌Escherichia coliXL1-Blue、原核表达载体pET28a均由郑州师范学院分子生物学实验室提供。DMEM/F12培养基为Gibco产品。E.coliBL21(DE3) 化学感受态细胞、TransGen质粒提取试剂盒、Anti-His Mouse Monoclonal Antibody、HRP标记的Goat Anti-Mouse IgG(H+L)、6× Protein Loading Buffer及DNA marker购自北京全式金生物技术有限公司。DNA胶回收试剂盒为QIAgen产品。Ni-NTA凝胶购自南京金斯瑞生物科技有限公司。ECL发光液试剂盒购自晶彩公司。Annexin-V FITC细胞凋亡检测试剂盒购自碧云天生物技术。胰酶替代物 (不含EDTA)和AlamarBlue™HS Cell Viability Reagent购自赛默飞世尔科技 (中国) 有限公司。碘化丙啶(Propidium iodide,PI) 购自Life technologies。限制性内切酶购自NEB北京。其他试剂为国产分析纯试剂。
1.2 羊GCSF的克隆
根据羊GCSF的C-末端的序列 (GenBank登录号:L07939),由GENEWIZ公司进行合成并连接到pUC57载体上。
pUC57-GCSF与载体质粒pET28a分别进行BamH Ⅰ和NcoⅠ双酶切后回收目的大小的DNA片段,用T4 DNA连接酶将两个片段连接后42 ℃热激60 s转化到感受态细胞E.coliXL1-Blue中,涂布于含有50 μg/mL卡那霉素和100 μg/mL四环素的2×YT固体培养基平板上,37 ℃培养过夜。次日挑取单克隆增菌培养后用TransGen质粒提取试剂盒提取质粒,对重组质粒进行酶切鉴定、PCR鉴定及序列测定 (GENEWIZ) 分析,将转化获得的阳性重组质粒命名为pET28a-GCSF。以热休克法 (42 ℃热激60 s) 将重组质粒pET28a-GCSF转化宿主菌E.coliBL21(DE3) 中,重组菌命名为BL21(DE3)/pET28a-GCSF。
1.3 羊GCSF的表达
取重组菌BL21(DE3)/pET28a-GCSF接种于2 mL的LB培养基 (含50 μg/mL卡那霉素) 中,37 ℃培养至OD600约为0.6时,加IPTG至终浓度为1 mmol/L,继续剧烈振荡培养5 h后,取1 mL菌液,10 000×g离心,弃上清,在沉淀中加入70 μL PBS、20 μL 6×蛋白上样缓冲液和10 μL 1 mmol/L DTT后,煮沸5 min,取10 μL用于SDS-PAGE。同时,设未诱导重组菌作为对照。确定重组羊GCSF能够表达后,进行大量摇菌表达,诱导表达方法同上。诱导表达结束后,用50 mL离心管收集全部培养物,8 000 r/min离心20 min收集菌体沉淀。
1.4 羊GCSF的纯化与鉴定
上述菌体沉淀加入20 mL的PBS溶液 (按照1︰20稀释),充分重悬菌体沉淀。对重悬液中的菌体进行冰浴超声破碎20 min,超声破碎程序:超声5 s,暂停5 s。超声后12 000 r/min离心收集上清。上清中的重组蛋白用Ni-NTA凝胶装填的重力柱进行纯化,详细的溶液配方与操作步骤参考Ni-NTA凝胶说明。主要包括2 mL的填料装填到25 mL的空柱中,依次用ddH2O和结合缓冲液各10 mL对柱子进行平衡;超声破碎后的上清全部过柱;之后用20 mL的结合缓冲液分两次洗涤柱子;待结合缓冲液全部流出后,用洗脱缓冲液洗脱柱子上结合的蛋白,并收集流出液。将所有收集的流出液用3 kDa的超滤管进行超滤浓缩,并用PBS替换其中的含有咪唑的溶液。浓缩后的样品用分子筛Superdex75 10/300 GL在AKTA蛋白纯化系统中进行精细纯化,收集进样后12 min出峰的溶液,最后再经3 kDa的超滤管进行超滤浓缩,浓缩液即为纯化的GCSF蛋白质溶液。
纯化的GCSF蛋白溶液用NanoDrop2000C测量浓度后进行分装。取2 μg用于SDS-PAGE和Western blotting检测。Western blotting检测采用硝酸纤维素膜,90 V转膜30 min,5%脱脂乳 (含有0.05%的Tween20的PBST配制) 室温封闭2 h,一抗为Anti-His Mouse Monoclonal Antibody,室温孵育1 h,二抗为HRP标记的Goat Anti-Mouse IgG(H+L),室温孵育1 h,ECL发光液显色,用多色荧光化学发光凝聚成像系统拍照保存结果。其余蛋白储存于−80 ℃备用。使用时用DMEM/F12培养基稀释至需要的浓度。
1.5 羊GCSF的活力验证
M-NSF60细胞是一种用于检测GCSF活力的细胞。从液氮中取出的M-NSF60细胞迅速在37 ℃的水浴中融化,立即转移到37 ℃预热的含10%FBS、1%双抗、2 nmol/L β-巯基乙醇、62 ng/mL hMCSF的RPMI1640培养基中重悬浮细胞,用白细胞计数板在显微镜下计数,调整细胞密度为2×104个细胞/mL,于37 ℃、5% CO2条件下培养48 h后离心收集细胞传代。进行GCSF生物学活性检测前,离心收集细胞,加入RPMI1640培养基(含10% FBS、1%双抗、2 nmol/L β-巯基乙醇) 洗涤细胞3次后,加入终浓度为0、0.03、0.30、3.00、30.00、300 ng/mL GCSF或62 ng/mL hMCSF的RPMI1640培养基 (含10% FBS、1%双抗、2 nmol/L β-巯基乙醇) 中用96孔细胞培养板培养48 h后,每孔分别再加入10 μL AlamarBlue™ HS细胞活力试剂溶液在细胞培养箱内继续孵育3 h,用EnVision®多标记微孔板检测仪在Ex/Em分别为560 nm/590 nm进行吸光值检测。
1.6 羊颗粒细胞的体外培养
从唐县瑞丽肉食屠宰场收集1岁左右的小尾寒羊卵巢,分别用医用酒精和生理盐水各冲洗表面3次后,立即放入盛有约37 ℃的生理盐水 (含1%的双抗) 的保温瓶中,3 h内带回实验室。将采回的卵巢用医用酒精冲洗3次,再用37 ℃预热的DPBS (Gibco) 缓冲液清洗3次,用已灭菌的小剪子剪掉卵巢外筋膜,将卵巢放在盛有37 ℃预热的含10% FBS (Gibco)、1.5%双抗 (Gibco) 的DMEM/F12 (Gibco) 培养基中,洗涤2次。用灭菌的刀片将卵泡直径为3–7 mm的卵泡逐个割破,用灭菌的小镊子将卵泡液挤压出来,然后将全部培养液吸至15 mL离心管中,吹打后垂直静置10 min,使卵母细胞和其他小组织沉淀,吸取上清液转移至新的无菌15 mL离心管,100×g离心10 min,弃掉上清。加入DMEM/F12培养基 (含10% FBS、1%双抗) 重悬细胞,离心洗涤 (100×g,10 min)后弃掉上清,重复3次。重悬浮细胞使之成为单细胞悬液,用白细胞计数板在显微镜下计数,调整细胞密度为2×104个细胞/mL,于37 ℃、5% CO2条件下培养,24 h后更换培养液,去除未贴壁的细胞。贴壁培养的细胞即为颗粒细胞,加入DMEM/F12培养基 (含10% FBS、1%双抗) 继续培养。
1.7 细胞增殖检测
待颗粒细胞长满至培养瓶的80%时用胰蛋白酶消化,并按1×105个细胞/mL分别接种于96孔板中,每孔100 μL,分成2个处理组:对照组 (不添加GCSF只添加DMEM/F12培养基) 和添加了不同浓度GCSF蛋白的DMEM/F12培养基稀释液的试验组 (600 ng/mL、60 ng/mL、6 ng/mL、0.6 ng/mL和0.06 ng/mL),每组设3个重复孔,连续培养2 d,每天定时加入10 μL AlamarBlue™HS细胞活力试剂溶液后在细胞培养箱内继续孵育3 h,用EnVision®多标记微孔板检测仪在Ex/Em分别为560 nm/590 nm进行吸光值检测。
1.8 细胞周期检测
待颗粒细胞长满至培养瓶的80%时用胰酶替代物 (不含EDTA) 消化,并按2×105个细胞/mL的密度接种4 mL于60 mm细胞培养皿中,分成2个处理组:对照组 (不添加GCSF只添加DMEM/F12培养基) 和添加了60 ng/mL GCSF蛋白的DMEM/F12稀释液的试验组,每组设3个重复。颗粒细胞处理24 h后,用胰酶替代物 (不含EDTA) 消化处理细胞3 min,100×g离心3 min收集细胞。PBS重悬细胞100×g离心3 min洗涤一次。细胞用1 mL的PBS重悬后,加入−20 ℃预冷的无水乙醇4 mL,边加边混匀,避免细胞结团。固定细胞过夜后,离心收集细胞,用含有2%FBS的PBS重悬细胞。加入终浓度为1 μg/mL的PI对细胞进行染色,避光室温孵育15 min。用流式细胞仪进行检测,每次计数最少2×104个细胞,结果用NovoExpress软件进行细胞周期拟合分析。
1.9 细胞凋亡检测
待颗粒细胞长满至培养瓶的80%时用胰酶替代物 (不含EDTA) 消化,并按1×105个细胞/mL的密度接种2 mL于6孔板中,分成2个处理组:对照组 (不添加GCSF只添加DMEM/F12培养基)和添加了60 ng/mL GCSF蛋白的DMEM/F12稀释液的试验组,每组设3个重复孔,继续培养24 h和48 h后,用胰酶替代物 (不含EDTA) 消化处理细胞3 min,加入含10% FBS的细胞培养液终止消化,将细胞轻轻吹打下来转入无菌的2 mL离心管中,100×g离心5 min。用含2% FBS的PBS洗涤细胞2次,100×g离心5 min,弃上清。加入500 μL结合缓冲液使细胞悬浮,分别单独或同时加入Annexin-V FITC 5 μL和PI染液5 μL,轻轻吹打混匀,室温 (25 ℃) 避光反应15 min后采用流式细胞仪进行检测。
1.10 统计分析
采用GraphPad 6.0软件进行统计分析。试验数据以表示。P<0.01表示差异极显著,P<0.05表示差异显著。
2 结果与分析
2.1 羊GCSF的克隆、表达与纯化
扩增得到的GCSF基因片段分别经双酶切后,回收目的片段,连接到同样经过双酶切的pET28a载体上并转化到E.coliXL1-blue宿主菌株中后,分别提取质粒进行PCR、酶切和测序鉴定,结果均与预期相符,其中测序结果与之前用L07939的序列绘制的质粒图谱比对结果如图1所示,测序得到的序列与预期序列完全一致。鉴定正确的质粒命名为pET28a-GCSF。

图1 GCSF基因片段的测序比对结果Fig.1 Alignment of GCSF sequence.The residues that match the pET28a-GCSF were hidden as“.”.
经鉴定正确的pET28a-GCSF转化到E.coliBL21(DE3) 中,将重组菌命名为BL21(DE3)/pET28a-GCSF。分别培养重组菌OD600达到0.6后,用IPTG诱导目的蛋白表达并纯化后进行SDS-PAGE和Western blotting检测 (图2)。
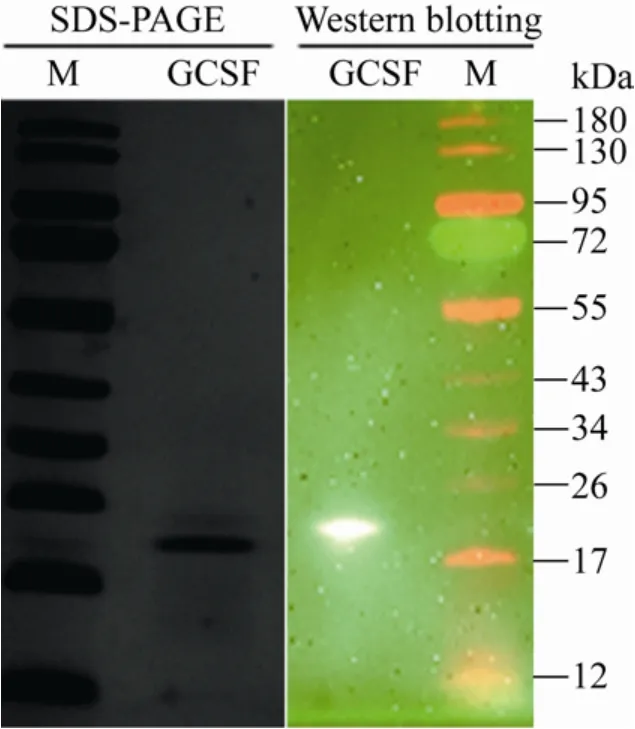
图2 SDS-PAGE和Western blotting检测纯化的GCSF蛋白Fig.2 SDS-PAGE and Western blotting analysis of purified GCSF protein.
2.2 羊GCSF的生物学活性检测
羊GCSF的生物学活性如图3所示。在0.03–300.00 ng/mL的终浓度范围内,随着加入GCSF蛋白浓度的增加,M-NSF60细胞的荧光强度逐渐升高。添加了羊GCSF的试验组中的M-NSF60细胞的荧光强度与阳性对照组趋势一致。证明本研究纯化的蛋白有GCSF生物学活性。
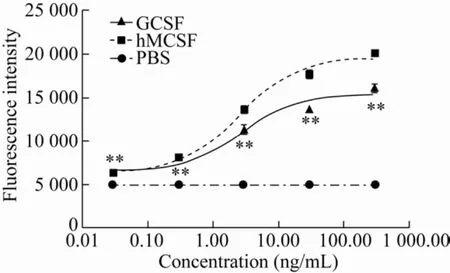
图3 GCSF蛋白的生物学活性检测结果Fig.3 Bioassay of GCSF protein.The data were averaged across subjects and tested for significance by pair-samples t-test.The P value of GCSF group vs PBS group.**:P<0.01.
2.3 GCSF对绵羊颗粒细胞增殖的影响
本实验室前期研究显示,体外培养的绵羊卵巢颗粒细胞,第1天颗粒细胞处于贴壁生长期,细胞缓慢生长,培养第2–4天细胞处于分裂高峰期,细胞开始大量增殖进入对数生长期,第4–5天之后,细胞开始走向衰老退化[17]。本研究中,颗粒细胞中添加了不同浓度的GCSF后,连续2 d,每天定时加入10 μL AlamarBlue™HS细胞活力试剂溶液后在细胞培养箱内继续孵育3 h,用EnVision®多标记微孔板检测仪在Ex/Em分别为560 nm/590 nm进行检测。结果如图4所示,在培养时间24 h和48 h、GCSF浓度0.06–600.00 ng/mL的范围内,随着加入的GCSF终浓度增加,荧光强度增大。其中在24 h添加GCSF浓度为6.00 ng/mL和60.00 ng/mL时与对照组相比差异极显著 (P<0.01),浓度为 0.60 ng/mL和600.00 ng/mL时与对照组相比差异显著 (P<0.05);48 h添加GCSF浓度为60.00 ng/mL和600.00 ng/mL时与对照组相比差异显著(P<0.05)。细胞活力与荧光强度成正比。
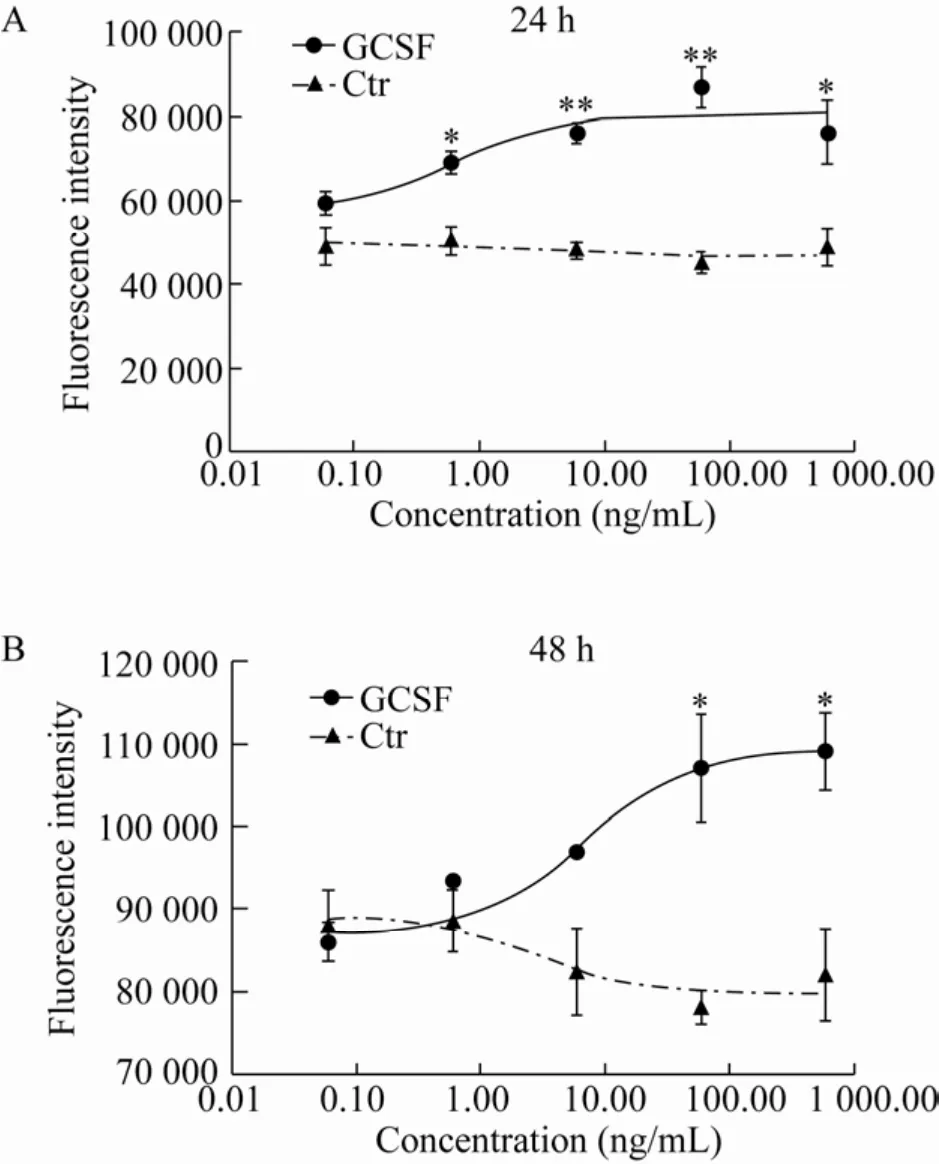
图4 GCSF对绵羊颗粒细胞增殖的影响Fig.4 The effection of GCSF on proliferation of sheep granulosa cells.The data were averaged across subjects and tested for significance by pair-samples t-test.The P value of GCSF group vs Ctr group.*:P<0.05;**:P<0.01.
2.4 GCSF对绵羊颗粒细胞周期的影响
外源添加GCSF培养颗粒细胞24 h后,细胞周期拟合结果如图5所示,与对照组相比试验组G1期细胞比例由 (63.98±1.32)%变为 (65.45±2.39)%,略有增加,差异不显著;S期细胞比例由(26.88±2.62)%变为 (15.53±1.72)%,显著减少(P<0.05),G2/M期细胞比例由 (9.37±0.84)%变为(16.94±2.06)%,显著增多 (P<0.05)。
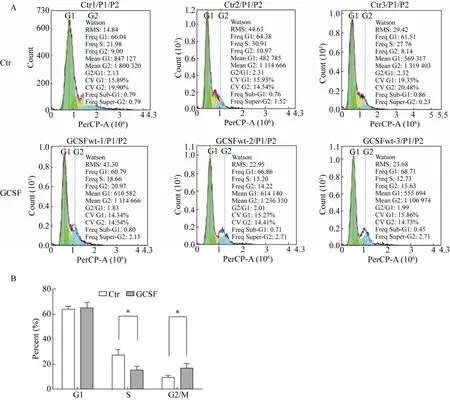
图5 细胞周期比较图Fig.5 Cell cycles analysis.(A) Cell cycle histogram of the flow cytometry.(B) The statistical analysis of GCSF group vs Ctr group was based on the values of each phase.Note:The data were averaged across subjects and tested for significance by pair-samples t-test.The P value of GCSF group vs Ctr group.* P<0.05.
2.5 GCSF对绵羊颗粒细胞凋亡的影响
颗粒细胞经GCSF处理后,经过AnnexinVFITC/PI染色如图6所示,检测结果将凋亡细胞(早期凋亡和晚期凋亡)、正常活细胞和坏死细胞区分开。24 h时对照组 (Ctr) 和试验组 (GCSF) 的凋亡率分别是 (7.02±0.35)%和(6.49±0.32)%。48 h时对照组和试验组的凋亡率分别是 (10.25±0.51)%和(8.09±0.41)%。试验组凋亡率和对照组相比,24 h检测时凋亡率差异不显著,48 h检测时凋亡率显著降低 (P<0.05)。

图6 GCSF处理后绵羊颗粒细胞凋亡图Fig.6 Treatment with GCSF on apoptosis in cultured sheep granulosa cells.Q2-4:early apoptotic cells;Q2-2:late stage apoptotic cells;Q2-3:normal living cell;Q2-1:dead cells.
3 讨论
GCSF可刺激粒细胞分化,延长中性粒细胞系各个阶段的祖细胞的存活时间,诱导成熟中性粒细胞增殖并提高其存活率,维持其表型,但是该蛋白的半衰期较短,体内研究中其他物种来源的GCSF半衰期一般在24 h以内[1-6]。持续时间越长,添加到培养基中的GCSF的剩余浓度越小,相对应的生物学活性也会随之降低。本研究表达纯化的羊GCSF蛋白用于活力检测时,参考了以往的研究报道[6],选择了在培养基中添加羊GCSF蛋白后的48 h这一时间点进行检测;在对颗粒细胞的影响的研究中,也选择了48 h以内的时间点进行检测。GCSF对绵羊颗粒细胞增殖的影响中,24 h结果中GCSF组与对照组相比有两对是差异极显著的,而48 h结果中仅为差异显著,这也很可能是由于添加到培养基中的GCSF蛋白被代谢消耗后浓度降低造成的。GCSF作为一种生物大分子,需要与其受体GCSF-R (granulocyte colony stimulating factor receptor) 结合,相互作用后将信号传导进入细胞。羊GCSF-R在羊颗粒细胞表面是否存在及存在量多少尚未得到验证,有待继续研究。本研究中使用的颗粒细胞为同一羊的卵巢中统一条件下分离用于后期实验,可以排除细胞实验条件的差异。此外,细胞增殖、凋亡和周期检测的结果可以互相印证羊GCSF促进细胞增殖,抑制细胞凋亡活性。
有研究表明GCSF有助于由化疗引起的大鼠卵泡严重损失的恢复[22-23]。卵泡从生长到成熟期包括募集、选择、优势化和闭锁几个重要环节,仅有少部分卵泡可以在发育过程之后成熟,大部分在卵泡发育的不同阶段逐渐闭锁退化[24]。在哺乳动物卵泡发育的各个时期受到一些与之相关的分子及信号通路的调控[24]。吴正中等发现使用GH组与未使用GH组卵相比,泡液GH与IGF-1含量及卵泡液E2浓度和卵巢颗粒细胞上GHR mRNA、IGF-1R mRNA和STAR mRNA的表达水平均显著正相关[25]。本研究结果表明GCSF的添加促进颗粒细胞的增殖。作为集落刺激因子的糖蛋白生长因子中的一员,可能以与GH相同的方式发挥作用,需要进一步验证。
细胞进入分裂期后,会严格执行细胞周期各阶段的程序及分子事件。细胞分裂周期主要分为3个阶段,包括:G1期,主要是细胞器的复制,细胞增大;接着,细胞进入S期,主要是DNA的复制;最后细胞进入G2/M期,细胞将各组分平均分配到各个子细胞中。通过流式细胞术可以很容易地检测细胞周期的不同阶段。如本研究图3所示,颗粒细胞经GCSF处理后,流式细胞仪结果显示,S期细胞显著减少,G2/M期细胞显著增加,处于分裂状态的细胞显著增加,在GCSF的动员下,颗粒细胞分裂速度加快,细胞周期的分布显著改变。
卵巢颗粒细胞的增殖和凋亡在卵泡闭锁中起重要的作用[26]。在发育卵泡中,10%的颗粒细胞凋亡将注定卵泡闭锁[23]。细胞凋亡是一种程序化的细胞自主死亡过程,在细胞凋亡的不同阶段具有不同的生物化学变化和细胞形态特征[27]。细胞凋亡有死亡受体通路、线粒体通路和内质网通路3条信号转导通路。颗粒细胞的凋亡主要参与两个途径(线粒体途径和死亡受体途径),这两个途径都能交汇Caspase家族的信号分子。颗粒细胞凋亡是由Caspase-3酶的活性、促凋亡和抗凋亡蛋白决定的[21]。有研究显示,GCSF可以在大鼠脑溢血模型中通过PI3K/AKT通路显著调高抗凋亡因子B细胞淋巴瘤-2 (B cell lymphoma-2,Bcl-2) 和血管内皮生长因子 (Vascular endothelial growth factor,VEGF) 的表达,抑制促凋亡因子Caspase-3的表达,从而影响细胞生长和凋亡[20,28-29]。本研究的结果显示,外源添加的GCSF可能以相同的方式影响细胞周期的分布,促进了颗粒细胞的增殖,抑制了颗粒细胞的凋亡,进而可能影响卵泡的发育及排卵,其分子机制还有待于进一步研究验证。
