双光子成像在细胞移植与治疗中的应用
2020-04-15杨皓旻张运海倪健强
杨皓旻,肖 昀,张运海,倪健强
1中国科学院苏州生物医学工程技术研究所,江苏省医用光学重点实验室,江苏 苏州 215163;2苏州大学附属第一医院神经内科,江苏 苏州 215006
双光子成像的基础理论提出后,Denk等[1]将双光子激发现象应用于激光共聚焦扫描显微镜中,提出双光子显微镜。在对生物组织成像的应用中,由于双光子成像一般使用红外波段的激光,受到生物组织散射影响较小,能够比传统的单光子共聚焦成像探测到更深的组织结构[2-3];同时,由于双光子的激发效应,对焦点外组织的荧光漂白效果较小,更适于进行活体长时间荧光成像。因此,在生命科学研究以及动物模型的应用中,双光子成像技术已有广泛应用[4-7]。本文将介绍双光子活体成像技术对细胞移植和治疗研究中发挥的作用,并简要探讨这项技术的发展趋势。
1 技术原理
双光子激发荧光是一个非线性光学过程[8-9]。与一般的单光子激发荧光不同,荧光分子被双光子激发的过程中,荧光分子要在飞秒量级时间内吸收两个光子,才能从基态跃迁至激发态,然后通过各种辐射或非辐射衰变路径返回至基态。当荧光分子通过自发辐射返回基态时,发出荧光。由于双光子成像采用近红外光作为激发光,受生物组织的散射影响相对较小,因此成像深度比可见光成像更深,一般可达到1 mm[10],对组织进行透明化处理手后成像深度可达到3 mm[11]。
双光子成像过程中,荧光的激发只发生在焦点附近很小的区域内,从原理上达到了空间滤波效果,避免了杂散光干扰,因此实际使用中不需要传统共聚焦成像结构中的针孔,更有利于收集在体成像时微弱的光信号。在活体成像中,除了通过加入外源性荧光分子对生物组织进行荧光标记[12-13],还可以利用组织中一些固有的荧光物质产生的自发荧光成像,这些荧光物质也被称为内源荧光团[14-16]。典型内源荧光团包括还原型烟酰胺腺嘌呤二核苷酸、还原型烟酰胺腺嘌呤二核苷酸磷酸、黄素腺嘌呤二核苷酸、卟啉类化合物等。利用双光子激发内源荧光团,进行自发荧光成像,已经应用于研究在体状态下细胞的形态学以及代谢水平[17-18]。
2 应用领域
随着转基因荧光标记技术[19-20]与双光子成像技术相结合,活体光学成像技术已经广泛应用于中枢神经系统、心肌、骨髓以及抗肿瘤药物等领域研究中。
2.1 干细胞移植用于中枢神经系统疾病的相关研究
双光子成像已用于研究神经元分布、环路结构等[21-24]等基础神经科学问题。突触连接是形成神经环路、实现中枢神经系统功能的基础。利用双光子成像技术进行在体光学成像,可以研究突触连接及其在学习与记忆、衰老、损伤后、疾病等过程中扮演的角色。目前,由于大部分神经连接生物学相关的基础问题只能在动物模型中研究,有关突触的许多问题仍有待解答,例如在成熟的功能网络中人类神经元是否经历重组,如何更好地模拟影响突触连接的一系列神经疾病等[25]。通过对人源神经元进行在体光学成像,可以为解答这些问题发挥作用。
人胚胎干细胞(ESCs)和诱导多能干细胞(iPSCs)有望模拟人脑在发育和疾病过程中的突触连接[26-28]。然而,由于体外培养的ESCs和iPSCs衍生的神经元存活期短,神经与突触成熟度不够,建立的研究模型并不完善。有学者[29-30]建立了一套研究方案,将人ESCs/iPSCs衍生的神经元移植进入啮齿动物的中枢神经系统。通过双光子成像技术,观察移植细胞进入大脑皮层的情况,以及移植2月后在纹状体、胼胝体等部位的轴突情况(图1),确认该方法可以增强人神经元的存活期和功能成熟度,更有利于开展人ESCs/iPSCs衍生神经元在突触形成与功能整合进入宿主的神经网络方面的研究。这套研究方法建立了更准确的大脑皮质疾病和修复模型,能够促进细胞移植治疗脑损伤等疾病的发展。
在通过移植iPSCs恢复神经系统功能方面,研究表明,移植iPSCs衍生的神经元可以促进损伤的神经环路功能恢复[31-32]。Falkner等[32]切除了成年鼠的一部分初级视皮层,然后将鼠胚胎神经元移植到相同区域。利用双光子成像技术进行刺激-诱发响应的在体成像,发现移植神经元响应视觉刺激的方式与宿主神经元一致,说明它已经完全整合进入了宿主的视觉通路,但整合的具体机制仍有待研究。
2.2 心肌细胞移植的功能研究

图1 人ESC移植到新生小鼠脑部2月后不同脑部区域的轴突双光子图像Fig.1 Axonal two-photon images of different brain regions of newborn mice after human ESC transplantation
心血管疾病是人类主要的致死性疾病,应对策略主要是改变生活方式预防、药物治疗和手术干预。在心力衰竭的情况下,需要建立新的方法改善诊断和治疗策略。心肌损失会导致心力衰竭,而移植是终末期心力衰竭的唯一具有确定长期疗效的治疗方法。但是,器官移植会带来一系列后续问题。干细胞疗法通过心肌细胞再生减少心脏变性,被认为是最有前景的治疗策略之一[33]。对单个离体心肌细胞的研究已在细胞和分子水平上提供了有关电特性和钙离子的重要信息。但是,与单个细胞相比,完整组织中心肌细胞动作电位的特性有所不同[34]。有鉴于此,在心肌细胞移植治疗的研究中,原位观察和评估移植后细胞功能恢复情况,是评价移植治疗效果的重要手段。
为了评估移植心肌细胞功能整合的程度,Rubart等[35-37]开展了一系列研究,将表达EGFP的转基因胚胎心肌细胞移植进入非转基因成年小鼠中,结合钙离子荧光指示剂rhod-2,对完整心脏中移植细胞和宿主细胞内钙离子信号的瞬时变化进行双光子成像。发现移植细胞与宿主细胞功能发生耦合,移植细胞可以与宿主心肌形成功能合胞体[35]。有研究还进行了心肌细胞移植治疗后的功能研究[36](图2)。通过双光子成像,监测单个心肌细胞动作电位诱发钙离子瞬时变化,并在连续电刺激的同时,通过线扫描模式下记录rhod-2的瞬时变化,分辨了钙离子变化的时间进程。这些研究为细胞移植后影响整体细胞功能原因的进一步研究提供了帮助。
利用双光子显微镜在跳动心脏中进行细胞水平的研究,不可避免地会受到跳动引起的位移干扰,Jones等[38]在经典双光子显微镜上进行了改进,消除了血流和心脏跳动的影响,同时测量了钙离子瞬态变化、血管尺寸和组织位移量,加以扩展后可用于现有研究模型中。
2.3 造血干细胞的相关研究
造血干细胞是骨髓微环境的重要组成,借助双光子成像技术对其动态观察,造血干细胞之间的相互作用以及对微环境的影响已有研究[39-41]。有研究利用双光子在体成像技术,使用了GFP、DiD、自发荧光和二次谐波4种信号通道,标记识别了鼠颅骨中的几种成分[41](图3)。并对其进行了多点延时成像,对造血干细胞和HSPCs进行监测,获得了HSPCs与周围环境的三维图像,对单个移植细胞实现了识别和长时间高精度监测,追踪了移植HSPCs在鼠颅骨骨髓中的迁移,并观察了HSPCs与基质细胞的相互作用。

图2 完整心脏中心肌细胞移植后的双光子图像Fig.2 Two-photon images of intact central cardiac muscle cells after transplantation
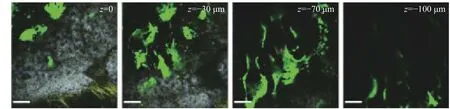
图3 对颅骨不同深度下的二维双光子图像Fig.3 Two-dimensional two-photon images of the skull at different depths
采用类似的装置,有研究在小鼠模型中,利用双光子显微镜研究了急性粒细胞白血病细胞对骨髓血管和造血干细胞的影响[42]。观察到急性粒细胞白血病中的骨髓血管受损、内膜血管丢失等现象,以及用小分子去铁胺或遗传方法,可以保存骨膜内皮,挽回造血干细胞的丢失,提高化疗疗效,并提高生存率。这些发现有可能改进现有治疗急性粒细胞白血病的方法。
2.4 抗肿瘤药物的疗效评价
在抗肿瘤药物的研究中,通常将肿瘤细胞移植到健康小鼠体内,建立异种移植模型。利用双光子成像技术等在体成像技术,可观察对抗肿瘤药物治疗后的肿瘤演变,进行药效评价[43-45]。有研究分别使用双光子显微镜实时观察了不同肿瘤在化疗药物使用后的变化[44-45]。Shimura等[44]研究了紫杉醇在胃癌腹膜转移性异种移植模型中的疗效(图4)。将表达红色荧光的胃癌细胞(NUGC4)移植进入绿色荧光小鼠的腹腔,治疗后,通过双光子成像观察,与解剖病理观察结果对比发现根据二者图像得到的结论一致。研究结果证明了该实验方法可用于抗胃癌药物临床前的药效评价,并可将个体差异降至最低。
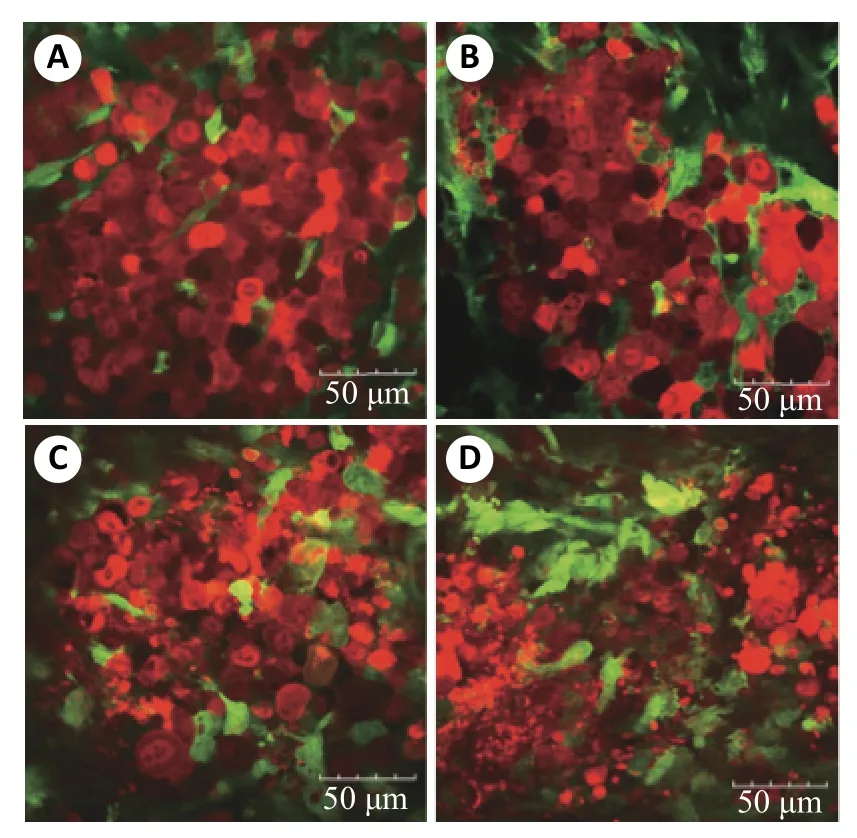
图4 紫杉醇治疗后的肿瘤细胞双光子图像Fig.4 Two-photon image of tumor cells treated with paclitaxel
3 总结与展望
在已经开展的研究中,双光子成像技术以其较大的成像深度、较高的成像质量等特点,满足了在体成像的需求,在以动物为研究对象的研究中发挥了重要的作用,使我们对活细胞生理、病理和药理领域的认识得到极大的发展。但是本技术还存在一定局限:成像深度仍在毫米量级;自发荧光成像对应基团有限;非荧光标记的二次谐波成像局限于特定蛋白结构;光源功率较高,尽管光漂白效果相对较弱,焦点附近样品仍可能受到热损伤。通过开发新型标记材料与方法,实现更低漂白效果和更丰富标记手段;与其它影像技术结合,跨尺度成像,实现形态结构判断与功能成像的结合,可能是本技术下一步的发展方向。
