基于扫频激光光源的皮肤血流OCT 成像系统研制与应用
2020-04-14李奇原任天慧李易陆王立伟李跃杰
李奇原,任天慧,李易陆,王立伟,李跃杰
(中国医学科学院北京协和医学院生物医学工程研究所,天津300192)
0 引言
皮肤是人体的第一道生理防线和最大的器官,且皮肤病种类繁多。近年来,由于环境恶化和不良生活习惯,皮肤病的患病率呈逐年上升趋势[1]。目前,皮肤病的诊断主要依赖组织病理学活检,而创伤性活检易引起患者疼痛、皮损部位感染,且仅能提供活检部位的即时信息[2]。此外,由冠心病、糖尿病等引起的外周动脉疾病(peripheral arterial disease,PAD)发病率显著提升,而严重肢体缺血则是外周动脉疾病最严重的临床表现,会导致肢体氧气与营养物质长期供应不足[3]。因此,皮肤病与肢体缺血早期临床诊断亟须一种无创、实时、高分辨力的检测手段,这就促进了皮肤影像学的产生和发展[4]。
现有的皮肤影像学成像技术主要包括皮肤镜、皮肤超声、皮肤CT、皮肤光学相干断层扫描(optical coherence tomography,OCT)等。其中,皮肤镜是主要针对色素性皮肤疾病的无创性辅助诊断仪器,可在体观察皮肤表层微细结构,但依赖诊断者主观经验且无法获得深层皮肤结构[5];皮肤超声可无损检测皮肤深层结构,尤其是高频超声对黑色素瘤、血管瘤等疾病诊断有重要指导意义,但其分辨力低,无法辨别皮肤肿瘤的良恶性,且易受探头压力等因素影响;皮肤CT 可实现实时、高分辨力三维皮肤成像,在银屑病、皮肤肿瘤等方面是一种可靠的诊断手段,但传统皮肤CT 无法提供微血管血流信息;皮肤OCT 技术基于低相干光干涉原理,具有无损、非接触、高灵敏度、高分辨力、实时动态成像等特点[6-8],可实现微血管血流成像,克服了以上几种成像技术的局限性,是具有广阔发展前景的无损皮肤影像学诊断技术。
本文设计并搭建了一套基于扫频激光光源的皮肤血流OCT 成像系统,通过对采集到的光相干扫描信号进行信号处理与图像重建,从而获得皮肤组织结构与微细血管血流图像。
1 设计方法
1.1 系统设计
基于扫频激光光源的皮肤血流OCT 成像系统由扫频激光光源及干涉仪组成的光学系统模块、平衡光电探测器及数据采集卡组成的信号采集模块、计算机及控制卡组成的系统控制模块以及图像处理模块构成。光学系统模块中样品返回的干涉光信号经信号采集模块采集并传输至计算机,经图像处理模块处理实现显示与存储;系统控制模块总体控制系统中相干信号的扫描、传输与采集。基于扫频激光光源的皮肤血流OCT 成像系统原理如图1 所示。
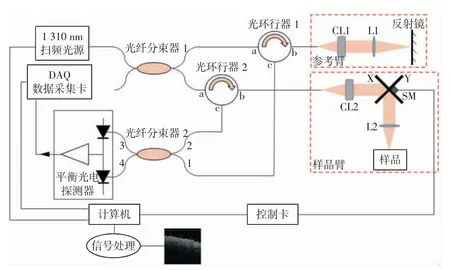
图1 基于扫频激光光源的皮肤血流OCT 成像系统原理图
1.1.1 光学系统模块
选择Axsun 公司中心波长1 310 nm、扫频范围140 nm、平均功率15 mW、扫频频率100 kHz 的扫频激光光源作为系统光源。对于高斯分布光源,系统纵向分辨力lc表达式为

其中,λ0为光源中心波长,Δλ 为光源带宽。根据Axsun 光源参数计算系统纵向分辨力可达6 μm。
扫频激光器发出的扫频激光经光纤分束器1将输入光分为2 路:一路送入光环行器1 的端口a,经光环行器1 的端口b 输出,送入参考臂;经延迟处理后的参考臂光环行器1 的端口b 和端口c 进入光纤分束器2 的端口1。另一路送入光环行器2 的端口a,经光环行器2 的端口b 输出,送入样品臂中的光纤准直镜CL2;光纤准直镜CL2 发出的准直光经扫描振镜X 和扫描振镜Y 投射到系统物镜L2。经系统物镜L2 输出的扫描成像光线投射到被测皮肤组织进行扫描成像。由被测组织反射回来的带有被测组织结构信息的扫描光线经系统物镜L2、扫描振镜X 和扫描振镜Y 返回到光纤准直镜CL2,并经光环行器2 的端口b 和端口c 进入光纤分束器2 的端口,在光纤分束器2 内与由光延迟线返回的参考臂光线进行汇聚干涉,输出汇聚光线,汇聚光线经光纤分束器2 的端口3 和端口4 输出到平衡光电探测器的差动输入端;平衡光电探测器的输出信号传输到数据采集卡,经计算机进行信号处理与血流信息提取,得到被照组织的2D/3D 层析图像及组织微血管血流图像。与计算机相连的控制卡控制样品臂中的扫描振镜X 和扫描振镜Y,实现扫描光线的X 方向与Y 方向扫描。
1.1.2 信号采集模块
信号采集模块由平衡探测器和DAQ 数据采集卡组成,其功能为将参考光与被测组织返回的样品光干涉形成的干涉光信号经平衡探测器转换为相应电信号,DAQ 数据采集卡采集电信号并传输至计算机,以便后续进行数据处理。本设计中DAQ 数据采集卡采用Axsun DAQ 数据采集卡,其包括小型微控制器与大型现场可编程逻辑门阵列(field programmable gate array,FPGA)处理器,微控制器负责处理链接数据库与激光驱动板的双向通信,加载FPGA相关程序;而FPGA 处理器负责计算密集型任务,如数据的采集与传输,并为计算机提供Enthernet/PCIe数据接口,以实现DAQ 数据采集卡对计算机的数据传输及计算机对DAQ 数据采集卡的控制。
1.1.3 系统控制模块
系统控制模块由计算机、DAQ 数据采集卡与同步控制卡组成,其功能为同步系统时钟、控制系统扫描与采集。DAQ 数据采集卡将同步时钟k-clock 输入同步控制卡,同步控制卡接收k-clock 信号并作为外部时钟源,以k-clock 为时钟基准编写并发出X 和Y 2 路三角波驱动振镜做3D 扫描,实现线同步。同时在每一个三角波波形开始时,反馈一个Image_sync信号给DAQ 数据采集卡作为帧刷新同步信号,实现帧同步。
本文针对系统控制模块功能进行人机交互界面设计,如图2 所示,包括X 和Y 2 路三角波的占空比与幅值的实时设置与刷新、3D 扫描中X 和Y方向线数设置、血流提取需求中重复帧数设置、时钟频率选择功能。

图2 系统控制模块界面
控制流程如下:(1)点击“开始”运行程序后,首先对系统进行初始化,包括同步控制卡管脚功能设置,并读取控制界面内的参数设置值。(2)接收扫描触发信号后,同步控制卡输出X 和Y 2 路三角波信号,控制振镜做平面内二维扫描,其中幅值决定扫描范围,线数决定扫描密度,Y 方向重复数决定单帧重复扫描次数,用于后期血流提取算法提取血流信息;同时发出一路同步信号Image_sync 反馈给DAQ 数据采集卡,开始同步采集。(3)每次扫描结束后,检测停止键状态(保证每次扫描均完整),直至检测到按下状态结束循环。
1.1.4 图像处理模块
计算机收到被测组织相关干涉信号后,经数据处理模块处理,得到皮肤组织结构与皮下微血流图像。数据处理流程如下:(1)样品深度信息原始数据经模数转换得到16 位二进制数据;(2)对数据进行窗口补零,将每个扫描线填充至2 048 个样本,便于后续逆傅里叶变换操作;(3)对采样的光谱数据进行相位校正,补偿色散,以提高分辨力;(4)对采样数据做逆傅里叶变换,将二进制数据转化为信号强度值;(5)减除未放置样品时采集的背景噪声;(6)图像数据经对数压缩后转化为8 位数据,并写入bmp 文件,实现皮肤组织结构图像的显示与存储。数据处理过程如图3 所示。
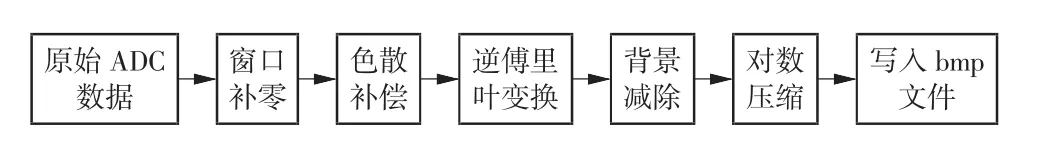
图3 数据处理流程图
1.2 皮肤血流信息提取
OCT 技术作为一种光学检测手段,可无创获得组织深层高分辨力图像[9]。本设计采用去相关标准差算法,通过对连续采集的皮肤组织OCT 结构图像进行去相关处理,然后对去相关图像计算标准差,从而获取血流信息。
1.2.1 去相关算法
去相关算法是利用去相关处理从组织结构图像中获取微血流信息并成像[10]。去相关算法能有效去除静态组织信息,保留动态组织信息,其中去相关度较大的为动态组织,去相关度较小的为静态组织。
Jia 等[11]提出一种运用于光学相干层析微血流成像技术的全频谱去相关算法。该算法在保证去相关水平的基础上,提高了去相关算法的运算速率。去相关运算公式如下:
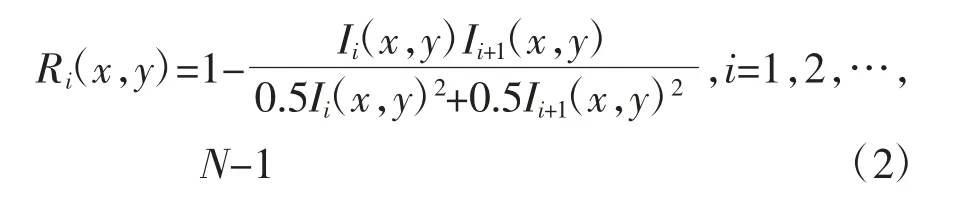
其中,Ri(x,y)为去相关图像,Ii(x,y)为第i帧同一位置OCT 图像,Ii+1(x,y)为第i+1 帧同一位置OCT图像。为了提取二维结构皮肤OCT 图像中的运动血流信息,本文对同一位置N帧OCT 图像中连续相邻图像分别进行去相关处理,去除静态组织信息并提取动态微血流信息,获得同一位置N-1 帧去相关图像。
1.2.2 标准差运算
同一位置采集的OCT 图像中,被测组织运动速度越快,相邻帧图像中差异值越大,运动组织的标准差越大,在微血流图中表现为明亮;相反,静态组织保持静止,相邻帧图像中差异小,标准差运算后值也小,在微血流图中表现为暗。因此,本研究对同一位置的N-1 帧去相关图像Ri(x,y)做标准差运算,增强动态组织运动信号并抑制静态组织信号,以实现微血管血流信息提取。标准差运算公式如下:

2 实验验证
2.1 皮肤组织二维结构与三维重建
应用本文设计的成像系统对人体手背皮肤进行检测试验,验证系统对皮肤组织成像的可行性。其中,X 方向A-line 设定为1 024,Y 方向设定1 024个扫描位置,扫描范围8 mm× 8 mm,相邻帧间隔7.8 μm,扫描频率100 kHz,采集时间11.66 s。实验结果如图4 所示。
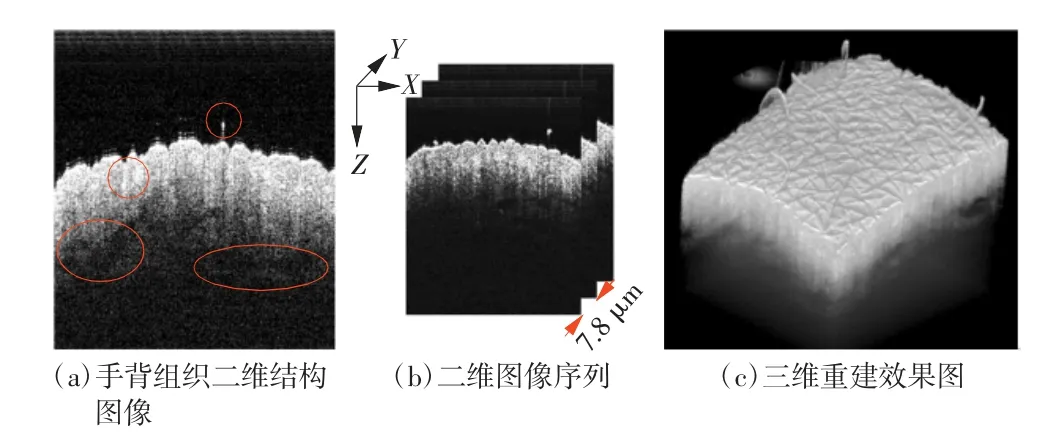
图4 手背皮肤二维结构与三维重建结果
结果显示,皮肤组织二维结构图像中表皮边界清晰,探测深度可达1.5 mm;二维图像序列经三维重建后可清晰重现扫描位置皮肤表面与皮下组织微细结构,包括皮肤表面纹路与汗毛,通过体数据旋转与切面可清晰观察扫描位置不同视角及深度信息。表明本文设计的皮肤血流OCT 成像系统可实现高分辨力二维结构成像与三维重建,具有一定的临床应用潜力。
2.2 皮肤微血管血流成像
血流作为静态皮肤组织中的动态信息,状态随时间变化而变化[12]。为提取运动微血流信号,本文在同一位置采集8 帧图像,通过去除相邻图像保持不变的静态组织信号来提取动态血流信息。采集位置选择手部内侧,该位置皮肤较薄且存在丰富的毛细血管网络,采集时保持手部稳定以减少运动影响,X方向A-line 设定为256,Y 方向设定256 个采集位置,相邻位置间隔15.6 μm,每个位置采集8 帧图像,扫描范围4 mm×4 mm,扫描频率100 kHz,采集时间6.06 s。原始数据与处理过程如图5 所示。
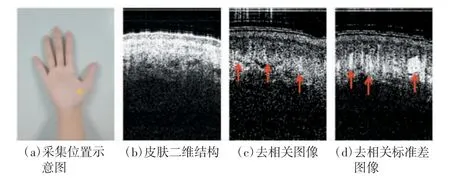
图5 皮肤血流提取过程图
实验结果显示,二维结构图像[如图5(b)所示]中清晰可见3 层皮下组织,皮下血管信息丰富;去相关图像[如图5(c)所示]中表层静态皮肤组织得到显著抑制,动态血流信号得以保留(红色箭头所示);去相关标准差图像[如图5(d)所示]中静态组织信号被抑制,血流信号得到进一步增强。
对标准差图像进行三维重建后提取en-face 微血流结果,如图6 所示,图中可见微血流网络清晰,细节完整,背景噪声低。
利用散斑方差OCT 算法[13]处理同组数据,以评估去相关标准差血流提取算法的有效性。散斑方差OCT 算法血流图如图7 所示,与图6 对比可知,去相关标准差算法血流图在较好地保留细微血管网络细节的基础上,有效抑制了背景噪声与呼吸、心跳等运动造成的纹理噪声,提高了信噪比。表明本文设计的皮肤血流OCT 成像系统通过去相关标准差血流提取算法可实现微血流信息的提取与成像,为OCT 在临床微循环观察与诊断上提供了实验基础。
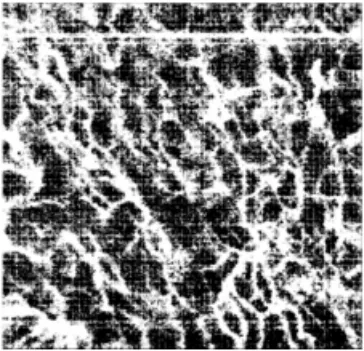
图6 去相关标准差算法血流图
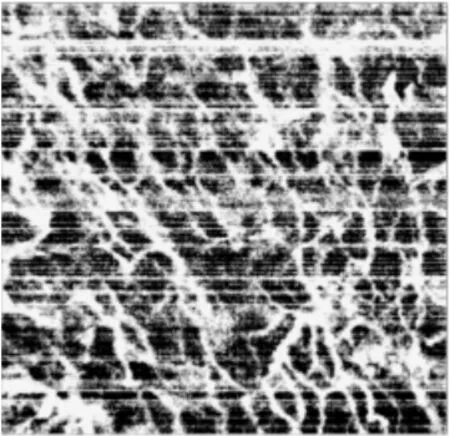
图7 散斑方差OCT 算法血流图
3 讨论
近年来,皮肤病与外周动脉疾病的发病率逐年上升,而现有的皮肤影像学检测手段如皮肤镜、皮肤超声等均存在分辨力低、无法获得微血流图像等局限性。本文设计并搭建的基于扫频激光光源的皮肤血流OCT 成像系统克服了以上技术的局限性,具有二维结构高分辨力成像与微血流成像的技术能力。
目前国内常见的OCT 成像系统多为时域OCT或光谱域OCT,临床上多应用于眼科相关检测与成像[14]。关于扫频激光光源OCT 成像系统的研究也多集中于皮肤组织结构成像系统的搭建与改进,如史伟松等[15]设计并搭建了一套扫频激光光源OCT 成像系统对人体皮肤进行在体成像,重点对手持式探头进行创新性设计以实现各个人体部位的皮肤组织结构在体成像。本文设计并搭建了基于1 310 nm 扫频激光光源的皮肤血流OCT 成像系统,在高散射皮肤成像上有效探测深度可达1.5 mm,扫频频率100 kHz,成像速度较传统时域OCT 和光谱域OCT 有显著提升[16-17],可对扫描部位进行三维重建,观察其不同深度与角度的细微结构,并将去相关标准差血流提取算法应用于皮肤微血管血流提取上。经实验验证,该算法可利用OCT 图像获得高分辨力微血流图像,对皮肤病与外周动脉疾病的早期诊断具有积极的临床意义。
但本文的研究也存在一定局限性,如针对高散射皮肤组织探测深度较浅,无法对深层病变组织成像。今后的研究中,在保证分辨力的前提下,可通过改进光学成像系统或寻求与其他技术融合的功能性OCT 来提高OCT 的探测深度,如光声OCT 成像[18]等。同时,由于呼吸、心跳造成的不自主运动,在图像中会表现为图像模糊,且使得静态组织因运动而在血流信号提取过程中被保留,产生虚假血流信号。未来需进一步完善图像处理过程,增加运动伪差校正与图像配准处理过程,减小被测组织运动对图像质量的影响。
4 结语
本文设计并搭建了基于1 310 nm 扫频激光光源的皮肤血流OCT 成像系统,可对皮肤组织结构进行高分辨力成像和三维重建,且可通过去相关标准差算法处理实现皮下微血流成像,为浅表皮肤病与外周动脉疾病的临床早期无创诊断奠定了实验基础。
