特殊类型高血压临床诊治要点专家建议
2020-04-14中国中医药研究促进会中西医结合心血管病预防与康复专业委员会高血压专家委员会北京高血压防治协会中国高血压联盟北京大学医学部血管健康研究中心
中国中医药研究促进会中西医结合心血管病预防与康复专业委员会高血压专家委员会,北京高血压防治协会,中国高血压联盟,北京大学医学部血管健康研究中心
1 特殊类型高血压概述
1.1 高血压的历史 《黄帝内经》是世界上最早在2000 多年前有关动脉压力升高的文字记载,“按尺寸,观浮沉滑数,而知病所生;以治无过,以诊则不失矣。审其阴阳,以别柔刚……”。第一次血压测量于1733 年由英国皇家学会斯蒂芬·黑尔斯(Stephen Hales,1677—1761 年)进行,他用尾端接有小金属管的长9 英尺(274 cm)直径1/6 英寸的玻璃管插入一匹马的颈动脉,柱高维持在270 cm。第一次真正意义上的袖带血压计于1896 年由意大利医生里瓦罗基制成,但是只能测量动脉的收缩压,俄国外科医生尼古拉柯洛特(Korotkoff,1874—1920 年)对其进行了改进,加上了听诊器。这一改进使血压测量迅速飞跃,直到现在仍然是血压测量的基本方法。1945 年罗斯福总统因高血压脑出血突然死亡,震惊全球,打破了医学界一直将高血压视为身体的正常代偿机制的观点;促进美国新任总统杜鲁门签署《国家心脏法案》,成立国家心脏研究所,并从国库中拨出巨款进行心脑血管疾病研究。1957年第一次将高血压界值定为≥160/95 mm Hg(1 mm Hg=0.133 kPa),揭开了心血管疾病预防与治疗的新时代、新篇章,打破了Charles Friedberg 在1949 年撰写的《心脏病学》中认为不超过210/100 mm Hg 为良性血压的定义,证明高血压、高血脂、高胆固醇是引发心脏病的危险因素,高血压是脑卒中的重要诱发原因。1999 年,WHO 将高血压定义为≥140/90 mm Hg,一直延续至今。2017 年美国将高血压定义为≥130/80 mm Hg[1],但其他国家仍然定义为≥140/90 mm Hg[2-3]。
1.2 特殊类型高血压的概念 2018 年欧洲心脏病学会(ESC)高血压指南的面世,较2013 年指南新增了特殊情况下高血压的诊断治疗篇章,将难治性高血压和继发性高血压归在特殊情况下高血压一章中,并较前更细化介绍,使广大医务工作者在常规治疗高血压的同时,对特殊情况下高血压的治疗有了更加深入的了解及处理能力。《中国高血压防治指南(2018 年修订版)》也细化出特殊人群高血压,但不同的是将难治性高血压和继发性高血压写在独立的章节中[3]。2017 年出版的《特殊类型高血压的诊断与治疗》一书[4],提出了特殊类型高血压这一概念,是以高血压临床诊治的实际需求为基础,以一种全新的视角去审视和探索高血压。将高血压分成一般类型和特殊类型两种,这与传统的原发性和继发性高血压的分类并不矛盾,两者既有平行,又有交叉,是将不同临床特征的高血压患者进一步更为细微的分类,进而在临床上进行更个体化的诊断和更特异有效的治疗。
2 老年高血压
2.1 流行病学特点 目前国际公认的老年定义为≥65 岁,而我国关于老年高血压的数据均为≥60 岁。2012年我国≥60岁人群高血压患病率为58.9%,知晓率、治疗率和控制率分别为53.7%、48.8%和16.1%[5]。
2.2 老年高血压的病理生理特点 (1)动脉硬化、血管弹性降低,收缩压升高、舒张压降低;(2)压力感受器敏感性下降,血压调节功能受损,出现血压变异性增大;(3)左心室收缩末压升高,心脏负荷增加,心房扩大,易发生心功能不全和心律失常;(4)肾脏方面,增龄相关的肾脏结构改变导致细胞外容量增加和水钠潴留,同时,长期的高血压影响肾灌注加剧肾功能的减退;(5)长期高血压导致血管内皮或脑血管的氧化应激损伤,继发大脑结构和功能损伤,还可导致脑白质变性。
2.3 临床诊断要点及鉴别点
2.3.1 临床诊断 年龄≥65 岁,血压持续或3 次以上非同日坐位收缩压≥140 mm Hg 和/或舒张压≥90 mm Hg。若收缩压≥140 mm Hg,舒张压<90 mm Hg,定义为单纯收缩期高血压(ISH)。若患者年龄≥80 岁,定义为高龄高血压[6]。
2.3.2 临床特点 (1)以收缩压增高为主,脉压增大;(2)血压波动大:高血压合并体位性血压变异和餐后低血压者增多,前者包括直立性低血压和卧位高血压;(3)常见血压昼夜节律异常:表现为非杓型或超杓型,甚至为反杓型,清晨高血压增多;(4)白大衣高血压和假性高血压增多;(5)多种疾病并存:常与冠心病、心力衰竭、脑血管疾病、肾功能不全、糖尿病等并存,治疗难度增加;(6)继发性高血压不少见。
2.3.3 鉴别点 对血压难以控制的高龄患者,应考虑到与肾血管性高血压、肾性高血压、原发性醛固酮增多症、睡眠呼吸暂停综合征等继发性高血压相鉴别。
2.4 常规治疗及治疗的特殊点
2.4.1 治疗原则 老年高血压治疗的主要目标是保护靶器官,最大限度降低心脑血管事件和死亡风险。65~79岁的老年人,第一步应降至<150/90 mm Hg(2018 年ESC 指南标准是<140/90 mm Hg);如能耐受,大多数患者治疗的目标为血压<140/90 mm Hg(ESC 指南标准是收缩压130~139 mm Hg,舒张压<80 mm Hg)。≥80 岁应降至<150/90 mm Hg[3];如患者收缩压<130 mm Hg,且耐受良好,可继续治疗而不必回调血压[2]。
2.4.2 常规治疗
2.4.2.1 非药物治疗 同《中国高血压防治指南(2018年修订版)》[3]。
2.4.2.2 药物治疗 推荐利尿剂、钙离子通道阻滞剂(CCB)、血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)应用于老年高血压患者,可初始或联合药物治疗,从小剂量开始,逐渐增加至最优剂量。(1)利尿剂:推荐用于老年高血压患者的初始及联合降压治疗,尤其适用于合并心力衰竭、水肿患者。常用小剂量噻嗪型利尿剂(氢氯噻嗪)或噻嗪样利尿剂(吲达帕胺)。估算肾小球滤过率(eGFR)<30 ml·min-1·(1.73 m2)-1时应使用袢利尿剂,如呋塞米或托拉塞米等。保钾利尿剂可用于继发性或顽固性高血压的治疗。不良反应呈剂量依赖性,大剂量利尿剂可影响糖脂代谢、诱发电解质紊乱。(2)CCB:长效二氢吡啶类CCB 适用于老年单纯收缩期高血压患者。主要不良反应包括水肿、头痛、面色潮红、牙龈增生、便秘等。(3)ACEI/ARB:推荐用于合并冠心病、心力衰竭、糖尿病、慢性肾脏病或蛋白尿的老年高血压患者。ACEI 最常见不良反应为干咳,不能耐受者可改用ARB。(4)β-受体阻滞剂:用于合并冠心病、慢性心力衰竭、快速性心律失常、交感活性增高的患者,从小剂量起始,根据血压、心率调整剂量。(5)α-受体阻滞剂:不作为首选药,可用于合并前列腺增生患者或难治性高血压患者,警惕直立性低血压发生。(6)联合治疗:不同机制降压药物联合治疗,提高患者服药依从性(见表1)。
2.4.3 特殊情况下的治疗 降压治疗应以避免脑缺血症状为原则,避免降压过度,宜适当放宽血压目标值。对于共病和衰弱患者应综合评估后,确定个体化血压起始治疗水平和治疗目标值。神经源性直立性低血压伴卧位高血压患者,治疗过程中需密切监测血压,避免直立位血压过低而致跌倒[7-9]。根据患者的危险因素、亚临床靶器官损害及合并临床疾病情况,可优先选择某类降压药物(见表2)。
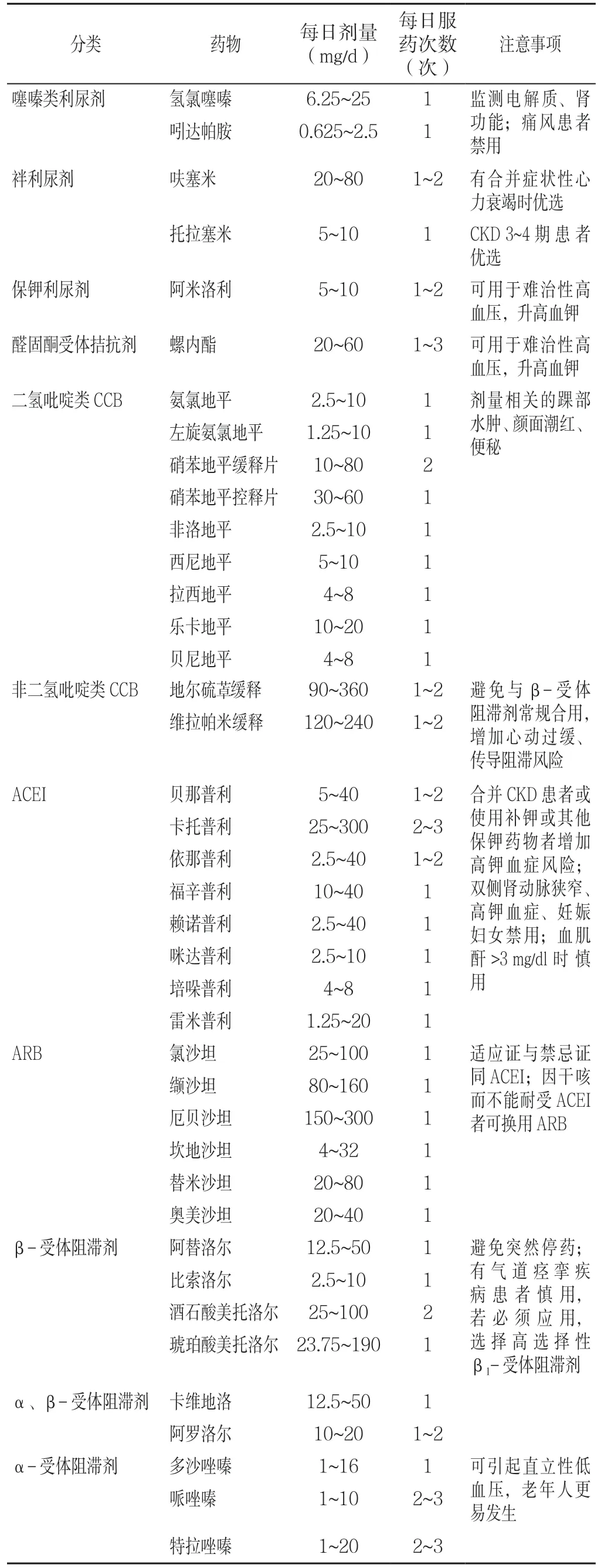
表1 常用降压药物Table 1 Common antihypertensive drugs
2.4.4 老年高血压合并异常血压波动
2.4.4.1 老年高血压合并体位性血压波动 (1)直立性低血压:患者由卧位转化为直立位(或头高位倾斜>60°)3 min 内收缩压下降≥20 mm Hg 和/或舒张压≥10 mm Hg,可伴头晕、乏力、晕厥、跌倒等脑灌注不足表现。该类患者应平稳缓慢降压,减少直立性低血压发生,预防跌倒,在起身站立时动作应缓慢,尽量减少卧床时间,可选择ACEI 或ARB 等药物,从小剂量起始,缓慢增加剂量。避免使用利尿剂、α-受体阻滞剂等可能加重直立性低血压的药物。(2)直立性低血压伴卧位高血压:指老年直立性低血压患者中,卧位时收缩压≥140 mm Hg 和/或舒张压≥90 mm Hg,是一类特殊的血压波动。该类患者应强调个体化的治疗方案,在夜间休息时尽量抬高床头10°~15°,避免在日间仰卧,睡前1 h 内避免饮水。根据卧位血压水平进行降压治疗,推荐在睡前应用小剂量、短效降压药,避免使用中长效降压药或利尿剂[7-9]。
2.4.4.2 餐后低血压 指餐后2 h 内收缩压较餐前下降≥20 mm Hg;或餐前收缩压≥100 mm Hg,而餐后<90 mm Hg;或餐后血压下降未达到上述标准,但出现餐后脑灌注不足症状。对该类患者,可采用餐前进水、少食多餐、减少碳水化合物摄入等避免餐后血压下降,合理降压避免餐前血压过高也可避免餐后血压过度下降,α-葡萄糖苷酶抑制剂、咖啡因、瓜尔胶等可能会减少餐后血压下降,但疗效缺乏有效验证,目前未在临床推广。
2.5 新进展 对老年患者,年龄不再是降压治疗的限制因素,主要考虑其生物学年龄而非实际年龄,若患者能耐受,治疗就不应保守,仍推荐血压达标。在制定降压治疗方案时,除了考虑血压水平外,还需对患者进行认知功能与衰弱程度的评估。
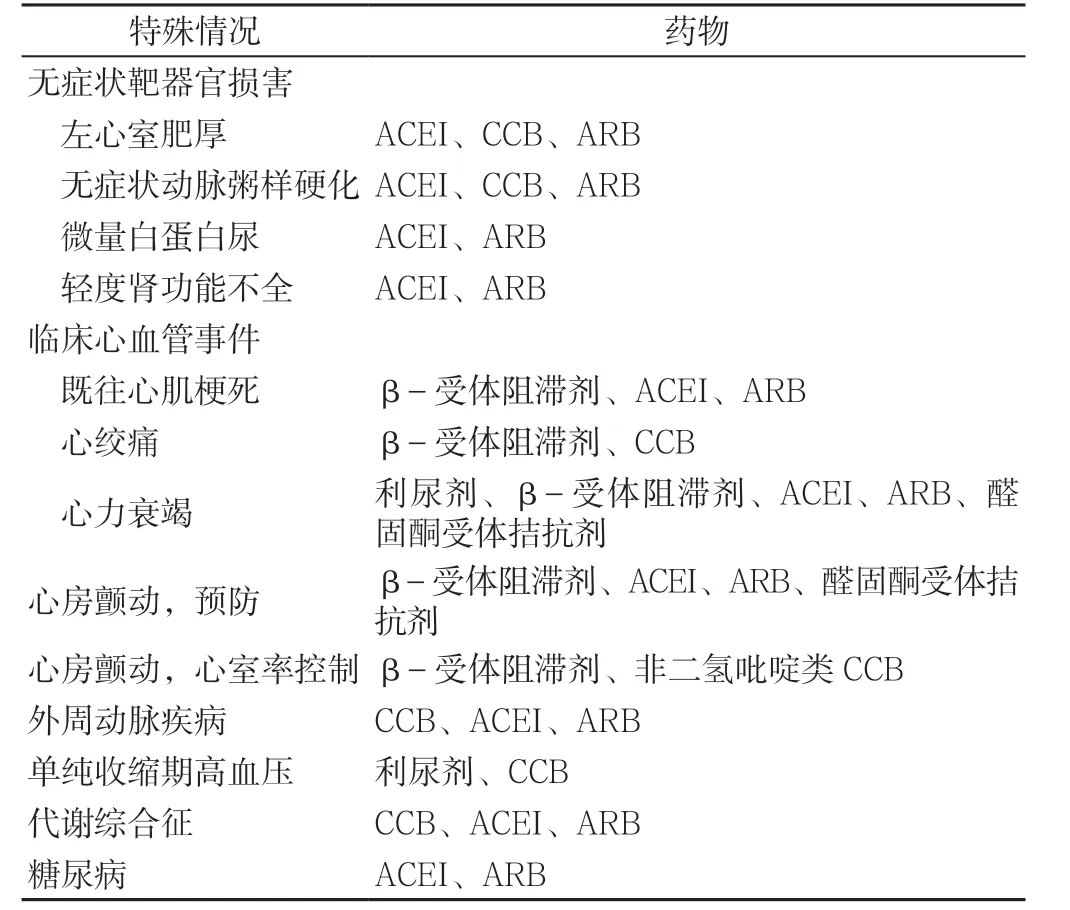
表2 特殊情况下首选的降压药物Table 2 Preferred antihypertensive drugs in special cases
3 儿童青少年高血压
3.1 流行病学特点 儿童青少年高血压与肥胖、缺乏运动、不健康饮食习惯、代谢综合征、吸烟、阻塞性睡眠呼吸暂停综合征(OSAS)、慢性肾功能不全、早产和低出生体质量等多种因素及慢性病密切相关。美国全国健康和营养检查的研究数据显示,男童高血压患病率为15%~19%,女童为7%~12%。西班牙裔及非裔儿童高血压患病率高于白裔儿童。儿童青少年高血压患病率高于幼儿[10]。在我国,超重、肥胖在儿童青少年中越来越普遍,儿童青少年高血压患病率也逐渐升高。根据 2010年全国学生体质调研报告,我国中小学生的高血压患病率为14.5%,男生高于女生(16.1%与12.9%)[11]。
3.2 儿童青少年高血压定义 美国儿科学会(AAP)发布《儿童青少年高血压筛查和管理的临床实践指南》,定义儿童青少年的年龄范围是1~18 岁。高血压的定义仍是基于健康儿童青少年血压的参考范围。对于≥13岁的青少年,分级标准与2017 年美国心脏协会(AHA)和美国心脏病学学会(ACC)成人高血压指南一致。儿童根据年龄不同,血压亦不同。需要进一步评估血压的儿童青少年简化表格见表3。该表格基于不同年龄、性别、身高第5 百分位儿童青少年的第90 百分位血压,使表格中数据的阴性预测值>99%。对于≥13 岁的青少年(无论性别)简化表格中使用120/80 mm Hg。这个表格是一种筛查工具,仅用于识别需要重复测量血压以进一步评估其血压情况的儿童青少年,不能单独用来诊断高血压。
《中国高血压防治指南(2018 年修订版)》也是应用百分位法“表格标准”诊断儿童高血压[3]。并且在2010 年中国儿童血压参照标准的基础上,增加了身高对血压的影响。制定出中国3~17 岁男、女年龄别和身高别的血压参照标准:收缩压和/或舒张压≥第95 百分位诊断为高血压,第90~95 百分位或≥120/80 mm Hg 为“正常高值血压”[12]。然后进行高血压程度分级:(1)1级高血压:第 95~99 百分位+5 mm Hg;(2)2 级高血压:≥第99 百分位+5 mm Hg。
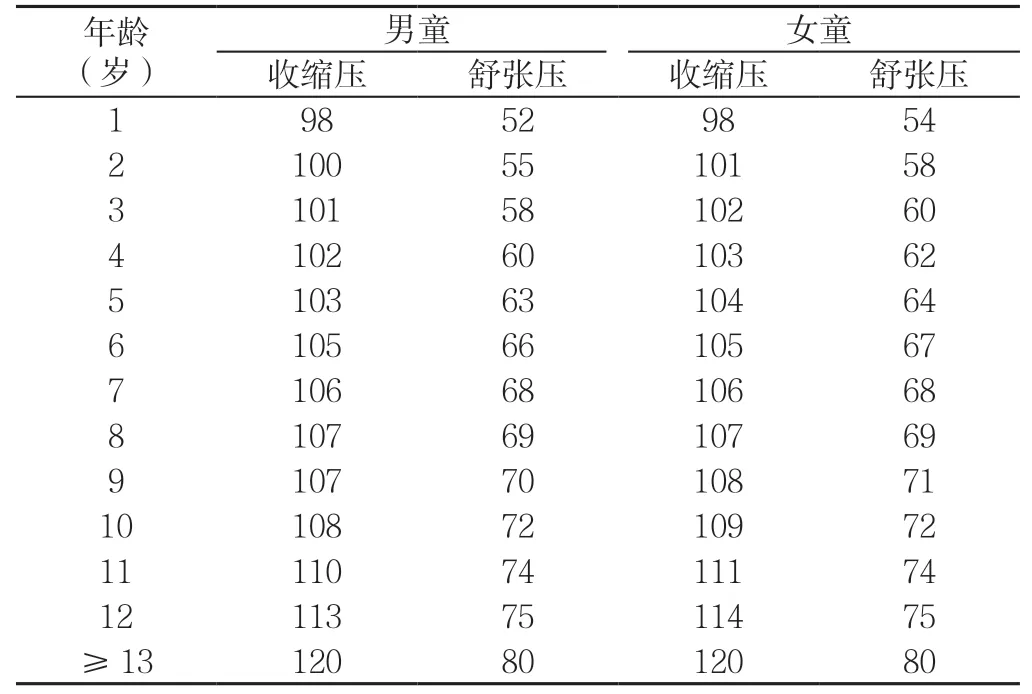
表3 需进一步评估血压的儿童青少年简化表格(mm Hg)Table 3 Simplified table for children and adolescents who need further assessment of blood pressure
为方便临床医生的快速诊断,建议首先采用简化公式标准进行初步判断,其判定的结果与百分位法“表格标准”诊断儿童高血压的一致率接近95%。简化公式标准为:男童,收缩压=100+2×年龄(岁),舒张压=65+年龄(岁);女童,收缩压=100+1.5×年龄(岁),舒张压=65+年龄(岁)。对简化公式标准筛查出的可疑高血压患儿,再进一步采用“表格标准”确定诊断。
3.3 儿童青少年血压测量 (1)血压计的选择:常用血压测量方法有听诊法和示波法。儿童青少年标准血压数据均是基于听诊法测量得出的结果,示波计式血压仪可用于儿童青少年的血压筛查。(2)袖带的要求:准确的血压测量需要使用合适尺寸的袖带,儿科诊室应该配备各种尺寸的袖带,包括用于严重肥胖儿童青少年和青少年大腿的袖带。袖带长度应为上臂周长的80%~100%,宽度至少为其40%。(3)血压测量频率:≥3 岁儿童青少年每年体检时要进行血压监测[3]。有高血压高危因素的儿童青少年(如肾脏疾病、糖尿病、主动脉弓梗阻或缩窄,或正在服用已知会升高血压的药物),应该在每次就诊时测量血压;其他健康的儿童青少年,只需要每年测量1 次血压;如果<3 岁的儿童,存在患高血压的风险:比如早产、低出生体质量儿、需重症监护的其他新生儿并发症、先天性心脏病(已修复或未修复)、反复泌尿系统感染、血尿或蛋白尿、泌尿系畸形、先天性肾脏疾病家族史、实体器官移植、恶性肿瘤、使用已知可升高血压的药物、伴随高血压的全身性疾病、颅内压升高等。每次健康体检时均需测量血压。
3.4 儿童青少年高血压的原发和继发病因 既往国内外研究均显示儿童青少年高血压以继发性高血压为主[13],但美国转诊中心发现儿童青少年和青少年的主要诊断为原发性高血压病[14]。原发性高血压病患儿的一般特征包括:年龄较大(≥ 6 岁)、父母和/或祖父母有高血压家族史、超重和/或肥胖。继发性病因主要包括:(1) 肾实质性和肾血管性疾病,是最常见的继发原因;(2)心血管系统疾病,包括主动脉缩窄等;(3)内分泌性高血压,如库欣综合征、原发性醛固酮增多症等;(4)环境因素与药物。
3.5 儿童青少年高血压的诊断性评估 儿童青少年高血压的诊断性评估主要包括4 个方面:(1)评估血压水平的真实性,进行高血压分级;(2)明确高血压原发与继发病因;(3)检测与评估靶器官损害及其程度;(4)评估有无糖尿病等其他合并症。
3.6 儿童青少年血压管理 管理目的:控制血压水平、降低靶器官损害、降低成年后高血压及其相关心血管疾病的风险。管理目标(最佳治疗水平):为血压<第90 百分位或<130/80 mm Hg,两者取较低者。管理方式:生活方式改变和药物治疗。应鼓励高血压患儿参加体育锻炼和加强体育活动,但有左心室肥厚和/或 2 级高血压的运动员,限制其参加竞技体育和/或高强度训练。儿童青少年高血压的首选药物包括:ACEI、ARBs、CCB 或噻嗪类利尿剂。β-受体阻滞剂不良反应相对较多,且缺乏改善预后的证据,因此不推荐作为儿童高血压的初始治疗药物。对于合并慢性肾脏病、蛋白尿或糖尿病的儿童青少年,除非有绝对禁忌证,否则建议首先使用ACEI 或 ARBs。对于2 种或更多推荐药物无效的高血压患儿,可以考虑其他降压药(如α-受体阻滞剂,β-受体阻滞剂,α、β- 受体阻滞剂复方药物,中枢性作用药物,保钾利尿剂和直接血管舒张药物)[15]。
3.7 总结 随着不良生活方式及肥胖等在儿童青少年中的流行,儿童青少年高血压患病率逐渐增加。2017 年,美国儿科学会颁布了新一版的《儿童青少年高血压诊断、评估和治疗的第四次报告》,基于正常体质量儿童青少年,制定了新的儿童青少年血压数据表格,建议儿童青少年从3 岁开始规律测量血压,有高危因素的儿童青少年每次就诊时均应测量血压,其他健康儿童青少年每年需测量1 次血压;3 岁以下儿童患高血压的风险增加时,每次健康体检时均应测量血压。早期筛查,对于明确诊断的高血压患儿,要做到早期、有效、长期管理。
4 女性高血压
4.1 女性在不同阶段的生理和病理变化 女性的血压受年龄、月经周期、生育及疾病过程和特殊药物等多方面影响,比男性高血压更复杂。
4.1.1 月经周期 雌激素能通过减少儿茶酚胺的分泌来影响交感神经系统的兴奋性,降低血压,并对血管紧张素转化酶有抑制作用,能通过降低血管紧张性和血管阻力来防止女性心血管疾病的发生。在月经周期的滤泡期、排卵期、黄体期不同阶段,雌激素水平不断波动以影响血压,因此滤泡期舒张压较黄体期明显升高[16]。
4.1.2 避孕药 服用避孕药是女性高血压患者的独立危险因素,且不受年龄、体质量及降压药等因素的影响。口服避孕药可使极少数血压正常的女性血压升高,以及原有高血压加重,且减弱降压药的降压疗效,常呈现中到重度高血压,甚至顽固性高血压。停服避孕药后,血压在短期内即降至参考范围,而且不再上升。
4.1.3 妊娠高血压 妊娠高血压综合征指妊娠20 周后孕妇发生高血压、蛋白尿及水肿。其中高血压指血压≥140/90 mm Hg,或血压较孕前或孕早期升高≥25/15 mm Hg。妊娠期高血压综合征是导致孕产妇和围生儿死亡的重要原因[17]。如果只是血压升高而无蛋白尿出现,称为妊娠高血压,多指妊娠结束后血压可以很快恢复的这部分患者。从流行病学的研究资料来看,初产妇、孕妇年龄<18 岁或>40 岁、多胎妊娠、有妊娠期高血压病史者,在孕期发生妊娠高血压综合征的比例会明显增加。
4.1.4 更年期及绝经期 更年期的女性,雌激素水平降低,对血管紧张素转化酶的抑制作用减弱,从而产生绝经期的高血压。研究发现,绝经后女性对盐的敏感性较年轻、未使用避孕药的女性明显增加[18],可能由于钠的排泄与女性激素水平有关,这个机制可以解释老年女性高血压患者采用利尿剂效果较好的现象。
4.2 各个时期降压药物应用有何异同及注意事项
4.2.1 青春期 青少年女性(7~<25 岁,多为学生):主要是预防高血压的发生,包括调整生活方式,少食油炸食品,限制甜食,增加运动。
4.2.2 育龄期 青年女性(25~40 岁,多为工作的青年):体质量控制不良是高血压的主要原因,同时规律的月经周期中雌激素水平的变化也是血压波动的原因之一。然而这部分女性雌激素水平良好,保护性作用相对正常。对于月经中高血压的患者,建议周期性使用小剂量利尿剂(经前1~2 d 至经后1~2 d 加利尿剂),也可配一定的镇静剂进行血压的调整。
4.2.3 妊娠期 慢性高血压的降压治疗可以继续使用妊娠前的降压药物,不过要注意药物的不良反应。妊娠期高血压疾病的降压治疗需慎重,因其并不能预防子痫前期发生和改善胎儿娩出,且会因为血压降低导致胎儿头部和子宫供血不足,因此启动降压治疗前,需评估妊娠期的血压增高对母亲和胎儿是否有影响。但是当血压过高时,降压治疗还是很必要的。在妊娠3个月内血压持续在160/100 mm Hg以上者建议终止妊娠,在此期间降压药物的治疗会影响胎儿的正常发育,尽可能不服任何降压药物。妊娠的全过程不能使用ACEI 和ARB,孕5~7 个月可以选用拉贝洛尔,孕7~10 个月可以加用CCB 和小剂量甲基多巴。
4.2.4 哺乳期 高血压的母亲哺乳要保证母乳喂养的安全,降压药物可能会分泌到母乳中,高血压1 期的母亲如果希望母乳喂养,可在密切关注血压的情况下短期喂乳,终止喂养后开始降压治疗。在哺乳期间如需要降压治疗,应当禁用ACEI、ARB,可服用小剂量CCB 及β-受体阻滞剂。利尿剂可减少母乳的分泌量,应当予以注意。
4.2.5 更年期 女性更年期高血压主要与绝经后体内雌激素水平低下有关,因此有效地调节体内激素水平,服用β-受体阻滞剂和盐酸维拉帕米缓释片可以改善交感神经兴奋性对高血压的影响,ACEI/ARB 可以改善雌激素诱发的肾素-血管紧张素-醛固酮系统(RAAS)激活。ACEI/ARB联合CCB 有可能作为绝经期后高血压的主流治疗。
4.3 多囊卵巢综合征与高血压
4.3.1 多囊卵巢综合征导致高血压机制 (1)患者存在高雄激素血症和高胰岛素血症,可直接致大血管损伤,提高交感神经兴奋性,引起高血压。(2)高胰岛素血症可引起糖、脂代谢紊乱,产生肥胖,影响血黏度,引起高血压。(3)高血压多发生在多囊卵巢综合征患者,合并肥胖的患者收缩压较消瘦患者及同龄健康人群明显升高。
4.3.2 多囊卵巢综合征的治疗 (1)非药物治疗:主要针对提高胰岛素敏感性和降低高雄激素血症,减轻体质量,改善糖、脂代谢紊乱,降低血黏度等。(2)药物治疗:对于饮食和生活方式干预无效者,药物治疗包括利尿剂、CCB、ACEI 或β-受体阻滞剂等。
5 围术期高血压
5.1 围术期高血压定义 围术期高血压是指从确定手术治疗到与本手术有关的治疗基本结束期间内,患者血压升高幅度大于基础血压的30%,或收缩压≥140 mm Hg和/或舒张压≥90 mm Hg。围术期高血压会增加手术患者急性心肌梗死、急性心力衰竭、急性脑血管病、急性肾损伤、手术出血增加等事件的发生,增加手术并发症,危及患者生命,应当引起重视,严重的围术期高血压为高血压急症之一。
5.2 围术期血压波动的病理生理机制 围术期患者由于紧张等因素导致交感神经系统激活,麻醉药物使用等均可影响血压。对血压正常者,麻醉诱导期间交感神经激活,可引起血压增加20~30 mm Hg,心率增加15~20次/min[19]。随着麻醉深度的增加,平均动脉压趋于下降,已有高血压的患者更可能出现术中血压不稳定(低血压或高血压)[20]。术后随着患者从麻醉效应中恢复,血压和心率缓慢增加。但术后也可由于疼痛、麻醉苏醒时兴奋,以及高碳酸血症等出现高血压。研究显示,高血压常始于手术结束后30 min 内,持续大约2 h[21]。
围术期高血压的高危和诱发因素包括:(1)原发性高血压病;(2)继发性高血压;(3)清醒状态下进行有创操作;(4)手术操作刺激;(5)麻醉深度不当或镇痛不全;(6)气管插管、导尿管、引流管等不良刺激;(7)药物使用不当;(8)颅内高压;(9)低氧或二氧化碳蓄积;(10)寒战、恶心、呕吐等不良反应;(11)紧张、焦虑、恐惧、失眠等心理应激因素[22]。
5.3 高血压患者术前评估及准备 传统评估大多依据血压水平来进行,但靶器官损害程度及并存临床疾病可能对患者预后评估更为重要,其他相关指南已对此进行探讨,本专家建议仅就血压水平进行讨论。目前尚无延期手术的高血压阈值,原则上轻、中度高血压(<180/110 mm Hg)不影响手术进行;为抢救生命的急诊手术,不论血压多高,都应急诊手术;对进入手术室后血压仍高于180/110 mm Hg 的择期手术患者建议推迟手术;限期手术患者与家属协商后手术。
对于疑似继发性高血压的患者,行择期手术前最好明确高血压病因。然而只要血电解质和肾功能正常,高血压不严重,大多数患者可耐受手术。但是早期研究显示嗜铬细胞瘤患者未被诊断而接受手术,手术死亡率可能高达80%[23]。
对于规律降压者,口服降压药应继续服用至手术时,术晨以少量水送服,因突然停用某些药物(如β-受体阻滞剂、可乐定)可能引起血压反弹。但如果没有心力衰竭或术前无法改善的高血压通常在术前24 h 停用ACEI 和ARB,因其可能会减弱术中肾素-血管紧张素系统的代偿性激活,导致低血压。术前使用利尿剂者应注意有无低钾血症和低血容量。CCB 可使用,但因其可能抑制血小板聚集,需注意术后出血发生率可能增加。β-受体阻滞剂可减少术中心肌缺血,对于有基础冠状动脉疾病的患者,突然停用β-受体阻滞剂除了会引起血压升高外,还可导致恶化型心绞痛、心肌梗死或猝死。
5.4 围术期高血压降压药物的选择、静脉药与口服药的转换应用原则 围术期血压管理的原则是保证重要脏器灌注,降低心脏后负荷,保护心功能,减少围术期由于血压波动导致的心血管事件。
5.4.1 血 压 控 制 目 标 (1) 一 般 认 为 血 压<180/110 mm Hg,不影响手术进行。也有指南建议平均诊室血压应控制于160/100 mm Hg 以下再考虑择期外科手术[24]。应根据患者的血压水平、靶器官损害程度、手术类型及手术迫切性等进行综合评估。(2)术中血压波动幅度不超过基础血压的30%。(3)应注意预防围术期低血压。
5.4.2 治疗原则 与高血压急症和亚急症治疗原则相同。(1)术前镇静。(2)静脉药物:对于高血压急症或者不能口服降压药者,常用的药物包括艾司洛尔、拉贝洛尔、乌拉地尔、尼卡地平、硝普钠和硝酸甘油等。有时由于手术的紧迫性,对于高血压亚急症也可以考虑静脉药物治疗。(3)尽早过渡到常规口服药物治疗:术后高血压患者应注意纠正导致血压增高的因素,如疼痛、激越、高碳酸血症、低氧、血容量过多和膀胱充盈等。对于先前没有高血压但术后出现高血压的患者,一旦患者的外科情况稳定且目标血压已维持至少24 h,可停止降压治疗,并观察48~72 h。如果血压始终高于参考范围上限,应启动降压治疗。对于合并特殊临床疾病,如心脏手术围术期、主动脉夹层、妊娠高血压、颅内病变围术期、嗜铬细胞瘤围术期等血压管理,可参考中国心胸血管麻醉学会和北京高血压防治协会共同编写的《围术期高血压管理专家共识》[22]。
5.5 特殊临床疾病围术期血压管理
5.5.1 心脏手术围术期高血压管理 基本原则是先麻醉再降压。体外循环期间应该维持适当灌注量,当平均动脉压(MAP)>90 mm Hg,应加深麻醉或使用降压药物。主动脉瓣术后容易发生高血压,应适当降压。合并心肌肥厚患者血压应维持在较高水平。左心房室瓣成型术后收缩压应<120 mm Hg。冠脉旁路移植术围术期MAP 应>70 mm Hg[23]。
5.5.2 主动脉夹层围术期血压管理 术前应积极控制血压和心率,防治夹层扩展。可耐受的情况下尽快将收缩压控制于100~120 mm Hg,心率控制于50~60 次/min。药物首选β-受体阻滞剂[22]。
5.5.3 妊娠期高血压围术期血压管理 应注意降压药对母体及胎儿的双重影响,降压宜平稳。常用药物为CCB 和乌拉地尔。为保证胎儿血流,血压不应低于130/80 mm Hg[22]。
5.5.4 颅内病变围术期血压管理 颅内病变多伴随颅内高压。对于自发性脑出血患者,急性期收缩压降至140 mm Hg 是安全的。为防止过度降压导致脑灌注不足,可在入院血压基础上每日降压15%~20%。可选用乌拉地尔、艾司洛尔等。动脉瘤性蛛网膜下腔出血在动脉瘤处理前可将收缩压控制于140~160 mm Hg。术后应注意避免低血压导致脑灌注不足[22]。
5.5.5 嗜铬细胞瘤围术期血压管理 术前应充分补液,最终目标为术前24 h 内未出现血压>160/90 mm Hg,未发生血压<80/45 mm Hg 及直立性低血压。降压药物以酚苄明和酚妥拉明最常用,避免未使用α-受体阻滞剂时单独使用β-受体阻滞剂。术中血压超过基础血压的1/3 或者200 mm Hg 时,应提示外科医师暂停手术操作,并寻找原因给予降压治疗[22]。
6 高血压合并心律失常
6.1 流行病学特点 高血压可导致心肌结构和功能的病理生理改变。因此,高血压可合并多种形式的室上性及室性心律失常,为常见的临床情况。一项Meta 分析显示,合并左心室肥厚的高血压患者室上性心律失常发生率为11.1%,而非左心室肥厚者仅为1.1%[25]。其中以心房颤动最为常见。在流行病学研究和真实世界的注册研究中,超过70%的心房颤动患者合并高血压[26]。在一些小样本研究中,>40%的高血压患者在心电监测中出现室性心律失常[25];Meta 分析结果显示,合并左心室肥厚的患者出现室性心律失常的比例为5.5%,非左心室肥厚者为1.2%[25]。
6.2 病理生理特点 高血压导致心律失常的机制较为复杂,其中核心因素和中心环节为RAAS 和交感神经系统激活,其他的机制包括心房压力增加、心房增大、左心室肥厚、基因因素等。高血压导致的结构重构在改变钠、钾等离子通道的同时,还会造成激动传导不均一,心电图上即表现为QRS 时限、QT 间期的延长和碎裂QRS 波的出现,是心律失常形成的电生理基础。另外,心脏肥大会导致细胞氧气的供需失衡,形成心肌缺血,多种基因与心律失常相关,这些因素相互作用,共同参与心律失常的发生(见图1)[27]。
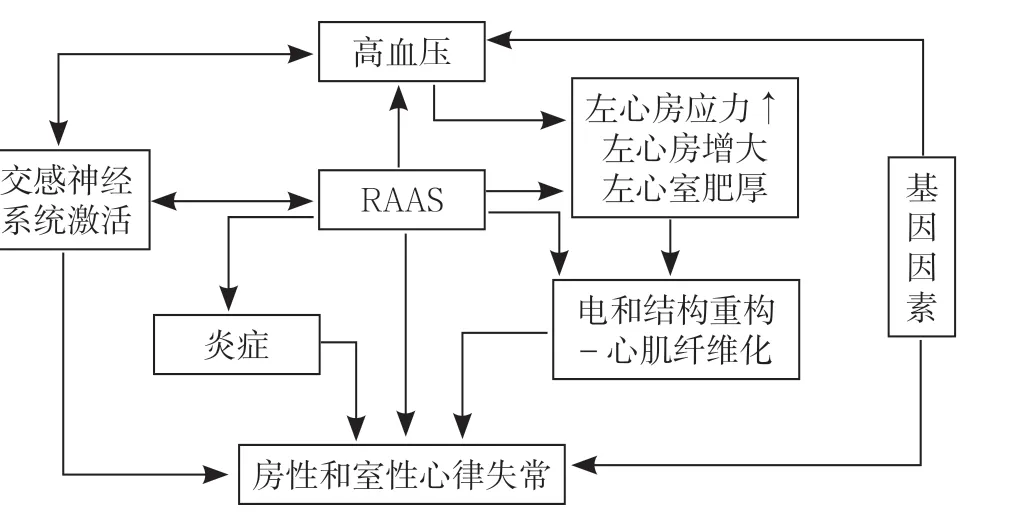
图1 高血压合并心律失常的病理生理机制Figure 1 Pathophysiological mechanism of hypertension with arrhythmia
6.3 临床诊断要点 心律失常的诊断依靠症状、体格检查和实验室检查。临床表现取决于心律失常的类型、节律和频率异常对血流动力学的影响,可无症状而通过体检发现,或轻者出现心慌、心悸和运动耐量降低,重者可诱发或加重心功能不全,更严重者可能表现为晕厥甚至心源性猝死。详细追问病史,有助于判断心律失常的性质。详细的体格检查,包括脉搏、心界叩诊、心率及节律听诊、心脏杂音等,均有助于判断是否存在心律失常及可能的病因。
确诊心律失常的实验室检查为心电图和动态心电图。12 导联心电图可发现左心室肥厚、左心房扩大、心律失常或伴随的心脏疾病。有心律失常病史或体检发现的所有患者应进行24 h 动态心电图监测,甚至更长时程心电图监测,怀疑运动诱发的心律失常者应考虑行运动心电图检查;必要时行超声心动图检查以细化心血管风险,心电图证实左心室肥厚、左心房扩大的诊断或可疑伴发的心脏病病史。
6.4 常规治疗及特殊治疗
6.4.1 高血压合并室上性心律失常
6.4.1.1 室上性期前收缩 文献证实,患者有频发室上性期前收缩及左心室肥厚,是发生心房颤动的高危因素,因此建议延长心电监测时间以发现心房颤动。大部分经常发生室上性期前收缩的患者,建议改善生活方式(限制饮酒、咖啡),优化控制血压,尤其是合并有左心室肥厚者。
6.4.1.2 心房颤动 (1)降压治疗:高血压伴心房颤动患者的降压治疗原则包括降低血压和降低左心房负荷。对于心房颤动患者首选以下几类降压药:①ACEI和ARB:多个临床试验证实,以ACEI 或ARB 为基础的治疗可以减少高血压患者新发心房颤动的发生。国内外指南均推荐ACEI 和ARB 用于预防心房颤动的发生和进展,单药控制不良时,优先推荐 ACEI/ARB 与CCB或噻嗪类利尿剂联用[28-29]。②β-受体阻滞剂:对于高血压伴心房颤动患者,β-受体阻滞剂可以控制发作时心室率、促进心房颤动转复为窦性心律和维持窦性心律,以及减少心房颤动复发[29]。对于心房颤动急性期,普萘洛尔、美托洛尔、阿替洛尔和艾司洛尔都可以静脉给药以快速控制心室率,其中艾司洛尔和美托洛尔因起效快、t1/2短是主要推荐的静脉适用药物,同时对合并高血压的患者发挥降压作用。但对于伴心功能不全的患者应首先评估心功能情况;禁用于伴有预激综合征的心房颤动患者。在长期控制心房颤动和拮抗交感神经兴奋性方面,β-受体阻滞剂也能安全应用,其控制运动状态的心室率比地高辛有效。③非二氢吡啶类CCB:2014年AHA/ACC/HRS 美国心房颤动管理指南推荐,对于需要控制心率的心房颤动患者,一线治疗药物为β-受体阻滞剂和非二氢吡啶类 CCB(地尔硫和维拉帕米),但一般情况下不推荐两者联用[30]。对不伴有收缩功能不全的心房颤动且合并高血压患者,急性期心室率控制可采用缓慢静脉注射地尔硫注射液或维拉帕米注射液。禁用于伴有预激综合征的心房颤动患者。(2)抗凝治疗:在心房颤动患者中,合并高血压者卒中/血栓栓塞事件的发生风险增加2 倍。因此高血压合并心房颤动患者需重视抗凝治疗,应在综合评估卒中和出血风险及临床净获益的基础上考虑给予口服抗凝药物治疗。华法林与新型口服抗凝药物均可作为心房颤动患者血栓栓塞预防的首选药物。建议采用心房颤动抗凝治疗出血(HAS-BLED)评分系统评估出血风险,评分≥3 分的患者应严密监测随访,并纠正可逆的危险因素(例如未控制的高血压),单独HAS-BLED 高评分不能作为终止口服抗凝药的理由。高血压监测及良好的血压控制对于降低卒中和血栓栓塞的风险起着重要的作用,也可以降低抗栓治疗的出血风险。
6.4.1.3 其他类型室上性心律失常 高血压合并其他类型的室上性心律失常如下:(1)病态窦房结综合征(SSS)及房室传导紊乱:常与高血压左心室肥厚相关,部分与OSAS 相关(夜间出现窦房结及房室传导障碍,日间消失,治疗OSAS 如呼吸机正压通气治疗可好转)。建议排除OSAS 并给予治疗。(2)房内及室内传导阻滞:高血压伴有左心室肥厚及左束支传导阻滞(LBBB),或QRS 波分裂顿挫者,心血管疾病风险及猝死、心力衰竭的发生率均增高。综合评估患者心血管风险,积极控制血压;若传导阻滞达到起搏器植入指征,可考虑起搏治疗。(3)静息心率增加:静息心率增加(>85 次/min),不仅预示冠心病及心力衰竭患者预后不良,对于高血压患者也一样。因此,在高血压治疗中,应用规律控制心室率、无并发症(如损害左心室功能)的药物(如β-受体阻滞剂)是必要的。
6.4.2 高血压合并室性心律失常 针对高血压合并室性心律失常,建议寻找可能的病因,以及评估心脏功能,以决定室性心律失常处理方案[27]。控制并维持合适的血压水平应成为高血压合并室性心律失常,尤其是重度左心室收缩功能障碍〔射血分数(EF)<35%〕的首要目标。可选择的合适降压药物包括:β-受体阻滞剂和ACEI/ARB 类药物。β-受体阻滞剂可应用于高血压合并冠状动脉疾病和心力衰竭患者的管理。ACEI 和ARB 所具有的逆转心肌肥厚、改善冠状动脉血流等作用,有助于预防和减少室性心律失常的发生。此外,高血压合并左心室肥厚患者应注意避免低钾血症或使用延长 QT 间期的药物。对于持续性室性心律失常或频发非持续性室性心律失常伴左心室收缩功能障碍的患者,β-受体阻滞剂、醛固酮受体拮抗剂和沙库巴曲/缬沙坦可降低猝死风险。对于室性心律失常是否应用抗心律失常药物取决于患者的心脏情况。抗心律失常药物可能加重心力衰竭、促心律失常和死亡等,不应常规用于心力衰竭合并无症状室性心律失常患者。在低射血分数和高频率的异位室性心律失常患者(>15%~20%的总心率,或室性期前收缩>10 000 次/24 h),抗心律失常药物和射频消融均可考虑,以逆转潜在的心动过速诱导性心肌病。对于血流不稳定性室性心律失常的恢复期患者,若预计存活期超过1 年,应植入埋藏式心律转复除颤器(ICD)以减少猝死及全因死亡风险。对于持续性重度左心室收缩功能障碍患者,充分控制血压及心力衰竭管理后,仍持续存在频发室性期前收缩的情况下,如有缺血性心脏病明显证据,可植入 ICD。
7 高血压合并冠心病、心肌病、心力衰竭
7.1 高血压合并冠心病
7.1.1 流行病学特点 高血压是冠心病的主要独立危险因素,研究表明收缩压每升高10 mm Hg,发生心肌梗死的风险可增加31%。60%~70%的冠状动脉粥样硬化者患有高血压,而高血压患者发生冠状动脉粥样硬化较血压正常者高3~4 倍。
7.1.2 病理生理特点 多种病理生理学机制导致血压的升高和相关靶器官损害(如冠心病)。这些机制包括交感神经系统和 RAAS 活化的增加;血管扩张剂释放或活性减低,如一氧化氮和前列环素,以及利钠肽水平的变化;动脉系统生长因子与炎性细胞因子表达的增加;血流动力学影响;传输动脉和阻力动脉结构和功能异常,尤其血管僵硬度的增加和血管内皮功能障碍。这些神经激素通路与遗传、人口和环境因素相互作用,决定个体是否进展为高血压或冠心病。同时伴发的代谢紊乱,如糖尿病、胰岛素抵抗和肥胖,也导致具有血管活性的细胞因子的产生,促进血管收缩,血管内皮功能障碍,增加血管系统的炎症和氧化应激,增加高血压和冠心病的风险。这些共同的病理生理机制,可能为高血压和冠心病的预防和治疗提供新的治疗靶点,可能超出降压的益处。
7.1.3 临床诊断要点及鉴别点
7.1.3.1 高血压合并冠心病的临床诊断 高血压诊断同一般类型高血压。心绞痛根据典型的发作特点和体征,发作时心电图的改变,或作24 h 动态心电图连续监测。心肌梗死的诊断依据典型的临床表现、特征性的心电图改变和实验室心肌酶和/或肌钙蛋白的检查。冠心病诊断的“金标准”为冠状动脉造影术。
7.1.3.2 鉴别诊断 需要注意鉴别急性心肌炎、心包炎和其他疾病引起的心前区疼痛,血压升高排除因肾脏病、肾动脉狭窄、原发性醛固酮增多症等引起的继发性高血压。
7.1.4 常规治疗及治疗的特殊点 慢性冠心病和稳定型心绞痛患者的高血压治疗目的是预防死亡、心肌梗死和卒中,减少心肌缺血发作的频率和持续时间,以及改善症状。生活方式改变是关键,平常注意控制饮食,限制食盐摄入,适度饮酒,规律锻炼,减轻体质量,戒烟。识别和治疗甲状腺功能低下和OSAS 是高危患者的重要辅助治疗。药物治疗是必需的。
7.1.4.1 冠心病合并高血压患者的降压治疗推荐 (1)高血压合并慢性稳定型心绞痛患者:既往心肌梗死患者用β-受体阻滞剂,既往心肌梗死、左心室功能障碍、糖尿病或慢性肾脏病用一种ACEI 或ARB,和一种噻嗪类利尿剂(ⅠA)。(2)对无心肌梗死既往史、左心室功能障碍、糖尿病或慢性肾脏病蛋白尿患者,也应考虑β-受体阻滞剂、ACEI 或ARB,和噻嗪类利尿剂联合使用(Ⅱa B)。(3)如果β-受体阻滞剂禁忌或产生不能耐受的副作用,非二氢吡啶类CCB(地尔硫或维拉帕米)可以代替,但是不用于左心室功能障碍者(Ⅱa B)。(4)如果心绞痛或高血压仍未控制,在β-受体阻滞剂、ACEI 和噻嗪类利尿剂基本方案基础上,可以加用长效二氢吡啶类CCB。对有症状冠心病和高血压的患者,应该谨慎联合使用β-受体阻滞剂和非二氢吡啶类CCB(地尔硫或维拉帕米),因其增加严重缓慢性心律失常和心力衰竭的风险(Ⅱa B)。(5)稳定型心绞痛患者,血压目标值为<140/90 mm Hg(ⅠA)。但是冠心病、既往卒中或短暂脑缺血发作及冠心病等危症(颈动脉疾病、周围动脉疾病、腹主动脉瘤)的部分患者,可以考虑较低血压目标值(<130/80 mm Hg)(Ⅱb B)。(6)高血压患者使用抗血小板或抗凝药物无特别禁忌证,但严重未控制的高血压患者正在使用抗血小板或抗凝药物,需立即降压以降低出血性卒中的风险(Ⅱa C)[31]。
7.1.4.2 急性冠脉综合征(ACS)合并高血压患者的降压治疗推荐 目前ST 段抬高型心肌梗死(STEMI)或非ST 段抬高急性冠脉综合征患者高血压治疗的资料极少。资料显示,STEMI 患者高血压的发病率为65.2%,而非ST 段抬高型心肌梗死(NSTEMI)为79.2%。急性冠脉综合征患者中,随着年龄的增加高血压的发病率明显增高,>75 岁患者较<45 岁患者高血压发病率约增加1 倍。急性冠脉综合征患者的血压靶目标尚未特别确立。研究证实,低血压与死亡率和出血率相关,提示急性冠脉综合征患者治疗的重要原则是避免低血压。急性冠脉综合征早期血压可能波动,降压达标前应重点控制疼痛和稳定临床症状。第二应缓慢降压,谨慎避免舒张压降至<60 mm Hg,因其可降低冠状动脉灌注并加重缺血。出院时<130/80 mm Hg 的靶目标是合理的。脉压宽的老年患者,收缩压的降低可能导致极低的舒张压,易导致严重心肌缺血。
高血压合并急性冠脉综合征的降压治疗推荐:(1)急性冠脉综合征患者,如果β-受体阻滞剂使用无禁忌,最初降压治疗包括短效β1-选择性受体阻滞剂并无内在拟交感活性(酒石酸美托洛尔、比索洛尔)。通常于就诊24 h 内开始口服用药(Ⅰ A)。严重高血压或持续缺血患者,可考虑静脉用β-受体阻滞剂(艾司洛尔)(Ⅱa B)。血流动力学不稳定患者或出现心力衰竭失代偿时,β-受体阻滞剂的使用应延迟至病情稳定(Ⅰ A)。(2)急性冠脉综合征合并高血压的患者,应考虑使用硝酸酯类降低血压或缓解持续心肌缺血或肺淤血(Ⅰ C)。疑似右心室梗死患者和血流动力学不稳定患者,应避免使用硝酸酯类。如果适宜,最初治疗首选舌下含服或静脉用硝酸甘油,随后可改为长效制剂。(3)无左心室功能障碍或心力衰竭时,如果β-受体阻滞剂存在禁忌或不能耐受,持续缺血的患者则可用非二氢吡啶类CCB代替,如地尔硫或维拉帕米。如果单纯β-受体阻滞剂不能控制心绞痛或高血压,合理使用ACEI 后可以加用长效二氢吡啶类CCB(Ⅱa B)。(4)如果患者发生前壁心肌梗死,血压持续升高,出现左心室功能障碍或心力衰竭的证据,或患糖尿病,应该加用ACEI(Ⅰ A)或ARB(Ⅰ A)。左心室射血分数保留和无糖尿病的较低危急性冠脉综合征患者,ACEI 可以考虑作为一线降压药物(Ⅱa A)。(5)心肌梗死后左心室功能障碍患者出现心力衰竭或糖尿病,并已经接受β-受体阻滞剂和ACEI 治疗,适用醛固酮受体拮抗剂,但必须监测血清钾水平。血清肌酐水平升高(男性≥2.5 mg/dl,女性≥2.0 mg/dl)或血钾升高(≥5.0 mEq/L)的患者,应避免使用这些药物(Ⅰ A)。(6)急性冠脉综合征患者出现心力衰竭〔纽约心功能分级(NYHA)Ⅲ级或Ⅳ级〕或慢性肾脏病患者eGFR<30 ml·min-1· (1.73 m2)-1,袢利尿剂优于噻嗪类利尿剂。持续高血压患者,用β-受体阻滞剂、ACEI 和醛固酮受体拮抗剂血压仍未控制,部分患者可以加用噻嗪类利尿剂以控制血压(Ⅰ B)。
(7)急性冠脉综合征患者血流动力学稳定,血压目标值为<140/90 mm Hg(Ⅱa C)。出院时血压目标值<130/80 mm Hg 是合理的选择(Ⅱb C)。血压应该缓慢降低,谨慎以避免舒张压降至<60 mm Hg,以免导致冠状动脉灌注降低并加重缺血。
7.2 高血压合并心肌病
7.2.1 流行病学特点 高血压左心室肥厚的发生率为20%~40%,随着年龄的增大,左心室肥厚的发生率增多。左心室肥厚是高血压心血管事件及预后最强的独立预测指标,有左心室肥厚的患者发生心血管事件的风险可升高2~4 倍。
7.2.2 病理生理特点 高血压所致的左心室肥厚是一种心肌对血压升高的代偿性改变,心肌收缩力增强以维持足够的心排量,早期出现心肌重塑现象,即向心性重塑,心肌细胞肥大,但数量并不增加,排列改变,胶原纤维增多,胶原逐步累积超过20%出现纤维化,以取代失去功能的细胞,从而发生向心性肥厚,最后发生容量负荷增加引起离心性肥厚。左心室肥厚可导致心肌顺应性与充盈能力下降,舒张功能不全,并可逐渐出现收缩功能减退,冠状动脉储备能力下降及发生心律失常。
7.2.3 临床诊断要点及鉴别点 高血压合并左心室肥厚需与肥厚型心肌病(HCM)进行鉴别,有以下鉴别要点:(1)病史:高血压合并左心室肥厚,常见于中老年患者,存在高血压病史,通常血压数值较高,且长期降压控制不佳;而肥厚型心肌病以青壮年多见,常有家族史。(2)临床症状:可以无症状,也可以有心悸、劳力性呼吸困难、心前区闷痛、易疲劳等症状。肥厚型心肌病,尤其是肥厚梗阻型心肌病可出现晕厥甚至猝死。晚期出现左心力衰竭的表现。(3)查体:高血压合并左心室肥厚者,心界向左下扩大,主动脉瓣区第二音增强,可因相对性左心房室瓣关闭不全而在心尖部听到收缩期杂音。而肥厚梗阻型心肌病患者胸骨左缘可出现粗糙的收缩中晚期喷射性杂音,可伴震颤,应用洋地黄制剂、硝酸甘油、静点异丙肾上腺素及Valsalva 动作后杂音增强,反之应用β-受体阻滞剂、去甲肾上腺素及下蹲时杂音减弱。有些患者闻及S3 和S4 心音及心尖区相对性左心房室瓣关闭不全的收缩期杂音。(4)实验室检查:1)超声心动图:对肥厚型心肌病诊断有重要意义:①室间隔肥厚与左心室游离壁厚度之比>1.5;②左心房室瓣前叶收缩期向前移动及主动脉收缩中期关闭现象;③心室腔小;④左心室流出道狭窄<2.0 cm;⑤左心室流出道血流速度加快;⑥休息时收缩期左心室心尖部心腔与流出道压力阶差>30 mm Hg,则认为存在左心室流出道梗阻。对称性左心室肥厚时室间隔与左心室游离壁一致。目前认为高血压患者心肌肥厚>2.5 cm 时,才可以诊断高血压合并肥厚型心肌病;否则,应考虑高血压引起的心肌肥厚。但是,具体到患者应根据高血压的时间和程度而定。2)心电图:左心室或双室肥厚及ST-T 改变,深而倒置的T 波、有时有异常Q 波。房室传导阻滞和束支传导阻滞。还可以发现其他心律失常如心房颤动、期前收缩等。3)心脏MRI:其灵敏度高于超声心动图,但费用较高,对于诊断特殊部位的肥厚和不典型的肥厚最为灵敏。还可以发现心肌纤维化组织。4)心内膜下心肌活检及基因检测:对肥厚型心肌病诊断还可以借助免疫性荧光,可发现肥厚心肌内儿茶酚胺含量增高,组织学可见心肌排列紊乱和肥大的心肌细胞。基因检测是确诊肥厚型心肌病的“金标准”[32]。
7.2.4 高血压合并左心室肥厚的治疗要点 (1)推荐使用RAAS 抑制剂联合CCB 或利尿剂(Ⅰ A);(2)收缩压应降至120~130 mm Hg(Ⅱ a B)。
7.3 高血压合并心力衰竭
7.3.1 流行病学特点 心力衰竭是多种心血管疾病的严重和终末阶段,是全球心血管疾病防治的重要内容。欧美流行病学数据显示成人心力衰竭患病率为1%~2%;中国流行病调查数据显示在35~74 岁人群中心力衰竭的发病率为0.9%,近20~30 年,心力衰竭的病因由风湿性心脏瓣膜病转变为冠心病。据《中国心血管病报告2018》统计,我国心血管患病人数2.9 亿,其中心力衰竭450 万[33]。心力衰竭患病率随年龄的增加而明显上升。
7.3.2 病理生理特点 (1)左心室肥厚:高血压左心室肥厚首先反映在室间隔增厚上,后者是心脏大小循环所共有的部分,对左右心室收缩功能均有十分重要的作用。(2)舒张功能减退:舒张期心力衰竭的特征是左心室容积减少和舒张末压升高,左心室射血分数正常或轻度减低。这主要是由于心室肌松弛性和顺应性减低使心室充盈减少;为增加心室充盈,左心室必须提高充盈压而获得正常的心室充盈和每搏量。另外左心室肥厚使心肌细胞肥大,尤其是心肌纤维化使心肌舒张期压力-容量关系发生变化,也使心腔内舒张压升高,因此左心室肥厚可引起舒张功能减退。高血压早期心脏结构功能改变,其中舒张功能减退约占11%。(3)收缩功能减退:已知有左心室肥厚者比无左心室肥厚者心力衰竭发生率高10 倍,这是因为长期压力升高引起后负荷过度增高,引起血管壁厚度及心脏向心性肥厚和舒张期松弛性受损,最终出现心肌收缩力下降,心腔扩大,心室舒张末期容量增大,心室充盈压和心房压力均增高,肺静脉回流受阻,发生高血压心脏病急性或慢性左心衰竭。
7.3.3 临床诊断要点及鉴别点
7.3.3.1 临床诊断要点 (1)高血压病史。(2)临床表现:在心功能代偿期仅有高血压的一般症状;当心功能失代偿时,可出现左心衰竭的症状,轻者仅于劳累后出现呼吸困难,重者则出现端坐呼吸、心源性哮喘,甚至发生急性肺水肿;久病患者可发生右心衰竭最终导致全心衰竭。(3)体格检查:发现心尖搏动增强呈抬举性,心界向左下扩大,主动脉瓣区第二心音亢进可呈金属调,肺动脉瓣听诊区可因肺动脉高压而出现第二心音亢进,心尖区和/或主动脉瓣区可闻及Ⅱ~Ⅲ/Ⅳ级收缩期吹风样杂音,左心衰竭时心尖部可闻及舒张期奔马律。全心衰竭时,皮肤黏膜重度发绀、颈静脉怒张、肝大、水肿及出现胸、腹腔积液等。(4)实验室检查:心电图检查有单侧或双侧心室肥大及/或劳损,P 波增宽或出现切迹,V1 导联中P 波终末电势(PTF-V1)增大,各种心律失常等。胸部X 线检查有主动脉迂曲扩张、左心室或全心扩大、肺间隔线出现、肺淤血等。超声心动图示单侧心室或双侧心室肥厚扩大,左心室舒张功能减退,射血分数降低等。
7.3.3.2 高血压性心脏病鉴别诊断 主要与肥厚型心肌病相鉴别,前文已介绍鉴别要点。
7.3.4 常规治疗及治疗的特殊点 (1)及早控制血压:早期降压达标是治疗高血压性心脏病的首要任务,应考虑收缩压目标值<140 mm Hg。(2)逆转左心室肥厚:Framingham 心脏研究通过长期随访已经证实逆转左心室肥厚,心血管死亡率下降。逆转左心室肥厚包括非药物治疗:优化生活方式,低盐饮食;控制体质量;限酒;减少某些交感活性激素,如儿茶酚胺升高、RAAS 激活应激状态等。降压药物中ACEI、ARB 可能预防左心室肥厚及心肌纤维化的发生。动物实验和人体研究也证实CCB 能逆转左心室肥厚。(3)心力衰竭治疗:心力衰竭一旦出现明显症状时死亡率就很高,因此要加强对早期无症状心力衰竭(收缩期或舒张期心功能减退)的防治。对于收缩性心力衰竭,建议使用ACEI、β-受体阻滞剂、利尿剂、ARB 和/或醛固酮受体拮抗剂,降低死亡率及住院率。对于舒张性心力衰竭(射血分数保留的心力衰竭)的高血压患者,至今尚无证据显示降压治疗或者任何降压药物是有益的。然而,对于这些患者及高血压合并收缩功能下降的患者,应考虑将收缩压降至140 mm Hg 以下。
8 泌尿系统疾病与高血压
8.1 肾实质性疾病
8.1.1 流行病学特点 肾实质性高血压是指包括急慢性肾小球肾炎、慢性肾盂肾炎、多囊肾等多种肾脏病变引起的高血压,是继发性高血压最常见的原因,占全部高血压的5%~10%。我国目前仍以急慢性肾小球肾炎为主,但糖尿病肾病逐年增多[34-35]。
8.1.2 病理生理特点 肾实质性高血压的主要发病机制是球-管失衡导致的水钠潴留,其次是交感神经系统及肾素-血管紧张素系统的激活,其他因素还包括内皮素、氧化应激和炎性递质等[34-35]。
8.1.3 临床诊断要点及鉴别点 肾实质性高血压与原发性高血压肾损害较难区分,如条件允许应行肾穿刺活检以确诊。以下要点提示肾实质性高血压的可能性更大:(1)血压重度增高,尤以舒张压增高明显;(2)在发现血压增高时已合并血尿、蛋白尿;(3)血压增高的程度及病程与蛋白尿的程度及肾小球滤过率的降低不匹配;(4)肾性贫血出现较早;(5)眼底出血渗出病变[34-35]。
8.1.4 常规治疗及治疗的特殊点 肾实质性高血压的治疗应从控制原发病和降低血压两方面着手。(1)原发肾脏疾病如能明确病理类型,应及时给予相应治疗,如免疫抑制剂或激素,以逆转甚至根治。(2)降压目标值:<140/90 mm Hg,如能耐受,尤其是合并蛋白尿者,可进一步降低至120~130/70~80 mm Hg。(3)降压药物的选择:ACEI 或ARB 应作为首选,可联合长效CCB和利尿剂。若血肌酐水平>265 μmol/L,或肾小球滤过率低于30 ml/min,应慎用RAAS 抑制剂,可联合应用二氢吡啶类CCB、α-受体阻滞剂及β-受体阻滞剂,噻嗪类利尿剂应替换成袢利尿剂[34-35]。
8.2 肾血管性疾病
8.2.1 流行病学特点 肾血管性高血压是单侧或双侧肾动脉主干或分支狭窄引起的高血压,一般认为不足高血压人群的5%。50 岁以后主要病因是肾动脉粥样硬化,年轻人主要病因为肾动脉纤维肌性发育不良和大动脉炎[36]。
8.2.2 病理生理特点 肾动脉狭窄可导致肾实质缺血,激活RAAS,外周血管收缩、水钠潴留,从而升高血压[36]。
8.2.3 临床诊断要点及鉴别点 下述因素提示肾血管性高血压:(1)35 岁以前或50 岁以后发生高血压;(2)病程短而血压水平重度增高,降压药疗效差;(3)原有高血压的中老年人血压短期内迅速恶化,尤以舒张压升高明显;(4)四肢血压不对称或无脉症;(5)腹部/颈部血管杂音;(6)ACEI 或ARB 降压幅度非常大或诱发急性肾功能不全;(7)与左心功能不匹配的发作性肺水肿。实验室检查中最特异性的是肾素活性明显升高,还可见尿蛋白弱阳性或血肌酐轻度升高、血钾轻度降低。肾脏B 超示双肾大小不一致,肾血管超声及肾动脉CT/MRA 可提供肾动脉狭窄的解剖学诊断,卡托普利肾图试验可提供肾动脉狭窄的功能学诊断。肾动脉造影是诊断肾动脉狭窄的“金标准”[36]。
8.2.4 常规治疗及治疗的特殊点 肾血管性高血压治疗的目的主要是降低血压和保护肾功能。(1)肾动脉血运重建:如患肾出现萎缩趋势或肾功能明显下降,或药物治疗血压难以控制,则有血运重建的指征。肾动脉血运重建术包括单纯球囊扩张、支架置入术和外科手术。选用何种方式取决于肾动脉狭窄的病因,如纤维肌性发育不良可单纯球囊扩张,而动脉粥样硬化性病变则首选经皮肾动脉支架置入术(PTRA),大动脉炎患者在介入治疗前必须判断炎症活动状态。但如患侧肾脏已明显萎缩(长径<7.0 cm)或肾小球滤过率<10 ml/min,则失去了血运重建的机会。(2)药物治疗不能阻止肾动脉狭窄的进展,仅起到帮助控制血压的作用。单侧肾动脉狭窄呈高肾素者首选ACEI 或ARB,必须从小剂量开始,逐渐增加剂量。服药1~2 周复查血钾和血肌酐水平,血钾明显升高,或血肌酐较基线升高30%以上需要减量或停药。对于双侧或单功能肾肾动脉狭窄患者禁用此类药物[36]。
8.3 肾上腺疾病 多种肾上腺疾病与血压增高有关,主要包括原发性醛固酮增多症、嗜铬细胞瘤和库欣综合征,每种疾病的诊治要点见表4[37-39]。
8.4 透析患者降压药物的应用及注意事项
8.4.1 流行病学特点 高血压是透析患者常见的并发症之一,有报道维持性血液透析患者高血压的发生率高,达70%~90%[40]。
8.4.2 病理生理特点 与前述肾实质性高血压一致,透析患者高血压最主要的原因是水钠潴留,其他还包括交感神经系统和RAAS 激活、促红细胞生成素(EPO)应用、OSAS、继发性甲状旁腺功能亢进等。与非透析者相比,透析患者的血压随透析治疗发生周期性变化,总体表现为透析中逐渐下降,透析间期逐渐升高。透析过程中可出现矛盾性高血压,与毒素快速清除引起透析失衡综合征、透析液钙浓度过高导致血管收缩和心肌收缩力增加、快速脱水激活RAAS 等有关[40]。
8.4.3 临床诊断要点及鉴别点 透析患者在非透析日3 次以上诊室血压高于140/90 mm Hg 即可诊断,鉴别诊断主要在于分析患者血压升高的主要机制,从而进行更有针对性的治疗[40]。
8.4.4 常规治疗及治疗的特殊点 透析患者高血压的治疗需要综合多种药物及非药物干预措施:(1)控制干体质量:维持干体质量是控制透析患者血压的基础,可通过调整透析方案达到,同时透析间期限制摄入量以控制体质量增长;(2)减少钠摄入:2017 欧洲高血压学会(ESH)共识建议透析患者每日盐摄入量<4 g;(3)降压药物:5 种一线降压药物在透析患者均可应用,但要注意首选蛋白结合率高透析不被清除的药物,如药物可通过透析清除,应该在透析后给药[40]。
8.5 促红细胞生成素应用后高血压的处理
8.5.1 流行病学特点 l7%~47%的患者用促红细胞生成素后发生高血压或原有高血压进一步加重,有时可出现高血压脑病和脑血管意外,血压升高与红细胞比容(HCT)呈正相关[41-42]。
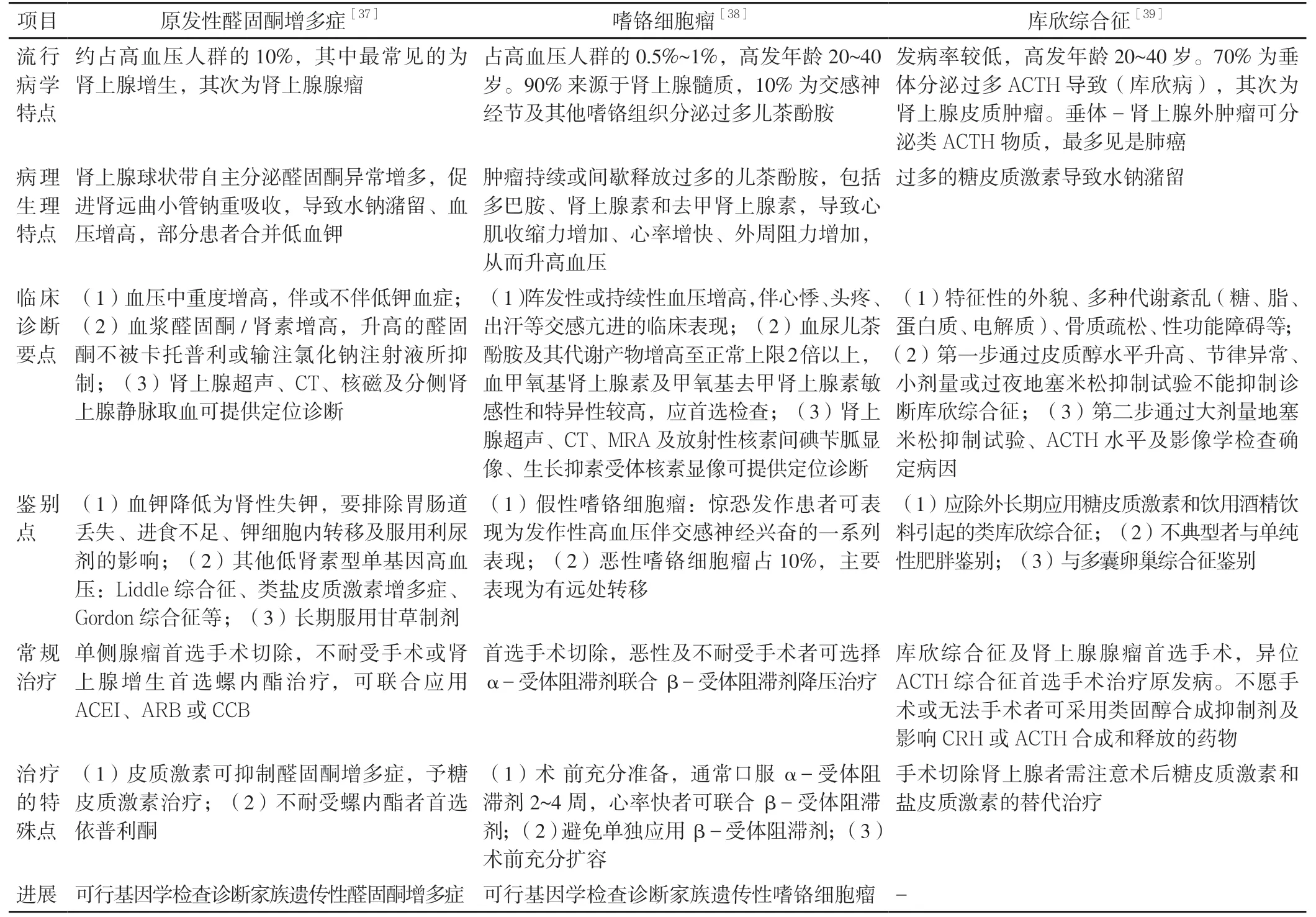
表4 肾上腺疾病的诊治要点Table 4 Diagnosis and treatment of adrenal diseases
8.5.2 病理生理特点 促红细胞生成素升高血压的机制尚未明确,可能与红细胞生成增加导致血液黏度增加和血容量增多、末梢血管异常反应性收缩及增多的血红蛋白与血管内皮舒张因子(EDRF)结合使血压升高有关[41-42]。
8.5.3 临床诊断要点及鉴别点 患者使用促红细胞生成素后出现高血压或原有高血压加重,需要考虑促红细胞生成素导致的高血压。主要鉴别在于这些患者通常为慢性肾脏病患者,难治性高血压常见,故在血压难以控制时,要考虑多方面因素,而不仅归因于促红细胞生成素的使用[41-42]。
8.5.4 常规治疗及治疗的特殊点 控制HCT 上升速度和程度可预防促红细胞生成素所致的血压增高,措施包括初始用量应<150 U·kg-1·周-1,HCT 升高速度每周<1%,控制HCT ≤33%。改善全球肾脏病预后组织(KDIGO)指南建议,每个月控制血红蛋白升高幅度在10~20 g/L,如果任意两周内血红蛋白增加超过10 g/L,促红细胞生成素剂量应降低约25%[41-42]。
9 脑部疾病与高血压
高血压是动脉粥样硬化最主要的危险因素。高血压导致的脑动脉硬化,临床常见的表现形式有脑梗死、脑出血。据统计,70%~80%的脑卒中患者都有高血压病史[3]。高血压可以引起脑血管疾患,同样脑部本身的疾患(脑血管或脑实质的病变)也可以引起血压的异常,成为继发性高血压的原因。后者虽然少见,但必须引起重视。由于头颅外壳坚实且相对密闭,脑容量的增加会影响颅内压的变化,颅内压的增高会影响血压的变化。增加大脑容量的情况可见于:脑实质的脑出血(创伤、肿瘤、高血压性)、水肿、炎症、蛛网膜下腔出血、脑脊液的循环不畅等。颅内压急剧升高时,患者出现血压升高、脉搏减慢、呼吸节律紊乱及体温升高等变化,这种变化称库欣(Cushing)反应。
9.1 与高血压相关导致的脑部动脉硬化性疾患的处理原则
9.1.1 急性缺血性脑血管病患者的血压处理原则 约70%的缺血性卒中患者急性期血压升高,原因主要包括:病前存在高血压、疼痛、恶心呕吐、颅内压增高、意识模糊、焦虑、卒中后应激状态等。多数患者在卒中后24 h 内血压自发降低。病情稳定而无颅内高压或其他严重并发症的患者,24 h 后血压水平基本可反映其病前水平。脑卒中急性期的降压处理要谨慎,降压同时注意脑灌注。目前关于卒中后早期是否应该立即降压、降压目标值、卒中后何时开始恢复原用降压药及降压药物的选择等问题尚缺乏充分的可靠研究证据。中国急性缺血性脑卒中降压试验(CATIS)提示强化降压组无明显获益,但可能是安全的[43]。卒中后低血压虽很少见,但要注意。原因有主动脉夹层、血容量减少及心排血量减少等。应积极查明原因,给予相应处理。
推荐意见:(1)准备溶栓者,血压应控制在收缩压<180 mm Hg、舒张压<100 mm Hg。(2)缺血性脑卒中后24 h 内血压升高的患者应谨慎处理,应先处理紧张焦虑、疼痛、恶心呕吐及颅内压增高等情况。血压持续升高,收缩压≥200 mm Hg 或舒张压≥110 mm Hg,或伴有严重心功能不全、主动脉夹层、高血压脑病的患者,可予降压治疗,并严密观察血压变化。可选用拉贝洛尔、尼卡地平等静脉药物,避免使用引起血压急剧下降的药物。(3)卒中后若病情稳定,血压持续≥140/90 mm Hg,无禁忌证,可于起病数天后恢复使用发病前服用的降压药物或开始启动降压治疗。(4)卒中后低血压的患者应积极寻找和处理原因,必要时可采用扩容升压措施。可静脉输注0.9%氯化钠溶液纠正低血容量,处理可能引起心排血量减少的心脏问题。
9.1.2 急性脑出血的血压管理 (1)应综合管理脑出血患者的血压,分析血压升高的原因,再根据血压情况决定是否进行降压治疗。(2)当急性脑出血患者收缩压>220 mm Hg 时,应积极使用静脉降压药物降低血压;当患者收缩压>180 mm Hg 时,可使用静脉降压药物控制血压,根据患者临床表现调整降压速度,160/90 mm Hg 可作为参考的降压目标值(Ⅱb,B)。(3)在降压治疗期间应严密观察血压水平的变化,每隔5~15 min 进行1次血压监测(Ⅰ级推荐,C 级证据)。
9.1.3 病情稳定的脑卒中患者的血压管理 (1)抗高血压药物的治疗能使卒中复发风险降低22%。遵循指南,病情稳定的卒中患者,降压目标<140/90 mm Hg。(2)颈动脉超声对发现颅外颈部血管病变,特别是狭窄斑块,很有帮助;经颅多普勒超声(TCD)可检查颅内血流、微栓子及监测治疗效果。(3)颅内大动脉粥样硬化性狭窄(70%~99%),推荐血压达到<140/90 mm Hg。注意患者自我感受,个体化确定降压目标值,保证大脑的灌注压力。
9.2 脑实质疾病引起的血压变化 颅内占位病变、颅内感染性疾患、颅内神经内分泌肿瘤引起的血压升高均有报道。如对患者的症状体征不加以仔细的观察判断,很有可能被漏诊。患者首先的表现是头痛、血压升高,且血压控制下来后,仍然有明显的头痛、呕吐不缓解,要注意脑部疾病的并存或脑部占位引发的血压增高。完善头颅CT、MRI、脑血管造影检查,对明确诊断将会有帮助[44]。
10 睡眠呼吸暂停综合征与高血压
10.1 流行病学特点 阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)与高血压常合并发生,是继发性高血压的重要原因。50%~92%的OSAHS 患者合并有高血压,而30%~50%的高血压患者同时伴有OSAHS[45]。顽固性高血压与OSAHS 关系更为密切,在OSAHS〔呼吸暂停低通气指数(AHI)≥10 次/h〕患者中顽固性高血压患病率为83%[46]。早在2003 年美国预防、检测、评估与治疗高血压全国委员会第7 次报告(JNC-7)中已明确将睡眠呼吸暂停列为继发性高血压主要病因之一[47]。
10.2 病理生理特点 OSAHS 和高血压关系密切,可通过多种机制参与血压升高:(1)交感神经兴奋:①反复发作的呼吸暂停,造成低氧血症和高碳酸血症,通过反馈机制,造成刺激主动脉弓和主动脉体的化学感受器,使交感神经活性增加,血压升高;②在睡眠过程中反复的低氧、复氧,导致睡眠结构的紊乱;③反复的觉醒、唤醒,导致睡眠的片段化,也导致交感神经的兴奋性增高,从而导致血压的升高[48]。(2)化学反射的异常:①反复的低氧血症刺激位于颈动脉体外周化学感受器;②高碳酸血症刺激中枢脑干的化学感受器,反复的低氧血症和高碳酸血症均会导致交感神经的兴奋性增加[49],而导致血压增高;③RAAS:反复的低氧和高碳酸血症激活RAAS,OSAHS 患者持续气道正压(CPAP)治疗可改善夜间的低氧,并降低夜间血压及日间血压,并观察到血浆醛固酮水平及肾素活性的降低[50]。
10.3 临床诊断要点及鉴别点 与OSAHS 相关联的高血压称为阻塞性睡眠呼吸暂停相关性高血压,诊断应包含两部分内容。(1)高血压诊断同前。(2)OSAHS诊断:主要根据病史、体征和多导睡眠监测(PSG)结果进行诊断。诊断标准:①临床有典型的夜间睡眠打鼾伴呼吸暂停、日间嗜睡〔Epworth嗜睡量表(ESS)<9分〕等症状,体征可见上气道任何部位的狭窄及阻塞,AHI≥5次/h者;②对于日间嗜睡不明显评分(ESS 评分≥9 分)者,但AHI ≥10 次/h,或者AHI ≥5 次/h 同时存在认知功能障碍、冠心病、脑血管疾病、糖尿病和失眠等1 项或1项以上合并症者也可确立诊断[51]。(3)阻塞性睡眠呼吸暂停相关性高血压的诊断:①血压24 h 持续的升高(非杓型或者反杓型);②血压可以伴随有呼吸暂停呈周期性的升高,或睡眠时血压高峰的出现与呼吸暂停发生、睡眠时相、低氧程度、呼吸暂停持续时间有明显的相关性。(4)病变程度判断:根据AHI 和夜间最低血氧饱和度(SpO2)将OSAHS 分为轻、中、重度,其中以AHI 作为主要判断指标,夜间最低SpO2作为参考(见表5)。
10.4 常规治疗及治疗的特殊点 CPAP 联合降压药物治疗较单纯药物治疗降压疗效好。
OSAHS 的治疗:(1)病因治疗。纠正导致OSAHS或使之加重的基础疾病,如甲状腺功能减低等。(2)生活方式改变,包括减肥、戒烟、戒酒、日间避免过于劳累。(3)慎用镇静催眠药、侧位睡眠等。(4)无创气道正压通气治疗,适用于中重度患者。①普通及智能型CPAP(Auto CPAP)通气(最为常用);②双水平气道正压(BiPAP)通气,有二氧化碳潴留明显者建议使用。可由非杓型或者反杓型恢复 杓型[52]。
对于OSAHS 合并高血压的药物降压治疗,选择降压药应注意以下问题:(1)首先考虑24 h 长效降压,对夜间血压增高的患者,可在睡前服用一种肾素-血管紧张素系统抑制剂(RAASI),如ACEI、ARB[53]。(2)要考虑药物对睡眠各阶段的降压作用:CCB 对OSAHS程度无影响。OSAHS 患者存在肾素血管紧张素系统过度激活的现象,ACEI 或ARB 不仅能够明显降低血压,且有改善患者呼吸暂停及睡眠结构作用。由于OSAHS患者经常合并血脂、血糖异常,除应注意控制上述危险因素外,还要考虑药物对代谢方面的影响[54]。(3)避免使用的降压药物:①中枢性降压药物:不选择具有中枢镇静作用的降压药物,以免加重呼吸暂停,如利血平、可乐定等。②非选择性β-受体阻滞剂:OSAHS患者呼吸暂停和低氧血症可致潜水样反射,激活心脏迷走神经反射,引起心动过缓,甚至心脏停搏,故β-受体阻滞剂应避免使用;同时对有明显气道阻塞的患者在使用β-受体阻滞剂时也应慎重。
11 心理障碍与高血压
11.1 高血压合并心理障碍的流行病学特点 据WHO统计,全球抑郁症发病率约为11%,仅次于心血管疾病、癌症、糖尿病而居第4 位。据估计,我国约有1.73 亿以焦虑、抑郁症状为主的精神障碍患者。国外研究报道高血压患者中抑郁的发生率为20%~30%[55],国内的研究结果与之相似。高血压患者合并焦虑障碍的发病率更高,达40%~50%[56]。高血压的控制程度与是否合并心理障碍密切相关。
11.2 高血压与心理障碍共病的发病机制 心理社会因素造成的不良刺激,使皮质对下丘脑和延髓等处的血管运动中枢的调节作用失常,血管收缩神经冲动占优势,引起小动脉紧张度增高,导致血压升高。此外,微血管发生适应性改变,管壁增厚 ,周围血管阻力增高,血压继续升高[57]。行为方式异常如生活方式、饮食、酗酒、吸烟、缺乏运动等通过垂体-下丘脑-肾上腺轴,使RAAS 慢性激活,神经递质传导失调,使得高血压和心理障碍之间的关系变得更加复杂。
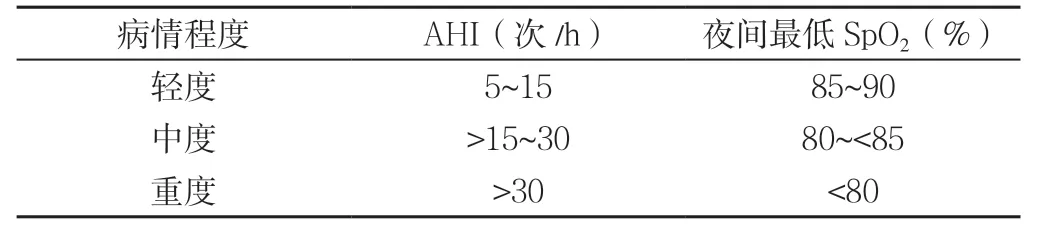
表5 成人OSAHS 病情程度判断依据Table 5 Criteria for judging the severity of OSAHS in adults
11.3 高血压患者心理障碍的特性 (1)心理因素导致血压升高:由于各种应激因素引起的血压升高称为应激性高血压。这一类患者通过相应心理治疗后高血压完全可以控制,不需要长期服用降压药物。(2)高血压与心理障碍共存。
11.4 高血压患者心理障碍的识别 (1)高血压诊断评估;(2)高血压合并心理障碍患者的识别:①焦虑、易激惹;②失眠、夜惊、多梦;③抑郁、乏力;④胃肠不适、厌食;⑤头懵、头疼、颈部痛、背部痛、腹部隐痛;⑥记忆力下降。(3)心理量表测试:目前识别心理障碍比较有效快速方便的是应用心理量表,如躯体化症状自评量表、患者健康问卷9 项(PHQ-9)(见表6)、广泛焦虑问卷7 项(GAD-7)(见表7)、综合医院焦虑抑郁量表(HAD)等。对于基层医生,心理障碍相关量表只作为粗筛查用,因躯体化症状自评量表和HAD,非精神科医生需要经过培训后才能用于临床,在此不再列表。
11.5 高血压患者的双心治疗
11.5.1 抗高血压治疗 首选抑制交感活性的药物,ACEI、ARB、选择性β1或α1、β1-受体阻滞剂。
11.5.2 心理治疗及抗焦虑抑郁药物的应用 高血压患者伴有心理障碍时,应对患者进行积极的心理疏导,此外考虑抗抑郁焦虑药物加降血压药物联合应用。PHQ-9、GAD-7 测评≥14 分者请精神专科进一步诊断与治疗。
有安全性证据用于心血管病患者的抗抑郁焦虑药物简介如下:(1)选择性5-羟色胺再摄取抑制剂(SSRI):如氟西汀、帕罗西汀、舍曲林、西酞普兰等,是世界精神病协会(WPA)推荐的首选药物,由于一般2 周以上起效,适用于达到适应障碍或更慢性的焦虑和抑郁情况。建议心血管病患者从最低剂量的半量开始,老年体弱者从1/4 量开始,每5~7 天缓慢加量至最低有效剂量。(2)苯二氮类:如地西泮、艾司唑仑、氯硝西泮、劳拉西泮、阿普唑仑、咪达唑仑、奥沙西泮等,用于焦虑症和失眠的治疗。特点是抗焦虑作用起效快。注意事项:有呼吸系统疾病者要慎用,易引起呼吸抑制,导致呼吸困难。长期使用会产生药物依赖,突然停药可引起戒断反应。建议连续应用不超过4 周,逐渐减量停药。(3)唑吡坦和佐匹克隆是在苯二氮类基础上开发的新型助眠药物,没有肌松作用和成瘾性。特点是对入睡困难效果好,晨起没有宿醉反应。但相应缺乏改善中段失眠的作用,也不能改善早醒。没有抗焦虑作用。部分老年患者用唑吡坦后,可能出现入睡前幻觉(视幻觉为主)。(4)氟哌噻吨美利曲辛(黛力新):该药是一个复合制剂,含有神经松弛剂(氟哌噻吨)和抗抑郁剂(美利曲辛),其中美利曲辛含量为单用剂量的1/10~1/5,降低了不良反应,并协同调整中枢神经系统功能、抗抑郁、抗焦虑和兴奋特性。
12 内分泌疾病与高血压
内分泌高血压是继发性高血压中的重要一类。因内分泌组织增生或者肿瘤导致的多种内分泌疾病引起,由于其相应的激素如儿茶酚胺、糖皮质激素、肾素血管紧张素、醛固酮等激素分泌过多,导致机体血压动力学改变而引起血压升高,这种内分泌激素分泌增多而导致的高血压,称为内分泌性高血压。本章中重点讲述糖尿病、甲状腺功能亢进症(甲亢)、甲状旁腺功能亢进症及先天性肾上腺皮质增生症。

表6 患者健康问卷9 项(PHQ-9)抑郁症筛查量表Table 6 PHQ-9 depression screening scale

表7 广泛焦虑问卷7 项(GAD-7)焦虑症筛查量表Table 7 GAD-7 anxiety screening scale
12.1 糖尿病与高血压 糖尿病是胰岛素分泌不足或者胰岛素抵抗引起的一类疾病,引起血糖升高及血糖升高引起的并发症,临床上常见糖尿病合并高血压患者。
12.1.1 流行病学特点 高血压在糖尿病中很常见,其患病率取决于糖尿病类型和持续时间、年龄、性别、种族、BMI、血糖控制史及肾脏疾病的存在[58]。两病合患在人群中有较高的比例,在原发性高血压门诊患者中,发现糖尿病患病率高达 24.3%,远远高于非高血压人群;在 2 型糖尿病患者中有30%~50%合并有高血压,我国为55%[59]。
12.1.2 病理生理特点 胰岛素抵抗对肾脏及水钠代谢平衡的不良影响在高血压发病的病理过程中扮演重要角色。胰岛素可以加强远曲小管对钠的重吸收,主要是通过提高钠转运通道的表达,并降低钠的排出[60];高胰岛素血症还可以通过对近端小管钠-氢交换作用的加强促进水钠潴留的发生和发展,并最终导致高血压的发生。高胰岛素血症所致的氧化应激状态对高血压产生有一定促进作用:主要是通过使机体对血管收缩及加压物质如血管紧张素Ⅱ等反应增强从而促进收缩压的升高[61]。空腹血糖受损(IFG)也是高血压发病的危险因素[62]。高血压患者常伴有RAAS 活性增加,RAAS 持续激活是导致高血压的一个重要因素,RAAS 活性越高,空腹血糖水平越高,患糖尿病的风险越大[63]。
12.1.3 临床诊断要点 按照糖尿病诊断标准:糖尿病症状加任意血糖≥11.1 mmol/L,或空腹血糖≥7.0 mmol/L,或者口服葡萄糖耐量试验(OGTT)2 h 血糖≥11 mmol/L。高血压诊断标准同前。
12.1.4 治疗要点 (1)对症降低血糖:包括口服降糖药及注射胰岛素。(2)高血压治疗推荐:①对于高血压140/90~160/100 mm Hg,给予生活方式改变和单一药物治疗,推荐优选ACEI、ARB,尤其合并蛋白尿或者肾病、有心血管风险因素者。②对于血压≥160/100 mm Hg:起始用两种药物治疗,如果合并蛋白尿,优选ACEI、ARB,联合治疗首选CCB,其次联合小剂量噻嗪类利尿剂〔对于肌酐>265 mmol/L 或 eGFR<30 ml·min-1·(1.73 m2)-1,宜选袢利尿剂〕,如果没有蛋白尿就是在起始治疗药物的基础上加用其他药;对于有心绞痛或者陈旧性心肌梗死患者,可联合使用β-受体阻滞剂;如果血压不达标,可以给予3 种降压药:优选RAAS 抑制剂+CCB+利尿剂。(3)降压目标:对于糖尿病患者,2017 年中国糖尿病防治指南建议,血压目标一般在130/80 mm Hg,对于老年或伴冠心病糖尿病患者,可根据患者情况相应地放宽至<140~150/90 mm Hg。对于有肾脏、眼睛、脑血管损伤的需<130/80 mm Hg,对于合并并发症或有药物不良反应的患者在不发生药物不良反应的情况下采用更严格的降压目标(如<120/80 mm Hg),更低的血压目标对于有心血管疾病高风险的患者有益,故尽可能降低至更低的血压。(4)对于没有蛋白尿和高血压的糖尿病患者,RAAS 抑制剂(ACEI、ARBs)并没有阻止糖尿病肾病的发展,不建议使用RAAS 抑制剂预防治疗。
12.1.5 高血压的管理 (1)饮食管理:合理膳食、多运动、戒烟戒酒、低盐低脂糖尿病饮食等,控制体质量。(2)控制血糖、血压在目标范围内,降脂治疗。(3)随访:定期检测血压、血糖,复查肝肾功能、血脂、电解质、尿酸、尿蛋白、尿微量白蛋白/肌酐等的变化,眼底镜检、颈动脉超声检查等。
12.2 甲亢与高血压 指甲状腺呈现高功能状态,持续产生和释放过多的甲状腺激素,引起高代谢和交感神经系统兴奋性增加的一系列临床症状。甲亢可以引起心脏损害,主要表现为心脏增大、心律失常、高血压、心力衰竭等。
12.2.1 流行病学特点 在继发性高血压患者中甲亢患者占13%[64],国外报道甲亢患者的高血压患病率高于甲状腺功能正常患者的发病率[65]。
12.2.2 病理生理特点 甲状腺激素直接作用于心肌细胞,提高心肌儿茶酚胺作用和敏感性,同时,甲状腺素分泌过多使交感神经兴奋性增加,提高心肌儿茶酚胺作用和敏感性,引起心动过速,收缩压增加。甲亢时代谢亢进,外周组织耗氧量增加致使外周血管扩张、动静脉交通支开放,阻力下降,导致心脏舒张期大动脉的压力即舒张压下降[66]。故脉压增大。
12.2.3 临床诊断要点 典型的临床症状即可诊断,不典型临床症状,依靠甲状腺激素的测定和一些特殊检查,如甲状腺摄131I 检查即可诊断。
12.2.4 鉴别诊断 (1)嗜铬细胞瘤:本病的高代谢症候群、心动过速、多汗酷似甲亢,但嗜铬细胞瘤高血压发病率较高,一般舒张期血压升高常见,血尿儿茶酚胺及其代谢产物升高,且无甲状腺肿大,检查甲状腺功能正常。(2)原发性高血压病:一般起病缓慢,有家族史,体检时发现血压升高,无高代谢症候群,检查甲状腺功能正常,可资鉴别。
12.2.5 治疗方法 (1)清淡饮食,低盐低碘饮食。(2)治疗原发病:对甲亢本身的治疗一般分为抗甲状腺药物、放射性碘治疗和甲状腺次全切除术,根据甲亢治疗指南选择相应的治疗方案。(3)对症处理高血压、心力衰竭及心房颤动:高血压治疗优选β-受体阻滞剂和利尿剂,β-受体阻滞剂主要为非选择性的β-受体阻滞剂,可同时阻断β1和β2受体,如普萘洛尔。心功能不全的治疗:同普通心力衰竭治疗,利尿剂降低前负荷,血管扩张剂降低心脏前后负荷,如硝酸甘油、硝普钠等;加强心肌收缩力。心房颤动治疗:转复(<48 h)、降低心室率及抗凝治疗。
12.3 甲状旁腺功能亢进与高血压 由于甲状旁腺腺瘤、增生或腺癌所引起的甲状旁腺分泌过多,其经典临床表现包括反复发生肾结石、骨质疏松、消化道溃疡、明显乏力、恶心呕吐及神经精神症状等。
12.3.1 流行病学特点 甲状旁腺功能亢进发病率我国尚缺乏报道,国外报道其发病率高达1/1 000~1/500,该病女性多见,男女比例1∶3,发病率随年龄增加而增加,大多数为绝经后妇女,为普通人群的5 倍[67]。甲状旁腺功能亢进患者约有1/3 合并高血压。
12.3.2 病理生理特点 主要的病理生理特点是甲状旁腺分泌过多的甲状旁腺激素(PTH)[68],PTH 与骨和肾脏的PTH 受体结合,使骨吸收增加,钙释放入血,肾小管回吸收钙的能力增加,并增加肾脏1,25-二羟维生素D2的合成,后者作用于肠道,并增加肠钙的吸收,导致血钙升高。高钙血症促进平滑肌收缩、血管钙化,引起血压升高。
12.3.3 临床诊断要点 主要是钙代谢紊乱所致的全身症状:临床主要表现为骨关节疼痛、病理性骨折、反复泌尿系感染及泌尿系结石。心血管方面:高钙血症促进血压升高、心律失常,还有肌力下降、肌肉疼痛等。临床上高度怀疑者,应进一步定性检查:(1)血清钙和游离钙:血钙升高,血钙>2.7 mmol/L,可呈持续性增高,需注意白蛋白对血钙水平的影响;血清游离钙不受白蛋白影响,正常为(1.18±0.05) mmol/L。(2)血清磷:多数<1 mmol/L。(3)血清碱性磷酸酶:升高,提示骨骼受损。(4)血甲状旁腺激素:对诊断至关重要,高于正常或正常范围高限水平,则高度怀疑甲状旁腺功能亢进。(5)影像学诊断:骨骼X 线检查提示骨质疏松、骨质软化;骨显像等。(6)超声检查:甲状旁腺超声检查,为定位诊断的有效手段,可进一步行针穿刺检查。(7)放射性核素及CT、MRI 检查可有助于诊断,还有正电子发射计算机断层显像/计算机断层扫描(PET/CT):可以反映甲状旁腺的代谢情况,其分辨率更高,检查耗时更少。原发性甲状旁腺功能亢进症(PHPT)诊断成立后,还需考虑发生病变的甲状旁腺的性质,因为不同病理类型所选术式、术后管理均不同,病变性质主要依赖于术前穿刺病理或术中冷冻快速病理诊断。
12.3.4 治疗方法 (1)同常规甲状旁腺功能亢进治疗;(2)甲状旁腺切除术后可使血压降低或可减少降压药物的使用[69]。
12.4 先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)与高血压 CAH 是一组由肾上腺皮质类固醇合成通路各阶段各类催化酶的缺陷,引起以皮质类固醇合成障碍为主的常染色体隐性遗传性疾病。CAH 以21-羟化酶缺陷症(21-hydroxylase deficiency,21-OHD)最常见,有发生致命的肾上腺失盐危象风险,高雄激素血症致生长和性腺轴紊乱。但其有确定的药物治疗。其中11β-羟化酶缺乏和17α-羟化酶缺乏可引起高血压。
12.4.1 流行病学特点 在世界范围内的活产新生儿发病率为1/15 000~1/10 000,以21 羟化酶缺乏症最为常见,占90%~95%,其11β-羟化酶缺乏症占3%~8%,17α-羟化酶缺乏比较罕见,约占CAH 的1%。
12.4.2 病理生理特点 (1)11β-羟化酶缺乏是由于CYP11B1 基因突变引起,导致11β-羟化酶活性失活,导致皮质醇合成不足、肾上腺雄激素合成过多的临床表现,由于去氧皮质酮(deoxycorticosterone,DOC)的盐皮质激素作用,2/3 的经典型 CYP11B1 患者在儿童中期出现高血压,很少出现低血钾,也不易出现肾上腺危象。(2)17α-羟化酶缺乏症:是由于CYP17A 基因突变造成的,CYP17A 的缺乏使糖皮质激素和肾上腺源性激素生成减少,为生成足够的具有较弱糖皮质激素作用的肾上腺皮质酮去代替皮质醇,去氧皮质酮水平急剧升高,去氧皮质酮有盐皮质激素作用,可导致高血压、低血钾及性腺功能减退等表现。
12.4.3 临床诊断要点 凡出生时外生殖器畸形,阴蒂肥大,阴茎粗大,小婴儿有失盐、体质量不增或外阴难辨认性别,应怀疑本病,对于临床上存在高血压、低血钾,伴有性发育异常的患儿应考虑17-羟化酮缺陷症(17-OHD)的可能。实验室检查:羟孕酮(17-OHP)与皮质醇水平是筛查指标。经典型患者血浆17-OHP水平通常超过100 μg/L,对于非典型患者,随机的17-OHP 水平可能正常,需要进一步行ACTH 刺激试验来观察17-OHP 的变化。
12.4.4 治疗方法 (1)糖皮质激素是经典型CAH 主要的治疗药物。通过糖皮质激素的替代,可以有效减少ACTH 和雄激素的过多分泌。一般小剂量氢化可的松10~20 mg·(m2)-1·d-1。加用盐皮质激素(常用为9α-氟氢可的松)以维持水盐代谢的平衡。青春期开始补充性激素。(2)外科治疗对于药物治疗不能控制的难治性CAH 患者,肾上腺切除术是一种可选的治疗方法[70-71]。
13 大血管疾病与高血压
13.1 动脉夹层
13.1.1 流行病学特点 多项研究均指出未控制的高血压是主动脉夹层(aortic dissection,AD)最主要的危险因素之一。为期10 年的牛津血管研究调查得出,主动脉夹层在每年每十万人中约发生6 例,发病率随年龄增长而升高;男女比例为1.5∶1,且女性的发病年龄明显高于男性[72]。在一项瑞典的研究中,男性发病率为16.3/100 000,女性为9.1/100 000,22% 的患者在到达医院前死亡,接受手术治疗的患者30 d 死亡率为22%,远期生存率为66%,其中60 岁以上人群的死亡率更高[73]。67.3%的患者在发病前服用过降压药物,但总体来说血压控制情况较差。在主动脉夹层发生之前的5 年中,56.0%的患者有过血压高于140/90 mm Hg的记录,46.0% 的患者有过至少一次收缩压超过180 mm Hg 的记录。在Stanford A 型夹层患者中,患病前血压越高,院前死亡的概率越大[72]。
13.1.2 病理生理特点 主动脉夹层被定义为由壁内出血引起的主动脉壁中层破坏,并形成相通或不通的真腔与假腔。大多数情况下,这一过程起源于主动脉内膜破损,血液由此进入中膜。中膜内血栓形成后,炎性反应会使平滑肌细胞进一步凋亡,弹性纤维继续降解,增加中膜破裂的风险[74]。升主动脉夹层向近心端蔓延可引起低灌注综合征、心包填塞、主动脉瓣关闭不全及急性心肌缺血等严重并发症;向远心端蔓延可波及无名动脉、左颈总及左锁骨下动脉,引起相应血管缺血症状。降主动脉夹层延展可引起肾脏、消化系统及下肢缺血[75]。
13.1.3 临床诊断要点及鉴别点 主动脉夹层的诊断需要结合临床表现、验前概率、实验室及影像学检查。初始评估需要详细的病史采集和体格检查。对脑、心脏、腹部和四肢的详细评估可以大致推断出夹层的位置和撕裂程度。主动脉夹层的排除很大程度上依赖验前概率,2010 年ACC/AHA 与2014 年ESC 指南均推荐将验前概率作为主动脉夹层诊断中的重要工具之一。其评估基于三方面数据(见表8):危险因素、疼痛特点和体格检查,将每一项的得分累加,得分越高,患主动脉夹层的验前概率越大。据此在诊断思路中做出相应调整,选择合适的实验室检查手段。血浆平滑肌肌球蛋白重链、D-二聚体、超敏C 反应蛋白等生物标志物在主动脉夹层的诊断中很有价值,但仍需大样本的前瞻性研究来证实。除此之外,还需行心肌损伤标志物、肌酐、乳酸、肝酶等检查以鉴别诊断或明确有无并发症。心电图、胸部X线等检查应常规进行,可以为诊断主动脉疾病提供进一步证据,或提供鉴别诊断思路。通过筛查,主动脉夹层高风险的患者应进行主动脉影像学检查,包括经胸或经食管主动脉彩超、胸部CT 或MRI。此外,由于部分主动脉夹层患者需要手术治疗,可一并检查手术所需的项目,以缩短治疗的延搁[74,76]。最初的评估应当直截了当,首先排除致死性疾病,如心肌梗死、心包填塞、心脏或主动脉破裂等情况[77]。主动脉夹层还应与急性肺栓塞、急性心包炎、气胸、脑卒中、急腹症等疾病相鉴别。
13.1.4 常规治疗及治疗的特殊点 及时治疗至关重要。对所有主动脉夹层患者都应当第一时间给予止痛、稳定血流动力学治疗。对于血压高、无休克患者,需尽快控制血压与心率,首选静脉注射β-受体阻滞剂,将收缩压维持在120 mm Hg 以下,目标是在维持灌注的情况下尽可能降低血压,防止主动脉壁进一步撕裂。主动脉夹层导致的低血压休克治疗方法有限,首先应积极补液扩容,必要时可以使用血管升压药,但存在使夹层扩大的风险。低血压是手术的指征。急性Stanford A 型主动脉夹层和有并发症的B 型主动脉夹层应尽快手术治疗。对于血流动力学稳定的主动脉夹层患者,应继续密切监测生命体征,控制血压及心率,逐步过渡至口服药物治疗[74,76]。目前认为主动脉夹层可分为急性期(0~14 d)、亚急性期(15~90 d)和慢性期(90 d 后)。慢性期血压需控制在130/80 mm Hg 以下,并避免提重物等体力活动。首选药物为β-受体阻滞剂,其能够减缓夹层动脉瘤的变性,减少晚期主动脉夹层相关手术[74]。

表8 验前概率的评估Table 8 Pre test probability evaluation
13.1.5 最新进展 一项20 人的研究发现高血压可以导致主动脉壁机械性质的改变,长期的张力导致主动脉壁硬化,弹性纤维降解,患主动脉夹层的概率增加[78]。2017 年ACC/AHA 的高血压指南中提出,β-受体阻滞剂的使用可以提高伴有高血压的主动脉夹层患者远期生存率,而ACEI则不能改善生存率[79]。夜间血压控制不佳,尤其是夜间收缩压超过124 mm Hg 的患者,再发心血管事件的可能性升高[80]。一项回顾性观察研究表明血压波动是主动脉夹层的独立危险因素[81]。对于80 岁以上,有明显假腔的主动脉夹层患者,手术治疗的生存率及生存质量远超保守治疗[82]。主动脉疾病患者是否应进行适当的体育锻炼目前仍存在争议,需要更多的前瞻性研究提供证据[83]。
13.2 间歇性跛行/外周动脉疾病 广义的外周动脉疾病(peripheral arterial disease,PAD)包括除心脑动脉以外所有动脉的疾病,但通常外周动脉疾病指下肢动脉粥样硬化性闭塞症,又称为下肢动脉疾病(lower extremity artery disease,LEAD),包含从无症状PAD 到慢性肢体重度缺血的一系列临床表现[75,84]。
13.2.1 流行病学特点 截至2010 年,全世界约有2 亿PAD 患者,69.7%居住于中低收入国家,其中太平洋西岸国家共有约4 590 万PAD 患者。在高收入国家中,45~49 岁PAD 发病率在女性中为5.28%,男性为5.41%,85~89 岁女性为18.38%,男性为18.83%。中低收入国家男性PAD 发病率低于高收入国家,在45~49 岁为2.89%,85~89 岁为14.94%。中低收入国家的女性发病率高于男性,尤其是年轻女性,45~49 岁女性PAD 发病率为6.31%,85~89 岁为15.22%。大多PAD 患者于50 岁后发病,65 岁后发病率呈指数增长[85]。一些心血管危险因素大大促进了PAD 的发生,如吸烟、糖尿病、高血压、高脂血症等[86]。其他危险因素尚不明确。单独发生的PAD 可以被视为心血管事件风险的标志。PAD 还与心房颤动、心力衰竭等疾病有一定关联[86-88]。
13.2.2 病理生理特点 PAD的本质是动脉粥样硬化病变。目前认为内皮损伤是动脉粥样硬化的始动因素。可导致本病的各种危险因素均会损伤内皮细胞,使其功能紊乱,表面抗血栓形成的特性发生改变,促凝性增加;内皮来源的血管收缩因子与扩张因子平衡发生倾斜,血管易痉挛。内皮细胞功能的改变引起了严重的细胞间相互作用,逐渐形成粥样硬化斑块,使管腔狭窄,相应器官缺血[75]。
13.2.3 临床诊断要点及鉴别点 LEAD 起病时可以无任何症状,或仅有肢体发凉、麻木等不适。随病情进展,30%~40%患者可以出现典型的间歇性跛行(intermittent claudication,IC),即行走后下肢肌肉出现疲劳、不适、痉挛或疼痛等症状,休息10 min 以内即可缓解。LEAD中最严重的类型为慢性肢体重度缺血(chronic limbthreatening ischemia,CLTI),以患肢缺血性静息痛,伴或不伴组织缺损和感染为特点。无症状的LEAD 患者中有一部分,其血管病变已经十分严重,但可能由于其他疾病不能进行体力活动,因而并未表现出症状,或由于糖尿病等病变使得感觉减退,称为隐匿性LEAD(masked LEAD)[86,88]。临床常用Fontaine 或Rutherford 分级来评估LEAD。2017 ESC指南强调了根据伤口(W)、缺血(I)和足部感染(fl)的WIfl 分级,可用于预测截肢风险[86]。
2017 ESC 指南和2016 AHA/ACC 指南均强调了踝肱指数(ankle-brachial index,ABI)的重要性,并作为Ⅰ级推荐。当ABI<0.9,诊断 LEAD 的灵敏度为68%~84%,特异度为84%~99%。但糖尿病及终末期慢性肾脏病患者动脉僵硬,ABI 可能并不降低,因此需要进一步的实验室检查来明确 LEAD 的诊断。此外,2017 ESC 指南还指出,ABI 可作为心血管事件风险分级的工具。多普勒超声(DUS)、CT 血管成像、MR 血管成像、数字减影血管造影(DSA)等影像学方法可明确狭窄的位置、程度。脚趾收缩压、趾肱指数(TBI)和经皮氧分压(TcPO2)均有助于LEAD 诊断,可作为补充[86,88]。LEAD 患者可以考虑进行其他部位血管病变的筛查,推荐等级为Ⅱa[88]。
13.2.4 常规治疗及治疗的特殊点 PAD 患者的治疗需要针对局部病变和全身心脑血管事件风险两方面来进行。预防总体心血管事件的发生至关重要,需要多学科的联合管理。应当从非药物和药物两个方面来减少心血管事件的危险因素。非药物治疗包括戒烟、减重和规律体育锻炼等,药物治疗则包括控制血压、血脂、血糖,以及抗血栓形成等。当日常活动受限时,可以考虑血运重建术,对于肢端坏疽的患者则应考虑截肢治疗[86,88]。
下肢PAD 伴高血压的患者,血压应控制在<140/90 mm Hg。降压过程应缓慢、渐进,防止患肢血流急剧下降。控制血压达标可降低心脑血管事件的发生率,还能减缓局部病变进程,降低截肢率。降压药物首选CCB 和RAAS 抑制剂(ACEI 或ARB),在降压同时可以改善病变血管的内皮功能。选择性β1-受体阻滞剂在PAD 合并高血压的治疗中有效,且并不会加剧患肢缺血程度,因此并非禁忌。利尿剂会减少血容量,增加血液黏滞度,因此不推荐应用[2-3]。
14 免疫系统疾病与高血压
自身免疫病可以从疾病本身和治疗药物两方面影响血压。疾病方面包括系统性或结缔组织病肾损害(如红斑狼疮、硬皮病等),因各种肾脏疾病导致的肾移植术后,大动脉炎引起的主动脉或肾动脉狭窄等;药物方面有糖皮质激素、免疫抑制剂(如环孢素)、非甾体消炎药(NSAIDs)等[2-3,79]。
14.1 流行病学特点 以肾动脉狭窄为例,一项1999—2014 年的研究调查了2 047 例肾动脉狭窄引起的高血压,其中259 例(12.7%)是大动脉炎导致的,且肾动脉狭窄的最常见病因在不同年龄段中差别很大,≤40岁人群中最主要的病因为大动脉炎,占比60.5%,而>40 岁人群中94.7%的病因为粥样硬化,大动脉炎的比例仅占3.8%。除了年龄因素,女性因大动脉炎导致肾动脉狭窄的比例明显高于男性[89]。自身免疫病的治疗经常需要使用糖皮质激素,但长期应用糖皮质激素将导致医源性库欣综合征。无论是医源性还是内源性,库欣综合征患者中约80%存在高血压[90]。接受糖皮质激素治疗的患者中约20%出现了高血压,且其中一些人的病情可以十分严重[91-92]。糖皮质激素诱发的高血压更常出现在老年人及有高血压家族史的人群中。环孢素导致的高血压在硬皮病患者当中也很常见[93]。
14.2 病理生理特点 免疫结缔组织病的共同特点是临床表现为多系统损害和血清中大量的自身抗体,病理特点为累及大小不等的血管炎。当血管炎累及大动脉、肾血管及肾实质时,患者即可出现不同程度的高血压。不同的免疫结缔组织病发生继发性高血压的机制不完全相同,可分为:(1)病变累及肾动脉及其分支,肾供血不足,造成血管紧张素Ⅱ的上升,血压升高,主要的疾病有系统性硬化病、结节性多动脉炎、大动脉炎、白塞病等;(2)病变累及肾实质,肾单位大量丢失,导致水钠潴留和细胞外容量增加,以及RAAS 激活、排钠减少,导致高血压,高血压又进一步升高肾小球内囊压力,形成恶性循环,加重肾脏病变。这类疾病包括狼疮肾炎、原发性舍格伦综合征、显微镜下血管炎、类风湿关节炎等;(3)病变直接累及大血管,如主动脉缩窄,这类疾病主要为大动脉炎、白塞病;(4)非疾病本身的其他因素:长期服用某些治疗药物(如环孢素A、肾上腺皮质激素、非甾体消炎药等)及因慢性炎症引起的肾淀粉样变等[2-3,79]。
大动脉炎是指主动脉及其主要分支的慢性进行性非特异性炎性疾病,是引起血压升高的主要病种,达半数以上大动脉炎患者并发高血压,或以高血压为首发表现。常累及主动脉及其主要分支如头臂动脉干、锁骨下动脉、椎动脉、颈动脉、肺动脉、冠状动脉及肾动脉等,导致相应部位血管的狭窄甚至闭塞,从而引起相应症状和体征。病理表现为受累的血管可发生全层动脉炎。早期血管壁为淋巴细胞、浆细胞浸润,偶见多形核中性粒细胞及多核巨细胞。由于血管内膜增厚,导致管腔狭窄或闭塞,少数患者因炎症破坏动脉壁中层,弹力纤维及平滑肌纤维坏死,而致动脉扩张、假性动脉瘤或夹层动脉瘤[94]。自身免疫病常用治疗药物也可以导致高血压(见表9)。
14.3 临床诊断要点及鉴别点 免疫结缔组织疾病导致的高血压多有较明确的免疫结缔组织病史,有蛋白尿、血尿、肾功能异常、eGFR 降低、肾脏大小或形态异常,且以上表现可早于高血压出现,血压常难以控制,必要时行肾脏活检以明确诊断[3]。
大动脉炎的临床表现缺乏特异性,主要取决于受累部位。累及肾动脉,引起肾动脉狭窄,导致肾血管性高血压,临床可见以舒张压升高为主要表现,可在腹部听诊闻及肾动脉杂音;累及胸腹主动脉,导致主动脉严重狭窄则主要表现为上肢高血压,下肢脉弱或无脉,双下肢血压明显低于上肢(ABI<0.9),狭窄部位听诊可闻及明显杂音。累及升主动脉,炎症破坏动脉壁中层导致升主动脉扩张或出现升主动脉瘤,继发主动脉瓣相对关闭不全,可出现相应体征,如主动脉瓣舒张期杂音等,临床表现为收缩期高血压;长期动脉炎症导致全身动脉硬化而出现高血压。大动脉炎也缺乏特异的血清标志物和监测疾病活动的可靠实验室指标,临床上习惯用C 反应蛋白和动态红细胞沉降率(ESR)作为疾病活动的检测指标。CT 及核磁可显示受累血管病变,核磁检查可通过血管壁水肿情况反映疾病活动程度。对可疑受累的动脉进行血管造影检查可明确狭窄部位、程度、侧支情况等。这些检查对大动脉炎的诊断具有重要价值。美国风湿病学会的大动脉炎诊断(分类)标准:(1)发病年龄≤40 岁;(2)肢体间歇性运动障碍;(3)肱动脉搏动减弱;(4)血压差>10 mm Hg;(5)锁骨下动脉或主动脉杂音;(6)血管造影异常。符合上述6 项中的3 项者可诊断本病[75]。当血压控制良好的患者突然血压升高时,应考虑到药物引起的血压波动。自身免疫病治疗中常见的可引起血压波动的药物见表2。通常,药物引起的血压升高幅度不大,持续时间较短,但也有导致高血压急症的报道。诊断时需要仔细评估患者使用的处方药和非处方药[93]。
14.4 常规治疗及治疗的特殊点 由于高血压在免疫结缔组织病患者中具有较高的发病率,在此类患者首诊及治疗过程中,需提高筛查高血压的意识,一旦确诊高血压,除积极控制其高血压外,尚需治疗相应的原发免疫结缔组织病。免疫结缔组织病人群的血压控制目标与其他人群相似。
已出现慢性肾脏病的患者收缩压应当控制在130~139 mm Hg 的范围内,可根据个体耐受程度调整。RAAS 抑制剂可以有效减轻蛋白尿,推荐使用的药物为1 种RAAS 抑制剂与1 种CCB 或利尿剂搭配,不推荐同时使用两种RAAS 抑制剂[2]。
大动脉炎所并发的高血压应使用降压药控制血压,以拮抗疾病本身和治疗药物引起的高血压。CCB 是安全有效的药物,ACEI/ARB 应慎用于单侧或双侧严重肾动脉狭窄。常规或单纯降压治疗多难以控制血压,应积极强调对大动脉炎的治疗。所有大动脉炎患者都应尽早给予足量糖皮质激素诱导缓解,维持3~4 周后逐渐减量。免疫抑制剂与糖皮质激素联合应用可增加疗效,使用过程中应严密监测血尿常规及肝肾功能,警惕骨髓抑制、肝功能损害等不良反应。对于已存在严重动脉狭窄的患者,可考虑在疾病活动控制后行血管重建术,首选腔内治疗,失败者可开放手术治疗[3]。大动脉炎继发高血压并不少见,而疾病预后也与高血压控制程度及造成相应器官并发症相关。因此需要临床医师充分掌握大动脉炎继发高血压相关诊治要点并予以积极治疗,从而提高患者生活质量并改善疾病预后。
对于药物引起的高血压,停药一般可以使患者血压恢复正常,若无法停药,则应增加适当的降压药物以控制血压,具体治疗方法及注意事项见表2。环孢素可以替换为他克莫司,这种药物的升压作用弱于环孢素,西罗莫司和霉酚酸酯则几乎没有肾毒性和升压作用[93]。
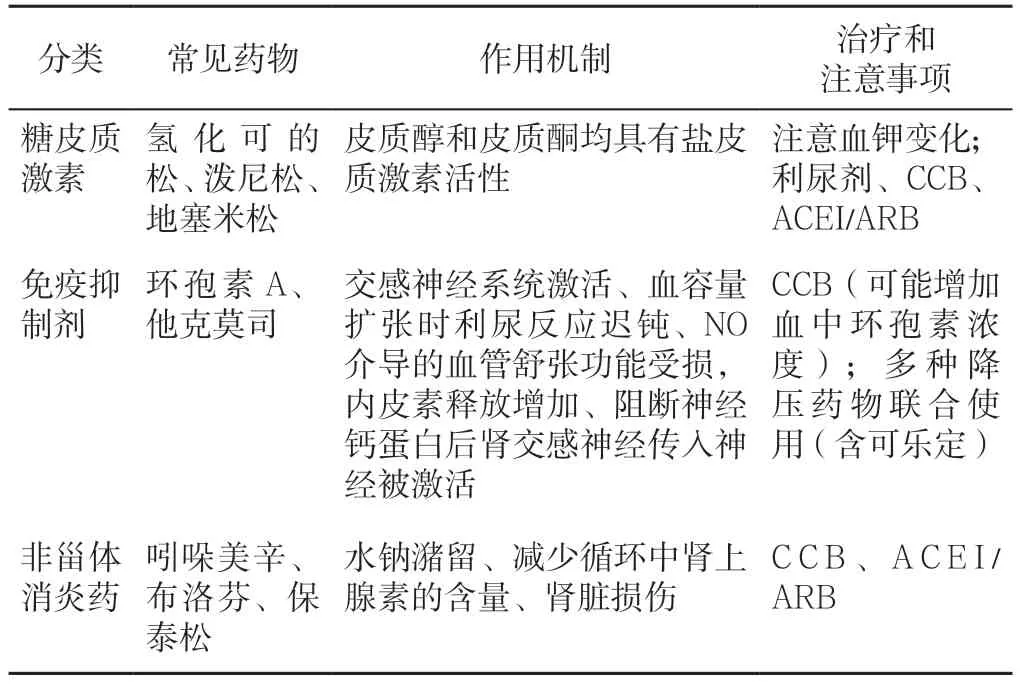
表9 自身免疫病治疗中影响血压的药物[3]Table 9 Drugs affecting blood pressure in the treatment of autoimmune diseases
15 肿瘤与高血压
15.1 流行病学特点 目前,越来越多的证据提示高血压与肿瘤之间具有一定的相关性,两者的流行病学及病理生理学机制相似;而且,高血压与肿瘤的危险因素相似,如年龄大、吸烟、糖尿病、高脂血症、肥胖等;高血压本身可能就是肿瘤发生的危险因素,并参与肿瘤发生的过程[95]。国内外研究提示,与非高血压患者相比,高血压患者发生肿瘤的风险更大[96-97];同时,血压每升高 10 mm Hg ,男性癌症患者死亡风险可增加 12%,女性癌症患者死亡风险可增加 6%,且和肾癌有较强的相关性[98]。而癌症患者高血压的患病率则与一般成年人群相似[99]。同时,近年研究提示,抗肿瘤药物也与高血压的发生发展密切相关;而降压药物在体内的长期暴露是否会引起 DNA 损伤,甚至诱发突变、导致肿瘤发生也是临床上关注的一个问题。
15.2 合并肿瘤患者的高血压诊断标准 结合目前相关文献,合并肿瘤患者的高血压的诊断标准仍为:在未使用降压药物的情况下,诊室收缩压/舒张压≥140/90 mm Hg。24 h 动态血压的高血压诊断标准为:24 h 平均收缩压/舒张压≥130/80 mm Hg;日间≥135/85 mm Hg;夜间≥120/70 mm Hg。家庭自测血压的高血压诊断标准为≥135/85 mm Hg[100]。
部分合并肿瘤患者需同时接受化疗。参照美国国家癌症研究所(National Cancer Institute,NCI)制定的化疗常见毒性分级标准中关于高血压的评分标准,应给予相应的处理。具体包括:0 分为无或无变化;1 分为无症状,舒张压呈一过性升高>20 mm Hg,既往正常血压升高至>150/100 mm Hg,不需治疗;2 分为经常出现或持续出现或有症状,舒张压升高>20 mm Hg 或既往正常,血压>150/100 mm Hg,不需治疗;3 分为需治疗;4 分为高血压危象。
15.3 与高血压发病相关的肿瘤的诊治 肾上腺肿瘤、嗜铬细胞瘤等内分泌系统肿瘤与高血压相关,少见的肾素瘤、垂体肿瘤等亦与高血压的发病相关[3]。详见前面相关章节。
15.4 抗肿瘤药物与高血压的相关研究进展 肿瘤的化学疗法引入了具有抗血管生成作用的靶向治疗药物〔血管生成抑制剂(intussusceptive angiogenesis,IA)〕,而大量研究发现高血压是 IA 的主要不良反应之一,此类药物主要包括血管内皮生长因子信号通路阻断剂(苏尼替尼、索拉非尼、安罗替尼等)和血管内皮生长因子受体抗体(贝伐珠单抗等)。IA 导致高血压的发生率为 19%~47%。
高血压是贝伐珠单抗最常见的心脏毒性反应,可发生在治疗过程中的任何阶段,且与剂量相关,其总体发生率为 4%~35%[101]。应用安罗替尼治疗非小细胞肺癌的临床试验中,55%患者出现高血压[102]。与安慰剂组相比,应用新型激素制剂治疗前列腺癌患者的总体高血压及严重高血压(NCI 毒性分级评分 3~4 分)发病率均明显增高,提示此类药物可能诱发高血压。其他用于肿瘤治疗的药物,如促红细胞生成素和非甾体消炎药及颈椎放射治疗等,也会导致患者血压升高[103]。
提示:参照国内外学者的建议[100],IA 治疗期间可考虑以下方面监测及控制血压:(1)在用药前,监测基线血压。对于那些在治疗前就有高血压的患者,在开始IA 治疗前,应将血压控制在 150/100 mm Hg 以下;而对于已有高血压并发症的患者(如脑血管意外、肾病等),可能需要更严格的血压控制。(2)用药期间,应加强对血压的监测。建议在药物输注之前、期间、结束时和结束1 h 后分别进行血压评估。NCI 建议使用IA 进行化学疗法的第1 个周期、治疗期间每周和治疗期后至少每2~3 周监测血压。此外,对于那些在治疗期间发生高血压或原有高血压加剧的患者,在治疗停止后,仍然应该规律性地监测血压。监测可以采取常规临床监测(如诊室血压,必要时24 h动态血压)或家庭自测血压监测。(3)处理方式:如果出现了高血压,则根据不同情况采取常规降压药物处理;若患者发生中度以上的高血压(收缩压>160 mm Hg,舒张压>100 mm Hg),应暂停 IA 药物,并给予降压治疗,直到血压恢复到治疗前水平或者低于150/100 mm Hg 时,方可恢复 IA 药物治疗;若患者的高血压经治疗1 个月后仍然未控制好或者发生高血压危象,应永久停用抗肿瘤血管生成药物。
15.5 降压药物与肿瘤的相关研究进展 现有研究提示降压药物与肿瘤的转移、复发及肿瘤相关性死亡等存在一定相关性。
15.5.1 利尿剂 常用的利尿剂可分为噻嗪型利尿剂、噻嗪样利尿剂及髓袢利尿剂。氢氯噻嗪的小鼠2 年致癌性实验可见肝肿瘤发生率增加,而吲达帕胺的致癌性实验结果为阴性。呋塞米的小鼠2 年致癌性实验中,雌性小鼠乳腺癌发生率增加,雄性大鼠罕见肿瘤发病率增加。
噻嗪类利尿剂有光敏感结构,可导致DNA 氧化损伤及环丁烷嘧啶二聚体(CPDs)的形成,诱发皮肤光敏感部位的肿瘤。FRIEDMAN 等[104]发现,氢氯噻嗪用药时间超过5 年的人群罹患唇癌的风险是对照组的4倍。目前,国际肿瘤研究机构(IARC)已将氢氯噻嗪分级为“可能对人体有致癌性”[105]。
2017 年来自丹麦南部大学和丹麦癌症协会的学者们利用国家数据库检查了超过 80 000 例被诊断患有非黑素瘤皮肤癌的患者,结果发现服用氢氯噻嗪的患者患皮肤癌的风险高达7 倍。提示氢氯噻嗪增加了患鳞状细胞癌和基底细胞癌的风险。2019 年3 月,英国和爱尔兰高血压学会专门发布了《氢氯噻嗪与皮肤癌风险的科学声明》,对氢氯噻嗪应用与皮肤癌风险增加的相关性进行了分析,认为噻嗪型(苄氟噻嗪)和噻嗪样(吲达帕胺)利尿剂在内的其他利尿剂的应用与皮肤癌风险增加无关[106]。
提示:对于已接受噻嗪类利尿剂治疗,血压稳定且控制良好的患者,可以继续治疗。对于曾患有皮肤癌并使用氢氯噻嗪的患者,建议患者进行定期检查,应检查所有可疑的皮肤损伤或痣,并建议患者避免暴露于阳光和紫外线下;暴露时可进行适当的保护措施,以降低皮肤癌发生风险。
15.5.2 β-受体阻滞剂 目前常用的β-受体阻滞剂包括普萘洛尔、阿替洛尔等。阿替洛尔的小鼠18 个月致癌性实验和大鼠18 或24 个月致癌性实验结果均为阴性,但另一项大鼠2 年致癌性实验可见肾上腺髓质良性肿瘤发生率增加;此外雌性大鼠可见乳房纤维腺瘤,雄性大鼠可见甲状腺髓样癌的发生率增加。β-受体活化后可以通过促进血管表皮生长因子(VEGF)的表达,加速血管生成,有利于肿瘤细胞的生长、转移[107]。因此,抑制β-受体活化可能产生肿瘤抑制的效果。大规模的流行病学研究发现,肿瘤患者中因高血压、心血管系统疾病口服β-受体阻滞剂者与未口服β-受体阻滞剂者相比,前者肿瘤远处转移率低于后者,而且总生存期也有较大的优势[108]。另一项临床回顾性队列研究提示,β-受体阻滞剂可降低乳腺癌的致死率,降低复发和转移风险,但生存率并没有受到影响[109]。另有研究分析了1 425 例难治性卵巢癌妇女的数据,发现接受β-受体阻滞剂的患者中位生存期延长5 个月。同时,服用非选择性β-受体阻滞剂者比服用选择性β-受体阻滞剂者生存期增加一倍以上。通过对1 762 例大肠癌和
1 708 例未患癌症的人群进行了随访研究,未发现β-受体阻滞剂降低结直肠癌风险。
提示:β-受体阻滞剂能够对肿瘤的侵袭转移起到抑制作用,β-受体阻滞剂可能增加卵巢癌生存时间。
15.5.3 CCB CCB 按结构可分为二氢吡啶类和非二氢吡啶类。二氢吡啶类 CCB 中,氨氯地平、硝苯地平等致癌性实验结果均为阴性,而拉西地平和非洛地平则均出现了大鼠良性睾丸间质细胞瘤增加。非二氢吡啶类CCB 中,维拉帕米和地尔硫的非临床评价均未见致癌性相关风险。
临床研究则提示CCB 可能与肿瘤发生相关。ROTSHILD 等[110]研究发现,CCB 用药后肺癌风险轻微增加,且肺癌发生率随用药时间延长而增加(P<0.001)。另外,硝苯地平也具有光敏感结构,可能与皮肤肿瘤发生相关,硝苯地平用药人群的唇癌发病率为对照组的2.5倍[104]。另有研究评价了55~74 岁的绝经后女性应用不同级别的降压药与乳腺浸润性导管癌和乳腺浸润性小叶癌的相关性。结果表明,长期应用CCB 与乳腺癌危险相关,且在应用不同类型CCB 时无明显差异。而利尿剂、β-受体阻滞剂和ACEI 均无此种相关性[111]。
提示:现有研究多为小样本,且为观察性研究,不主张对于已经长期使用CCB 治疗的高血压患者改变临床用药方案,CCB 仍然是一线的降压药物选择之一。
15.5.4 ACEI ACEI 可抑制RAAS 中血管紧张素转换酶的活性,减少血管紧张素Ⅱ的生成。目前ACEI 非临床致癌性实验结果均为阴性。
动物研究显示,低剂量的培哚普利即可抑制小鼠头颈癌的肿瘤生长及血管新生[112]。在LEVER 等[113]的研究中,长期服用ACEI(如卡托普利、依那普利)患者的乳腺癌和肺癌的比例较低。PRONTERA 等[114]也发现,卡托普利抑制大鼠纤维肉瘤的生长及血管新生是通过与纤溶酶原激活物的结合,对血管生成抑制因子产生影响,并非 ACEI 类药物共有的作用机制。但是,其他国外研究显示,与应用ARB 的患者相比,应用 ACEI的患者罹患肺癌的风险增加14%。而且,应用时间越长,肺癌发生风险越高,应用 10 年以上肺癌发生风险达到高峰,可达到 31%[115]。
提示:ACEI 类药物最常见的不良反应是咳嗽,常常会进行排除肺癌的相关检查,因此早期诊断肺癌的患者数量就可能增多。还需要长期随访和进一步深入研究,以明确这类降压药的长期安全性和未被发现的潜在风险。
15.5.5 ARB 血管紧张素Ⅱ与受体结合后,促进炎性反应及血管生成,可能与肿瘤风险相关。氯沙坦的非临床致癌性实验可见雌性大鼠胰腺腺泡腺癌的发生率轻微升高。
SIPAHI等[116]进行临床荟萃分析,发现服用ARB(包括氯沙坦、坎地沙坦、替米沙坦)的患者出现新生肿瘤比例略高于对照组(P=0.016)。进一步分析发现,前列腺癌和乳腺癌的发病率差异无统计学意义,肺癌发病率略高于对照组,肿瘤致死率的差异无统计学意义;缬沙坦和厄贝沙坦则未见肿瘤相关性。随后,美国食品药品监督管理局(FDA)纳入 31 个临床试验进行了荟萃分析,结果并没有发现ARB 对肿瘤发生或肿瘤致死率的影响[117]。同时,CHANG 等[118]分析台湾地区ARB用药的肿瘤发生情况,亦未发现ARB 的肿瘤风险。
提示:正确使用 ARB,心血管系统的预期获益可能远远超过了可能带来的癌症风险。
16 卧位性高血压与直立性低血压
16.1 卧位高血压[119]定义:仰卧位时收缩压≥ 150 mm Hg 或舒张压≥ 90 mm Hg。一般治疗指南建议对高血压进行干预,但合并因自主神经衰竭导致的神经源性直立性低血压(nOH)时,由于这些患者缺乏抵消高血压的正常血压缓冲机制,频发直立性低血压可能导致肾素-血管紧张素系统的慢性激活。卧位收缩压≥160 mm Hg 时应注意监测,但不一定需要治疗。神经源性直立性低血压卧位高血压的收缩压超过160~180 mm Hg时需要干预。站立时血压下降幅度较大的患者(下降>80 mm Hg)需要更高的仰卧位血压才能保持站立位,因此可能需要耐受允许的卧位高血压(见表10)。
16.2 直立性低血压/神经源性直立性低血压[119]
16.2.1 定义 (1)直立性低血压定义:在倾斜台上直立或头高位倾斜至少 60°时,3 min 内收缩压持续下降至少20 mm Hg,或舒张压持续下降至少 10 mm Hg,或两者兼有[120]。(2)神经源性直立性低血压定义:神经源性直立性低血压是直立性低血压的亚型,除符合直立性低血压定义外,神经源性直立性低血压患者还存在自主神经系统损害,特点为无法提供足够的自主体位反应,而自主神经最显著的作用是通过系统性血管收缩和代偿性心率加快维持正常血压,这种缺失很大程度上是交感神经释放去甲肾上腺素不足所致[121]。许多 神经源性直立性低血压患者同时患有卧位高血压,而治疗直立性低血压的药物治可能会加重卧位高血压,使得治疗更加棘手[122]。
16.2.2 直立性低血压的症状和体征 常见症状包括体位性头晕目眩、黑矇感,以及伴有或不伴晕厥的跌倒。较少见的症状包括直立性认知功能障碍(自主神经功能障碍患者在直立位时可能因一过性额叶低灌注而导致执行功能明显障碍)、精神迟钝、浑身无力、颈痛或枕骨下及颈旁不适(呈“衣架”式分布——低血压诱发颈带状肌缺血的表现)或斜卧呼吸(直立性低血压 引起通气时肺尖灌注不足或通气灌注失调,导致直立位呼吸困难)[123-127]。
16.2.3 筛查 神经源性直立性低血压的筛查应从确定直立性低血压的症状开始(见表11~13、图2)。
16.2.4 治疗 神经源性直立性低血压的治疗方案包括以下提议的 4个渐进步骤:(1)评估并调整目前用药;(2)采用非药物治疗措施;(3)实施单药治疗;(4)谨慎的药物联合治疗。建议在每一步骤时都对患者进行2 周的评估,以确定继续进行下一步骤之前症状改善是否达到满意的程度(见图3)[119]。
17 药物性高血压
临床常用的一些药物可能通过不同机制导致血压升高,引起高血压患者血压波动、控制困难或无高血压患者发生血压升高,了解药物对血压的影响及其机制,对于其他系统疾病治疗药物的选择及血压升高的控制非常重要。
17.1 呼吸系统药物 见表14。
17.2 抗菌药物 见表15。
17.3 肝胆疾病药物 (1)保肝药物:甘草酸二铵、甘草酸单铵;(2)机制、处理:见甘草制剂(见表14)。
17.4 内分泌系统药物 见表16。
17.5 肾内科药物 见表17。
17.6 化疗药物 见表18。
17.7 神经精神药物 见表19。
17.8 麻醉药物 见表20。
17.9 耳鼻喉科药物 见表21。
17.10 非甾体消炎药 见表22。
17.11 生殖相关药物 见表23。
17.12 减肥药 见表24。
18 无创中心动脉压(CAP)及左右心功能测定在高血压精准治疗中的地位
18.1 无创中心动脉压 中心动脉即主动脉,中心动脉压是主动脉根部血管壁承受血液的侧压力,其是左心室射血的压力负荷,中心动脉压分为中心动脉收缩压(CSBP)、中心动脉舒张压(CDBP)、中心动脉脉压(CPP)。一般所指的中心动脉压即中心动脉收缩压,中心动脉压是以左心室射血及中心动脉脉搏波为基础,由血管充盈和外周阻力共同形成。中心动脉压测定的方法主要有有创和无创两种,有创导管法测量中心动脉压采用左心导管直接测量升主动脉根部压力,是中心动脉压测量的最准确的方法,但属有创检查,成本高、操作难度高,临床广泛开展有一定的局限性,因此目前临床上广泛应用无创法测定中心动脉压。
18.1.1 无创中心动脉压测定原理 无创中心动脉压测定主要是通过动脉脉搏波分析仪检测颈动脉或桡动脉的压力波形,将周围动脉压力波形通过公式转换可获得中心动脉压波形。动脉压力波形的转换主要基于波反射的基础。假设动脉血压波形是一个复合的正向波,由左心室喷射血液而产生,外周细小动脉阻力高,因此大部分血液被重新反射回到升主动脉,因此在动脉树的任意位点记录到的压力波形都是前向波与返回波共同形成的复合体。多个反射的“小波”叠加在一起形成一个单一“有效”的反射波,从而使中心动脉的收缩压力增加。反射波增压指数(AI)即用于量化波反射,是指周围血管压力波反射叠加引起收缩压升高的值与脉压的比值。随着压力(和增压指数)的增加,主动脉绝对收缩压增加,并且放大,肱动脉和主动脉脉压的比率随之减小。动脉脉搏波分析仪通过采集桡动脉、颈动脉或肱动脉的压力波形计算出AI,再使用全身传递函数合成主动脉压力波形,从而算出CSBP 及CDBP。

表 10 神经源性直立性低血压相关仰卧位高血压的治疗建议Table 10 Treatment suggestions for nOH related supine hypertension
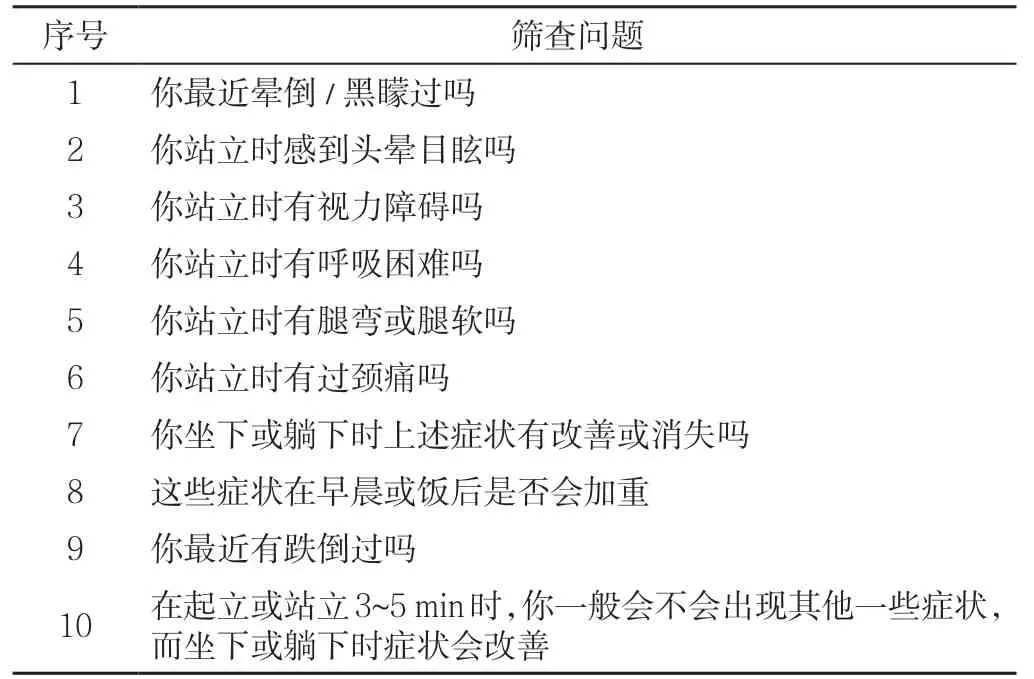
表11 疑似直立性低血压/神经源性直立性低血压的筛查问题Table 11 Screening problems of suspected OH/nOH

表12 可能导致直立性低血压或加重神经源性直立性低血压症状的常见药物Table 12 Common drugs that may cause OH or aggravate nOH symptoms

图2 神经源性直立性低血压逐步诊断方案Figure 2 nOH step-by-step diagnosis scheme

表 13 神经源性直立性低血压拟议分级表Table 13 Proposed classification of nOH
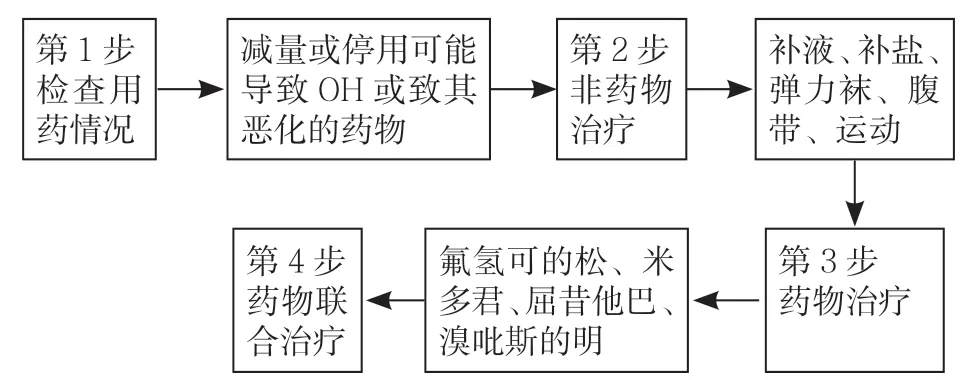
图3 治疗神经源性直立性低血压的4 个步骤Figure 3 Four steps of treating nOH

表14 呼吸系统药物对血压的影响Table 14 Effect of respiratory drugs on blood pressure

表15 抗菌药物对血压的影响Table 15 Effect of antibiotics on blood pressure
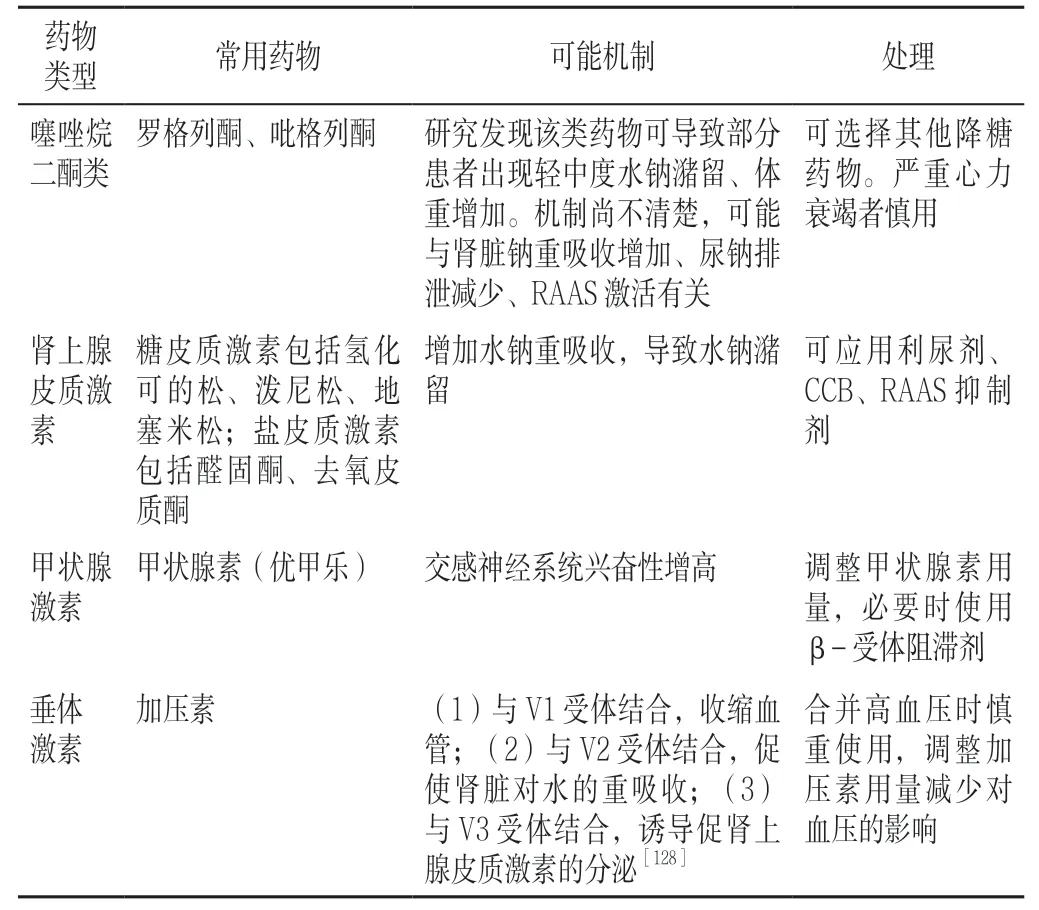
表16 内分泌系统药物对血压的影响Table 16 Effects of endocrine system drugs on blood pressure

表17 肾内科药物对血压的影响Table 17 Effect of renal medicine on blood pressure

表18 化疗药物对血压的影响Table 18 Effect of chemotherapy drugs on blood pressure

表19 神经精神药物对血压的影响Table 19 Effects of neuropsychotics on blood pressure

表20 麻醉药物对血压的影响Table 20 Effect of anesthetics on blood pressure
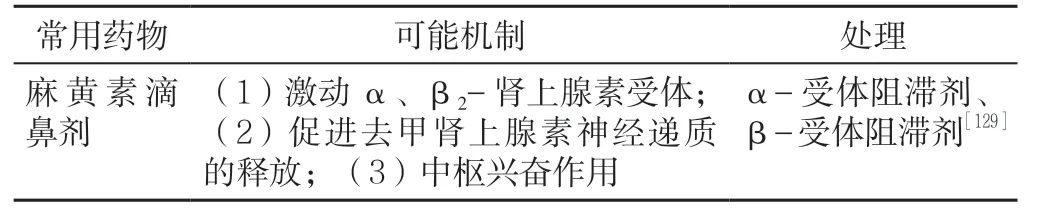
表21 耳鼻喉科药物对血压的影响Table 21 Effect of otolaryngology drugs on blood pressure

表22 非甾体药物对血压的影响Table 22 Effect of non steroidal drugs on blood pressure

表23 生殖相关药物对血压的影响[128]Table 23 Effects of reproductive drugs on blood pressure

表24 减肥药对血压的影响Table 24 Effect of diet pills on blood pressure
目前主要有两大类方法来记录动脉脉搏波形:一种是应用高品质压力传感器的笔形探头,在很小的压力敏感区域范围内,从体表动脉(如桡动脉)处获得连续的动脉压力波形;另一种是以袖带为基础,通过袖带给手臂肱动脉施加≥舒张压的压力负荷后,通过示波器传感器在10 s 内获取连续的肱动脉脉搏波。脉搏波的采集点直接与臂部血压的测量相连接。通过得到的肱动脉脉搏波,使用生物数学算法(广义传递函数)可以根据上臂肱动脉脉搏波数据计算主动脉脉搏波速度,即为aPWV(主动脉脉搏波),再应用专用算法(ARCSolver算法)将外周血压测量值计算得出主动脉血压(中心动脉压)[130]。多项研究证实该仪器与有创导管方法测得的中心动脉压数据之间具有良好的一致性。应用动脉脉搏波分析或以袖带为基础记录的前臂示波轨迹,可算出全天多个时间点的中心动脉压,以得到24 h 中心动脉压记录[131]。
18.1.2 中心动脉压与血压的相关性 2003 年ESH/ESC 指南指出:中心动脉压与肱动脉压存在差异[132]。2008 年,大型研究ACCTII 通过对10 613 例入选对象进行观察,发现70%以上的经测量肱动脉血压标定为临界高血压的患者,其中心动脉压数值却和高血压1 级患者相似。这表明外周动脉压测量正常的患者,其中心动脉压却不一定正常。同时发现测量肱动脉收缩压相同的患者,其中心动脉收缩压却不一定一致。王新宴等[133]通过对中国30 个省(自治区、直辖市)80 129 例青年男性的血压数据进行分析,结果发现肱动脉血压与中心动脉压之间存在1~55 mm Hg 的差值。其中,肱动脉收缩压均显示为140 mm Hg 的1 141例受试者,中心动脉压分布在96~136 mm Hg。由此看出,按照外周血压的标准,可能会对一些中心动脉压相对较低的受试者进行降压治疗,而对于那些中心动脉压升高的个体,其肱动脉血压可能低于当前治疗标准的阈值,没能得到及时治疗。因此,2013 年欧洲高血压指南中已提出了中心动脉压对于鉴别青年人的真假高血压存在应用价值[134]。
18.1.3 中心动脉压测定在高血压精准治疗中的地位
18.1.3.1 反映靶器官损害和预测心血管事件 理论上,中心动脉压与靶器官损害和心血管疾病关系更为密切,且对于心血管事件的预测价值优于外周肱动脉压,且近年来一些前瞻性的临床随访研究证实,中心动脉压升高与心、脑、肾等器官损害及其并发症发生有非常密切的关系。STRONG 心脏研究发现中心动脉压预测心血管事件的能力优于外周动脉(肱动脉)压力;进一步校正颈动脉粥样硬化病变,中心动脉压与心血管事件仍然明显独立相关[135]。ASCOT-CAFE 研究比较阿替洛尔和氨氯地平对肱动脉压和中心动脉压的影响,发现阿替洛尔组与氨氯地平组对肱动脉收缩压和脉压影响的差异很小,但是对中心动脉收缩压和脉压影响的差异则较大,阿替洛尔组中心动脉收缩压与脉压分别明显高于氨氯地平组。而对中心动脉压参数与复合终点事件(所有心血管事件,介入治疗和发生肾脏损害)关系的多因素分析得出,经基线资料校正后,只有中心动脉压显示与复合终点事件有明显关联(P<0.05)[136]。表明中心动脉压(主动脉压)比外周动脉压(肱动脉压)具有更好的临床预测价值。因此,在降压治疗过程中,应该更为关注中心动脉压。在2018 年ESC 高血压指南中提出:在高血压患者中,中心动脉压可以预测心血管事件,并且与肱动脉血压相比,降血压药物降压作用存在差异[2]。
18.1.3.2 指导降压药物应用 首先,前文已提到用肱动脉压力来指导降压治疗可能会造成一些患者治疗不足(肱动脉血压为临界,中心动脉压数值却和高血压1 级患者相似),或者造成过度治疗(肱动脉血压升高,中心动脉压却还在正常范围的患者)。因此,用中心动脉压来评估患者左心室后负荷承受的真实压力、判断是否启动降压治疗是有一定价值的。另外,由于中心动脉压可反映靶器官损害程度,因此降压药物的选择也可参考对中心动脉压的影响,以此减少对靶器官的损害。虽然在多数情况下中心动脉压与肱动脉压是平行的、相关的,但是该前提并非在任何情况下都成立,尤其在老年人或者采用不同类型降压药物进行治疗时,对中心动脉压的影响有所不同,不同药物对中心动脉压的影响见表25。在一项随机交叉比较噻嗪类利尿剂、β-受体阻滞剂、二氢吡啶类CCB 与ACEI 对肱动脉和中心动脉收缩压影响的研究中,发现噻嗪类利尿剂和二氢吡啶类CCB 降低肱动脉和中心动脉收缩压的幅度相同;β-受体阻滞剂降低中心动脉收缩压的幅度小于肱动脉;ACEI 降低中心动脉收缩压的幅度大于肱动脉。ASCOT-CAFE 研究发现阿替洛尔组降低中心动脉收缩压与脉压幅度小于氨氯地平组[136]。因此,仅凭治疗后肱动脉收缩压下降幅度,有可能过高或过低估计了具有重要意义的中心动脉压下降程度;可根据患者的中心动脉压水平,精准选择合适的降压药物(见表25)。
18.2 无创左右心功能测定
18.2.1 左右心功能测定原理 左右心功能同步检测技术是基于脉图理论,通过桡动脉、颈静脉监测的技术,结合心电图、心音图以得出比较全面的评估心功能的量化指标。该系统基于生物学血管系统的弹性管膜理论,从桡动脉及颈静脉采集动脉波及静脉波,根据脉搏图像分析理论及技术,采用时域分析的方法,对患者血流动力学参数用计算机进行准确分析,得出各项心血管功能变化的临床判断指标。即应用心电图、心音图、动脉传感器及静脉传感器进行无创采样,可得出左右心功能的时相、容量、阻抗及压力等50 余项血流动力学参数,达到了同时多功能检测左右心功能的目的。
18.2.2 左右心功能在高血压分型及精准治疗中的作用
(1)早发现,早干预:该系统所测得部分人群的平均动脉压、平均收缩压、平均舒张压超出参考范围时,用普通血压计测得的数据尚未达到临床高血压判定的标准,表明已存在高血压倾向,继而可能发展成高血压,这些患者可尽早进行危险因素干预,改变不良生活方式,改善饮食,加强运动等。(2)依据血流动力学表型指导治疗:应用左右心功能的测定,评估心脏、血管状况及血流动力学指标,将高血压更加细化分为高动力型、高心排血型、高阻抗型、高容量型及混合型而选择不同作用机制的降压药联合(见表26)。如高动力型可选择β-受体阻滞剂;高排量型可选择利尿剂+β-受体阻滞剂;高阻抗型可选择CCB。一项研究对原发性高血压病患者采用无创血流动力学指导的药物调整,调整前后患者的家庭收缩压从152.1 mm Hg 降低至131.0 mm Hg,降幅达21.1 mm Hg;而常规的药物调整组,调整前后其收缩压下降10.2 mm Hg,两组结果有明显差异。从研究数据看,以血流动力学的表型来管理血压,具有一定的精准性,对促进血压达标会带来帮助。同时使高血压患者治疗不仅是数值达标,而是真正意义上的心脏、血管、靶器官的保护,从而延缓靶器官的损伤。
建议编写专家组(均按姓氏汉语拼音排序)
核心专家组成员:郭继鸿(北京大学人民医院),华奇(首都医科大学宣武医院),李瑞杰(北京市中西医结合医院),刘力生(中国医学科学院阜外医院),孙宁玲(北京大学人民医院),孙英贤(中国医科大学附属第一医院),王宏宇(北京大学首钢医院),王继光(上海交通大学医学院附属瑞金医院),王增武(中国医学科学院阜外医院),吴兆苏(北京安贞医院)
组长:陈琦玲(北京大学人民医院)
专家组成员:白瑾(北京大学第三医院),卜培莉(山东大学齐鲁医院),陈红(北京大学人民医院),陈琦玲(北京大学人民医院),党爱民(中国医学科学院阜外医院),姜红岩(北京市中西医结合医院),姜娟(北京大学人民医院),姜一龙(大连医科大学附属第二医院),李勇(复旦大学附属华山医院),李中建(郑州大学第二附属医院),刘靖(北京大学人民医院),陆峰(山东中医药大学附属医院),罗素新(重庆医科大学附属第一医院),马庆春(北京大学人民医院),马为(北京大学第一医院),孙艳玲(洛阳市第一中医院) ,田江华(北京大学校医院),田庄(北京协和医院),王鸿懿(北京大学人民医院),王及华(北京大学人民医院),王鲁雁(北京大学人民医院),王新宴(空军特色医学中心) ,吴寸草(北京大学人民医院),吴海英(中国医学科学院阜外医院),吴晓君(空军特色医学中心) ,吴云(内蒙古自治区人民医院),喜杨(北京大学人民医院),谢建洪(浙江省人民医院),谢良地(福建医科大学附属第一医院),谢萍(甘肃省人民医院),杨进刚(中国医学科学院阜外医院),杨欣(北京大学人民医院),易忠(航天中心医院),余静(兰州大学第二医院) ,袁洪(中南大学湘雅三医院),张萌(航天中心医院) ,张新军(四川大学华西医学中心),张宇清(中国医学科学院阜外医院),赵玉娟(哈尔滨医科大学附属第一医院)

表25 不同降压药物对中心动脉收缩压的影响Table 25 Effect of different antihypertensive drugs on central systolic blood pressure
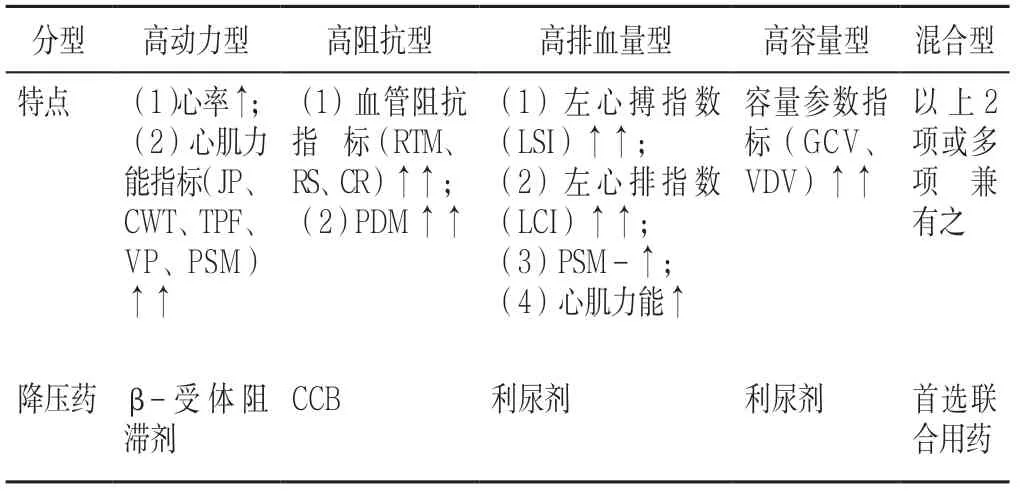
表26 不同类型高血压的血流动力学特点和适用的降压药物Table 26 Hemodynamic characteristics and applicable antihypertensive drugs of different types of hypertension
本文无利益冲突。
