SCN1A基因突变特点及相关癫痫的临床特征
2020-04-14吴计划杨广娥何远知叶小飞江亮亮
吴计划,杨广娥,何远知,叶小飞,江亮亮,杨 斌
SCN1A基因位于2号染色体2q24.3上,编码在神经系统发育和功能中起重要作用的Ⅰ型钠通道(Nav1.1)α亚基[1]。SCN1A基因的突变可导致γ氨基丁酸(GABA)能抑制性中间神经元的钠电流显著减少,从而损害GABA抑制功能,导致神经元网络过度兴奋性和癫痫发作[2]。这些降低的钠电流能进一步损害浦肯野细胞,导致运动障碍[3],也可导致行为问题和认知障碍[4]。目前发现有超过1 440个SCN1A基因突变,可导致各种不同的癫痫表型。本文总结了19例SCN1A基因突变特点及相关癫痫的临床特征,现作报道。
1 资料与方法
1.1 研究对象 收集我科2016年7月至2019年8月诊治的癫痫患儿,入组标准为经二代基因测序(next-generation sequence,NGS)证实为SCN1A基因阳性突变者,对每位入选的患儿进行详细的临床资料登记,通过门诊复诊或电话随访患儿病情发展情况,总结分析患儿临床特点。
1.2 方法
1.2.1 样本采集 在知情同意的前提下,采集先证者及其家系成员(父、母)各自全血2 mL(EDTA抗凝血) 进行基因分析。使用BloodGen Midi Kit (CWBIO,China) 提取患儿全基因组DNA,操作按照试剂盒说明书进行;本研究基因测序及分析由北京全谱医学检验实验室有限公司完成。
1.2.2 高通量测序 外显子捕获:应用IDT xGen Exome Research Panel捕获探针进行目标基因全外显子捕获;文库制备:应用Cavoris 仪打断至200 bp左右;片段化DNA在Klenow Fragment,T4 DNA polymerase和T4PNK的作用下进行末端补平修复;在聚合酶体系下,使上一步得到的修复产物在3′末端加上A碱基,为下一步连接做好准备;配置T4DNA连接酶反应体系,在Thermo mixer中适温反应一定时间使adapter和加“A”产物连接;连接产物经4~6轮LM-PCR扩增;文库与探针混于杂交体系中65 ℃,60~68 h杂交;使用链霉素磁珠,与杂交样本孵育后洗脱液洗脱;洗脱产物经10轮LM-PCR扩增;Illumina平台测序:测序,Illumina Novaseq6000平台标准化上机测序操作流程;测序得到图像原始数据,Illumina官方basecall分析软件BclToFastq得到原始数据(raw data)。
1.2.3 数据分析 原始数据产量统计:去接头污染,去低质量的数据;与参考序列对比:数据与参考序列比对统计(比对软件BWA),参考基因组为 hg19基因组;SNP检测与注释:分析软件 samtools;InDel变异检测与注释:分析软件 pindel;变异的假阳性过滤:根据测序深度和变异位点数据质量,对检测得到的SNP和InDel变异进行过滤筛选,得到高质量可靠的突变;变异注释:SNP和Indel根据在基因上的位置,分析得到的氨基酸变化的影响,对mRNA剪切的影响,UTR及内含子突变影响等;变异对蛋白功能影响的预测:应用Provean软件预测特定变异对蛋白质的影响;变异对mRNA剪切影响的预测:应用Maxent软件预测特定变异对mRNA剪切的影响。
1.2.4 Sanger测序验证阳性位点 经高通量测序,结合先证者各变异位点的携带情况与病例表型信息,筛选出基因变异与病人疾病高度相关,应用Sanger测序技术对该位点在先证者及其家系成员(父、母)中的携带情况进行检测和验证。
2 结果
2.1 SCN1A基因突变结果 共收集19例SCN1A基因突变阳性患儿,其中错义突变8例,无义突变7例,移码突变1例,剪切点突变2例,非移码缺失1例。所有病例中,遗传性突变3例,新生突变16例。遗传性自父源2例,来自母源1例(见表1)。有14个变异为新发现的致病位点,Pubmed、万方、知网、Human Gene Mutation Database等数据库均未收录。
2.2 临床特点 所有患儿癫痫起病年龄范围为新生儿期至9月龄,其中平均发病年龄为4.8月,起病年龄<6月者17例,6~12月起病者2例。癫痫发作形式为局灶性发作5例,全面性发作7例,两种发作形式均有7例,有癫痫持续状态16例;有丛集性特点14例;有热敏感15例;有不同程度的智力、运动发育落后14例。有抽搐家族史5例。诊断为Dravet综合征(Dravet Syndrome,DS)11例。所有患儿均进行头颅MRI检查,病例3及12显示为大脑半球沟回增深。病例8显示为额顶颞部白质信号稍高,髓鞘化未成熟。病例2显示为幕上脑室扩张,脑桥背侧T2WI和DWI略高信号。病例16显示为脑发育不全。所有患儿均进行视频脑电监测,脑电图正常4例,脑电图提示背景活动偏慢6例,局灶性痫样放电5例,多灶性痫样放电5例(见表2、3)。
续表2
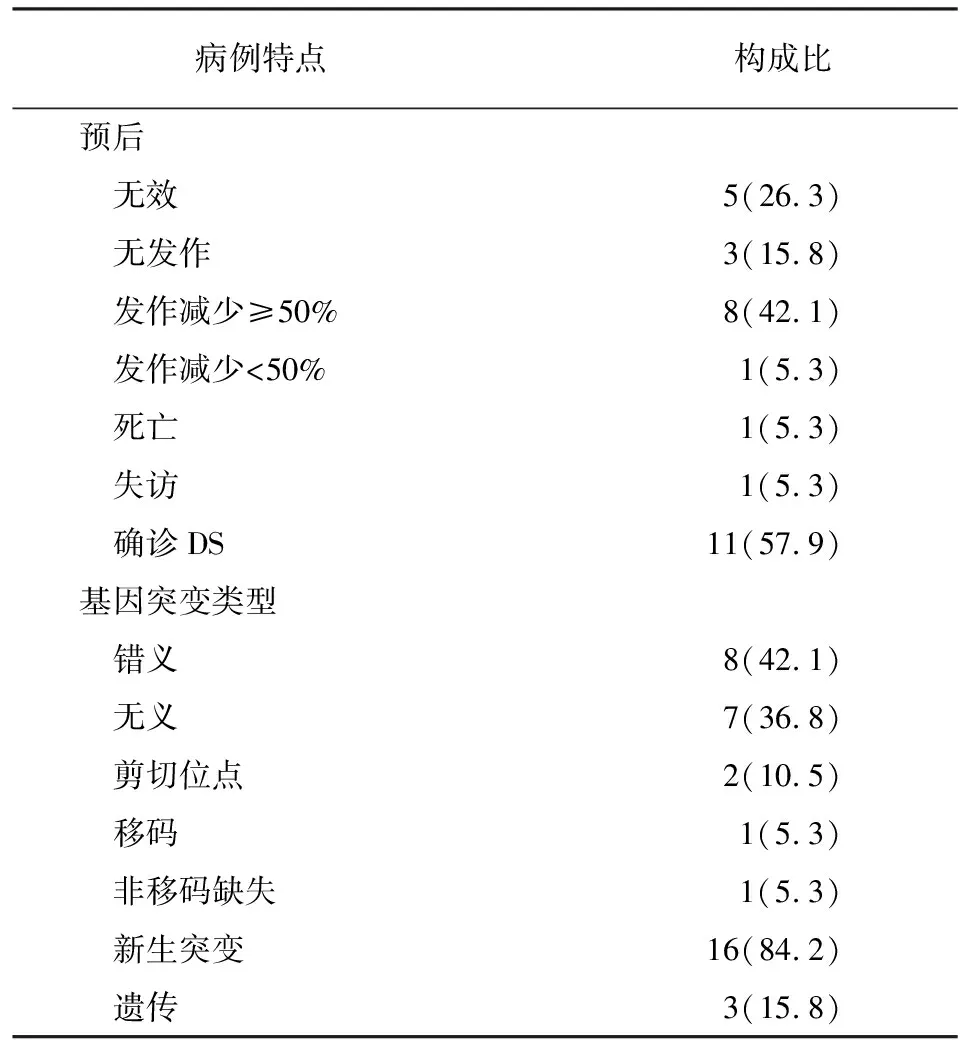
病例特点 构成比预后 无效5(26.3) 无发作3(15.8) 发作减少≥50%8(42.1) 发作减少<50%1(5.3) 死亡1(5.3) 失访1(5.3) 确诊DS11(57.9)基因突变类型 错义8(42.1) 无义7(36.8) 剪切位点2(10.5) 移码1(5.3) 非移码缺失1(5.3) 新生突变16(84.2) 遗传3(15.8)
2.3 治疗及随访情况 本组患儿末次随访年龄为12月至144月,其中药物治疗无效5例,未再发作3例,发作次数减少≥50%8例,<50%1例,死亡1例,失访1例。单药治疗1例,使用两种抗癫痫药物(AED)9例(丙戊酸钠和托吡酯联合5例,左乙拉西坦和托吡酯联合2例,丙戊酸钠和拉莫三嗪1例,左乙拉西坦和拉莫三嗪1例),使用三种及三种以上AED 6例(丙戊酸钠、左乙拉西坦、托吡酯联合5例,丙戊酸钠、左乙拉西坦、托吡酯、氯硝西泮联合1例)。病例10和15患儿尝试生酮饮食治疗,前者发作次数减少,后者抽搐无明显改变。
3 讨论
SCN1A基因编码的Nav1.1的α亚基,由85 kb的基因区域内的26个编码外显子组成。近年来有关SCN1A基因突变的文献报道逐渐增多,已报道多种SCN1A基因突变类型,包括错义突变、无义突变、移码突变、框内碱基缺失或插入突变、剪切位点突变,其中错义突变最常见。在SCN1A突变中,新生突变占突变的90%~95%,其余为遗传性突变[5-6]。本组19例患儿携带的SCN1A基因突变各不相同,无明显热点突变,其中错义突变占42.1%,基因突变位点已有文献报道者5例,其余突变位点均为首次发现的新生变异。
SCN1A突变引起的疾病范围从轻度表型到称为DS的严重表型,以及一些罕见表型包括West综合征和Panayiotopoulos综合征[7-11]。SCN1A与DS临床表型密切相关,文献[12]报道,DS中SCN1A突变阳性率在70%左右,本组患儿共19例SCN1A基因突变阳性,其中确诊DS患儿11例,与文献报道相符。SCN1A突变中导致钠通道功能完全丧失的致病变异与严重表型相关,而通道功能中较轻微的干扰通常导致温和的临床表型[6]。临床上首次发作一般很难区分哪种类型,早期识别较严重表型并及时治疗,可能有助于改善认知障碍,甚至阻止癫痫性脑病的进展。DE LANGE等[13]认为,癫痫首次发作年龄是SCN1A突变病人演变成DS的重要预测因子,CETICA等[14]也发现在SCN1A突变的个体中首次发作时的年龄比突变位置及突变类型更能预测癫痫的结局,他们认为SCN1A突变个体中6个月内出现癫痫发作者几乎都有规律的进展为癫痫性脑病。我们的病例中诊断为DS的大多数在6月龄之前发病,也支持这一观点。FANG等[5]认为SCN1A突变者中有复杂性发作的儿童,90%最终发展为DS或癫痫性脑病。本研究19例患儿中首次发病表现为复杂性热性惊厥5例,发展成DS有4例,疑诊1例,5例病人均表现不同程度的认知和运动迟缓,与文献结果类似。具有SCN1A突变的DS患儿往往在1岁之前出现与发热相关的癫痫持续状态[15],本组11例诊断为DS患儿均在1岁前出现过发热相关的癫痫持续状态。
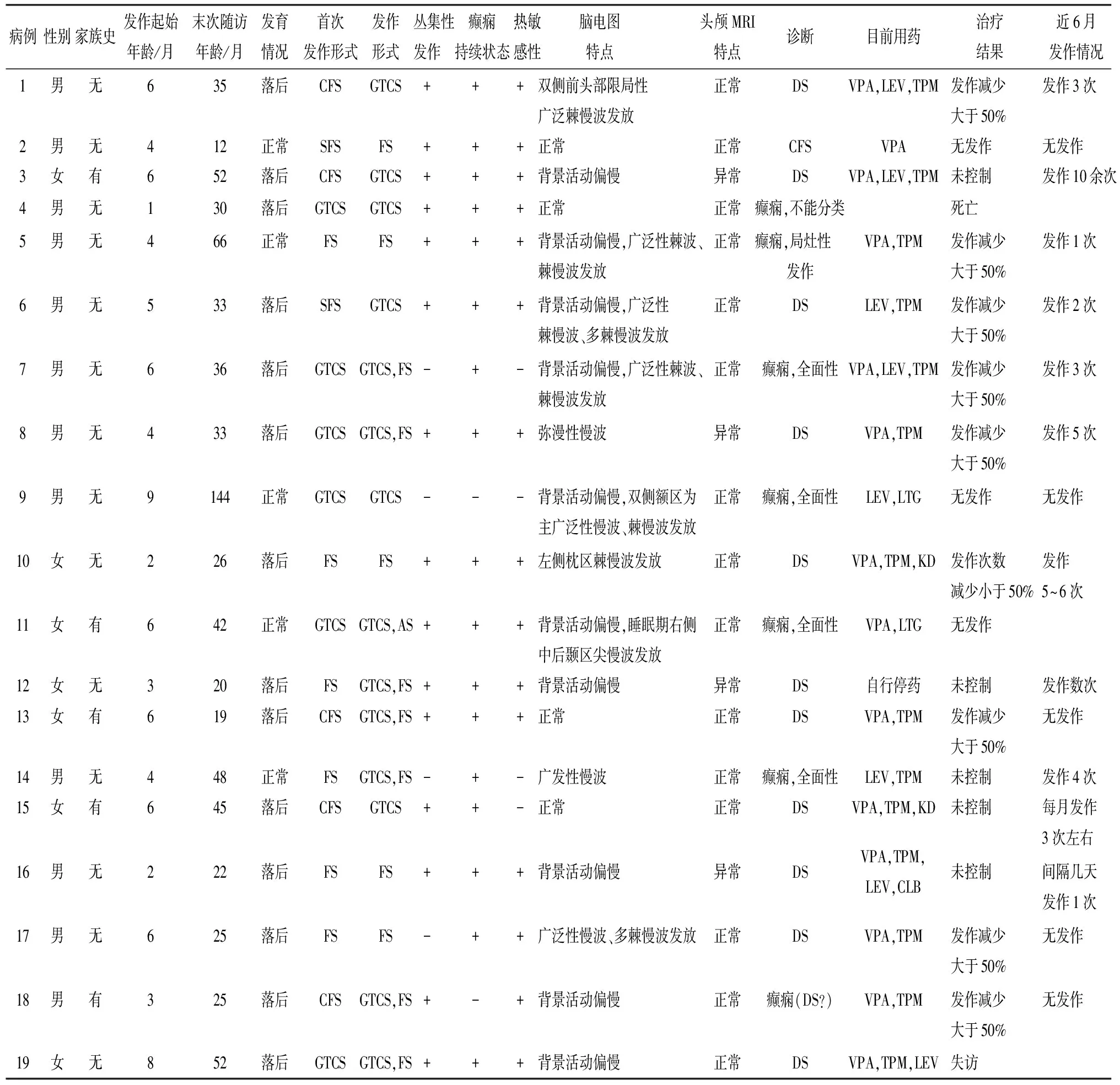
表3 病例资料
CFS:复杂性热性惊厥;GTCS:全面强直阵挛发作;SFS:单纯性热性惊厥;FS:局灶性发作;VPA:丙戊酸钠;LEV:左乙拉西坦;TPM:托吡酯;LTG:拉莫三嗪;KD:生酮饮食;CLB:氯巴占
SCN1A突变除引起癫痫的易感性外,还可以导致认知及行为障碍,临床上发育迟缓是由癫痫性脑病引起还是遗传改变本身所致,或是二者共同导致,目前存在争议。研究发现SCN1A表达降低导致前脑GABA能神经元功能障碍,从而影响发作前的认知[16],本组患儿虽然均有不同程度的发育落后,但大多数均在癫痫发作出现后被发现。SCN1A突变病人往往不会出现严重的脑结构异常,个别表现为脑萎缩、海马硬化、皮质发育不良[17],我们的病例中14例头颅MRI检查结果正常,5例存在异常,且均为非特异性表现。癫痫患儿早期脑电图异常可能预示不良的临床结局,但在SCN1A突变组中,近一半发作间期脑电图记录正常[18],我们也发现一半患儿早期脑电图正常或仅表现为背景活动偏慢的非特异性表现。
SCN1A突变病人的治疗结果与临床表型存在相关性,对于较温和的表型治疗效果好,而严重表型如DS或癫痫性脑病,大多数AED治疗效果较差。然而,KWAN等[19]认为47%的初诊癫痫病人在首次单药治疗后即可达到无癫痫发作状态,只有3%的病人需联合用药才能达到无癫痫发作。4种及更多的AED联合治疗,其疗效并不比单药治疗效果更好,故对于SCN1A突变的癫痫患儿选择适当的AED非常重要。最常用的药物是丙戊酸钠、左乙拉西坦、托吡酯、氯硝西泮,可有效减少癫痫发作频率[5,20-21],本组患儿主要以这几种药物为主,完全控制占15.8%,发作次数减少>50%占42.1%。有研究[1]表明对SCN1A突变病人,使用钠通道阻断剂如卡马西平、奥卡西平没有抗癫痫作用,甚至可能增加发作频率,本组研究中1例死亡患儿曾在外院应用奥卡西平抗癫痫治疗,该患儿死亡原因可能为癫痫猝死。
AED治疗效果不好的患儿可尝试生酮饮食(KD),研究[22]表明KD可用于治疗难治性癫痫,TIAN等[23]认为KD对超过一半的DS病人有效,KO等[24]发现在进展性癫痫性脑病的致病性突变中KD对SCN1A突变者有效,有效率达77.8%。KD能有效减少癫痫长时间发作和癫痫持续状态发生频率[25],同时改善病人的认知发展和行为障碍。KD开始治疗的时间越早,其抗癫痫作用越明显,早期KD可减少AED的联合应用[26],研究发现KD在患癫痫婴儿中有效且安全[27],因此笔者认为在SCN1A突变所致严重表型的癫痫患儿中,可早期应用KD,而不是仅仅作为最后的选择。
SCN1A基因突变包括新生突变和遗传性突变,其导致的癫痫多在婴儿早期起病,癫痫表型谱较广,其中较严重的为DS,而DS多数预后不良,伴有智力损害,癫痫猝死发生率高。本研究通过总结19例SCN1A突变的患儿基因及临床资料,扩大了该基因的变异谱,也为其他的SCN1A致病变异病人提供了临床表型参考。对疑似病例及时进行基因检测,有利于早期诊断,指导选择合适的治疗方案。
(感谢北京智因东方转化医学研究中心王亚健老师在实验技术及基因分析方面的帮助。)
