胡萝卜浓缩汁中耐热菌的分离及特性研究
2020-04-13刘彩琴魏兴虎陈蔚青
刘彩琴 魏兴虎 王 楠 陈蔚青 陈 虹 吕 韵 郑 刚
(1. 浙江树人大学生物与环境工程学院,浙江 杭州 310015;2. 山东金得利食品有限公司,山东 济宁 272200)
果汁营养丰富,但pH多为2.4~4.2[1],其常见污染菌为耐热、耐酸的霉菌、酵母菌和细菌[2-6]。耐热细菌如酸土环脂芽孢杆菌(Aliyclobacillusacidoterrestris)常引起巴氏灭菌果汁在常温条件下浊度升高,是浓缩果汁生产中最重要的目标控制微生物[7-8];耐热霉菌如多变拟青霉、尖孢镰刀菌、丝衣霉、篮状菌、新萨托菌和布氏正青霉、正青霉等常引起巴氏杀菌果汁的腐败[1];鲁氏接合酵母、酿酒酵母、出芽短梗霉等是导致果汁腐败变质的酵母菌[9-10]。控制微生物污染一直是果汁工业努力解决的难题,不同的原料使加工工艺、果汁的糖度和酸度等不相同,耐热微生物种类也不尽相同。
浓缩胡萝卜汁是中国复合果汁饮料和酸奶加工中常用的原料,经115~120 ℃杀菌处理30 s,其pH为6.0左右;为低酸性食品[11],冷藏条件下极少出现腐败变质现象。试验拟对某企业胀袋胡萝卜浓缩汁中耐热微生物进行分离及特性研究,以期为胡萝卜浓缩汁加工、保藏和利用提供依据。
1 材料与方法
1.1 材料
1.1.1 试验材料
胡萝卜浓缩汁:-18 ℃保存,山东某果汁生产企业。
1.1.2 试剂
PDA培养基、各种生化管:杭州微生物试剂有限公司;
麦芽汁琼脂(MEA)培养基:北京陆桥技术股份有限公司;
其他试剂均为国产分析纯。
1.1.3 仪器与设备
电子分析天平:PL303型,梅特勒—托利多仪器(上海)有限公司;
恒温水浴锅:HH-S型,金坛市江南仪器厂;
酸度计:FE20型,梅特勒—托利多仪器有限公司;
高压灭菌锅:GR60DA型,致微仪器有限公司;
超净工作台: HJ-VD-650型,上海苏净实业有限公司;
生化培养箱:SPX-250B-Z型,上海博讯实业有限公司医疗设备厂;
摇床:SW-CJ-1C型,上海福玛实验设备有限公司;
生物显微镜:YS100型,尼康仪器(上海)有限公司;
超声波细胞粉碎机:JY92-2D型,宁波新芝生物科技股份有限公司;
紫外分光光度计:UVmini-1240型,日本岛津公司。
1.2 方法
1.2.1 耐热菌的分离及纯化
(1) 耐热菌的富集培养:参照胡贻椿等[12]的方法并进行修改。吸取50 mL无菌样品,加入250 mL无菌三角烧瓶中,80 ℃水浴13 min,然后迅速冷却至45 ℃,以150 r/min摇床培养2 d。
(2) 分离及纯化:将培养后的样品用无菌生理盐水分别稀释至10-1,10-2,…,10-8。吸取浓度为10-7,10-8梯度的样液200 μL,涂布于PDA培养基平板上,28 ℃培养2~5 d,挑取典型单菌落,保藏并备用。
1.2.2 耐热菌的形态及理化特性
(1) 菌株形态:纯化后的菌株接种于MEA平板上,28 ℃培养3 d,观察菌落形态。
(2) 碳源利用情况:按D-葡萄糖、甘油、D-木糖、侧金盏花醇、肌醇、山梨醇、纤维二糖、D-乳糖(牛源)、海藻糖、D-松三糖、木糖醇、2-酮基-葡萄糖酸盐、D-麦芽糖、α-甲基-D-葡萄糖、D-棉籽糖、L-阿拉伯糖、D-半乳糖、N-乙酰葡糖胺、D-蔗糖生化鉴定管的要求接种耐热菌,考察菌株对碳源的利用情况。
(3) 菌株的耐热性:菌株经液体培养72 h后,80 ℃热处理13 min,稀释,取适量稀释液于80,90 ℃水浴锅中分别水浴5,10,15,20,25,30 min。分别涂布于PDA培养基上,于28 ℃恒温培养箱中培养2~5 d,观察生长情况。
(4) 菌株的耐酸特性:将液体培养72 h后,80 ℃热处理13 min,稀释,分别接种于pH为2.0,3.0,4.0,5.0,6.0,7.0,8.0的PDA培养基上(1 mol/L的盐酸或氢氧化钠调节),于28 ℃恒温培养2~5 d,观察生长情况。
1.2.3 耐热菌的鉴定 由中国食品发酵工业研究院中国工业微生物菌种保藏管理中心进行分子鉴定。
1.2.4 超声波功率对耐热菌色素提取效果的影响 参照叶伟庆等[13]的方法并进行修改。取适量培养48 h的发酵液,5 000 r/min离心15 min,沉淀经蒸馏水清洗3次,得湿菌泥1 g,加入 3 mol/L HCl 溶液10 mL,于200,400,600,800 W下超声1 h(每超声5 s间隔10 s),沸水浴10 min,再用冰水浴速冷,5 000 r/min离心15 min,得到上清液和红色沉淀。
(1) 还原糖和多糖含量的测定:分别采用DNS法[14]和苯酚硫酸法[14]测定上清液中还原糖和多糖含量。
(2) 吸光度值的测定:红色沉淀经蒸馏水清洗3次后,加入10 mL丙酮溶液浸提12 h,离心取红色上清液,于400~800 nm下测定吸光值。
1.3 数据处理
所有试验均为3次平行,数据经Excel软件分析;采用MEGA 5.0软件,邻近连接法分析“SR-1”与相关种的ITS rDNA序列系统发育树。
2 结果与分析
2.1 耐热菌的形态及理化特性
2.1.1 菌株形态 通过分离、筛选及纯化,得到1株经85 ℃水浴30 min后长势良好的粉红色菌株SR-1。由图1可知,SR-1在MEA培养基上呈奶油状,粉红色,表面反光,边缘整齐,菌落平伏,不透明。由图2可知,SR-1菌株在显微镜下细胞呈肾形,芽殖,大小为3.0~13.0 μm×3.0~5.0 μm。综上,菌株SR-1为酵母菌,与文献[15-16]中掷孢酵母属特征相近,孢子形状与王启明等[17]报道的肾形相似,初步判定为掷孢酵母。

图1 SR-1的菌落形态
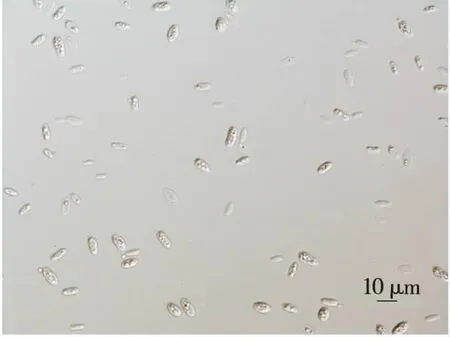
图2 SR-1的细胞形态
2.1.2 碳源利用情况 由表1可知,菌株SR-1可利用单糖如D-葡萄糖,能利用二糖如海藻糖、D-麦芽糖、D-蔗糖,能利用三糖如D-松三糖、D-棉籽糖,也能利用山梨醇,但不能利用甘油、D-木糖、侧金盏花醇、肌醇、纤维二糖、D-乳糖(牛源)、木糖醇、2-酮基-葡萄糖酸盐、α-甲基-D-葡萄糖、L-阿拉伯糖、D-半乳糖、N-乙酰葡糖胺,与已报道[16]的掷孢酵母对碳源的利用情况不一致,与Yang等[18]的肉色掷孢酵母对D-木糖、纤维二糖和侧金盏花醇利用情况不同。

表1 菌株SR-1对部分碳源的利用情况†
† “+”代表反应阳性;“-”代表反应阴性。
2.1.3 耐热耐酸特性 由表2可知,菌株SR-1经80 ℃水浴5,10,15,20,25,30 min后均在PDA培养基上生长良好;经90 ℃水浴5 min后能较好生长,水浴10,15 min后有生长,但长势不良,水浴20,25,30 min后不再生长,说明SR-1较耐热。由表3可知,菌株SR-1在pH 6.0~8.0下生长良好,在pH 4.0,5.0下能生长,但长势不好,在pH<3.0时不能生长,表明菌株SR-1在pH 3.0以下的强酸性环境中不能生长,但在pH 4.0以上均能生长,且在中性及偏碱性环境中生长良好,与温洪宇等[19]的结论相似。
2.2 菌株SR-1的ITS rDNA序列及分析
提取菌株SR-1的DNA,设计引物并PCR扩增,得到最终的ITS rDNA序列,序列长度为550 bp。由图3可知,SR-1与掷孢酵母属(Sporobolomyces)中的模式菌株SporobolomycescarnicolorJCM 3766T(登录号为AY069991)聚为一支,置信度为100%,序列相似性为100%,表明其亲缘关系最近。故将菌株SR-1命名为肉色掷孢酵母(Sporobolomycescarnicolor)SR-1。

表2 菌株SR-1的耐热特性†
† “+++”代表生长良好;“++”代表生长较好;
“+”代表生长;“-”代表不生长。

表3 菌株SR-1的耐酸特性†
† “+++”代表生长良好;“++”代表生长较好;“+”代表生长;“-”代表不生长。
2.3 超声波功率对菌株SR-1色素提取效果的影响
由图4可知,菌株SR-1上清液还原糖含量为6.02~7.86 mg/mL,多糖含量为32.93~41.78 mg/mL。当超声功率为600 W时,还原糖含量最高;当超声功率为400 W时,多糖含量最高。酵母胞内还原糖主要来源于细胞质中还原性糖类,如葡萄糖、果糖等,适度的超声处理有利于其释放;酵母胞内多糖主要来源于细胞壁中的葡聚糖和甘露聚糖等多糖[20],适度的破壁处理可使多糖充分释放;与王慧等[21]研究结果类似。
由图5可知,当超声功率为200,400,600 W时,菌体的丙酮提取液在414.0,539.0,634.0 nm处各有3个吸收峰,以539 nm处吸收峰值最大;当超声功率为800 W时,丙酮提取液在414 nm处无吸收峰,在539,634 nm处各有一吸收峰,仍以539 nm处吸收峰值最大。现有资料[22]显示,β-胡萝卜素的吸收峰为430,450,475 nm,圆酵母素的吸收峰为459,482,515 nm,红酵母红素的吸收峰为470,492,521 nm,与试验结果不同。
3 结论
试验从产气、胀袋的胡萝卜浓缩汁中分离出一株耐热菌SR-1,经形态学和ITS rDNA 基因序列分析为酵母菌属的肉色掷孢酵母,该菌经80 ℃热处理5~30 min和90 ℃热处理15 min以下均可生长,经90 ℃热处理20 min后不能生长;在pH 6.0~8.0环境中生长良好,在pH 3.0以下不生长。以盐酸为溶剂辅以超声波破壁技术,有利于菌株还原糖、多糖和色素的溶出,肉色掷孢酵母SR-1丙酮提取液吸收峰为414,539,634 nm。掷孢酵母SR-1对碳源的利用情况和色素吸收峰仍需进一步研究。
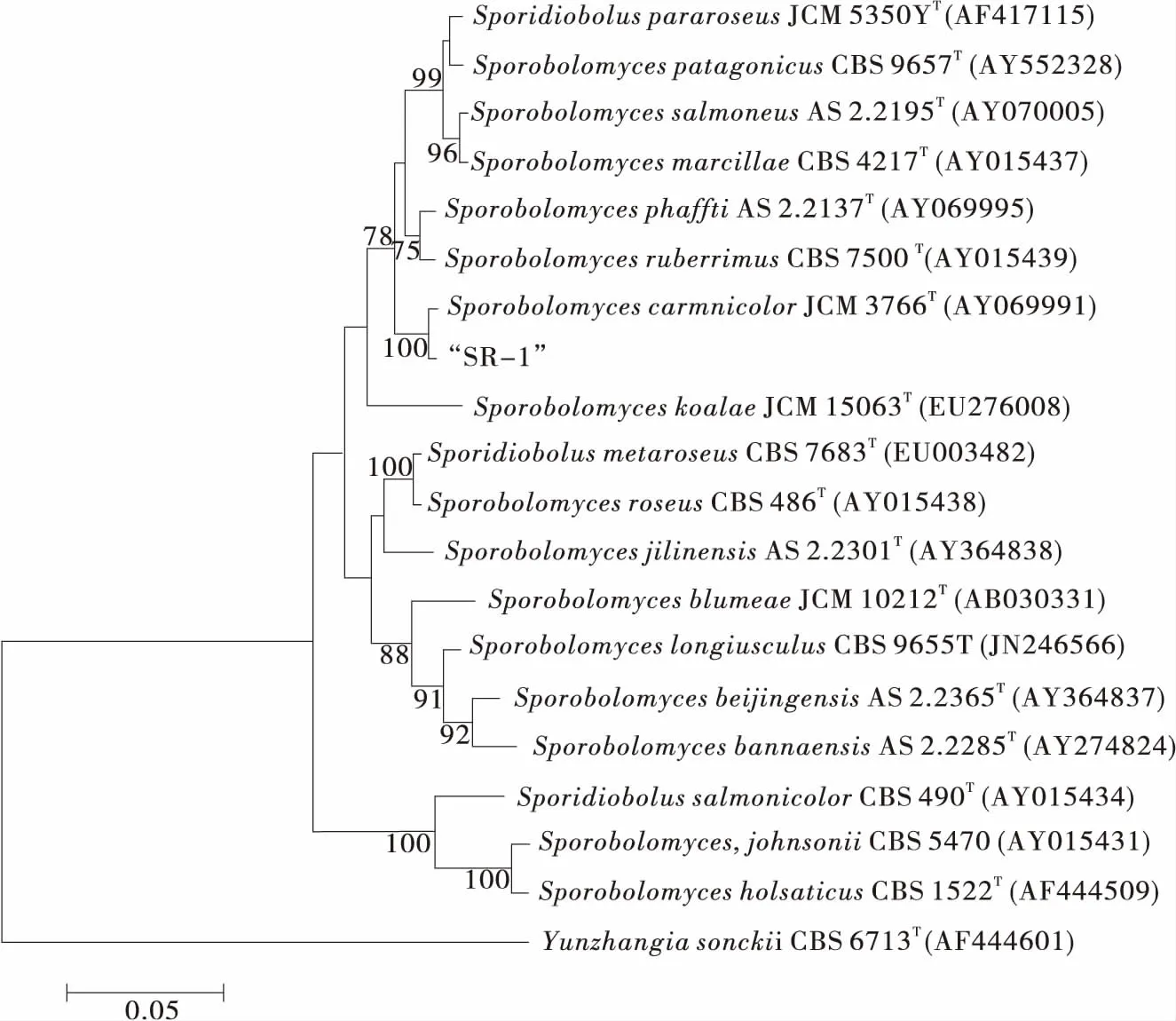
图3 菌株SR-1的ITS rDNA基因序列分析聚类结果

图4 超声功率对菌株SR-1多糖和还原糖含量的影响

图5 超声功率对菌株SR-1色素提取效果的影响
