人畜共患病病原——猪螺杆菌及其研究进展
2020-04-13张广智王明艳罗毅徐世行何顺东崔尚金
张广智,王明艳,罗毅,徐世行,何顺东, 崔尚金
人畜共患病病原——猪螺杆菌及其研究进展
张广智1,2,王明艳1,2,罗毅3,徐世行3,何顺东4, 崔尚金1,2
(1中国农业科学院北京畜牧兽医研究所,北京 100193;2农业部兽用药物与兽医生物技术北京科学观测实验站,北京 100193;3沈阳市动物疫病预防控制中心,沈阳 110034;4沈阳市沈河区市场监管事务服务与行政执法中心,沈阳 110161)
猪螺杆菌 (),革兰氏阴性菌,具有典型螺旋状外形,菌体末端因有平均4—10个鞭毛而具有高度的活动性。猪螺杆菌是一种重要人畜共患病病原, 近些年才被比利时科学家分离并成功体外培养。猪螺杆菌不同于主要感染人的幽门螺旋杆菌,猪螺杆菌主要感染大部分的猪,处于屠宰年龄的猪的感染率约在60%—95%。猪螺杆菌感染主要导致猪发生胃炎,胃部不适和降低猪的体重增加率。更重要的是,猪螺杆菌也感染部分人,造成患者发生各种胃部不适、胃病甚至胃癌(如粘膜相关淋巴组织淋巴瘤)。猪螺杆菌感染后虽然引发了机体强烈的先天免疫和适应性免疫应答,但是该菌进化了数种毒力因子用来逃避免疫系统的监控,最终可以持续地定植在宿主胃内,破坏胃上皮细胞稳态,引发慢性炎症,甚至胃癌。目前科学家对于猪螺杆菌的传播途径还不是很清楚,猪肉和相关制品,唾液,粪便可能是造成细菌传播的途径。猪、小鼠和蒙古沙鼠是目前常用的研究猪螺杆菌致病机理的动物模型。虽然猪螺杆菌对猪的健康、生产性能和动物福利乃至人的健康有重要影响,但是由于猪螺杆菌分离培养比较困难,细菌体外培养需要微需氧环境(85%N2,10%CO2和5%O2),国内对猪螺杆菌研究相对较少,一般主要涉及细菌的检测方面。目前,关于猪螺杆菌致病机理的资料比较少。通过分析猪螺杆菌基因组结合已知发现,大家推测该菌可能通过以下几个机制来干扰或逃避宿主防御应答:鞭毛的高度运动性和对酸的中和能力、对胃上皮细胞的较高黏附性、对氧化应激压力的解毒能力、诱导细胞死亡和免疫调节等。鉴于此,本文作者结合多年猪螺杆菌研究经历以及文献资料从猪螺杆菌的研究历史、细菌的基本特征和培养条件、流行现状、致病机理和国内外研究现状等几个方面进行了详细综述,旨在提高国内对猪螺杆菌及其致病性的认识和重视程度,也为猪螺杆菌未来的研究和防控提供重要的参考和指导。
猪螺杆菌;人畜共患病病原;胃病;毒力因子;致病机理
1 研究历史
1984年,MARSHALL和WARREN首次发现一种弯曲状细菌可以导致人发生胃溃疡,胃炎,粘膜相关淋巴组织(MALT)淋巴癌和其他胃部疾病,这种胃内弯曲状革兰氏阴性细菌后被命名为幽门螺旋杆菌()[1]。自此幽门螺旋杆菌逐步受到临床医生和基础研究工作者的重视,细菌体外分离培养技术的成功也为科学家进一步研究细菌的结构,耐药性,以及致病机理铺平了道路,为世界幽门螺旋杆菌感染患者的治疗带来了福音。MARSHALL和WARREN也因此获得2005年诺贝尔医学奖。目前,幽门螺旋杆菌的感染率在亚洲,南美,东欧等地区均高于50%[2],被世界卫生组织列为胃癌一级致病因子[3]。
研究显示幽门螺旋杆菌并不是唯一能定植在人胃黏膜的病原菌,典型螺旋状的非幽门螺旋杆菌也相继在患者胃活组织检查中被发现,这一类螺杆菌被统称为非幽门螺旋杆菌螺杆菌(Non-helicobacters, NHPH)[4-5]。NHPH感染同样可以引起患者多种胃部疾病,而且研究显示感染NHPH的患者发展为MALT淋巴癌的可能性比感染幽门螺旋杆菌的患者要高得多[6-7],因此就更需引起重视。NHPH主要包括猪螺杆菌,犬螺杆菌,猫胃螺杆菌,胆汁螺杆菌等数种螺杆菌,其中猪螺杆菌是NHPH中最流行的研究的较多的螺杆菌[8-10]。猪螺杆菌主要感染猪,同时也感染人以及少量的恒河猴和食蟹猴,主要定植在宿主胃内,引起各种胃部疾病和不适,具有重要的公共卫生学意义。在猪胃内,猪螺杆菌最初是1990年在猪胃的黏液层和窦窝内发现的,经过数次更名,最终确定了猪螺杆菌的名字和学术位置。
2 细菌的基本特征和培养条件
猪螺杆菌属于革兰氏阴性菌,具有最多达6个转向的典型螺旋状外形。细菌菌体长约2.3—6.7µm,宽0.9—1.2µm。在猪螺杆菌的菌体末端具有平均4—10个鞭毛,因此细菌具有高度的活动性[11],体外培养和实验性感染小鼠体内的细菌扫描电镜图片见下图1。
猪螺杆菌培养条件及其苛刻,因此非常难分离和培养,一直到2008年此菌的体外培养才获得突破,比利时根特大学的Haesebrouck F教授所在实验室是迄今为止唯一从猪胃内分离并成功体外培养猪螺杆菌的实验室[11]。猪螺杆菌通常需在pH为5的双相布氏琼脂培养基生长,培养基需添加20%(v/v)的胎牛血清,两性菌素B以及Vitox附加生长液等添加物。另外,每2d需要添加适量的布氏肉汤培养基(含20%的胎牛血清)。细菌培养条件为微需氧环境(85%N2,10%CO2和5%O2)。其他国家或地区的实验室均以小鼠作为猪螺杆菌的载体进行相关研究,用感染猪螺杆菌的小鼠胃匀浆物作为感染源,但是小鼠胃内的细菌成分复杂,因此用此模型研究猪螺杆菌致病机制的模式具有一定的局限性。
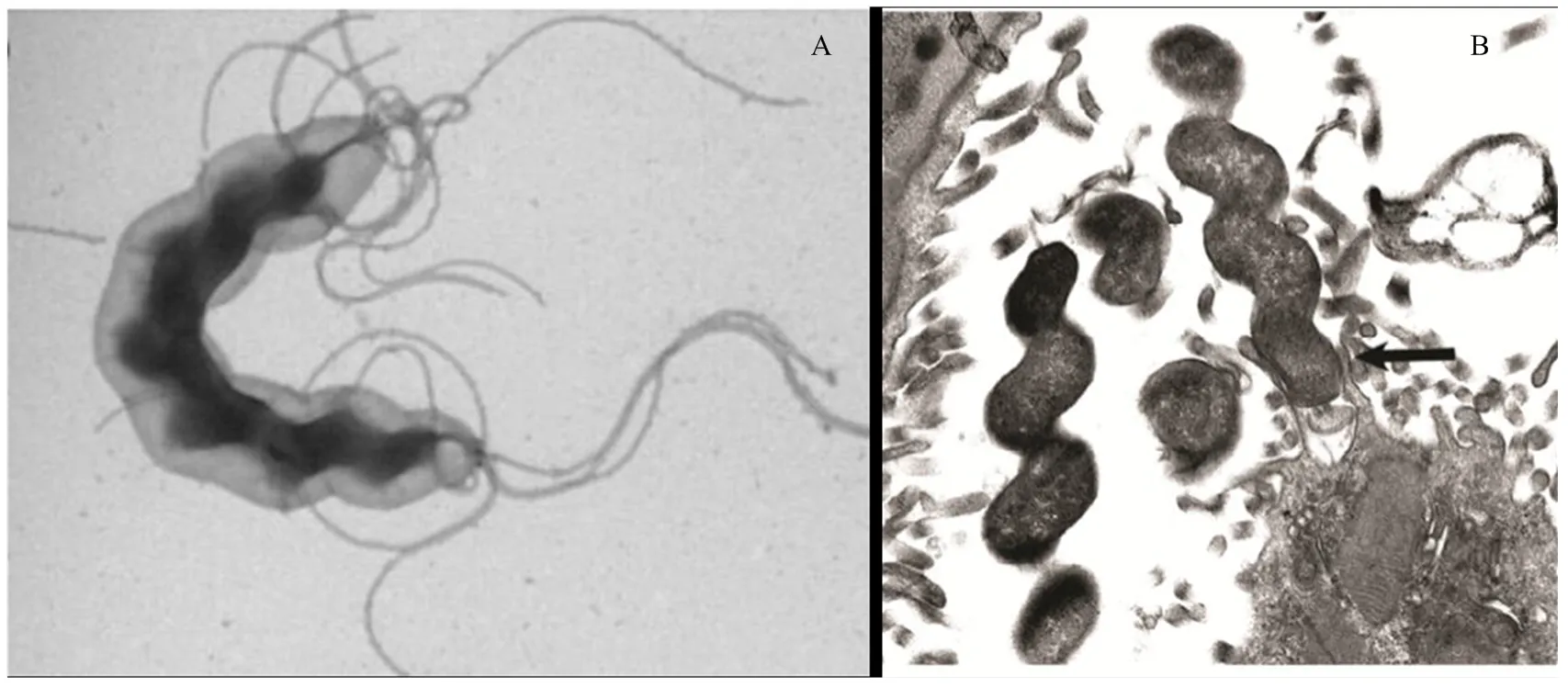
A:体外培养的展示两极鞭毛的猪螺杆菌;B:黏附在实验性感染BALB/c小鼠胃上皮细胞上的猪螺杆菌
3 流行现状
目前,在已经报道的国家和地区中(包括欧洲,美国,亚洲部分地区),猪螺杆菌在猪胃中的检出率均大于60%[12-14]。ELLEN等证实猪螺杆菌感染猪后可以导致胃炎的发生以及日增重减低,第一次通过动物感染性试验证明该菌对猪的危害性[15]。猪螺杆菌可以感染各个年龄段的猪,仔猪断奶后细菌感染率迅速上升,据报道欧美地区屠宰年龄的猪感染率平均在60%以上。细菌感染主要集中在猪的胃底和胃窦两部分[12-13,15]。对于猪螺杆菌在猪群内的传播途径目前还没定论,一些学者猜测饲料和分泌物(包括粪便和唾液)可能是潜在的感染途径之一[9]。
除了猪,人也是猪螺杆菌的感染对象。根据报道的国家和地区不同,猪螺杆菌在胃病患者中的检出率约为1.8%—6.94%[9-10,16]。NHPH在中国的感染也非常的普遍,中国疾病控制中心的张建中研究员发现北京市幽门螺旋杆菌阳性患者中NHPH感染率高达11.87%,其中猪螺杆菌的感染比例排第一,高达6.94%,并且一些患者存在3种不同螺杆菌混合感染现象,这些都使临床医生用药治疗相关胃部病变的情况更加复杂[10]。感染包括猪螺杆菌在内NHPH的患者主要引起胃肠道不适等临床症状,比如消化不良,上腹疼痛和反酸等,但是症状一般要比感染幽门螺旋杆菌的患者症状要轻[17]。除了胃部不适,近期研究显示帕金森患者中感染猪螺杆菌的比例要明显高于普通对照组患者,提示了胃-脑轴在联系胃部感染和精神系统疾病中的主要作用[18-19]。
目前对于猪螺杆菌感染人的途径还不是特别清楚。LEEN等发现屠宰场的猪尸体是细菌感染人的潜在传染源之一[14],另外,与猪及猪肉类产品(比如食用猪胃)频繁接触很有可能是人感染猪螺杆菌的主要途径之一,研究显示猪螺杆菌在污染的肉中可以存活48h,同时超市的肉馅中也被检出有活的猪螺杆菌存在[20-22],另外也有猪场中的兽医感染猪螺杆菌的报道,患者经过抗菌治疗后症状得到有效缓解[22]。
国内对于猪螺杆菌的致病机理研究相对较少,主要原因可能是缺少体外培养的猪螺杆菌限制了细菌致病机理的研究。近期笔者通过分析在国内部分地区采集的猪胃样品检测到猪螺杆菌[10,23],但猪螺杆菌在中国主要养猪大省以及农村散养户中的总体流行情况还不清楚,将来国内猪螺杆菌分离成功会极大推动国内该病原的相关研究,比如中国流行菌株的特点,致病性和致病机理,相关的致病基因以及免疫调控机制。中国是幽门螺旋杆菌高感染国家,普通人群感染率在34%—80%之间[24]。张建中等发现相当高比例的猪螺杆菌存在于幽门螺旋杆菌阳性患者中,同时还证明了猪螺杆菌和幽门螺旋杆菌共感染导致患者胃内菌群的显著变化[10,25]。猪螺杆菌PCR检测方法也在国内建立并得到初步应用[26]。这些研究都将对未来预防和控制猪螺杆菌的感染提供理论依据和实验室基础,更重要的是可以为感染猪螺杆菌的胃病患者治疗提供宝贵的实验室数据。
4 致病机理
猪螺杆菌是目前最流行的NHPH,该菌感染猪后可以导致胃炎以及其他胃部不适等症状,进而影响猪的经济价值。更重要的是,研究显示直接或者间接的与猪接触可以导致人感染猪螺杆菌,引起胃病甚至胃癌[9-10, 21]。因此研究此菌的致病机理具有重要的意义,但由于此菌的分离培养要求条件比较苛刻,所以全世界集中研究猪螺杆菌的实验室并不多,主要集中在比利时,中国和日本,其他国家也有零星研究,其中比利时HAESEBROUCK教授领衔的团队研究的相对最多[9]。2011年比利时科学家首次对分离的猪螺杆菌基因组进行了测序并公布,为深入研究猪螺杆菌提供了可能和依据,成功体外分离猪螺杆菌并测序是研究猪螺杆菌历史上具有里程碑意义的突破[27]。
与狡黠的幽门螺旋杆菌类似,猪螺杆菌通过一些毒力因子的精密组合来调控机体的免疫反应,巧妙躲避机体免疫细胞的有力攻击,在宿主体内定植、繁殖进而建立长期的感染。关于猪螺杆菌对机体的免疫调控机制已经有了一些研究,猪螺杆菌主要通过以下几个方面来调控机体的防御应答。
4.1 鞭毛的高度运动性以及对酸的中和能力
由于较低的pH环境以及时刻不断的分泌和剥落黏液层,对于大部分细菌来说动物和人的胃是个极富挑战性的存活环境[28]。具有高度运动性的诸多鞭毛赋予了猪螺杆菌在黏液中可以高效地游到胃表面的上皮细胞附近的能力。猪螺杆菌可以编码尿素酶,尿素酶可以水解尿素生成氨和二氧化碳,氨可以用来中和胃内的大量酸让菌体附近的环境达到近乎中性,这是完成感染非常重要的一步[27]。缺失鞭毛编码基因或者尿素酶编码基因的螺杆菌不能持续地定植在宿主胃内[29-30]。猪螺杆菌的全基因组测序显示该菌拥有中和酸和赋予细菌高度活动性的大部分毒力因子[27]。研究显示猪螺杆菌可以在体内和体外作用于泌酸细胞,降低其细胞活力,影响其泌酸能力和相关信号通路的传递[31](图2)。
4.2 对胃上皮细胞的黏附性
科学家对于螺杆菌对胃上皮细胞的黏附研究集中在幽门螺旋杆菌上面,幽门螺旋杆菌的大部分黏附素均是大的外膜蛋白家族,比如目前研究的比较多的几个黏附素,包括血型抗原结合黏附素(BabA),唾液酸结合黏附素(SabA),N-乙酰神经氨酰乳糖结合原纤维样血凝素(HpaA)和HorB[32-34]。猪螺杆菌的体外分离培养的成功突破为科学家研究该菌的致病机制提供了极大的便利,包括黏附因子和其他毒力因子的挖掘。猪螺杆菌的基因组分析显示其拥有和HpaA和HorB同源性非常高的类似黏附因子[27],构建这些黏附因子的基因突变株对于研究这些潜在的黏附因子在黏附宿主上皮细胞中的作用和细菌的致病机理十分必要。近期PADRA等首次证明猪螺杆菌通过2种模式结合人胃和猪胃黏液素上的碳水化合物,第一种模式是结合末端为Galβ3GlcNAc的多糖,第二种模式是结合一种带负电的结构[35]。进一步鉴定和研究以上这些和猪螺杆菌相互作用的多糖对于未来设计新的抗菌策略十分必要。
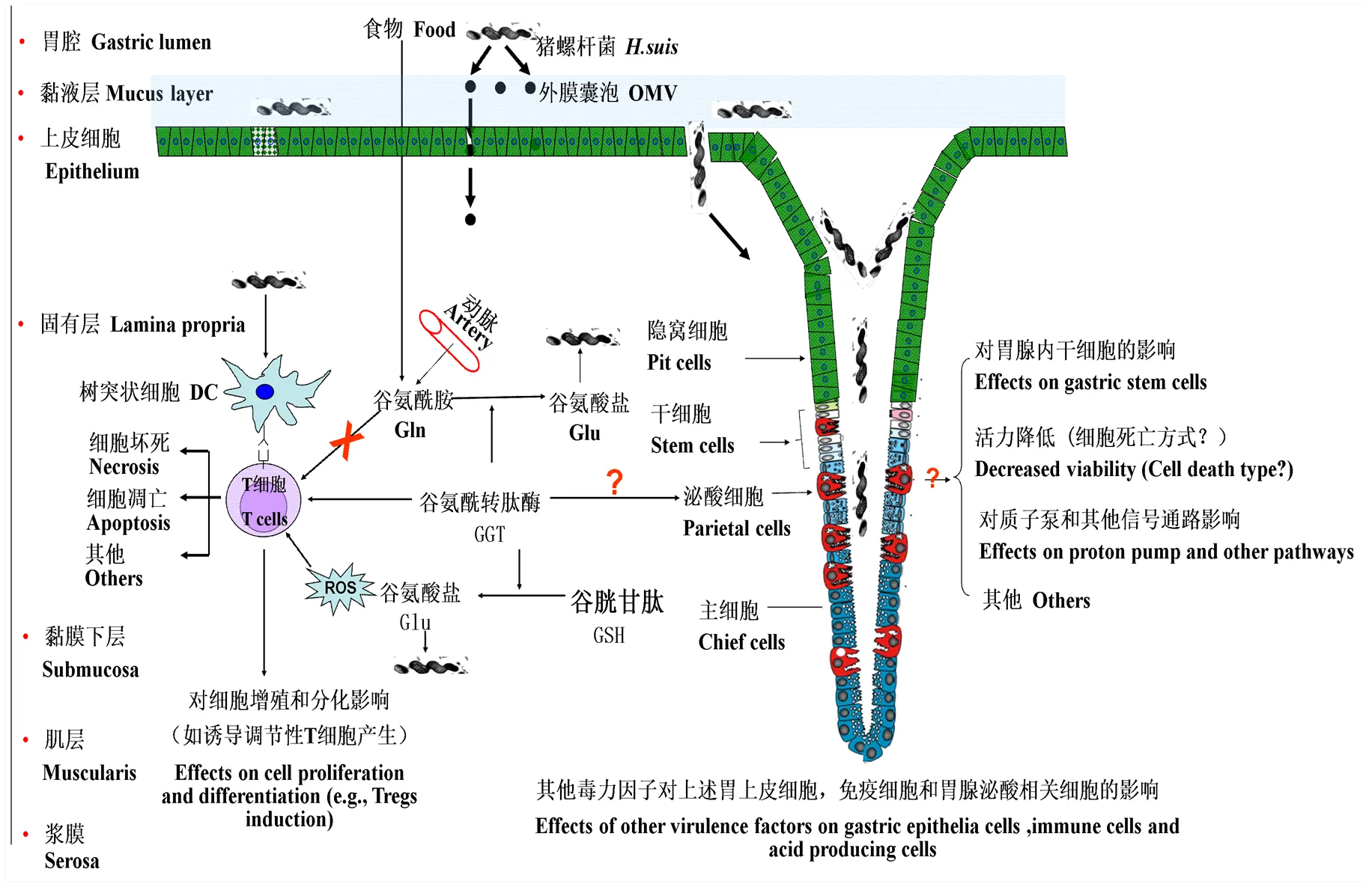
图2 猪螺杆菌及其毒力因子GGT与宿主的相互作用示意图
4.2 对抗氧化应激压力
众所周知,宿主体内的活性氧对于对抗致病性细菌具有重要的作用,致病性细菌,比如幽门螺旋杆菌,均具有对抗这些氧化应激压力的毒力因子[36]。猪螺杆菌基因组内也有编码抗氧化应激压力因子,比如过氧化氢酶,超氧化物歧化酶和NADPH醌还原酶等基因[27],这些都暗示了和幽门螺旋杆菌类似的猪螺杆菌也拥有对抗体内氧化应急压力的因子,但是这些毒力因子在猪螺杆菌感染宿主和致病性中的重要性和各自的角色还未曾得到科学家的证实。
4.3 诱导细胞死亡
胃内螺杆菌包括幽门螺旋杆菌和NHPH,两者均可以引起宿主不同程度的胃黏膜损伤。胃上皮细胞死亡(包括细胞凋亡和细胞坏死)是造成胃黏膜损伤的重要机制之一,一系列诱导细胞死亡的毒力因子相继被发现,其中谷氨酰转肽酶(GGT),空泡形成细胞毒素(VacA)和细胞毒素相关基因致病性岛(PAI)是研究较多的3个毒力因子[1, 37-39]。
猪螺杆菌基因组分析显示该菌缺少VacA或者缺失功能性的PAI,GGT是目前猪螺杆菌中参与细胞死亡和免疫调控的唯一研究的比较多的毒力因子(图2)。GGT是猪螺杆菌的毒力因子,膜结合状态的GGT同样也表达于人和动物机体内,比如肾脏,肝脏和脑部[40],临床上血清内的GGT水平是鉴定肝脏和胆囊相关疾病的标志物[41]。一系列研究显示来自猪螺杆菌和其他螺杆菌的GGT参与了诱导胃上皮或肠道上皮细胞凋亡和坏死的过程,并且添加外源性谷胱甘肽加剧了细胞死亡的程度[39, 42-44](图2),这些结果提示了胃内氨基酸或者多肽也参与了螺杆菌感染机体后的病理发展变化,胃内氨基酸或者多肽在细菌感染中的具体角色和机制还有待进一步研究。
4.4 调节机体免疫应答
机体的先天免疫和获得性免疫是抵抗外来微生物入侵的主要防线,猪螺杆菌可以成功定植于动物和人胃内并持续存在致病,这些都提示了此菌拥有复杂的免疫抑制或免疫调控机制。机体的先天免疫主要涉及巨噬细胞(Mφ),嗜酸性粒细胞,中性粒细胞,树突状细胞(DCs),机体的获得性免疫应答主要涉及DCs,辅助性T细胞(T helper cells),B细胞和调节性T细胞(Tregs)等细胞。
DCs是先天性免疫细胞,同时也是先天性免疫应答和获得性免疫应答的桥梁,是机体最强大的专职抗原提呈细胞(APCs)[45]。研究显示猪螺杆菌感染小鼠和蒙古沙鼠后胃局部呈现DCs, Mφ和中性粒细胞浸润等细胞浸润[46-47],说明猪螺杆菌感染机体后引发了先天性免疫应答,但是这些应答不足以控制猪螺杆菌的感染,因此机体进一步启动了获得性免疫应答。
体内和体外试验显示机体感染猪螺杆菌后引起强烈的T细胞应答,猪螺杆菌的重要毒力因子GGT可以抑制人T淋巴细胞系和鼠源原代T淋巴细胞的增殖和功能性细胞因子的分泌[48-49]。笔者进一步证明了GGT抑制T细胞增殖的部分机理,众所周知,谷氨酰胺是一种条件性必须氨基酸,大量存在于动脉循环和胃肠道的腔道内(存在于食物中),对于维持正常的胃肠道粘膜功能包括上皮细胞的功能非常重要[50]。而谷氨酰胺是T细胞活化必须的能量原料[51-52],研究结果显示猪螺杆菌可以通过竞争性的争夺谷氨酰胺而有效的抑制T细胞的增殖和分化[38],而GGT酶解谷氨酰胺后产物谷氨酸盐是猪螺杆菌分裂生长的因子(图2)。
Tregs通过分泌一些抑炎细胞因子,比如TGF-β和IL-10,从而不同程度的抑制机体的免疫应答。研究显示一些致病菌可以巧妙的调控T细胞的分化方向,进而逃避机体的免疫应答,比如结核分枝杆菌就可以诱导Tregs来逃避免疫系统的攻击[53]。BOSSCHEM等证实猪螺杆菌可能通过诱导Tregs的产生而逃避免疫应答[54]。体内和体外研究还证实猪螺杆菌可以影响胃泌酸细胞的功能,这也可能是猪螺杆菌感染导致胃炎和其他胃部疾病的原因之一[31, 47]。
另外,杨等证明感染猪螺杆菌的小鼠胃内呈现较高水平的γ干扰素(IFN-γ),这些IFN-γ来自B细胞且和胃内淋巴滤泡的形成和MALT淋巴癌的发生有关系[55-56]。趋化因子CXCL13又名B淋巴细胞趋化因子,和淋巴滤泡中生发中心的形成密切相关。值得注意的是,我们和其他国家的科学家均发现小鼠和蒙古沙鼠感染猪螺杆菌后胃内表达非常高水平的CXCL13,应用CXCL13中和抗体可以干扰淋巴滤泡的形成[54,56-57],充分显示了抗CXCL13抗体在未来处理螺杆菌感染中的作用和应用前景。
4.5 其他机制
随着抗生素耐药性的日益增多,人们对于抗生素使用越来越谨慎,益生菌作为一种新型微生态制剂,在畜牧业和人医临床得到越来越多的应用,具有诸多优点。2017年研究发现布拉酵母菌作为益生菌可以有效降低猪螺杆菌在小鼠胃内的载菌量,同时有效抑制猪螺杆菌感染引起的淋巴滤泡的形成[58]。对于益生菌在调控猪螺杆菌感染方面的作用还需要进行大量研究,比如体外进行益生菌干预后对猪螺杆菌在猪体内或患者体内的分布以及病理变化影响,同时对宿主肠道内菌群的组成影响。此外,不久前研究发现高脂饮食诱导的肥胖可促进猪螺杆菌感染后胃 MALT 的形成,白介素22可能介导了这一过程[59]。这些研究都说明了猪螺杆菌在胃部相关疾病中扮演了非常重要的角色,更深入的致病机理方面的研究亟需展开。胃内菌群对于猪螺杆菌感染宿主后的病理变化也有一定的影响。近期,研究发现胃梭杆菌在猪螺杆菌感染所诱导的胃溃疡中也起到了一定的促进作用[60],对于胃梭杆菌和猪螺杆菌在宿主胃病发生中的具体作用还需要进一步研究。
由于猪螺杆菌感染宿主广泛,主要包括猪,人和非人类灵长类动物,细菌的进化一直吸引了不少世界科学家的目光。2018年,比利时科学家联合国内郭爱珍教授团队,以及世界上十几个国家的科学家,历时5年通过采集世界上大量猪胃样本进行进化分析显示猪螺杆菌很有可能在100 000—150 000年前从恒河猴跨越到宿主猪内,之后再感染人[23],揭示了猪螺杆菌的进化历史轨迹,为猪螺杆菌的研究提供了宝贵数据。
5 结语
我国是养猪大国,猪的存栏量一直居世界前列。但猪螺杆菌等病原是猪只健康和我国养猪业的潜在威胁。目前对猪螺杆菌的毒力基因研究的较少,因此,有必要加强研究摸清猪螺杆菌对猪的致病途径,致病机理。同时,我国作为胃病包括胃癌高发病率国家,系统性研究猪螺杆菌不仅可以为研究细菌对猪的致病性提供重要的平台,同时也可以对国内幽门螺旋杆菌和猪螺杆菌混合感染的胃病患者临床治疗提供必要的实验室理论支持,具有重要的公共卫生学意义。
[1] MARSHALL B J, WARREN J R.Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration., 1984, 1(8390):1311-1315.
[2] EUSEBI L H, ZAGARI R M, BAZZOLI F, Epidemiology ofinfection., 2014,19 (Suppl. 1): 1-5.
[3] HATAKEYAMA M.CagA and gastric cancer: a paradigm for hit-and-run carcinogenesis, 2014, 15(3): 306-316.
[4] HEILMANN K L, BORCHARD F. Gastritis due to spiral shaped bacteria other than: clinical, histological, and ultrastructural findings., 1991, 32(2):137-140.
[5] SOLNICK J V. Clinical significance ofspecies other than, 2003, 36(3): 349-354.
[6] STOLTE M, KROHER G, MEINING A, MORGNER A, BAYERDORFFER E, BETHKE B. A comparison ofandgastritis. A matched control study involving 404 patients, 1997, 32(1): 28-33.
[7] MORGNER A, LEHN N, ANDERSON L P, THIEDE C, BENNEDSEN M, TREBESIUS K, NEUBAUER B, NEUBAUER A, STOLTE M, BAYERDORFFER E.- associated primary gastric low-grade MALT lymphoma: complete remission after curing the infection, 2000, 118(5): 821-828.
[8] VAN DEN BULCK K, BAELE M, DRIESSEN A, DEBONGNIE J C, BURETTE A, STOLTE M, DUCETELLE R, HAESEBROUCK F. Identification of non-spiral organisms in gastric samples from humans, dogs, and cats2005, 43(5):2256-2260.
[9] HAESEBROUCK F, PASMANS F, FLAHOU B, CHIES K, BAELE M, MEYNS T, DECOSTERE A, DUCATELLE R. Gastric helicobacters in domestic animals and nonhuman primates and their significance for human health, 2009, 22(2): 202-223.
[10] LIU J, HE L, HAESEBROUCK F, GONG Y, FLAHOU B, CAO Q, ZHANG J. Prevalence of Coinfection with Gastric Non-Helicobacter (NHPH) Species in-infected Patients Suffering from Gastric Disease in Beijing, China., 2015, 20(4): 284-290.
[11] BAELE M, DECOSTERE A, VANDAMME P, CEELEN L, HELLEMANS A, MAST J, CHIERS K, DUCATELLE R, HAESEBROUCK F. Isolation and characterization ofsp. nov. from pig stomachs, 2008, 58(Pt 6):1350-1358.
[12] PARK J H, SEOK S H, CHO S A, BAEK M W, LEE H Y, KIM D J, PARK J H. The high prevalence ofsp. in porcine pyloric mucosa and its histopathological and molecular characteristics2004, 104(3-4):219-225.
[13] HELLEMANS A, CHIERS K, DE BOCK M, DECOSTERE A, HAESEBROUCK F, DUCATELLE R, MAES D. Prevalence of 'Helicobacter suis' in pigs of different ages, 2007, 161(6):189-192.
[14] DE COOMAN L, HOUF K, SMET A, FLAHOU B, DUCATELLE R, DE BRUYNE E, PASMANS F, HAESEBROUCK F. Presence ofon pork carcasses, 2014, 187:73-76.
[15] DE BRUYNE E, FLAHOU B, CHIERS K, MEYNS, KUMAR S, VERMOOTE M, PASMAN F, MILLET S, DEWULF J, HAESEBROUCK F, DUCAELLE R. An experimentalinfection causes gastritis and reduced daily weight gain in pigs, 2012, 160(3-4):449-454.
[16] ALI B, CHLOE W, MEHMET A, SOFIE B, ANNEMIKE S, GOKHAN T, TULIN G G, FREDD H, FATIH K. Presence of gastricspecies in children suffering from gastric disorders in Southern Turkey., 2018,23(5):e12511.
[17] SINGHAI A V, SEPULVEDA A R.gastritis- A case study with review of literature, 2005, 29(11):1537-1539.
[18] BLAECHER C, SMET A, FLAHOU B, PASMAN F, DUCATELLE R, TAYLOR D, WELLER C, BJARNASON I, CHARLETT A, LAWSON A J, DOBBS R J, DOBBS R J, DOBBS S M, HAESEBROUCK F. Significantly higher frequency ofin patients with idiopathic parkinsonism than in control patients, 2013, 38(11-12): 1347-1353.
[19] BLAECHER C, GORLE N, BAUWENS E, FLAHOU B, DUCATELLE R, LIBERT C, VANDENBROUCKE R E, HAESEBROUCK F, Smet A. Influence of the stomach-brain axis in relation to an experimentalinfection in mice2015, 20: 84-84.
[20] DE COOMAN L, FLAHOU B, HOUF K, SMET A, DUCATELLE R, PASMAN F, HAESEBROUCK F. Survival ofbacteria in retail pig meat., 2013, 166(1):164-167.
[21] LIANG J, DUCATELLE R, PASMANS F, SMET A, HAESEBROUCK F, FLAHOU B. Multilocus sequence typing of the porcine and human gastric pathogen, 2013, 51(3):920-926.
[22] JOOSTEN M, FLAHOU B, MEYNS T, SMET A, ARTS J, DE COOMAN L, PASMANS F, DUCATELLE R, HAESEBOUCK F. Case report:infection in a pig veterinarian, 2013, 18(5):392-396.
[23] FALHOU B, ROSSI M, BAKKER J, LANGERMANS J A, HEUVELMAN E, SLONICK J V, MARTIN M E, O'ROURKE J, NGOAN L D, HOA N X, NAKAMURA M, ØVERBY A, MATSUI H, OTA H, MATSUMOTO T, FOSS D L, KOPTA L A, OMOTOSHO O, FRANCIOSINI M P, CASAGRANDE PROIETTI, GUO A, LIU H, BORILOVA G, BRACARENSE A P, LINDEN S K, DE BRUYCKERE S, ZHANG G, DE WITTE C, SMET A, PASMANS F, DUCATELLE R, CORANDER J, HAESEBROUCK F. Evidence for a primate origin of zoonoticcolonizing domesticated pigs., 2018, 12(1):77-86.
[24] 万红宇, 刘建生, 田怡, 莫文辉, 方青青.上海闵行地区近5年门幽门螺旋杆菌感染情况变化分析. 吉林医学, 2016, 37(12): 2912-2913.
WAN H Y, LIU J S, TIAN Y, MO W H, FANG Q Q. The change of prevalence ofinfection in Minhang district of Shanghai in recent 5 years., 2016, 37(12):2912-2913. (in Chinese)
[25] ANAND S, MANDE S S. Diet, microbiota and gut-lung connection, 2018, 9: 2147.
[26] 王艳冬. 猪螺杆菌聚合酶链反应检测方法的建立及初步应用[D].北京: 中国疾病预防控制中心, 2013.
WANG Y D, Establishment of PCR assay to detectand preliminary application[D]. Beijing: Chinese Center For Disease Control And Prevention, 2013. (in Chinese)
[27] VERMOOTE M, VANDEKERCHHOVE T T, FLAHOU B, PASMANS F, SMET A, D E GROOTE D, VAN CRIEKINGE W, DUCATELLE R, HAESEBROUCK F. Genome sequence ofsupports its role in gastric pathology, 2011, 42:51.
[28] SPOHN G, SCARLATO V. Motility, Chemotaxis, and Flagella, in:. Mobley H L T, G L. Mendz, and S.L. Hazell, Editors. Washington (DC) : ASM Press, 2001.
[29] DEBOWSKI A W, WALTON S M, CHUA E G, TAY A C, LIAO T, LAMICHHANE B, HIMBECK R, STUBBS K A, MARSHALL B J, FULURIJA A, BENGHEZAL M.gene silencingdemonstrates urease is essential for chronic infection, 2017, 13(6): e1006464.
[30] SCHOEP T D, FULURIJA A, GOOD F, LU W, HIMECK R P, SCHWAN C, CHOI S S, MITTL P R, BENGHEZAL M, MARSHALL B J. Surface Properties ofurease complex are essential for persistence, 2010, 5(11): e15042.
[31] ZHANG G, DUCATELLE R, MIHI B, SMET A, FLAHOU B, HAESEBROUCK F.affects the health and function of porcine gastric parietal cells2016, 47(1): 101.
[32] MAHDAVI J, SONDEN B, HURTIG M, ET A L.SabA adhesin in persistent infection and chronic inflammation, 2002, 297(5581):573-578.
[33] ZHANG M J, ZHAO F, XIAO D, GU Y X, MENG F L, HE L H, ZHANG J Z. Comparative proteomic analysis of passaged, 2009, 49(5): 482-490.
[34] ODENBREIT S, Adherence properties of: Impact on pathogenesis and adaptation to the host.2005, 295(5):317-324.
[35] PADRA M, ADAMCZYK B, BENKTANDER J, FLAHOU B, SKOOG E C, PADRA J T SMET A, JIN C, DUCATELLE R, SAMUELSSON T, HAESEBROUCK F, KARLSSONN G, TENEBERG S, LINDEN S K.binding to carbohydrates on human and porcine gastric mucins and glycolipids occurs via two modes, 2018, 9(1): 898-918.
[36] WANG G, MAIER R J. An NADPH quinone reductase ofplays an important role in oxidative stress resistance and host colonization2004, 72(3): 1391-1396.
[37] SALAMA N R, HARUNG M L, MULLER A. Life in the human stomach: persistence strategies of the bacterial pathogen.2013, 11(6): 385-399.
[38] ZHANG G, DUCATELLE R, FASMANS F, D'HERDE K, HUANG L, SMET A, HAESEBROUCK F, FLAHOU B. Effects ofgamma-glutamyl transpeptidase on lymphocytes: modulation by glutamine and glutathione supplementation and outer membrane vesicles as a putative delivery route of the enzyme, 2013, 8(10): e77966.
[39] FLAHOU B, HAESEBROUCK F, CHIERS K, VAN DEUN K, DE SMET L, DEVREEESE B, VANDENBERGHE I, FAVOREEL H, SMET A, PASMANS F, D'GERDE K, DUCATELLE R. Gastric epithelial cell death caused byandgamma-glutamyl transpeptidase is mainly glutathione degradation-dependent2011, 13(12): 1933-1955.
[40] YOKOYAMA H, [Gamma glutamyl transpeptidase (gammaGTP) in the era of metabolic syndrome], 2007, 42(3):110-124.
[41] CORTI A, FRANZINI M, PAOLICHI A, POMPELLA A. Gamma- glutamyltransferase of cancer cells at the crossroads of tumor progression, drug resistance and drug targeting, 2010, 30(4):1169-1181.
[42] ROSSI M, BOLZ C, REVEZ J, JAVED S, EI-NAJJAR N, ANDERL F, HYYTIANEN H, VUORELA P, GERARD M, HANNINEN M L. Evidence for conserved function of gamma-glutamyltranspeptidase ingenus, 2012, 7(2): e30543.
[43] ROSSI M, BOLZ C, REVEZ J, JAVED S, EI-NAJJAR N, ANDERL F, HYYTIANEN H, VUORELA P, GERARD M, HANNINEN M L. Gamma-glutamyltranspeptidase expression by, an enterohepaticspecies isolated from cotton top tamarins with chronic colitis., 2019, 21(3): e12968.
[44] WUSTNER S, MEJIAS-LUGUE R, KOCH M F, RATH E, VIETH M, SIEBER S A, HALLER D, GARHARD M.gamma-glutamyltranspeptidase impairs T-lymphocyte function by compromising metabolic adaption through inhibition of cMyc and IRF4 expression2015, 17(1):51-61.
[45] WORBS T, HAMMERSCHMIDT S I, FORSTER R. Dendritic cell migration in health and disease, 2017, 17(1): 30-48.
[46] DE WITTE C, TAMINIAU B, FLAHOU B, HAUTEKIET V, DAUBE G, DUCATELLE R, HAESEBROUCK F. In-feed bambermycin medication induces anti-inflammatory effects and prevents parietal cell loss without influencingcolonization in the stomach of mice, 2018, 49(1): 35.
[47] FLAHOU B, HAESEBROUCK F, PASMANS F, D'HERDE K, DRIESSEN A, VAN DEUN K, SMET A, DUCHATEAU L, CHIERS K, DUCATELLE R.causes severe gastric pathology in mouse and mongolian gerbil models of human gastric disease., 2010, 5(11):e14083.
[48] ZHANG G, DUCATELLE R, DE BRUYNE E, JOSSEN M, BOSSCHEM M, SMET A, HAESEBROUCK F, FLAHOU B. Role of gamma-glutamyltranspeptidase in the pathogenesis ofandinfections, 2015, 46:31. doi.org/10.1186/s13567-015-0163-6.
[49] ZHANG G, DUCATELLE R, PASMANS F, D'HERDE K, HUANG L, SMET A, HAESEBROUCK F. FLAHOU B. effects ofgamma-glutamyl transpeptidase on lymphocytes: modulation by glutamine and glutathione supplementation and outer membrane vesicles as a putative delivery route of the enzyme, 2013, 8(10): e77966.
[50] REEDS P J, BURRIN D G. Glutamine and the bowel., 2001, 131(Suppl.9): 2505-2508.
[51] LIAN G, GNANAPRAKASAM J R, WANT T, WU R, CHEN X, LIU L, SHEN Y, YANG M, YANG J, CHEN Y, VASILIOU V, CASSEL T A, GREEN D R, LIU Y, FAN T W, WANG R. Glutathione de novo synthesis but not recycling process coordinates with glutamine catabolism to control redox homeostasis and directs murine T cell differentiation, 2018, 7: e36158.
[52] RHOADS J M, ARGENZIO R A, CHEN W, RIPPE R A, WESTWICH J K, COX A D, BERSCHNEIDER H M, BRENNER D A. L-glutamine stimulates intestinal cell proliferation and activates mitogen-activated protein kinases., 1997, 272(5 Pt 1):G943-G953.
[53] ZHANG X, LI S, LUO Y, CHEN Y, CHENG S, ZHANG G, HU C, CHEN H, GUO A.and BCG induce different patterns of cytokine and chemokine production in dendritic cells and differentiation patterns in CD4+T cells-Sgm, 2013, 159: 366-379.
[54] BOSSCHEM I, FLAHOU B, VAN DEUN K, DE KOKER S, VOLF J, SMET A, DUCATELLE R, DEVRIENDT B, HAESEBROUCK F.Species-specific immunity to, 2017, 22(3). doi: 10.1111/hel.12375.
[55] YANG L, YAMAMOTO K, NISHIUMI S, NAKAMURA M, MATSUI H, TAKAHASHI S, DOHI T, OKADA T, KAKIMOTO K, HOSHI N, YOSHIDA M, AZUMA T. Interferon-gamma-producing B cells induce the formation of gastric lymphoid follicles afterinfection, 2015, 8(2): 279-295.
[56] YAMAMOTO K, NISHIUMI S, YANG L, KLIMATCHEVA E, PANDINA T, TAKAHASHI S, MATSUI H, MATSUI H, NAKAMURA M, ZAUDERER M, YOSHIDA M, ZAUMA T. Anti-CXCL13 antibody can inhibit the formation of gastric lymphoid follicles induced byinfection2014, 7(5):1244-1254.
[57] BOSSCHEM I, FLAHOU B, BAKKER J, HEUVELMAN E, LANGERMANS J A, DE BRUYNE E, JOOSTEN M, SMET A, DUCATELLE R, HAESEBROUCK F. Comparative virulence of-cultured primate- and pig-associatedstrains in a BALB/c mouse and a Mongolian gerbil model., 2017, 22(2). doi: 10.1111/hel.12349.
[58] YANG L, TIAN Z B, YU Y N, ZHANG C P, LI X Y, MAO T, JING X, ZHAO W J, DING X L, YANG R M, ZHANG S Q. Saccharomyces boulardii administration can inhibit the formation of gastric lymphoid follicles induced byinfection., 2017, 75(1). doi: 10.1093/femspd/ftx006.
[59] 孔玲玲, 田字彬, 杨林, 张翠萍, 于亚男, 杨若明, 刘亚倩, 张帅庆. 白细胞介素-22在猪螺杆菌感染的肥胖小鼠胃黏膜相关淋巴组织中的表达及意义. 胃肠病学和肝病学杂志, 2018, 27(2): 195-198.
KONG L L, TIAN Z B, YANG L, ZHANG C P, YU Y N, YANG R M, LIU Y Q, ZHANG S Q. Expression and significance of IL-22 in the gastric mucosa associated lymphoid tissue ofinfected obese mice., 2018, 27(2):195-198. (in Chinese)
[60] DE WITTE C, DEMEYERE K, DE BRUYCKERS S, TAMINIAU B, DAUBE G, DUCATELLER, HAESEBROUCK F. Characterization of the non-glandular gastric region microbiota in- infected versus non-infected pigs identifies a potential role forin gastric ulceration.2019, 50(1):39.
The Zoonotic Bacterium-and Its Research Progress
ZHANG GuangZhi1,2, WANG MingYan1,2, LUO Yi3, XU ShiHang3, HE Shundong4, CUI ShangJin1,2
(1Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193;2Scientific Observation and Experiment Station of Veterinary Drugs and Diagnostic Technology of Beijing, Ministry of Agriculture, Beijing 100193;3Center for Animal Disease Control and Prevention, Shenyang 110034;4Market Supervision Service and Administrative Law Enforcement Center, Shenhe District, Shenyang 110161)
(), a Gram negative bacterium, has a typical spiral-shaped morphology and it is highly motile by means of 4-10 flagella at both ends of the cells.is a vital zoonotic pathogen, and is identified and only recently isolated successfullyby Belgian scientists. Different fromwhich mainly colonizes the human stomach,colonizes the majority of the porcine stomach, and infection rate in pigs at slaughter age can reach 60%-95%, causing gastritis, gastric disorders and decreased weight gain. More importantly,also infects a minority of human, leading to diverse gastric disorders, gastric diseases even gastric cancer (Mucosa-associated lymphoid tissue lymphoma). Although vigorous innate and adaptive immune response in hosts are induced byinfection,has evolved series of virulence factors to evade the host immune surveillance to persistently colonize the host stomach, resulting in disruption of gastric homeostasisinduction of chronic inflammation and gastric cancer. Currently scientists are not aware of the transmission route of this bacterium, and pork and related products, saliva and faeces are the most possible carriers for transmission. Pigs, mice and Mongolian gerbils are common animal models to study the pathogenesis ofinfection. Althoughhas substantial effects on porcine health, production performance and welfare as well as human health, there is very limited research onin China due to the difficulties in bacterial isolation and culture, and research onin China mainly focus on bacterial detection in clinical samples.needs microaerobic conditions (85%N2,10%CO2and 5%O2) forculture. So far there is very limited information about the pathogenesis ofinfection in hosts. Through analyses withgenome and known discoveries, it can be speculated thatmay interfere with or evade host defense responses via several mechanisms: high mobility of flagella and acid neutralization, considerable adhesion ability to the gastric epithelial surface, detoxification ability of oxidative stress,induction of cell death and of immune regulation. Combined with the authors’ several years’ research experience inand available literature, this review summaries and extensively discusses several aspects ofin terms of research historybacterial features and culture conditionsprevalence statuspathogenesis and current research progress in China and abroad, aiming at enhancing our understanding ofand its pathogenicity as well as providing reference and directions for the future prevention and control of this bacterium.
; zoonotic pathogen; gastric diseases; virulence factors; pathogenesis
2019-04-11;
2019-09-11
国家自然科学基金(31873019)、中国农业科学院创新工程计划(ASTIP-IAS15)
张广智,E-mail:zgz_126com@126.com,通信作者崔尚金,E-mail:Cuishangjin@caas.cn
(责任编辑 林鉴非)
