广玉兰树叶中温发酵产沼气潜力的试验研究
2020-04-10施彦岑衡圆圆
曾 锦,孙 蓉,施彦岑,徐 锐,贺 俊,衡圆圆,郑 昊
(云南师范大学 能源与环境科学学院,云南 昆明 650500)
广玉兰,又名百花果、洋玉兰、荷花玉兰等,是木兰科木兰属植物。它四季常青,树形优美,花大而香,具有很好的观赏价值,常作为行道树绿化道路,目前广泛种植于长江以南及长江流域[1]。其花、叶可提取香料,也具有一定的药用价值。
广玉兰落叶作为城市中常见的园林废弃物之一,不仅涉及范围较广而且数量较大,因此如何能够有效地利用处理它们值得深入思考和研究。何开跃等[2]对广玉兰叶片的抗氧化活性做出了评价,测定其叶片成分主要含有黄酮类化合物和酚类化合物。金玉兰等[3]测定广玉兰叶的乙醇提取物和各萃取部分对植物病原真菌的抑菌活性,以期能够开发一种新的植物源农药杀菌剂。曹艳晓等[4]将广玉兰落叶用于生活污水的反硝化处理,作为反硝化的外加碳源。关于广玉兰叶的利用方式多种多样,然而目前尚未见有以广玉兰叶作为原料进行沼气发酵的相关研究报道,具体产气情况尚不清楚。因此,笔者以掉落的广玉兰叶为原料进行厌氧消化产沼气试验,旨在探讨其产气潜力和产气规律,为广玉兰叶厌氧消化产沼气应用提供参考。
1 材料与方法
1.1 材料
1.1.1 发酵原料
发酵原料采用云南师范大学呈贡主校区掉落的广玉兰叶,经测定广玉兰叶TS(总固体含量)为80.92%,VS(挥发性固体含量)为78.50%。
1.1.2 接种物
接种物为实验室长期驯化的猪粪厌氧消化活化污泥,经测定,其TS为14.32%,VS为60.35%,pH为7.0。
1.1.3 试验设备
采用实验室自制的容积为500 mL的批量式发酵装置,该试验装置由500 mL的发酵瓶、1000 mL的集气瓶、1000 mL的计量瓶以及温控系统组成。广玉兰叶发酵的实验装置如图1所示。
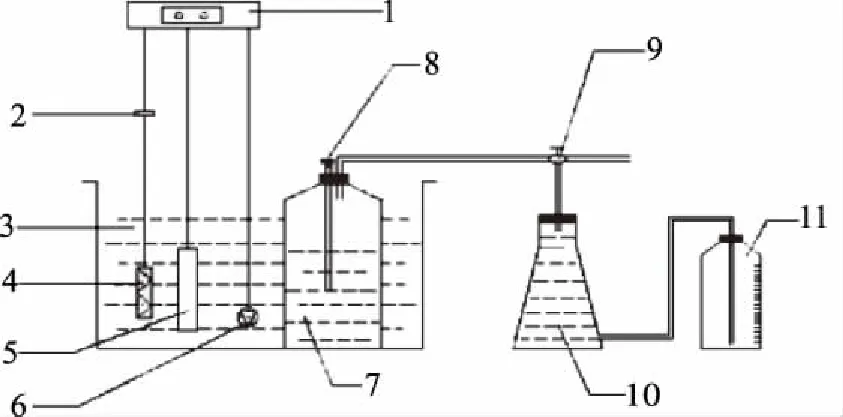
图1 实验装置Fig.1 Experimental equipment1.温控仪; 2.交流接触器; 3.水槽; 4.电热管; 5.热电偶; 6.循环水泵; 7.发酵瓶; 8.取样口; 9.玻璃三通; 10.集气瓶; 11.计量瓶。1.Temperature controller; 2.AC contactor; 3.Water channel; 4.Heating element; 5.Thermocouple; 6.Circulating water pump; 7.Fermentation bottle; 8.Sampling hole; 9.Three links of glass; 10.Gas collecting bottle; 11.Gas collecting bottle.
1.2 试验方法
1.2.1 预处理
广玉兰叶切成1~5 cm的条状;利用粉碎机(CS-700)将广玉兰叶碎成粉状,使其能够与接种物充分混合均匀。
1.2.2 试验设计
(1)发酵系统料液的配比。本试验由4个试验组和1个对照组构成,每组均重复设置三个平行试验,料液配法如下:
试验组A1:接种率为30%的接种物120.00 g,条状玉兰叶3.48 g,加水至400 mL,总发酵浓度控制在5%左右。
试验组A2:接种率为30%的接种物120.00 g,粉状玉兰叶3.48 g,加水至400 mL,总发酵浓度控制在5%左右。
试验组B1:接种率为30%的接种物120.00 g,条状玉兰叶15.48 g,加水至400 mL,总发酵浓度控制在7.4%左右。
试验组B2:接种率为30%的接种物120.00 g,粉状玉兰叶15.48 g,加水至400 mL,总发酵浓度控制在7.4%左右。
对照组:接种率为30%的接种物120.00 g,加水至400 mL。
(2)试验过程中,通过运用智能数显温控仪(C3W-221)确保中温沼气发酵环境的正常运行,使发酵温度维持在(30±0.2)℃。
(3)试验启动后,每日定点记录各套装置的产气量,每隔2~4 d
利用气相色谱仪(GC9790II)测一次甲烷含量。
1.2.3 分析方法
(1)pH测定:采用5.7~8.5精密pH试纸测定pH。
(2)TS、VS测定:按常规方法分别用烘箱和马弗炉进行测定[5]。
(3)产气量测定:采用排水集气法收集气体并测定产气量,试验启动以后,每天同一时间(20: 00)记录各组的产气量,通过计算各组平行试验的平均产气量来最终确定发酵过程中每天的产气量。
(4)甲烷含量测定:采用实验室GC9790II气相色谱仪测定气体的甲烷含量。
2 结果与分析
2.1 产气情况分析
2.1.1 日产气量
试验启动后,每天定时记录产气情况,以试验组每天的净产气量数据得到广玉兰叶沼气发酵时间和产气量的规律。试验组日产气量变化曲线如图2所示。
由图2可知,广玉兰叶发酵试验启动较快,第1~5 d产气较多。试验组第1 d产生的气体均无法点燃,说明甲烷含量较低,这可能是因为试验启动阶段广玉兰叶被水解产生大量的CO2未及时被产甲烷菌消化利用[6];对试验组第2 d产生的气体进行点火试验,均出现明亮的淡蓝色火焰,初步判定甲烷含量在40%以上[7];试验组A1和A2的第一产气高峰均出现在第2 d,产气量分别为108 mL、134 mL,试验组B1和B2的第一产气高峰均出现在第3 d,产气量分别为310 mL、378 mL;试验组在发酵过程中均出现了多个产气高峰,可能是因为试验组在第一阶段产气的同时,不断产生有机酸,微生物菌群因pH值降低而抑制了它们活动,从而产气下降,以后随着氨化作用产生缓冲剂氨,pH值上升,恢复了产甲烷菌活性,出现第二阶段产气[8];试验组A1的产气次高峰出现在第4 d,试验组A2的产气次高峰出现在第7 d,试验组B1的产气次高峰出现在第16 d,试验组B2的产气次高峰出现在第15 d,随着发酵浓度提升,产气次高峰出现的时间出现了延迟,这可能是因为随着发酵原料量增加,原料水解阶段产生了大量有机酸,无法在短时间内被有限的产氢产乙酸菌消纳[9]。

图2 日产气量曲线图Fig.2 Daily gas production graph
对对照组产生的气体进行点火试验,结果在整个发酵过程中均不能点燃,所以初步判断对照组中的甲烷含量均在40%以下。由图3可知,试验组A1在发酵的第4 d,甲烷含量几乎达到整个发酵过程中的峰值,为54.40%;试验组A2在发酵的第4 d,甲烷含量几乎达到整个发酵过程中的峰值,为51.02%;试验组B1在发酵的第4 d,甲烷含量几乎达到整个发酵过程中的峰值,为53.88%;试验组B2在发酵的第4 d,甲烷含量几乎达到整个发酵过程中的峰值,为50.29%;5%发酵浓度的试验组A1和A2发酵稳定后甲烷含量起伏较大,但甲烷含量相对较高;7.4%发酵浓度的试验组B1和B2发酵稳定后甲烷含量变化相对稳定,但甲烷含量相对较低;在发酵末期,由于发酵底物即将消耗殆尽,甲烷的含量逐渐降低直至反应结束。
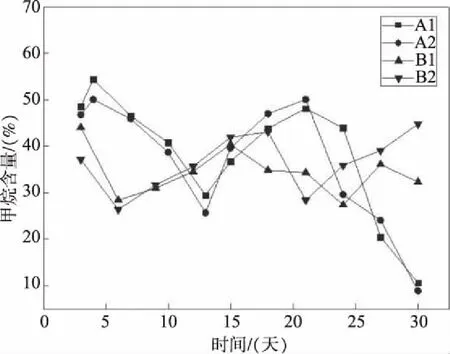
图3 甲烷含量曲线图Fig.3 Methane content graph
2.1.2 累积产气量和产气速率
统计本次试验组累计产气量,详见表1。
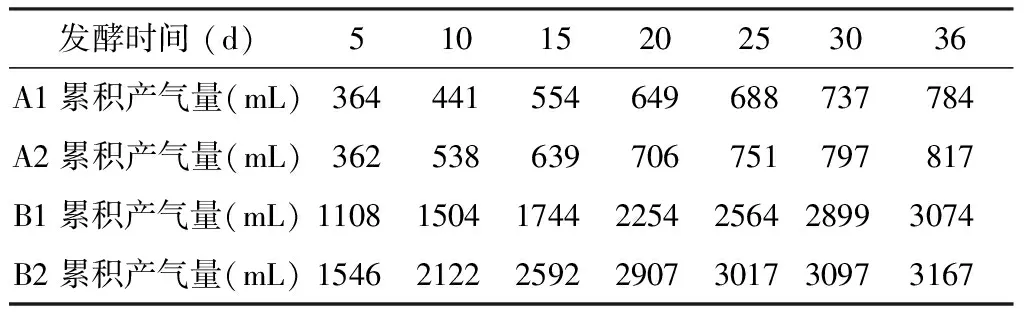
表1 广玉兰叶累积产气量
由表2可知,在整个广玉兰叶发酵过程中,经粉碎处理后的试验组A2和B2的累计产气量分别略高于未经粉碎处理的试验组A1和B1,最终的累积产气量分别提高了4.21%和3.03%;试验组A1、A2、B1、B2在第1~5 d产气量增速较快,分别达364 mL、362 mL、1108 mL、1546 mL;第6~10 d、11~15d 产气量的增加幅度相差不大;试验组A1、A2第21~25 d、26~30 d、31~36 d产气量增加的幅度不明显,试验组B1第31~36 d产气量增加的幅度不明显,试验组B2第26~30 d、31~36 d产气量增加的幅度不明显,这主要是因为到了发酵后期,可被降解的有机质含量逐渐减少,无法提供产甲烷菌生长繁殖所需营养,因此菌种活性有所降低,进而导致其发酵后期的产气量比前期少[10-11]。由上述规律可知,试验组A1、A2发酵产沼气主要集中在前20 d,试验组B1发酵产沼气主要集中在前30 d,试验组B2发酵产沼气主要集中在前25 d,所有试验组产气较快阶段主要集中在第1~5 d。
关于累积产气量的变化规律,依据发酵时间和累积产气量,由累积产气量占总产气量的比例,得到广玉兰叶沼气发酵的累积产气速率,详见图4。

图4 产气速率Fig.4 Gas production rate
由图4分析可知:在广玉兰叶整个发酵过程中,产气速率是先增加,后逐渐趋于平缓的;在前20 d累积产气速率总体呈上升趋势,特别是第1~5 d曲线最为陡峭。试验组A1、A2在广玉兰叶发酵的第20 d,累积产气量已达总产气量80%以上;试验组B1在广玉兰叶发酵第25 d,累积产气量已达总产气量的80%以上;试验组B2在广玉兰叶发酵第15 d,累积产气量已达总产气量80%以上,可以得出广玉兰叶在厌氧消化产沼气的过程中主要集中在前20~25 d产气。同时由图4可知,试验组B2的累积产气速率>试验组A2的累积产气速率>试验组A1的累积产气速率>试验组B1的累积产气速率,试验组B2的产气速率最快。
2.2 产气潜力分析
结合广玉兰叶的TS、VS 等值对其厌氧消化产沼气潜力进行计算,结果见表2。
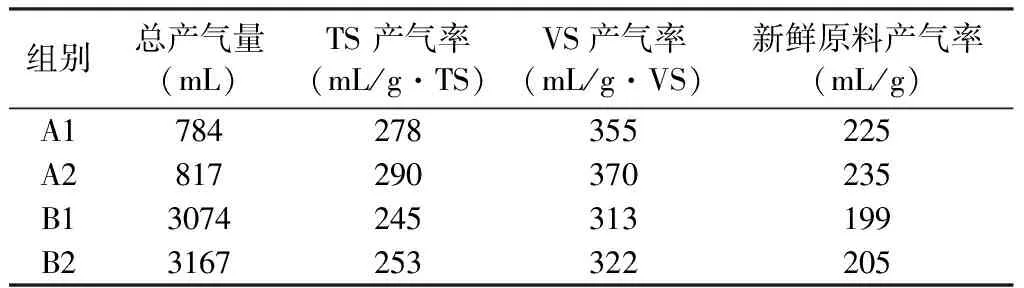
表2 广玉兰叶沼气发酵的产气潜力
由表2可知,5%发酵浓度的试验组(A1、A2)的产气率均高于7.4%发酵浓度的试验组(B1、B2);经粉碎处理后的试验组(A2、B2)的产气率分别略高于相应发酵浓度未经粉碎处理的试验组(A1、B1)。试验组A2的TS产气率、VS产气率是最高的,分别为290 mL/g·TS、370 mL/g·VS。因此我们也可以知道试验组A2的发酵条件更能激发广玉兰叶的产气潜力。
为更加客观地评价广玉兰叶的产气潜力,将其与其他植物叶子的产沼气潜力进行对比,结果如表3所示。

表3 不同植物叶的产气潜力
由表3可知,广玉兰叶的TS产气率为267 mL/g·TS(平均值),仅低于银杏叶,但其发酵时间比银杏叶短。因为各种植物叶子含有丰富的纤维素和半纤维素,糖类和淀粉含量较低,所以它们的TS产气率普遍较低。通过精密pH试纸测量,广玉兰叶的发酵体系pH值始终维持在沼气发酵微生物最适宜的pH值范围内(pH为6.5~7.5)[5],在整个发酵过程中未出现酸化现象,无需其他物质来调节,可见其具有很强的自我调节能力。因此利用废弃的广玉兰叶进行厌氧消化产沼气是一种可行方式,利用率较高。
3 讨论与结论
以废弃广玉兰叶为发酵原料,在中温(30±0.2℃)进行批量式沼气发酵试验,经粉碎处理后的试验组A2和B2相比于未经粉碎处理的试验组A1和B1,TS产气率分别提高了4.32%和3.27%,这是因为机械粉碎破坏了发酵原料的细胞壁结构,易于微生物菌群侵入和分解发酵原料,同时粉碎后的原料能与接种物均匀接触,致使沼气发酵更加充分[16],但在以广玉兰叶为发酵原料的实际工艺中需要考虑预处理的成本费用;7.4%发酵浓度下的试验组B1和B2相比于5%发酵浓度下的试验组A1和A2,TS产气率分别下降了11.87%和12.76%,说明增加含固率可能会降低物料的分解转化效率[17-18],因为产酸菌活性会随着发酵浓度提高而提高[19],而过多的产酸菌抑制了产甲烷菌的活性[20]。
本研究发现,广玉兰叶在厌氧消化产沼气的过程中主要集中在前20~25 d产气,经粉碎处理后的广玉兰叶在7.4%发酵浓度下产气速率最快,在5%的发酵浓度下发酵效果最好。因此,在以广玉兰叶为发酵原料的实际工艺中,可以根据工艺的需求不同选择合适的沼气发酵浓度,而沼气工程的水力滞留时间(HRT)可设计为20~25 d,这在一定程度上可以减少资金投入,缩短投资回收期。
通过与表3中同类原料的比较结果来看,废弃的广玉兰叶是一种较好的沼气发酵原料。该研究为广玉兰落叶的资源化利用途径提供了新的参考,而以新鲜的广玉兰叶为原料进行沼气发酵有待进一步研究。
