中缝核miR-16与5-羟色胺转运体在失眠模型大鼠中的表达
2020-04-09方芳罗伏钢宋明芬李静刘文娟胡霖霖李梅张永华邵琼琰
方芳 罗伏钢 宋明芬 李静 刘文娟 胡霖霖 李梅 张永华 邵琼琰

[摘要] 目的 研究中縫核miR-16以及5-羟色胺转运体(serotonin transporter,SERT)的表达在失眠症发病机制中的作用。 方法 20只雌性SD大鼠,随机分成对照组和失眠组。失眠组大鼠接受腹腔注射对氯苯丙氨酸(p-chlorophenalanine,PCPA)350 mg/(kg·d),连续3 d,对照组给予等量生理盐水。取中缝核组织,测定其miR-16、SERT mRNA与SERT蛋白水平,进行注射前后的组间比较。 结果 失眠组大鼠中缝核miR-16相对水平(1.23±0.33)与对照组(0.71±0.25)比较明显升高,差异具有统计学意义(t=6.68,P=0.000);而失眠组SERT mRNA相对水平(0.68±0.14)以及SERT蛋白相对水平(0.28±0.11)显著低于相应的对照组(1.06±0.30,0.57±0.15)(t=3.94,P=0.004;t=4.69,P=0.002)。 结论 中缝核miR-16以及SERT的异常表达,可能参与了失眠症的发病机制。
[关键词] 失眠;miR-16;5-羟色胺转运体;中缝核
[中图分类号] R74 [文献标识码] A [文章编号] 1673-9701(2020)02-0034-04
Expression of raphe nuclei miR-16 and serotonin transporter in insomnia model rats
FANG Fang1 LUO Fugang2 SONG Mingfen3 LI Jing3 LIU Wenjuan4 HU Linlin4 LI Mei4 ZHANG Yonghua4 SHAO Qiongyan5
1.Emergency Room, Hangzhou Seventh People's Hospital, Hangzhou 310013, China; 2.Department of Geriatrics, Hangzhou Seventh People's Hospital, Hangzhou 310013, China; 3.Molecular Biology Laboratory, Hangzhou Seventh People's Hospital, Hangzhou 310013, China; 4.Department of Psychophysiology, Hangzhou Seventh People's Hospital, Hangzhou 310013, China; 5.Third Clinical College, Zhejiang University of Traditional Chinese Medicine, Hangzhou 310053, China
[Abstract] Objective To study the role of raphe nuclei miR-16 and serotonin transporter(SERT) expression in the pathogenesis of insomnia. Methods Twenty female Sprague-Dawley rats were randomly divided into control group and insomnia group. Rats in the insomnia group received intraperitoneal injection of p-chlorophenalanine(PCPA) 350 mg/(kg·d) for 3 days, and the control group was given the same amount of saline. The raphe nuclei tissue was taken and the levels of miR-16, SERT mRNA and SERT protein were measured, and the comparison between groups before and after injection was performed. Results The relative level of miR-16 in the raphe nuclei(1.23±0.33) of the insomnia group was significantly higher than that in the control group(0.71±0.25). The difference was statistically significant(t=6.68, P=0.000). The relative levels of SERT mRNA (0.68±0.14) and SERT protein (0.28±0.11) in insomnia group were significantly lower than those(1.06±0.30, 0.57±0.15) of the corresponding control group(t=3.94, P=0.004; t=4.69, P=0.002). Conclusion Abnormal expression of miR-16 and SERT in the raphe nuclei may be involved in the pathogenesis of insomnia.
[Key words] Insomnia; miR-16; Serotonin transporter; Raphe
当今社会失眠发病率不断攀升,据报道失眠的发病率高达10%[1,2],已成为危害身心健康的社会公共卫生问题[3]。但是失眠的发病机制未明。现有研究提示,失眠的发病机制与5-羟色胺(5-HT)系统功能低下有关[4,5]。5-羟色胺转运体(serotonin transporter,SERT)分布于神经突触前膜,从突触间隙中回收5-HT,起到调节突触间隙5-HT浓度的作用,决定与突触后受体结合的5-HT量和作用持续时间,在5-HT神经传递系统中起关键作用[6]。目前研究表明,SERT基因是miR-16的靶基因[7-9]。但是失眠症miR-16及其靶基因SERT的表达水平尚不清楚。本次实验建立对氯苯丙氨酸(p-chlorophenalanine,PCPA)大鼠失眠模型,检测中缝核miR-16与SERT水平,探讨miR-16及其靶基因SERT的表达在失眠症发病机制中的作用,为进一步了解失眠症的5-HT机制提供参考。
1 对象与方法
1.1 研究对象
清洁级健康雌性Sprague Dawley(SD)大鼠,购自浙江省医学科学院实验动物中心,动物合格证号:SCXK(浙)2014-0001,8周龄,体重约250 g。饲养室温度控制在(25±1)℃, 相对湿度为(55±5)%,12 h/12 h明暗交替照明,自由饮水和摄食。实验前适应性饲养1周。
1.2 方法
1.2.1 动物处理 20只SD大鼠按随机数字表法分成对照组和失眠组。大鼠失眠模型的建立参照以往的研究进行[10]。PCPA(购自美国Sigma公司),用生理盐水制成混悬液,现用现配。失眠组大鼠腹腔注射PCPA剂量为350 mg/kg,体积为10 mL/kg,1次/d,连续3 d。对照组大鼠腹腔注射等量的生理盐水。
1.2.2 大鼠一般状况观察 观察两组大鼠一般状况,包括精神状态、对应激的反应情况、毛发情况、日间与夜晚活动情况等。
1.2.3 造模成功的判断 采用戊巴比妥钠翻正实验判断。在第3次注射后36 h,两组大鼠均腹腔注射戊巴比妥钠(购自美国Sigma公司)50 mg/kg(引起所有大鼠睡眠的最小域剂量),将大鼠腹部朝上平放,以翻正反射消失为发生睡眠,以翻正反射恢复为觉醒[10],记录大鼠的睡眠潜伏期及睡眠持续时间。若大鼠白天与夜晚都频繁活动,且戊巴比妥钠翻正实验中对照与失眠组的睡眠潜伏期、睡眠持续时间比较有统计学差异,则造模成功。
1.2.4 中缝核取材 戊巴比妥钠翻正实验结束后,断头处死大鼠,剪开颅骨,分离脑组织置于冰上,从脑干中切取中缝核,-80℃冷冻待测miR-16、SERT mRNA和SERT蛋白。
1.2.5 实时荧光定量PCR法测定miR-16 通过总RNA提取试剂盒[天根生化科技(北京)有限公司]提取中缝核总RNA,用Nanodrop(美国thermo scientific公司)测定浓度和纯度;取2 μg总RNA用cDNA第一链合成试剂盒[天根生化科技(北京)有限公司]反转录成cDNA,然后进行实时定量荧光PCR扩增测定miR-16水平,miRNAs荧光定量检测试剂盒(SYBR Green)购自天根生化科技(北京)有限公司。miR-16正向引物:5'-TAGCAGCACGTAAATTGGCG-3'。反向引物从miRNAs荧光定量检测试剂盒(SYBR Green)中获得,序列未显示。PCR扩增程序为:94℃ 2min预变性;然后94℃ 20s,52℃ 30s,72℃ 30s,循環35次。荧光PCR仪购自ABI公司,型号Stepone Plus,获得Ct值,并根据内参U6计算miR-16的相对含量。
1.2.6 实时荧光定量PCR法测定中缝核SERT mRNA水平 上述获得的cDNA采用SYBR Green法测定SERT mRNA水平,荧光定量检测试剂盒(SYBR Green)购自大连TaKaRa公司,步骤按照说明书进行。使用β-actin作为内参,得出大鼠中缝核组织中SERT mRNA的相对表达水平。
1.2.7 Western blot法测定SERT蛋白 使用总蛋白提取试剂盒(碧云天生物技术公司)提取中缝核组织的总蛋白,并且通过BCA法(碧云天生物技术公司)对蛋白进行定量。SERT抗体以及辣根过氧化物酶标记的二抗均购自Santa Cruz公司。使用ChemiDocTM XRS+分子成像仪(美国Bio-rad公司)进行蛋白条带分析,并用内参β-actin校正,得出相对SERT蛋白的相对水平。
1.3 统计学处理
采用SPSS19.0统计学软件进行分析。注射前失眠组和对照组之间比较、注射后失眠组和对照组之间比较采用成组t检验;失眠组在注射前后比较、对照组在注射前后比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般状况
对照组大鼠精神状态良好,活动机灵,反应敏捷,毛发有光泽。失眠组大鼠精神亢奋,易激惹,毛发光泽较对照组差,日间与夜晚皆活动不断。
2.2 大鼠失眠模型的评定
失眠组睡眠潜伏期明显长于对照组(P<0.01),而睡眠持续时间明显短于对照组(P<0.01)。见表1。
表1 戊巴比妥钠翻正实验结果(x±s,min)
2.3 两组大鼠中缝核miR-16水平变化
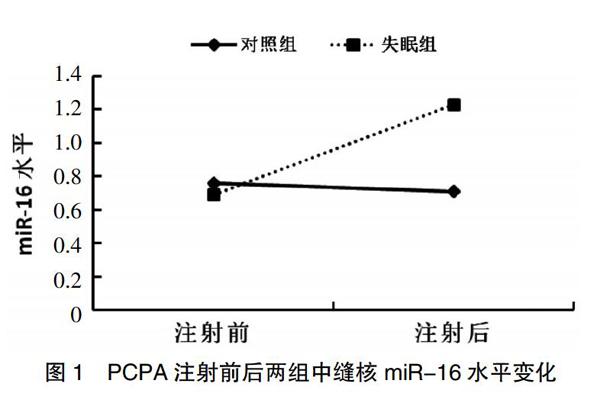
PCPA注射前,失眠组miR-16相对含量(0.69±0.17)与对照组(0.76±0.21)比较无明显差异(t=1.45,P=0.190);注射后,失眠组miR-16相对含量(1.23±0.33)明显高于对照组(0.71±0.25),差异有统计学意义(t=6.68,P=0.000)。见图1。
图1 PCPA注射前后两组中缝核miR-16水平变化
2.4 两组大鼠中缝核SERT mRNA变化
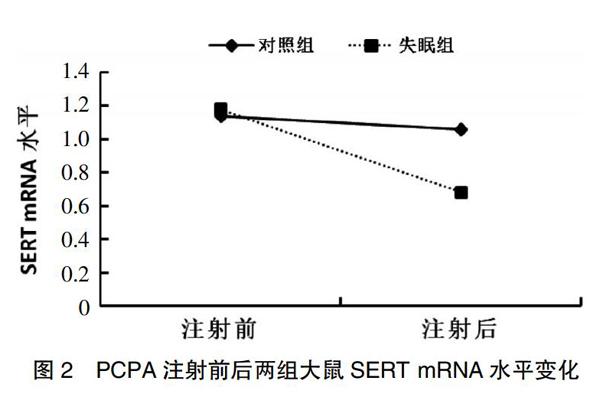
PCPA注射前,失眠组SERT mRNA相对含量(1.20±0.28)与对照组(1.14±0.36)比较,差异无统计学意义(t=0.39,P=0.700);注射后,失眠組SERT mRNA相对含量(0.68±0.14)明显低于对照组(1.06±0.30),差异有统计学意义(t=3.94,P=0.004)。见图2。
图2 PCPA注射前后两组大鼠SERT mRNA水平变化
2.5 两组大鼠中缝核SERT蛋白表达变化
PCPA注射前,失眠组SERT 蛋白相对含量(0.62±0.23)与对照组(0.51±0.15)比较无显著差异(t=1.50,P=0.170);注射后,失眠组SERT 蛋白相对含量(0.28±0.11)明显低于对照组(0.57±0.15),差异有统计学意义(t=4.69,P=0.002)。见图3。
3讨论
针对失眠症患者5-HT神经递质功能低下的特点,临床上选择性5-羟色胺再摄取抑制剂类药物(selective serotonin reuptake inhibitors,SSRIs)通常用于失眠症的治疗,且获得较好的临床疗效[11,12]。SSRIs类药物以SERT为作用靶点,通过抑制SERT对突触间隙5-HT的再回收,提高突触间隙5-HT水平,进而增强5-HT系统功能而发挥其药理学作用[13]。本次研究结果表明,失眠大鼠的SERT mRNA与SERT蛋白表达水平均显著低于对照组,提示SERT参与了失眠的发生和发展。分析SERT表达下降的原因可能为失眠大鼠的5-HT功能下降,突触间隙5-HT水平降低,使SERT反馈性低表达,以减少5-HT从突触间隙再摄取至突触前神经元内,从而增加和突触后膜上5-HT受体结合的5-HT量。
越来越多的证据表明,miRNAs在脑组织中呈特异性表达,它们可能在大脑神经可塑性以及脑功能发挥中起重要作用[14],同时,它们可能参与了诸多精神疾病如抑郁症的表观遗传学机制和药物治疗机制[15,16]。有研究指出,miRNAs可能参与调节昼夜节律,因而与失眠相关。CLOCK基因在昼夜节律调控方面发挥重要作用,miR-182对该基因的表达具有调节作用[17];另外,miR-219-1/132/183/96/182也参与了生物钟的调节[18]。Saus等[19]发现pre-miR-182的rs76481776位点T等位基因与抑郁症患者的失眠相关。在治疗方面,miR-101a被发现参与针灸治疗失眠的作用机制[20]。多项研究指出,SERT基因表达受miR-16的调节,miR-16与SERT mRNA的3非翻译区(3-untranslated region,UTR)结合,引起mRNA的降解,抑制基因翻译,从而在翻译水平调节SERT表达[21-24]。有学者对miR-16与抑郁症的关系方面进行了阐明,母爱剥夺抑郁模型大鼠海马miR-16水平明显高于对照组大鼠,且miR-16的高低与抑郁行为相关[25];抗抑郁药氟西汀能降低小鼠海马组织miR-16,如果使用人工合成的抗miR-16对miR-16进行中和,则小鼠亦表现出抑郁样行为[26]。但是,miR-16是否与失眠症相关,至今相关的报道较少。本次研究发现,miR-16在失眠模型大鼠中表达升高,提示miR-16作为SERT基因的调节因子,可能通过介导SERT基因的表达调节,发挥其在失眠症中的作用。。
本研究存在不足。(1)本次实验选用雌性大鼠作为研究对象。研究提示,失眠症存在性别差异[27],临床上失眠症患者女性多于男性,本次研究采用雌性大鼠作为研究对象,今后需对雄性大鼠进行相关研究,以明确不同性别间的差异。(2)因中缝核与5-HT系统功能密切相关,本次实验只对5-HT能神经元聚集的中缝核进行了研究,今后有待对失眠症相关的其他脑区进行研究。
总之,本次实验提示失眠模型大鼠中缝核miR-16、SERT基因表达发生异常,miR-16可能通过参与改变SERT蛋白水平,从而调节体内5-HT递质系统,参与失眠症的发病机制。
[参考文献]
[1] 王宏展,董慧. 黄连复方治疗原发性失眠研究进展[J]. 湖北中医杂志,2018,40(5): 64.
[2] 张翼,廖远高. 舍曲林联合右佐匹克隆治疗失眠伴抑郁焦虑[J]. 实用医药杂志,2018,35(3):240-242.
[3] 赵雅娟,符浩,王勇. 网络化认知行为治疗在睡眠障碍中的应用[J]. 上海交通大学学报(医学版),2018,38(5):556-560.
[4] 高岩,赵亚明,马辛. 米氮平与度洛西汀对老年抑郁症失眠者的疗效及5-HT的影响[J]. 西北药学杂志,2018, 33(2):241-244.
[5] 李勇,李恒飞. 调任通督针法联合疏肝安神汤治疗失眠的疗效及对5-羟色胺和多巴胺水平的影响[J]. 现代中西医结合杂志,2017,26(32):3561-3563,3594.
[6] 张焕,刘薇. 强迫症候选基因的研究新进展[J]. 神经疾病与精神卫生,2018,18(2): 102-108.
[7] Issler O,Chen A. Determining the role of microRNAs in psychiatric disorders[J]. Nat Rev Neurosci,2015,16(4):201-212.
[8] Farazi TA,Hoell JI,Morozov P,et al. MicroRNAs in human cancer[J]. Adv Exp Med Biol, 2013,774:1-20.
[9] Dwivedi Y. Evidence demonstrating role of microRNAs in the etiopathology of major depression[J]. J Chem Neuroanat,2011,42(2):142-156.
[10] 武静,王慧,史琴,等. PCPA失眠大鼠不同时间皮质前额叶ATP水平变化及酸枣仁汤的干预作用[J]. 重庆医学,2017,4(4):439-441.
[11] 余正和,王晟东,宋明芬,等. 帕罗西汀联合唑吡坦治疗原发性失眠的临床疗效与安全性[J]. 中国临床药理学杂志,2015,32(9):771-773.
[12] 毛洪京,徐莲莲,刘义. 艾司西酞普兰联合唑吡坦治疗原发性失眠的临床疗效和安全性评价[J]. 中国临床药理学杂志,2015,31(5):339-341.
[13] Nackenoff AG,Moussa-Tooks AB,McMeekin AM,et al. Essential contributions of serotonin transporter inhibition to the acute and chronic actions of fluoxetine and citalopram in the SERT Met172 mouse[J]. Neuropsychopharmacology,2016,41(7):1733-1741.
[14] Petri R,Malmevik J,Fasching L,et al. miRNAs in brain development[J]. Exp Cell Res, 2014,321(1):84-89.
[15] Serafini G,Pompili M,Hansen KF,et al. The involvement of microRNAs in major depression,suicidal behavior,and related disorders: a focus on miR-185 and miR-491-3p[J]. Cell Mol Neurobiol,2014,34(1):17-30.
[16] Baudry A,Mouillet-Richard S,Schneider B,et al. miR-16 targets the serotonin transporter:A new facet for adaptive responses to antidepressants[J]. Science,2010,329(5998):1537-1541.
[17] Nirvani M,Khuu C,Utheim TP,et al. Circadian rhythms and gene expression during mouse molar tooth development[J]. Acta Odontol Scand,2017,75(2):144-153.
[18] Hansen KF,Sakamoto K,Obrietan K. MicroRNAs:A potential interface between the circadian clock and human health[J]. Genome Med,2011,3(2):10.
[19] Saus E,Soria V,Escaramis G,et al. Genetic variants and abnormal processing of pre-miR-182,a circadian clock modulator,in major depression patients with late insomnia[J]. Hum Mol Genet,2010,19(20):4017-4025.
[20] Bo A,Si L,Wang Y,et al. Mechanism of Mongolian medical warm acupuncture in treating insomnia by regulating miR-101a in rats with insomnia[J]. Exp Ther Med,2017,14(1): 289-297.
[21] Moya PR,Wendland JR,Salemme J,et al. miR-15a and miR-16 regulate serotonin transporter expression in human placental and rat brain raphe cells[J]. Int J Neuropsychopharmacol,2013,16(3):621-629.
[22] Murphy DL,Moya PR. Human serotonin transporter gene(SLC6A4) variants:Their contributions to understanding pharmacogenomic and other functional GxG and GxE differences in health and disease[J]. Curr Opin Pharmacol,2011,11(1):3-10.
[23] Yang Y,Hu Z,Du X,et al. miR-16 and fluoxetine both reverse autophagic and apoptotic change in chronic unpredictable mild stress model Rats[J]. Front Neurosci,2017, 11:428.
[24] Tamarapu Parthasarathy P,Galam L,Huynh B,et al. MicroRNA 16 modulates epithelial sodium channel in human alveolar epithelial cells[J]. Biochem Biophys Res Commun,2012, 426(2):203-208.
[25] Bai M,Zhu X,Zhang Y,et al. Abnormal hippocampal BDNF and miR-16 expression Is associated with depression-like behaviors induced by stress during early life[J]. PLoS One,2012,7(10):e46921.
[26] Launay JM,Mouillet-Richard S,Baudry A,et al. Raphe-mediated signals control the hippocampal response to SRI antidepressants via miR-16[J]. Transl Psychiatry,2011, (1): e56.
[27] 張蕾,和申,余一旻,等. 原发性失眠人群特征、睡眠质量及危险因素的研究[J]. 上海交通大学学报(医学版),2016,36(5):689-694.
(收稿日期:2018-12-28)
