miR-34a通过HDAC1调控子宫内膜癌细胞增殖和凋亡的机制研究
2020-04-08何武奇罗婷娟王沂峰
何武奇,罗婷娟,王沂峰
子宫内膜癌(endometrial cancer, EC)是最常见的妇科癌症,也是女性第4大常见癌症[1]。微小RNA(microRNA, miRNA)是由20~24个核苷酸组成的非编码RNA序列,已有研究显示,有些miRNA(如miR-15a-5p、miR-137、miR-250等)与EC的发生和发展有相关性,并且miRNA还可通过靶向调节下游基因的表达参与EC的发展[2-4]。国内有研究显示,miR-34a可能与EC的临床特征有密切关系[5]。国外也有研究显示,miR-34a具有调节EC转移的作用[6]。但是关于miR-34a对EC细胞的影响及其作用机制尚不明确。组蛋白去乙酰化酶1(histone deacetylase-1, HDAC1)是一种重要的表观遗传因子,具有调节肿瘤细胞增殖、凋亡、迁移、侵袭的作用[7]。本次研究发现miR-34a对EC具有抑癌作用,并能够通过靶向HDAC1调节EC细胞的增殖和凋亡。现报告如下。
1 材料与方法
1.1实验试剂与仪器 人EC细胞系HEC-1A细胞购自ATCC细胞库(美国)。DMEM培养基、胎牛血清购自Invitrogen公司(美国)。miR-34a类似物(mimic)、HDAC1 pcDNA以及相应的阴性对照质粒由Thermo Fisher公司(美国)设计和合成。Lipofectamine 2000购自Invitrogen公司(加拿大)。荧光酶素报告试剂盒(Promega;Madison,美国)。CCK-8试剂盒购自武汉华美生物科技公司(中国)。酶标仪(ELX 800;Bio-Teck,美国)。凋亡试剂盒购自武汉华美生物科技公司(中国)。流式细胞仪(BD FACScanto Ⅱ;BD Biosciences,美国)。HDAC1、Wnt1、β-catenin抗体以及二抗购自Abcam公司(美国)。PVDF膜(Bio-Rad,美国)。PCR引物由Genewiz公司(中国)设计和合成。逆转录试剂盒和SYBR Prellix Ex Taq TM实时PCR试剂盒购自TaKaRa公司(日本)。
1.2生物信息学预测和荧光素酶报告 通过TargetScan(http://www.targetscan.org/vert_72/)预测miR-34a的靶基因和潜在结合位点。使用双荧光素酶报告验证在HEC-1A细胞中是否靶向HDAC1。首先分别将HDAC1-wt(野生型)或HDAC1-mut(突变型)以及miR-34a mimic或阴性对照质粒通过质粒转染技术转染至HEC-1A细胞中,最后使用荧光酶素报告试剂盒评估荧光素酶活性。
1.3细胞分组和转染 将HEC-1A细胞分为对照组、mimic组、mimic+HDAC1组和HDAC1组。其中mimic组、mimic+HDAC1组和HDAC1组按照分组分别通过质粒转染技术转染miR-34a mimic或(和)HDAC1 pcDNA以上调miR-34a或(和)HDAC1的水平;对照组转染等量的阴性对照质粒,转染48 h后收集细胞进行后续实验。
1.4qPCR检测miR-34a和HDAC1 mRNA表达水平 细胞在液氮的保护下裂解并收集总RNA,将RNA通过逆转录试剂盒合成cDNA。通过cDNA进行qPCR检测,95℃下2 min,95℃下15 s,60℃下25 s和72℃下60 s,共进行40个循环。以U6作为miR-34a的内参,以GAPDH作为HDAC1的内参,使用2-ΔΔCT法计算miR-34a和HDAC1 mRNA的相对表达量。
1.5CCK-8法检测细胞生长情况 将转染后的各组细胞调节至2×104/ml的密度,分别接种于96孔板中,每孔100 μl,培养48 h后加入10 μl的CCK-8试剂,37℃条件下培养2 h。然后在酶标仪上测量450 nm处的光密度(OD)以观察细胞生长情况,计算细胞活力。
1.6流式细胞术检测细胞凋亡情况 将各组细胞培养48 h后加入凋亡试剂进行标记,严格按照试剂盒说明书进行操作,然后通过流式细胞仪检测各组细胞的凋亡率。
1.7Western blot检测HDAC1、Wnt1和β-catenin蛋白表达水平 将各组细胞清洗后裂解、离心收集总蛋白并检测蛋白浓度。使用10%的SDS-PAGE凝胶电泳分离蛋白,100 V下电泳120 min。电泳后转膜至PVDF膜并在室温下用5%无脂牛奶封闭2 h。分别加入相应的一抗室温震荡2 h,然后4℃孵育过夜,加入二抗。检测蛋白条带的灰度值并计算目标蛋白质的相对表达量。

2 结果
2.1miR-34a直接靶向HDAC1 首先通过TargetScan预测了miR-34a靶向HDAC1的结合位点。见图1。然后通过双荧光素酶实验验证了同时转染miR-34a mimic和HDAC1-wt细胞的荧光素酶活性显著降低(P<0.05)。见图2。说明在HEC-1A细胞中miR-34a直接靶向HDAC1。

图1 TargetScan预测miR-34a与HDAC1的潜在结合位点
HDAC1为组蛋白去乙酰化酶1
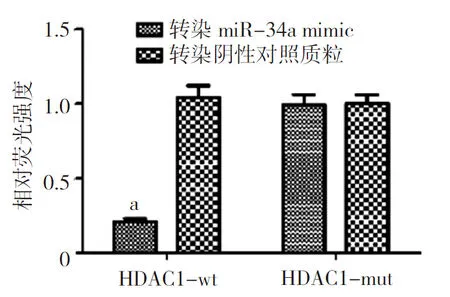
图2 miR-34a靶向HDAC1的荧光素酶报告实验结果
HDAC1为组蛋白去乙酰化酶1;与HDAC1-mut比较,aP<0.05
2.2miR-34a以及HDAC1 mRNA和蛋白的表达水平比较 与对照组比较,mimic组和mimic+HDAC1组的miR-34a表达水平显著升高,HDAC1组的HDAC1 mRNA和蛋白表达水平也显著升高(P<0.05),提示转染实验成功。此外,mimic组的HDAC1 mRNA和蛋白表达水平显著低于对照组(P<0.05)。mimic+HDAC1组的HDAC1 mRNA和蛋白表达水平显著高于mimic组(P<0.05)。说明miR-34a可以靶向抑制HDAC1的表达,并且过表达HDAC1可逆转miR-34a对HDAC1的抑制作用。见表1和图3。

表1 4组HEC-1A细胞miR-34a以及HDAC1 mRNA和蛋白的相对表达水平比较
注:对照组转染阴性对照质粒,mimic组转染miR-34a mimic,mimic+HDAC1组转染miR-34a mimic和HDAC1 pcDNA,HDAC1组转染HDAC1 pcDNA;HDAC1为组蛋白去乙酰化酶1;与对照组比较,aP<0.05;与mimic组比较,cP<0.05
2.3细胞活力和凋亡率比较 与对照组比较,mimic组的细胞活力显著降低,而凋亡率显著升高(P<0.05)。此外,HDAC1组的细胞活力显著高于对照组,而凋亡率显著低于对照组(P<0.05)。并且mimic+HDAC1组的细胞活力显著高于mimic组,而凋亡率显著低于mimic组(P<0.05)。见表2。

图3 4组HEC-1A细胞中HDAC1蛋白的表达水平
对照组转染阴性对照质粒,mimic组转染miR-34a mimic,mimic+HDAC1组转染miR-34a mimic和HDAC1 pcDNA,HDAC1组转染HDAC1 pcDNA;HDAC1为组蛋白去乙酰化酶1
表2 4组HEC-1A细胞的细胞活力和凋亡率比较
注:对照组转染阴性对照质粒,mimic组转染miR-34a mimic,mimic+HDAC1组转染miR-34a mimic和HDAC1 pcDNA,HDAC1组转染HDAC1 pcDNA;HDAC1为组蛋白去乙酰化酶1;与对照组比较,aP<0.05;与mimic组比较,cP<0.05
2.4Wnt1和β-catenin蛋白表达水平比较 与对照组比较,mimic组的Wnt1和β-catenin蛋白表达水平显著下调(P<0.05)。HDAC1组的Wnt1和β-catenin蛋白表达水平显著高于对照组(P<0.05)。并且mimic+HDAC1组的Wnt1和β-catenin蛋白表达水平显著高于mimic组(P<0.05)。见表3。

表3 4组HEC-1A细胞的Wnt1和β-catenin蛋白表达水平比较
注:对照组转染阴性对照质粒,mimic组转染miR-34a mimic,mimic+HDAC1组转染miR-34a mimic和HDAC1 pcDNA,HDAC1组转染HDAC1 pcDNA;HDAC1为组蛋白去乙酰化酶1;与对照组比较,aP<0.05;与mimic组比较,cP<0.05
3 讨论
尽管超过70%的EC患者可以在早期得到诊断,但仍有多达28%的患者出现局部或远处转移。不幸的是EC的预后通常很差,5年生存率小于40%。目前,我国EC患者的发病率呈上升趋势,虽然大多数EC能够早期诊断,并且通过外科手术进行管理获得良好临床结果,但由于缺乏对晚期、复发或转移EC的有效治疗手段,仍有许多病例预后不良[8]。因此,开发新的EC治疗策略至关重要,而明确EC发生的分子机制则有助于开发新的EC治疗靶点。
miR-34a是近年来新发现的一种与肿瘤发生和发展密切相关的miRNA,过往有研究显示,miR-34a可以作为诊断和治疗卵巢癌的生物标志物[9]。Tian等[10]的研究发现,肝细胞癌患者血清中miR-34a显著降低,并且与肝细胞癌的临床表型和预后有关,可作为诊断肝细胞癌的标志因子。国内最新研究显示,miR-34a在EC患者中显著下调,并且低水平的miR-34a预示着EC的恶性表型,提示miR-34a在EC发生和发展过程中的重要作用。本次研究结果显示,过表达miR-34a会显著抑制EC细胞的生长并促进EC细胞的凋亡,这与国外的相关研究结果一致,该研究显示miR-34a可以抑制EC的增殖和侵袭[11]。这提示miR-34a可以抑制EC细胞的增殖并促进其凋亡,发挥着显著的抑癌作用。
为进一步分析miR-34a调节EC细胞增殖和凋亡的机制,本研究验证了在HEC-1A细胞中miR-34a能够靶向调节HDAC1的表达。HDAC1是一种重要的表观遗传因子,可拮抗组蛋白和非组蛋白的乙酰化状态,与癌症的发展和进展密切相关。HDAC1已被证实在许多癌症中过表达,包括乳腺癌、肺癌、结肠癌等,HDAC1可作为预测病情和预后的标志因子[12-14]。Stojanovic等[15]研究发现,HDAC1可通过调节p53的表达促进胰腺癌的进展。国内也有研究显示,HDAC1具有调节细胞凋亡的作用[16]。还有研究发现,干扰HDAC1后还会增强癌细胞的化疗敏感性[17]。本文进一步的研究结果显示,过表达HDAC1可显著促进EC细胞的增殖,并抑制其凋亡,还能逆转miR-34a抑制EC细胞增殖和促进凋亡的作用。此外,也有研究显示miR-761可通过靶向HDAC1的水平抑制结直肠癌的增殖和侵袭[18]。这提示miR-34a可通过靶向抑制HDAC1的水平,从而抑制EC细胞增殖并促进其凋亡。有相关研究已经证实,Wnt/β-catenin通路在EC中的作用[2]。本次研究结果还显示,miR-34a能够抑制Wnt1和β-catenin蛋白表达,而HDAC1促进Wnt1和β-catenin蛋白表达,并部分逆转miR-34a对Wnt/β-catenin通路的抑制作用。Masoumi等[19]的研究显示,HDAC1具有调节Wnt通路的作用。国内也有研究显示,HDAC1可通过调控Wnt/β-catenin调节乳腺癌细胞的凋亡[20]。
综上所述,miR-34a可通过靶向调节HDAC1的水平调控EC细胞的增殖和凋亡,这种调节作用可能通过影响Wnt/β-catenin通路实现。但是关于miR-34a以及HDAC1在EC中的具体作用机制还需要进一步研究。
