葡聚糖凝胶柱层析富集黑果枸杞总花色苷工艺及其抗氧化性研究
2020-04-08
(江苏食品药品职业技术学院,江苏淮安223003)
黑果枸杞(Lycium ruthenicum Murr.)为茄科枸杞属多年生灌木野生植物,富含多种维生素、矿物质和花色苷,具有高度药食两用价值[1-2]。其中花色苷为花青素与不同单糖以糖苷键相连形成的化合物,有研究发现,其具有抗氧化、抗动脉粥样硬化、调节血脂及增强机体免疫等功效[3-4],因而前人在其分离提取研究方面作出大量工作。由于光照、温度、pH值等理化因素均会影响其结构的稳定性,郑覃等采用超声提取黑果枸杞花色苷,极大缩短提取时间,增大提取效率[5];同时,赵文娟等先后利用不同型号树脂对提取物进一步纯化,使得产物总花色苷含量明显提高[6-7],但一般树脂精制取得的产物仍含有较多糖类、蛋白质等杂质[8],因此对其提取物的纯化再研究,仍具有重大意义。
凝胶柱层析作为经典的分离纯化技术,具有选择性高、干扰因素少、可重复循环利用等特点,被广泛用于化工、制药、生物、环境等领域[9-11]。本研究利用Sephadex LH-20葡聚糖凝胶分离特性,探讨富集黑果枸杞总花色苷的最佳工艺条件,从而为黑果枸杞花色苷的后续开发利用提供参考。
1 材料与方法
1.1 材料与试剂
黑果枸杞干果:宁夏杞爱原生黑果枸杞股份有限公司;AB-8大孔树脂:天津市西金纳环保材料科技有限公司;Sephadex LH-20填料:美国GE公司;无水乙醇、甲醇、氯化钾、醋酸钠、醋酸、盐酸、磷酸、硫酸亚铁、双氧水、水杨酸:分析纯,国药集团上海化学试剂有限公司;锦葵色素-3-葡萄糖苷:天津一方科技有限公司;DPPH试剂:上海化成工业发展有限公司;试验用水为二次纯化水。
1.2 仪器与设备
AE224型电子天平:上海舜宇恒平科学仪器有限公司;雷磁PHS-3C型pH计:上海精密科学仪器有限公司;RE-52型旋转蒸发仪:上海亚荣生化仪器厂;XO-SM 200型超声微波协同反应器:南京先欧仪器制造有限公司;TU-1900型紫外分光光度计:北京普析通用仪器有限责任公司;FD-1C-80型冷冻干燥机:北京博医康试验仪器有限公司。
1.3 方法
1.3.1 总花色苷粗提物制备
准确称取2.0 g黑果枸杞干粉置于圆底烧瓶内,加入50 mL,1%盐酸酸化的80%乙醇溶液后,避光于50℃超声提取(超声频率:40 KHz)1 h,离心(转速:4 000 r/min)收集上清液后,旋转蒸发乙醇,冷冻干燥,即得粗提物[5]。
1.3.2 树脂纯化物制备
依照文献所述树脂纯化条件[7],采用AB-8大孔树脂纯化提取物中花色苷,所得产物即树脂纯化物。
1.3.3 凝胶柱预处理
葡聚糖凝胶湿法填装至层析柱(规格:15 mm×50 cm)后,采用2倍~3倍柱体积的无水乙醇平衡。每次上样前,经无水乙醇平衡后,进行上样吸附与洗脱[11]。
1.3.4 总花色苷含量测定
样品中总花色苷含量以锦葵色素-3-葡萄糖苷表示,采用pH示差法测定,具体如下:准确称取一定量粗提物溶于酸性乙醇后定容于100 mL容量瓶,准确移取一定体积分别使用pH 1.0和pH 4.5的缓冲溶液稀释10倍后,摇匀置于恒温水浴锅中30 min,分别测得在波长530 nm和700 nm处吸光度,另作空白试验,按照下式计算样品中总花色苷含量,平行测定6次[12]。

式中:W为样品总花色苷含量,mg/g;M为锦葵色素-3-葡萄糖苷摩尔质量,493 200 mg/mol;DF稀释因子;V为提取液体积,mL;ε为摩尔吸光系数,29 600 L/(mol·cm);l为光程宽度,cm;m 为粗提物质量,g。
1.3.5 不同吸附条件影响
根据预试验结果,分别考察上样液浓度、pH值和上样流速对总花色苷吸附率的影响,具体如下:1)以50 mL无水乙醇为溶剂,将粗提物配制成pH值为3.0,浓度分别为 10、20、30、40、50 mg/L 的上样液,以1.0 mL/min流速上样;2)将粗提物配制成浓度为30 mg/L,pH 值分别为 2.0、3.0、4.0、5.0、6.0 的上样液,以1.0 mL/min流速上样;3)将粗提物配制成总花色苷浓度为30 mg/L、pH值为3.0的上样液,分别以0.5、1.0、2.0、3.0、4.0 mL/min流速上样,凝胶对粗提物中总花色苷的吸附率Q,照下式计算:

式中:m0为提取物总花色苷质量,mg;me为吸附后流出液中总花色苷质量,mg。
1.3.6 不同洗脱条件影响
根据预试验结果,考察上样结束后,洗脱液浓度、pH值和洗脱流速对产物中总花色苷解吸率影响,具体如下:1)分别以体积 150 mL,50%、60%、70%、80%、90%的pH值为3.0乙醇溶液为洗脱液,在1.0 mL/min流速洗脱;2) 分别以 pH 值为 2.0、3.0、4.0、5.0、6.0 的80%乙醇溶液为洗脱液,在1.0 mL/min流速洗脱;3)以pH值为3.0的80%乙醇溶液为洗脱液,分别在0.5、1.0、2.0、3.0、4.0 mL/min 流速下洗脱,每 5 mL 洗脱液为1管,测定洗脱液中总花色苷的浓度,并照下式计算解吸率。

式中:D为洗脱产物中总花色苷的解吸率,%;m0为提取液总花色苷质量,mg;md为洗脱液总花色苷质量,mg;me为吸附后流出液中总花色苷质量,mg。
1.3.7 动态吸附条件考察
在单因素试验基础上,采用三因素三水平的正交试验,以凝胶对样品总花色苷的吸附率为衡量指标,考察上样液浓度、上样液pH值和上样流速对总花色苷吸附效果的影响,确定最佳吸附条件,具体因素水平见表1所示。

表1 正交试验因素水平表Table 1 Table of the factorial experiment
1.3.8 动态洗脱条件考察
在单因素试验基础上,采用三因素三水平的正交试验,以产物中总花色苷解吸率为衡量指标,釆用不同浓度的乙醇为洗脱液,考察洗脱液浓度(A)、洗脱液pH值(B)和洗脱流速(C)对总花色苷洗脱效果影响,确定最佳洗脱条件,具体因素水平见表2所示。

表2 正交试验因素水平表Table 2 Table of the factorial experiment
1.3.9 抗氧化性研究
1.3.9.1 DPPH自由基清除率检测
准确移取2 mL样品溶液至试管内,另加入2 mL DPPH乙醇溶液(0.2 mol/L),摇匀后,避光放置30 min,以无水乙醇作空白对照,测得517 nm波长处吸光度,平行测定3次,照下式测得DPPH自由基清除率[13]。

式中:w为DPPH自由基清除率,%;A1为样品与DPPH自由基混合液吸光度;A2为样品与无水乙醇混合液吸光度;A0为DPPH自由基与无水乙醇混合液吸光度。
1.3.9.2 羟自由基清除率检测
准确移取2 mL样品溶液至试管内,另加入2 mL硫酸亚铁(3 mmol/L)和2 mL水杨酸-乙醇溶液(3 mmol/L)摇匀,最后加入2 mL双氧水(5 mmol/L)混合均匀后,于37℃水浴避光放置30 min,以纯化水作空白对照,测得510 nm波长处吸光度,平行测定3次,照下式测得羟自由基清除率[13]。
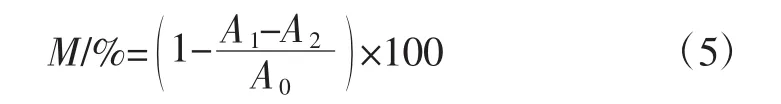
式中:M为羟自由基清除率,%;A0为纯化水+硫酸亚铁+水杨酸-乙醇+双氧水溶液的吸光度;A1为样品+硫酸亚铁+水杨酸-乙醇+双氧水溶液的吸光度;A2为样品+硫酸亚铁+水杨酸-乙醇+纯化水的吸光度。
2 结果与讨论
2.1 单因素试验
2.1.1 上样液浓度对凝胶吸附率影响
若上样液浓度过高,易使得凝胶吸附达到饱和,导致花色苷过早泄漏,造成吸附率下降。而上样液浓度过低,分离纯化耗时过长,影响试验效率,不同上样液浓度对吸附率的影响,见图1。

图1 上样液浓度对吸附率影响Fig.1 The influence of sample concentration on adsorption rate of gel column
从图1可知,葡聚糖凝胶对花色苷的吸附率随浓度的增大先升高后降低,当上样液浓度为30 mg/L时,吸附率达到最大值为88.7%,因此本研究选择25、30、35 mg/L上样液浓度作为正交试验因素考察水平。
2.1.2 上样液流速对凝胶吸附率影响
在动态吸附过程中,上样流速过快,会使得目标分离物与凝胶接触不充分,而过早泄漏,但流速过慢,吸附工艺耗时过长,且对后续凝胶再生造成困难,不同上样流速对吸附率的影响,见图2。

图2 上样液流速对吸附率影响Fig.2 The influence of sample solution flow rate on adsorption rate of gel column
从图2可知,随着上样流速增大,吸附率不断下降,因此综合考虑吸附效率与效果,本研究选择0.5、1.0、2.0 mL/min上样流速作为正交试验因素考察水平。
2.1.3 上样液pH值对总花色苷吸附率影响
由于花色苷在较低pH值环境下易形成黄烊盐,而在较高pH值条件下又易电离质子,均会减少在凝胶中吸附[14],不同上样液pH值对吸附率的影响,见图3。

图3 上样液pH值对吸附率影响Fig.3 The influence of sample solution pH value on adsorption rate of gel column
从图3可知,随着上样液pH值的增大,凝胶对总花色苷的吸附率先升高后降低,当pH值为3.0时达到最大值,因此本研究选择上样液pH值3.0、3.5、4.0作为正交试验因素考察水平。
2.1.4 洗脱液浓度对总花色苷解吸率影响
吸附在凝胶上的花色苷回收,依赖洗脱液洗脱,不同浓度乙醇对总花色苷的洗脱效果,见图4。

图4 洗脱液浓度对花色苷解吸率影响Fig.4 The influence of elution concentration on recovery
从图4可知,随着洗脱液浓度的增大,解吸率逐渐增大,至80%开始降低。这可能因为采用较高浓度乙醇,有利于争夺凝胶中活性位点,但浓度过高,会降低对花色苷部分组分的洗脱能力[15],综合考虑本研究选择75%、80%、85%乙醇浓度作为正交试验因素考察水平。
2.1.5 洗脱液流速对总花色苷解吸率影响
不同洗脱流速对花色苷的解吸率影响,见图5。

图5 洗脱液流速对花色苷解吸率影响Fig.5 The influence of elution flow rate on recovery
从图5可知,随着洗脱流速的增大,解吸率逐渐降低,这源于洗脱液不能充分接触凝胶,即直接流出,且洗脱液用量也会增大,而流速过低,又延长洗脱过程,因此本研究选择1.0、1.5、2.0 mL/min洗脱流速作为正交试验因素考察水平。
2.1.6 洗脱液pH值对总花色苷解吸率影响
由于洗脱液pH值影响花色苷的洗脱效果[15],因而分别考察不同洗脱液pH值对花色苷解吸率的影响,结果见图6。
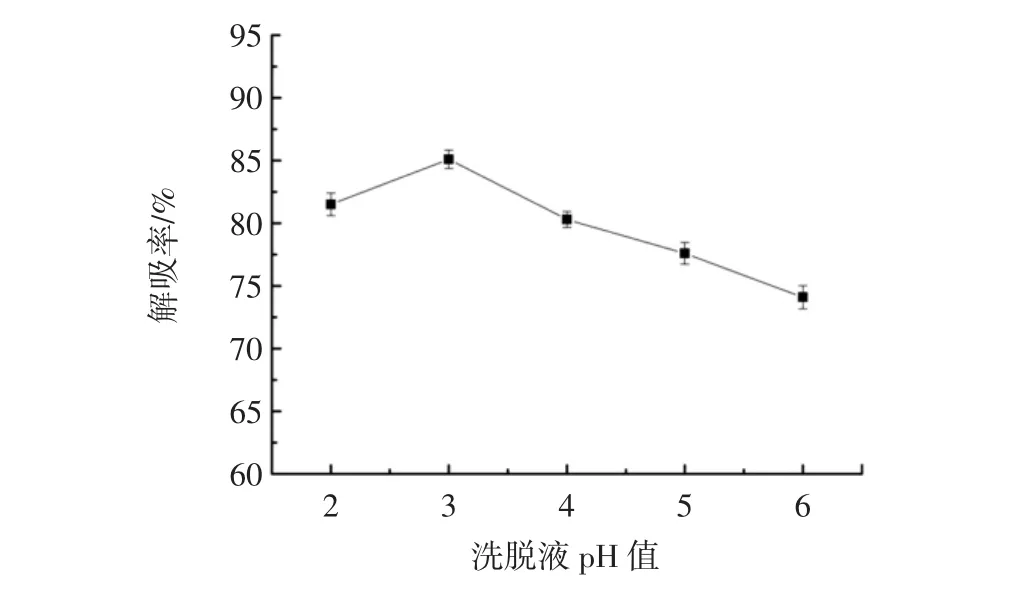
图6 洗脱液pH值对花色苷解吸率影响Fig.6 The influence of elution pH value on recovery
从图6可知,随着洗脱液pH值的增大,花色苷的解吸率缓慢升高,至pH值为3.0时开始急剧下降,因此本研究选择洗脱液pH值2.5、3.0、3.5作为正交试验因素考察水平。
2.2 动态吸附工艺确定
根据上述单因素试验结果可知,上样液浓度、pH值和流速对凝胶吸附花色苷的效果影响较大,考虑单因素试验结果并非最优值,因此采用以三者为变量的正交试验,确定最佳动态吸附条件,结果见表3,试验结果方差分析见表4。
从表3与表4结果可知,各因素对凝胶吸附粗提物中总花色苷的影响顺序为A>C>B,其中上样液浓度对吸附率影响极其显著(P<0.01),上样流速对吸附率影响显著(P<0.05),通过极差分析可知,最佳动态吸附工艺条件为A1B2C2,即25 mg/L的pH值为3.5样品溶液,以1.0 mL/min流速上样至Sephadex LH-20葡聚糖凝胶柱中,有利于花色苷以分子形式较好吸附在凝胶筛孔内。

表3 吸附工艺正交试验结果Table 3 Results of the orthogonal-test method of adsorption process

表4 吸附工艺结果方差分析Table 4 Analysis of variance for the adsorption process factors
2.3 动态洗脱工艺确定
根据单因素试验结果可知,洗脱液浓度、pH值和洗脱流速对凝胶中花色苷的洗脱效果影响较大,因此采用正交试验,确定最佳动态洗脱工艺,结果见表5,相应结果方差分析见表6。
从表5与表6结果可知,各因素对花色苷的解吸率影响影响顺序为C'>A'>B',其中洗脱流速对解吸率影响极其显著(P<0.01),通过极差分析得到,最佳洗脱工艺条件为A'3B'3C'1,因此选择采用85%的pH值为3.5乙醇溶液,以1.0 mL/min流速洗脱被凝胶吸附的总花色苷。

表5 洗脱工艺正交试验结果Table 5 Results of the orthogonal-test method of elution process

表6 洗脱工艺结果方差分析Table 6 Analysis of variance for the elution process factors
2.4 最佳分离纯化条件验证和结果比较
根据上述单因素与正交试验优选得到的Sephadex LH-20葡聚糖凝胶富集纯化黑色枸杞花色苷工艺条件为:质量浓度为25 mg/mL的pH值为3.5样品溶液以1.0 mL/min流速上样至凝胶柱后,采用pH值3.5的85%乙醇溶液,以1.0 mL/min流速洗脱,平行试验6次,测得对花色苷的吸附率与洗脱率分别为90.9%和85.3%,另外采用凝胶富集、树脂纯化及超声提取得到的产物中总花色苷的含量比较,见表7,凝胶柱层析富集后产物的总花色苷含量高于树脂纯化物。

表7 不同产物中总花色苷的含量(n=6)Table 7 The results of anthocyanins contents of different product(n=6)
2.5 总花色苷抗氧化性
2.5.1 DPPH自由基清除能力
不同产物对DPPH自由基的清除率结果见图7。

图7 不同产物对DPPH自由基的清除率Fig.7 The clearance rate of DPPH free radicals for different product
过量的DPPH自由基容易造成细胞组织损伤和生物大分子结构的变化,总花色苷可提供质子氢,还原自由基,形成稳定化合物。从图7可见,黑果枸杞总花色苷浓度在0.01mg/mL~0.05 mg/mL时,随着其质量浓度增加,对DPPH自由基清除率不断增强,当质量浓度为0.05 mg/mL时,提取物、树脂和凝胶纯化黑果枸杞总花色苷的清除率分别为77.4%、82.8%、85.2%,表明提取物、树脂与凝胶纯化后产物对DPPH自由基的清除能力依次增大,且DPPH自由基清除率与总花色苷浓度呈正相关,与相关文献所述一致[16-17]。
2.5.2 羟自由基清除能力
不同产物对羟自由基的清除率结果见图8。

图8 不同产物对羟自由基的清除率Fig.8 The clearance rate of hydroxyl radical for different product
向双氧水反应体系中加入总花色苷后,有色化合物生成量减少,可利用吸光度变化反映总花色苷抗氧化能力。从图8可知,黑果枸杞总花色苷浓度在0.01 mg/mL~0.05 mg/mL时,随着其质量浓度增加,对羟自由基清除率不断增强,当质量浓度为0.05 mg/mL时,提取物、树脂和凝胶后产物对羟自由基的清除率分别为88.4%、91.5%、94.2%,从而可知3种产物对羟自由基的清除能力依次为凝胶纯化>树脂纯化>提取物。
3 结论
本研究采用Sephadex LH-20葡聚糖凝胶柱富集黑果枸杞粗提物中总花色苷,利用单因素与正交试验优化得到的最佳富集纯化工艺条件:质量浓度为25 mg/L的pH值为3.5样品溶液,以1.0 mL/min流速上样至凝胶柱后,采用85%的pH值为3.5乙醇溶液,以1.0 mL/min流速洗脱,对总花色苷的吸附率和解吸率分别为90.9%、85.3%,得到的富集产物含量明显高于树脂纯化物。该工艺操作简便、富集纯化效率较高,且产物对羟自由基和DPPH自由基清除作用较好,可为黑果枸杞花色苷的后续开发利用提供参考。
