羽衣甘蓝类蛋白质二硫键异构酶PDIL1-2的基因克隆及蛋白表达分析
2020-04-08施亚坤高士科李晓屿蓝兴国
李 阳 施亚坤 高士科 李晓屿 蓝兴国
(东北林业大学生命科学学院,哈尔滨 150040)
蛋白质二硫键异构酶(PDIs)及其类蛋白(PDILs)是硫氧还蛋白超家族的成员,不仅具有催化蛋白质二硫键氧化、还原和异构的功能,而且还具有分子伴侣活性和参与新陈代谢的功能[1~5]。典型的PDI由5个结构域(a,b,b’,a’,c)以及一个N端信号肽和C端的内质网滞留信号(KDEL)组成。其中a型结构域(a和a’区)与硫氧还蛋白(Trx)家族具有同源性,分别包含一个氧化还原活性位点-CGHC-,能催化蛋白质二硫键的氧化与还原[6];b型结构域(b和b’区)二级结构与a型相似,具有异构酶的活性和与底物结合的能力;c区的C末端富含酸性氨基酸,是Ca2+结合区域并具有异构酶的活性[7~8]。
PDILs主要是由a型和b型同源结构域以不同的排列方式组合而成。PDILs目前主要分为6簇,1簇除典型结构域(a,b,b’,a’,c)外还含有N末端酸性结构域;2簇为真菌PDI,含a,a’或a,b,a’结构域;植物的PDI大多在3簇,含有典型的5个结构域(a,b,b’,a’,c);4簇仅有a结构域;5簇中的PDI含有与典型结构域不同的D结构域;大部分动物的PDI属于6簇,含有a,b,b’,a’结构域[3]。它们多数具有催化蛋白质二硫键氧化还原的功能和分子伴侣活性,其间差异可能体现在底物的结合能力和组织特异性、表达水平和调控模式上[9~10]。
目前,在动物和真菌中的研究发现,PDI和PDILs不仅与癌症、精卵细胞的融合有关[11~12],而且在细胞稳定、离子吸收、基因活化和细胞分化等方面具有重要的作用[13]。在植物研究中,从拟南芥(Arabidopsisthaliana)、水稻(OryzasativaL.)、小麦(TriticumaestivumL.)、玉米(ZeamaysL.)等克隆了一些PDIs和PDILs[14~19]。拟南芥中的PDILs有12种,其中AtPDIL1的表达能够提高胁迫条件下种子的萌发和幼苗根的生长[20]。水稻中的PDILs有12种,其中OsPDIL1-1参与胚乳内质网上谷蛋白和醇溶蛋白的成熟过程[21~22],它的缺失导致水稻粉状淀粉的形成和对内质网胁迫的响应[18]。小麦中的PDILs蛋白有9种,它们与面筋蛋白的合成有关[23]。玉米中的PDILs蛋白有12种,它们受干旱、冷、ABA和盐等逆境胁迫诱导表达[13]。甘薯中分离出了PDIL的cDNA,其中SPPDI1具有脱氢抗坏血酸还原酶活性和单脱氢抗坏血酸还原酶活性[24]。胡萝卜中分离出了PDI,可催化胰岛素中二硫键的氧化还原和变性RNase A的复性[25]。
目前植物PDILs的生物学功能研究主要集中在种子萌发调控及逆境响应等方面,然而在其他方面的功能仍亟待研究[26~27]。在本研究中将羽衣甘蓝自交不亲和系(S13-bS13-b)作为研究材料,利用RT-PCR和RACE方法分离羽衣甘蓝PDIL1-2基因并进行序列分析,通过原核表达纯化系统获得BoPDIL1-2的融合蛋白,并制备多克隆抗体和免疫印迹分析BoPDIL1-2组织表达模式以及在柱头发育过程中的表达情况,从而为深入研究BoPDIL1-2的功能奠定理论基础。
1 材料与方法
1.1 试材及取样
于2017年6月在东北林业大学花卉生物工程研究所种植羽衣甘蓝自交不亲和系(S13-bS13-b)。在2018年2月~4月开花期间,采集当天开花的花蕾和茎、叶,用镊子分别剥取花柱、花瓣、柱头、子房和花药,选取不同花蕾长度(S1-S5)的柱头为不同发育时期材料,用液氮速冻后,存于-80℃冰箱备用[28]。
1.2 羽衣甘蓝PDIL1-2全长cDNA的分离
利用CTAB法从羽衣甘蓝柱头中提取总RNA[29]。使用DnaseⅠ酶(RNase free)消化后的柱头总RNA作为模板,采用锚定引物Oligo(dT)18和AMV反转录酶(TaKaRa)进行RNA反转录,程序为:42℃孵育30 min,99℃变性5 min,4℃孵育5 min。根据GenBank数据库中已经发表甘蓝PDIL1-2基因的5′和3′末端序列,设计一对特异性引物PDIL1-2-RT-For和PDIL1-2-RT-Rev(表1),模板为反转录产物cDNA的第1条链,使用LA taq DNA聚合酶(TaKaRa)进行PCR扩增。扩增条件为:94℃预变性2 min,94℃变性30 s,60℃退火30 s,72℃延伸2 min,进行35次循环后,72℃延伸7 min。用E.Z.N.A.TMGel Extract kit对PCR产物进行回收,回收后与pGEM-T载体连接,转化到Top10菌株中,用蓝白斑筛选法挑选阳性克隆并检测核酸序列。
根据所得的PDIL1-2的cDNA(BoPDIL1-2)序列,分别设计5′RACE的特异性引物PDIL1-2-SP1和PDIL1-2-SP2,及3′RACE的特异性引物PDIL1-2-SP5(表1),按照RACE试剂盒Roche 5′/3′ RACE Kit,2ndGeneration说明书进行cDNA末端快速扩增。利用试剂盒引物Oligo(dT)-Anchor primer和PCR Anchor primer,采用嵌套PCR和Touchdown PCR进行扩增。将得到的5′末端序列和3′末端序列以及中间序列拼接,得到cDNA的全长序列,利用NCBI网站进行BLAST比对,并用在线网站ProtParam(http://www.expasy.org)预测编码蛋白的分子量、保守结构域及理论等电点等。
1.3 羽衣甘蓝PDIL1-2的原核表达、纯化及多克隆抗体制备
1.3.1 原核表达质粒pET-14b-BoPDIL1-2的构建
引物PDIL1-2-pET-For(5′-GACGGTACCATGGCGTCTAACGGCTTCGC-3′),下划线代表KpnⅠ酶切位点;PDIL1-2-pET-Rev(5′-GACGGATCCCTACAGCTCGTCCTTCGCGG-3′),下划线代表BamHⅠ酶切位点。以PDIL1-2的cDNA(BoPDIL1-2)编码序列为模板,利用KOD高保真酶进行PCR扩增。扩增条件为94℃变性15 s,55℃退火30 s,68℃延伸2 min,30个循环后,72℃延伸7 min。对PCR产物进行回收、纯化和双酶切后,插入pET-14b载体中。将重组载体转化到大肠杆菌DH5α中,经PCR和酶切鉴定正确后,进行核酸序列分析。
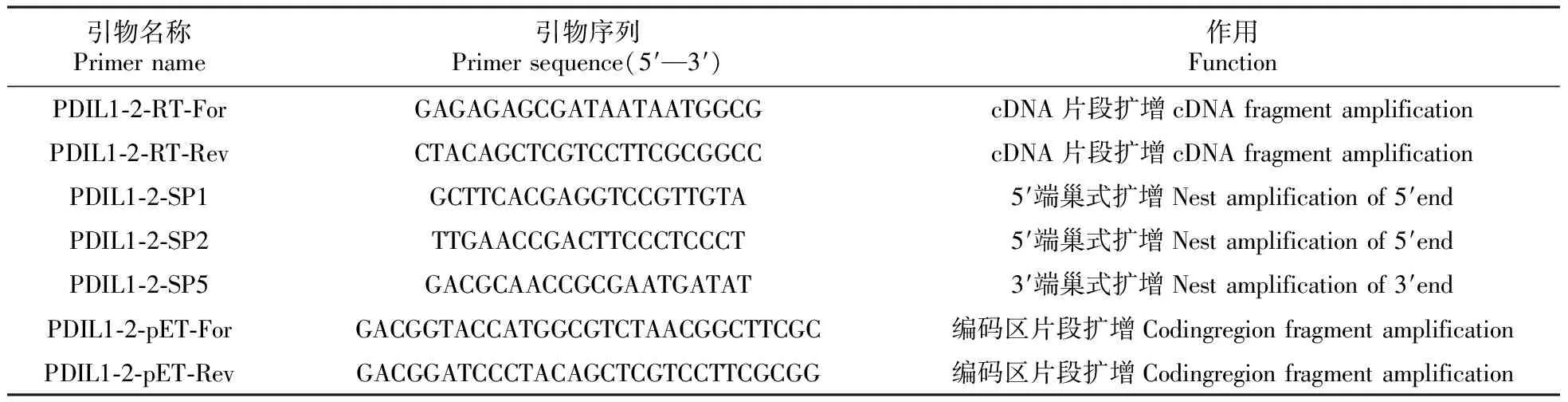
表1 羽衣甘蓝BoPDIL1-2基因克隆及原核表达分析所用引物
1.3.2 BoPDIL1-2重组蛋白质的原核表达
经鉴定后正确的阳性重组质粒转化到大肠杆菌BL21(DE3)pLysS中。在5 mL LB培养基中加入单菌落,于37℃振荡培养至对数期A600=0.6,加入终浓度为1 mmol·L-1的异丙基β-D-硫代半乳糖苷(IPTG),37℃诱导4 h后进行12%的SDS-PAGE电泳,考马斯亮蓝染色后对其表达进行检测。
1.3.3 BoPDIL1-2融合蛋白的纯化及多克隆抗体制备
大量扩增诱导并收集细菌;用5 mL结合缓冲液重悬细菌沉淀(30 mmol·L-1NaCl;10 mmol·L-1咪唑;20 mmol·L-1Tris-base;pH 8.0),细菌经超声破碎后,12 000 r·min-1、4℃离心15 min。Poly-Prep chromatography column层析柱被结合缓冲液平衡后,加上清,并向其中加入100 μL Ni2+-NTA琼脂糖(Novagen公司),4℃结合30 min后,依次用20、30和40 mmol·L-1咪唑洗脱缓冲液对Ni2+-NTA琼脂糖进行洗脱,最后用250 mmol·L-1咪唑洗脱并收集融合蛋白。过滤含有目的蛋白的洗脱液Amicon® Ultra-4(3 kD截流,Millipore公司),然后用PBS缓冲液(2.68 mmol·L-1KCl,1.46 mmol·L-1KH2PO4,137 mmol·L-1NaCl,8.1 mmol·L-1Na2HPO4,pH7.4)进行透析。利用获得的重组BoPDIL1-2融合蛋白免疫小鼠,制备BoPDIL1-2多克隆抗体,具体方法参考Li等[30]。
1.4 BoPDIL1-2在不同组织及柱头不同发育时期的表达
采集羽衣甘蓝茎、叶、花柱、花瓣、子房、柱头、花药,以及花蕾大小在S1(0~4.0 mm)、S2(4.1~6.0mm)、S3(6.1~8.0 mm)、S4(8.1~10.0 mm)和S5(>10.1 mm)时的柱头,总蛋白提取及蛋白定量参照Lan等的方法[26]。
1.5 免疫印迹
取已经定量的蛋白样品各10 μg,进行12%的SDS-PAGE凝胶电泳。电泳后将蛋白转移至PVDF膜(Amersham Biosciences)中。在室温下,用含有5%牛血清白蛋白(BIOSHARP)的TBST(137 mmol·L-1NaCl,20 mmol·L-1Tris base,0.1% Tween-20)封闭1 h。一抗为Anti-BoPDIL1-2,稀释倍数为1∶2 000。二抗为山羊抗鼠抗体,其上偶联有辣根过氧化物酶,稀释倍数为1∶5 000。经一抗、二抗结合后,把LumiGLO混合液(Cell Signaling Technology)均匀地滴在PVDF膜上,用Kodak IS2000R进行化学发光检测。
2 结果与分析
2.1 羽衣甘蓝PDIL1-2基因的克隆、序列分析及蛋白结构域分析
用羽衣甘蓝柱头总RNA作为模板,以RT-PCR法获得长度为1 545 bp的cDNA序列。然后分别通过5′RACE和3′RACE的方法获得长度为415 bp的5′末端序列和341 bp的3′末端序列。将cDNA序列和5′末端序列以及3′末端序列进行拼接,获得了一个1 689 bp的全长cDNA序列,将其命名为BoPDIL1-2,GenBank登录号为MK241691。BoPDIL1-2的全长cDNA含有一个1 530 bp的开放阅读框(open reading frame,ORF),对应编码一个含509个氨基酸残基的蛋白质,52 bp的5′非翻译区和107 bp的3′非翻译区(图1)。BoPDIL1-2的理论等电点(pI)为5.00,相对分子质量约为55.7 kD。氨基酸序列比对分析结果表明,BoPDIL1-2与油菜BnPDIL1-2具有97.3%的一致性,与拟南芥AtPDIL1-2具有85.5%的一致性(图2)。
蛋白结构域分析结果显示,BoPDIL1-2蛋白由一个N端的信号肽(SP)、中间4个结构域(a,b,b’,a’)和C末端携带内质网滞留信号肽KDEL组成(图3)。a和a’区与硫氧还蛋白(Trx)家族有同源性,都包括一个氧化还原活性位点-CGHC-;b和b’区和硫氧还蛋白没有同源性,但其二级结构同a或a’相似。
2.2 羽衣甘蓝PDIL1-2原核表达分析
利用PCR方法扩增PDIL1-2的编码序列,通过双酶切消化构建到pET-14b载体上,通过测序确定构建了pET-14b-BoPDIL1-2表达质粒。将构建好的pET-14b-BoPDIL1-2表达质粒,转化到BL21(DE3)pLysS菌株中。在37℃下用IPTG诱导4 h,裂解细菌。SDS-PAGE电泳结果表明,在经IPTG诱导后的菌液蛋白中,有一条58 kDa左右的蛋白条带被特异性地诱导出来(图4)。由于考虑到表达载体表达His6标签等氨基酸的分子量,因此认为这个诱导58 kDa的蛋白与预测重组蛋白质的分子量相符。大量扩增表达菌液后,利用超生方法破碎细胞,通过Ni2+-NTA亲合树脂纯化后,进行SDS-PAGE电泳。从图4中的结果显示出,重组蛋白质(His6-BoPDIL1-2)纯化出来,而且蛋白的纯度较高。利用纯化的重组蛋白免疫小鼠,制备BoPDIL1-2的多克隆抗体。

图1 羽衣甘蓝BoPDIL1-2全长cDNA核苷酸序列及其推测的氨基酸序列Fig.1 The full-length cDNA nucleotide sequence of BoPDIL1-2 and its putative amino acidsequence

图2 羽衣甘蓝BoPDIL1-2与油菜BnPDIL1-2、拟南芥AtPDIL1-2氨基酸序列比对 彩色背景为不一致的氨基酸序列。Fig.2 Alignment of predicted amino acid sequences among BoPDIL1-2,Brassica napus BnPDIL1-2 and Arabidopsis thaliana AtPDIL1-2 Colorful background are different residues.

图3 羽衣甘蓝BoPDIL1-2蛋白的结构域 SP.信号肽;KDEL.赖氨酸-天冬氨酸-谷氨酸-亮氨酸四肽序列,为内质网滞留信号;a、b、a’、b’为羽衣甘蓝PDIL1-2的四个结构域(a和a’区与硫氧还蛋白(Trx)家族同源;b和b’区和硫氧还蛋白不同源)Fig.3 The protein domain of BoPDIL1-2 SP.Signal peptide; KDEL.Lysine-aspartic acid-glutamic acid-leucine,a signal for endoplasmic reticulum retention; a,b,a’,b’ are the four domains of Ornamental Kale of PDIL1-2(a and a’ regions are homologous to the thioredoxin(Trx) family; b and b’ regions are different from Trx )
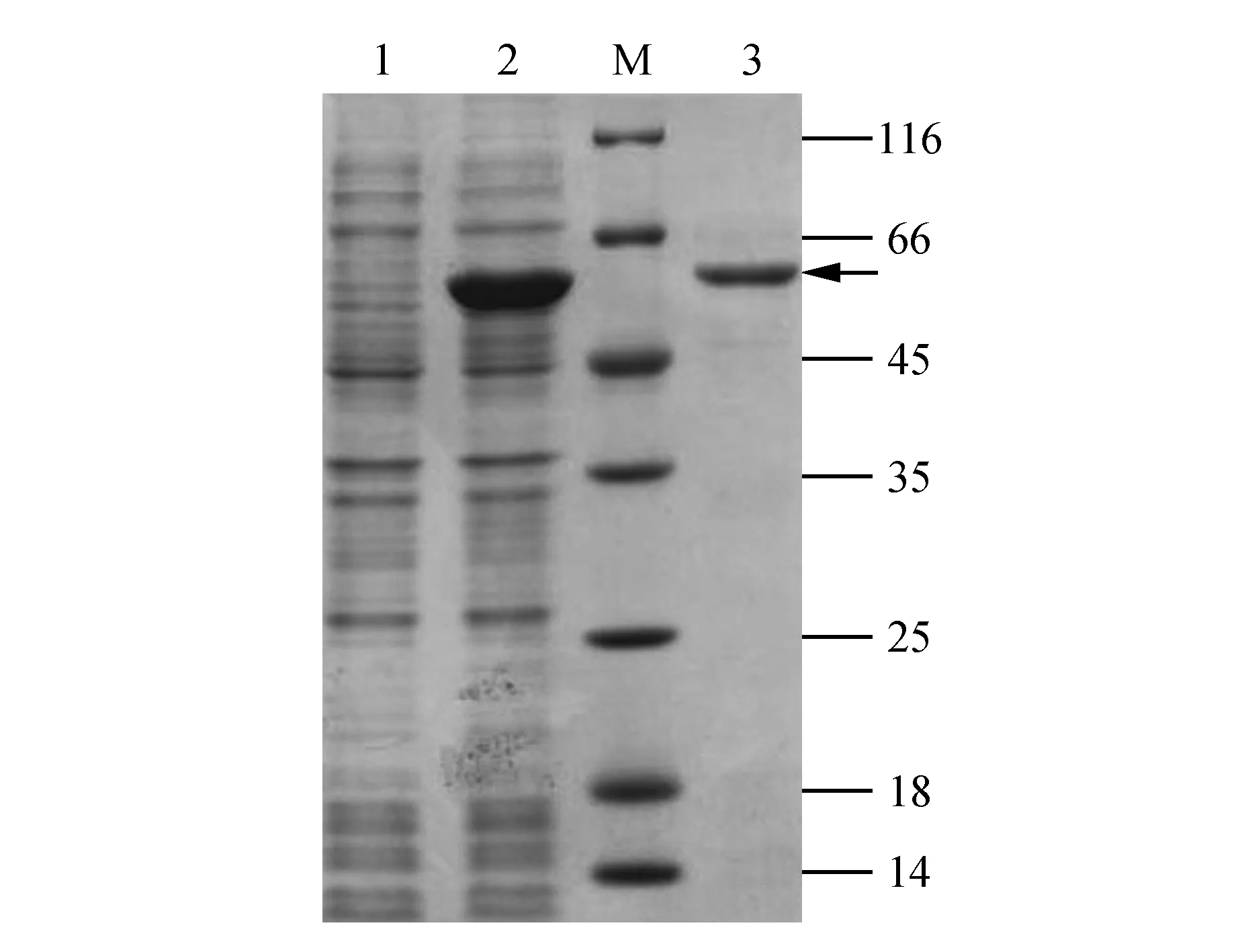
图4 BoPDIL1-2蛋白的诱导表达纯化 1.诱导前细菌蛋白;2.诱导后细菌蛋白;M.蛋白分子量标准;3.纯化的目的蛋白Fig.4 Induction and purification of recombination BoPDIL1-2 1.Bacteria protein before IPTG induction;2.Bacteria protein after IPTG induction;M.Protein marker; 3.Purification of target protein

图5 免疫印迹分析BoPDIL1-2在植物各组织中的表达水平Fig.5 Western blot analysis of BoPDIL1-2 expression levels in various tissue

图6 免疫印迹分析BoPDIL1-2在柱头发育过程中的表达水平Fig.6 Western blot analysis of BoPDIL1-2 expression levels in the different developmental stigma
2.3 免疫印迹分析BoPDIL1-2在各组织和柱头发育中的表达水平
为了分析BoPDIL1-2在植物组织中的表达水平,分别提取茎、叶、花瓣、柱头、花柱、子房和花药的总蛋白。利用制备的BoPDIL1-2多克隆抗体,通过免疫印记的方法检测BoPDIL1-2的表达水平。结果发现在检测的各组织中,在56 kD处有特异性条带出现,这与预测的BoPDIL1-2大小相近;BoPDIL1-2在柱头中的表达量最高,在茎、叶、花瓣、花柱、子房和花药表达量较低(图5)。这个结果说明在检测的组织样品中,BoPDIL1-2特异性地在柱头中表达。
为了进一步分析BoPDIL1-2在不同发育阶段柱头的表达情况,提取了S1到S5阶段的柱头总蛋白。免疫印记的结果显示,在柱头发育的早期阶段S1阶段,BoPDIL1-2的表达几乎检测不到;到S2阶段,BoPDIL1-2表达量逐渐升高;从S3到S5阶段柱头表达量较高(图6)。这个结果表明BoPDIL1-2表达与柱头发育密切相关,可能在柱头发育过程中具有重要的作用。
3 讨论
本研究从羽衣甘蓝自交不亲和系(S13-bS13-b)中分离出BoPDIL1-2基因。它的全长cDNA序列为1 689 bp,包含52 bp的5′非翻译区、107 bp的3′非翻译区和1 530 bp的开放阅读框,对应编码一个含509个氨基酸残基的蛋白质。对其结构域进行分析,发现BoPDIL1-2蛋白由一个N端的信号肽(SP)、中间4个结构域(a,b,b’,a’)和C末端的内质网滞留信号肽KDEL组成;它属于Meiri等规定的第三簇。a和a’区与硫氧还蛋白(Trx)家族同源有同源性,都包括一个氧化还原活性位点;b和b’区和硫氧还蛋白家族没有同源性,但其二级结构同a或a’相似。这说明BoPDIL1-2的活性与蛋白质二硫键异构酶相似,都具有催化蛋白质二硫键氧化、还原和异构的功能,此外,还可能有其他的生物学功能。氨基酸序列比对分析显示,BoPDIL1-2与油菜BnPDIL1-2具有97.3%的一致性,与拟南芥AtPDIL1-2具有85.5%的一致性,这暗示这个蛋白在进化过程中是保守的。此外,利用原核表达系统进行BoPDIL1-2融合蛋白的表达纯化。在原核表达分析中,58kD处发现了被诱导出来的蛋白,其分子量与预测的融合蛋白相符;在纯化的过程中并未形成包涵体,因此利用Ni2+-NTA树脂通过亲和层析的方法获得高纯度的BoPDIL1-2融合蛋白。
在免疫印迹中,BoPDIL1-2蛋白在柱头组织中表达量最高,在茎、叶、花瓣、花柱、子房和花药表达量较低;这与拟南芥中PDIs在花和未成熟种子中表达量较高具有一定的相似性[6,30];这也暗示了BoPDIL1-2可能特异性地参与柱头的生物学功能。在羽衣甘蓝柱头的不同发育阶段发现,BoPDIL1-2在S1阶段几乎不表达;从S2阶段开始BoPDIL1-2的表达量逐渐升高;在S3到S5阶段BoPDIL1-2的表达量较高。这个结果表明BoPDIL1-2的表达与柱头发育密切相关,暗示了BoPDIL1-2可能在柱头发育过程中具有重要的作用。
本试验通过对羽衣甘蓝BoPDI1-2基因进行克隆,对其进行序列及结构域的分析,丰富了对芸苔属植物PDIL1-2基因的认识。并通过对该基因在组织、柱头发育的表达量分析,认为BoPDIL1-2可能在柱头发育过程中起到重要的作用,这对羽衣甘蓝的培育和推广具有重要价值和意义,也为探讨植物中PDI的生物学功能提供了重要线索;但其具体作用机制仍不明确,在后续研究中我们将继续对BoPDIL1-2基因在羽衣甘蓝柱头发育过程的具体功能和作用机制进行分析。
