柚木无性系光合生理特征与生长综合评价
2020-04-08刘炳妤黄桂华梁坤南王西洋陈天宇周再知
刘炳妤 黄桂华 梁坤南 王西洋 陈天宇 周再知 杨 光
(中国林业科学研究院热带林业研究所,广州 510520)
柚木(TectonagrandisL.f)为马鞭草科(Verbenaceae)柚木属(Tectona)高大乔木,天然分布于印度南部与中部、泰国北部、缅甸和老挝,是世界名贵的用材树种,素有“万木之王”的美称,是制造军舰、码头、桥梁、建筑、车厢、家具、雕刻等的高级用材[1~2]。柚木作为速生阔叶珍贵用材树种,近十年来发展迅速,尽快选育出更加高效优质的柚木优良新品系,是大力发展柚木种植业迫切需要解决的现实问题。
植物在生长过程中是通过光合作用生产有机物,并在植物体内逐渐积累干物质。植物光合作用的强弱是其生长快慢的主要衡量指标之一[3~4]。研究植物光合生理特征及其与生长的关系,有助于了解植物生长过程及其对环境的适应性,对植物育种具有重要的指导意义。以提高产量为目标的高光效育种研究在作物中已有许多报道[5~7],林木中相关的理论与实践研究主要集中在杨树上[8~10]。褚延广等[8]系统地研究了欧洲黑杨基因资源光合作用气体交换、叶绿素荧光参数及其与生长的关系,发现起源于塞尔维亚及其他南欧、东欧的欧洲黑杨可作为杨树高光效育种选择的重点。柚木叶片十分宽大,属强阳性树种,喜温好光,培育光能利用率高的柚木新品种也是柚木育种的重要目标。当前,虽然已开展了单个柚木无性系盆栽苗期对模拟酸雨胁迫的光合响应[11]、柚木人工林中不同邻体干扰强度下的光合生理特征[12],以及柚木无性系盆栽苗期光合生理的日变化和季节性变化[13],但从育种角度出发,关于柚木基因资源光合生理特征及其与生长关系的研究非常有限[14]。本文基于柚木无性系大田测定林,测定评价不同无性系的气体交换参数、叶绿素荧光参数和生长性状,分析各性状遗传变异规律,揭示柚木光合生理特征与生长的关系,并筛选出光合效率高的柚木优良无性系。
1 材料与方法
1.1 材料与试验设计
本研究材料是从印度和缅甸不同种源中选择优树组培繁殖的19个柚木无性系,并以柚木嫁接种子园中优良家系为对照(表1)。2016年3月29日采用1年生苗在广东省英德市林业科学研究所(113°76′51″E,24°24′77″N)营建大田测定林,完全随机区组设计,9株(3×3)小区,6次重复。带状造林,三行一带,种植带内柚木株行距2 m×2 m,种植带间距8 m,挖穴规格:60 cm×60 cm×50 cm,基肥:1.0 kg钙镁磷肥+1.5 kg有机肥。
表1 参试柚木无性系及其来源信息
Table 1 Information of teak clones and their original provenances

造林编号Code无性系Clone选自种源Provenance name16601国内西双版纳植物园次生种源(缅甸6601)Domestic Banna botanical garden secondary provenance(Myanmar 6601)271-7印度种源3071India provenance 307137111印度种源3071India provenance 307147114印度种源3071India provenance 307157514国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)67544国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)77549国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)87552国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)97559国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)107663国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)117703国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)127765国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)137772国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)147773国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)157886国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)16CK种子园家系Seed orchard pedigree177024印度种源3070India provenance 3070187551国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)197813国内尖峰岭次生种源(缅甸83044)Domestic Jianfengling secondary provenance (Myanmar 83044)20FS3国内尖峰岭次生种源(印度FS3)Domestic Jianfengling secondary provenance (India FS3)
1.2 指标测定
2016年9月21日,测量了试验林0.5 a生树高(H)。在天气晴朗的2016年9月22、23、24日(重复测定3天)上午8:30~11:30,每个无性系和对照随机选择4株,每株选择植株顶芽向下数的第2对同龄向阳功能叶片,采用美国LI-COR公司Li-6400型便携式光合仪测定瞬时气体交换参数,包括净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)等。测定时利用叶室自动可调光源1 000 μmol·m-2·s-1,在自然CO2浓度400±15 μmol·mol-1的条件下进行,记录测定叶室温度为33~38℃。每次测定时,每叶片测定3次稳定值取平均值。
同时,采用美国OPTI-sciences公司生产的OS-30P+测定叶绿素荧光参数,包括PSⅡ最大光化学效率(Fv/Fm)、PSⅡ实际光化学效率(ΦPSⅡ)、非光化学淬灭系数(NPQ)[15~16]。各参试无性系植株测定叶片同上,测定前用叶片夹进行20 min遮光处理,以保证叶片完全进入暗适应状态。
1.3 数据分析
水分利用效率(WUE)按公式WUE=Pn/Tr计算[17]。变异系数按公式C=S/X计算,式中S为标准差,X为某一指标的总体平均值。采用SPSS 18.0软件进行方差分析和Duncan多重比较分析,并对光合参数、生长指标、水分利用率进行相关性分析。
2 结果与分析
2.1 柚木不同无性系气体交换、叶绿素荧光与生长特征
柚木不同无性系气体交换、叶绿素荧光及生长性状的方差分析结果见表2,各参数以及水分利用效率在无性系间都存在极显著差异。柚木不同无性系气体交换参数和水分利用效率邓肯多重比较见表3,主要参数Pn、Gs和Tr的平均值范围为9.61±4.54~19.53±3.40、0.02±0.01~0.09±0.05和1.25±0.76~3.39±1.51 mmol·m-2·s-1;计算出水分利用效率(WUE)在4.69±1.69~15.26±7.15 μmol·mmol-1。叶绿素荧光参数(表4)主要参数ΦPSⅡ、Fv/Fm和NPQ的平均值范围为0.50±0.05~0.63±0.02、0.77±0.04~0.81±0.01和0.38±0.19~0.85±0.44;0.5 a生树高平均值范围为0.43±0.26~0.92±0.36 m。气孔导度(Gs)、蒸腾速率(Tr)、非光化学淬灭系数(NPQ)和水分利用效率(WUE)变异系数较大,在0.511~0.670;PSⅡ最大光化学效率(Fv/Fm)变异系数较小,仅为0.033。以CK为参照,同时控制20%的入选率,筛选出早期生长好的柚木无性系FS3,光合速率高的柚木无性系为71-7和FS3;水分利用效率高的柚木无性系为7703、7024、7552和7813。
表2 柚木不同无性系气体交换、叶绿素荧光、水分利用率及生长参数的方差分析
Table 2 Variance analysis of gas exchange,chlorophyll fluorescence,water use effciency and growth parameters among teak clones

指标类别Category指标ParameterF值F valueP值P value变异系数Variation coeffcient气体交换Gas exchange净光合速率Pn40.523<0.0001∗∗0.318气孔导度Gs32.508<0.0001∗∗0.670蒸腾速率Tr34.729<0.0001∗∗0.511叶绿素荧光ChlorophyⅡ fluoresencePSⅡ最大光化学效率Fv/Fm 12.668<0.0001∗∗0.033PSⅡ实际量子产量ΦPSⅡ11.829<0.0001∗∗0.115非光化学淬灭系数NPQ4.413<0.0001∗∗0.612水分利用效率Water use efficiencyWUE24.082<0.0001∗∗0.548生长Growth树高H4.446<0.0001∗∗0.335
注:*表示差异显著(0.05水平);**表示差异极显著(0.01水平)。下同。
Note:*indicates a significant difference(0.05 level);**indicates a very significant difference(0.01 level).The same as below.
表3 柚木不同无性系气体交换参数和水分利用效率特征值
Table 3 Mean values of gas exchange and water use effciency among teak clones

无性系Clone净光合速率Pn(μmol·m-2·s-1)气孔导度Gs(μmol·m-2·s-1)蒸腾速率Tr(μmol·m-2·s-1)水分利用效率WUE660115.55±4.36e0.05±0.02def2.28±0.89cde7.43±2.54fjh71-719.53±3.40a0.05±0.01bcd2.64±0.67b7.67±1.45efjh711116.95±3.33cd0.05±0.01bcd2.74±0.72b6.37±1.39h711417.15±4.77cd0.04±0.02efg2.10±0.90e8.96±2.54cde751414.90±3.00e0.04±0.01gh1.79±0.64fg9.32±3.29cd754412.87±4.76fg0.03±0.02gh1.76±0.90fg9.05±4.36cde754915.45±4.86e0.06±0.03bc2.61±1.13b6.81±3.07jh75529.61±4.54i0.02±0.01i1.25±0.76h10.31±8.57c755912.79±3.72fg0.05±0.03def2.12±1.07e6.79±2.03jh766317.89±3.01bc0.05±0.02de2.48±0.88bcd9.06±8.18cde770314.97±3.51e0.03±0.02gh1.35±0.79h15.26±7.15a776511.23±2.99h0.03±0.01hi1.45±0.62h8.93±3.61cde777211.75±4.54gh0.03±0.02gh1.81±0.84f7.27±2.84fjh777317.14±3.76cd0.05±0.01bcd2.18±0.52de8.25±2.07defj788613.26±4.41f0.08±0.06a3.11±1.38a4.69±1.69iCK18.89±4.75ab0.06±0.04b2.53±1.12bc8.47±2.61def702415.88±2.89de0.04±0.02fg1.49±0.71gh12.78±4.6b755115.46±2.64e0.05±0.03cd2.24±1.11cde8.34±3.59def781311.95±4.02fgh0.03±0.01hi1.38±0.58h10.30±4.70cFS318.89±4.84ab0.09±0.05a3.39±1.51a6.59±2.91h
注:表中字母相同说明差异不显著,字母不同表示差异显著(0.05水平),下同。
Note:Same letters indicate that the difference is not significant, and different letters indicate a significant difference(0.05 level).The same as below.
表4 柚木不同无性系叶绿素荧光参数和树高特征值
Table 4 Mean values of chlorophyll fluorescence and tree height among teak clones
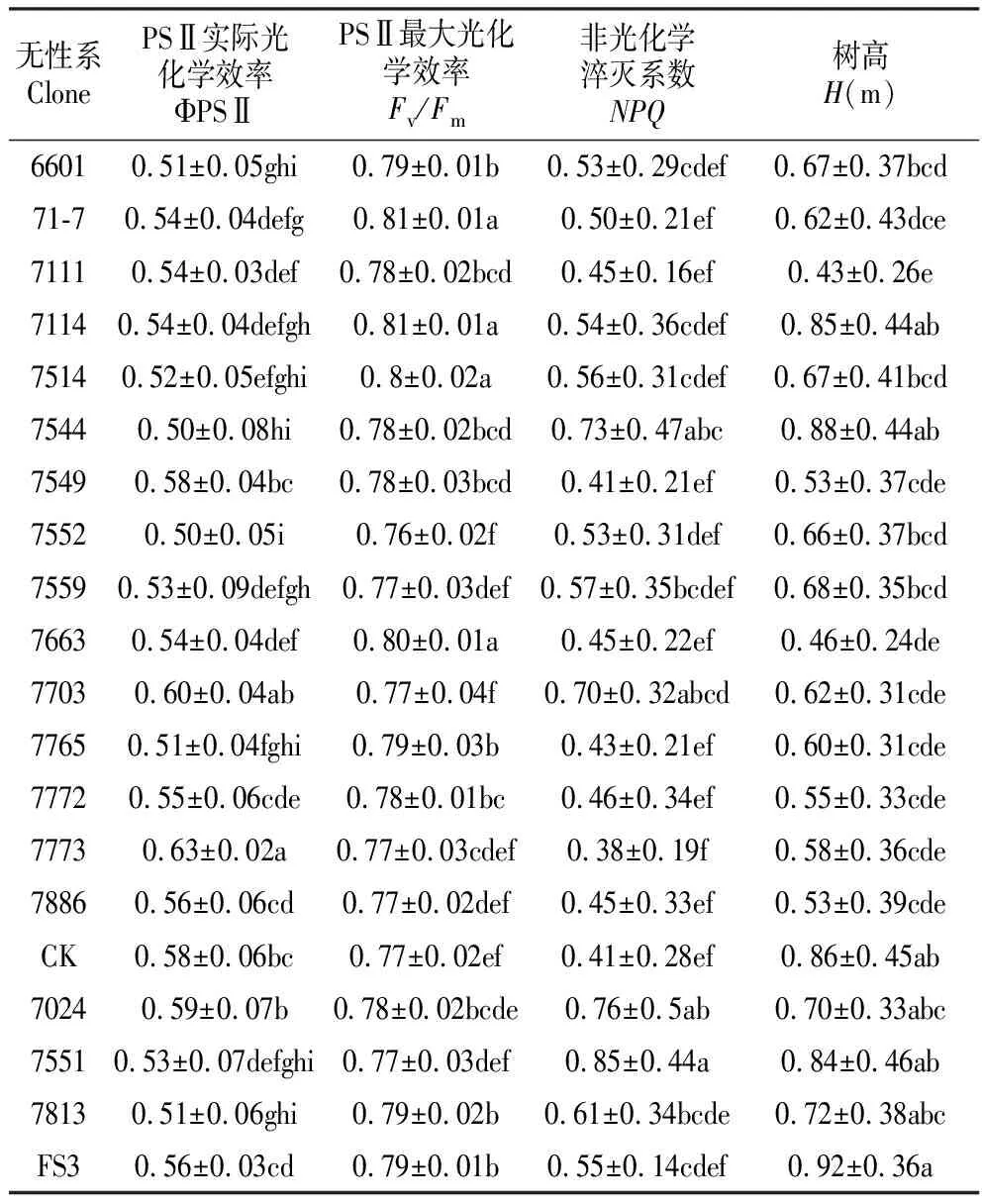
无性系ClonePSⅡ实际光化学效率ΦPSⅡPSⅡ最大光化学效率Fv/Fm非光化学淬灭系数NPQ树高H(m)66010.51±0.05ghi0.79±0.01b0.53±0.29cdef0.67±0.37bcd71-70.54±0.04defg0.81±0.01a0.50±0.21ef0.62±0.43dce71110.54±0.03def0.78±0.02bcd0.45±0.16ef0.43±0.26e71140.54±0.04defgh0.81±0.01a0.54±0.36cdef0.85±0.44ab75140.52±0.05efghi0.8±0.02a0.56±0.31cdef0.67±0.41bcd75440.50±0.08hi0.78±0.02bcd0.73±0.47abc0.88±0.44ab75490.58±0.04bc0.78±0.03bcd0.41±0.21ef0.53±0.37cde75520.50±0.05i0.76±0.02f0.53±0.31def0.66±0.37bcd75590.53±0.09defgh0.77±0.03def0.57±0.35bcdef0.68±0.35bcd76630.54±0.04def0.80±0.01a0.45±0.22ef0.46±0.24de77030.60±0.04ab0.77±0.04f0.70±0.32abcd0.62±0.31cde77650.51±0.04fghi0.79±0.03b0.43±0.21ef0.60±0.31cde77720.55±0.06cde0.78±0.01bc0.46±0.34ef0.55±0.33cde77730.63±0.02a0.77±0.03cdef0.38±0.19f0.58±0.36cde78860.56±0.06cd0.77±0.02def0.45±0.33ef0.53±0.39cdeCK0.58±0.06bc0.77±0.02ef0.41±0.28ef0.86±0.45ab70240.59±0.07b0.78±0.02bcde0.76±0.5ab0.70±0.33abc75510.53±0.07defghi0.77±0.03def0.85±0.44a0.84±0.46ab78130.51±0.06ghi0.79±0.02b0.61±0.34bcde0.72±0.38abcFS30.56±0.03cd0.79±0.01b0.55±0.14cdef0.92±0.36a
2.2 柚木不同种源气体交换、叶绿素荧光与生长特征
如表5显示,气体交换、叶绿素荧光及生长参数在柚木不同种源间都存在极显著差异。如表6~7显示,尖峰国内次生种源(印度FS3)和CK的净光合速率Pn最高,其次是种源3071,三者差异不显著;尖峰国内次生种源(印度FS3)的Gs和Tr值也最高,而印度种源3070的水分利用效率、PSⅡ实际光化学效率最高,印度种源3071的PSⅡ最大光化学效率最高,尖峰国内次生种源(印度FS3)树高生长最优。从种源水平来看,尖峰国内次生种源(印度FS3)、印度种源3071和3070为光合效率高的柚木种源;从不同国家的柚木种质资源来看,来自印度的柚木资源光合效率优于来自缅甸的柚木资源。
表5 柚木不同种源气体交换、叶绿素荧光、水分利用率及生长参数的方差分析
Table 5 Variance analysis of gas exchange, chlorophyll fluorescence, water use effciency and growth parameters among teak provenances

指标类别Category指标ParameterF值F valueP值P value气体交换Gas exchange净光合速率Pn63.772<0.0001∗∗气孔导度Gs38.207<0.0001∗∗蒸腾速率Tr45.012<0.0001∗∗叶绿素荧光ChlorophyⅡ fluoresencePSⅡ最大光化学效率Fv/Fm13.598<0.0001∗∗PSⅡ实际量子产量ΦPSⅡ7.379<0.0001∗∗非光化学淬灭系数NPQ3.3310.006∗∗水分利用效率Water use efficiencyWUE19.520<0.0001∗∗生长Growth树高H3.6360.003∗∗
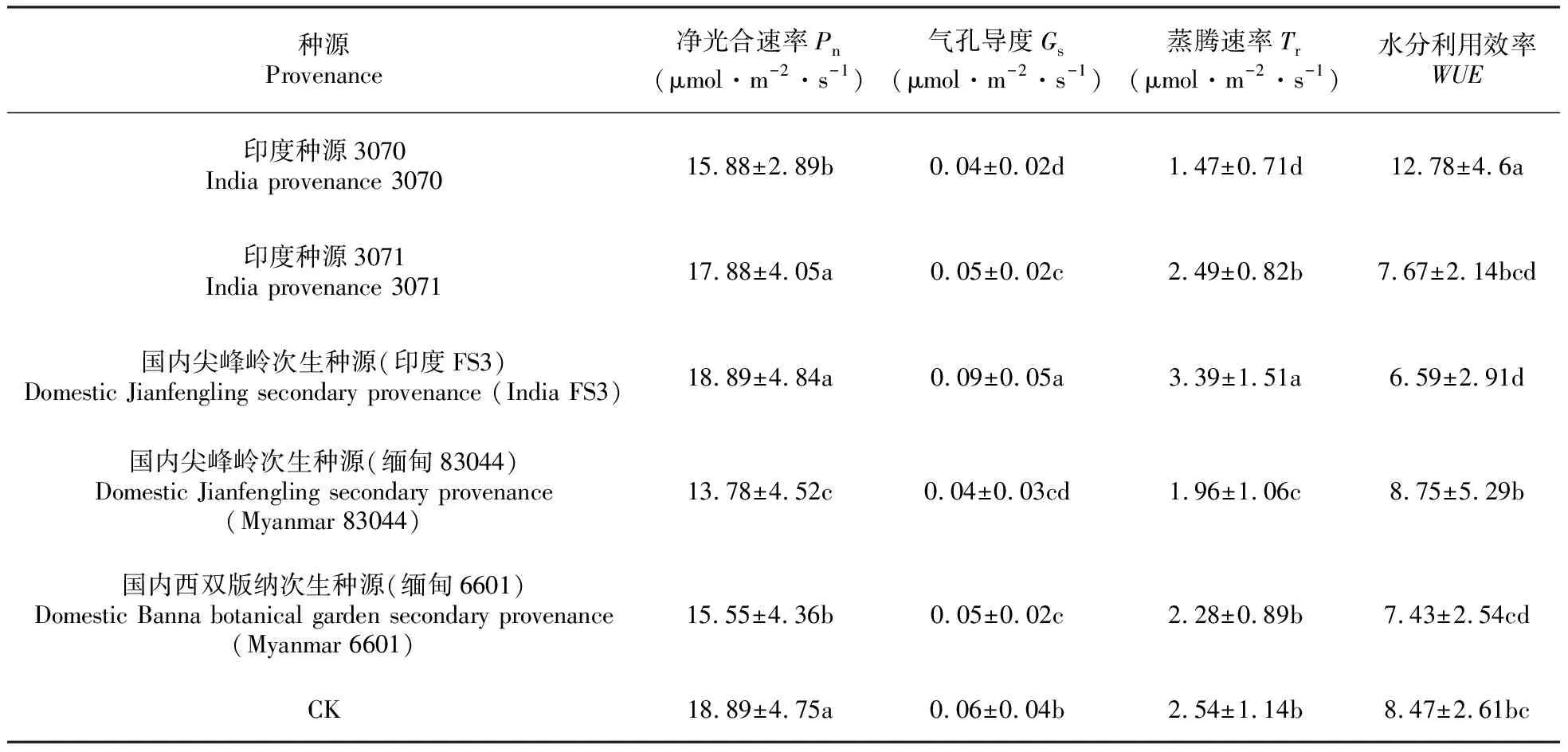
表6 柚木不同种源气体交换参数和水分利用效率特征值
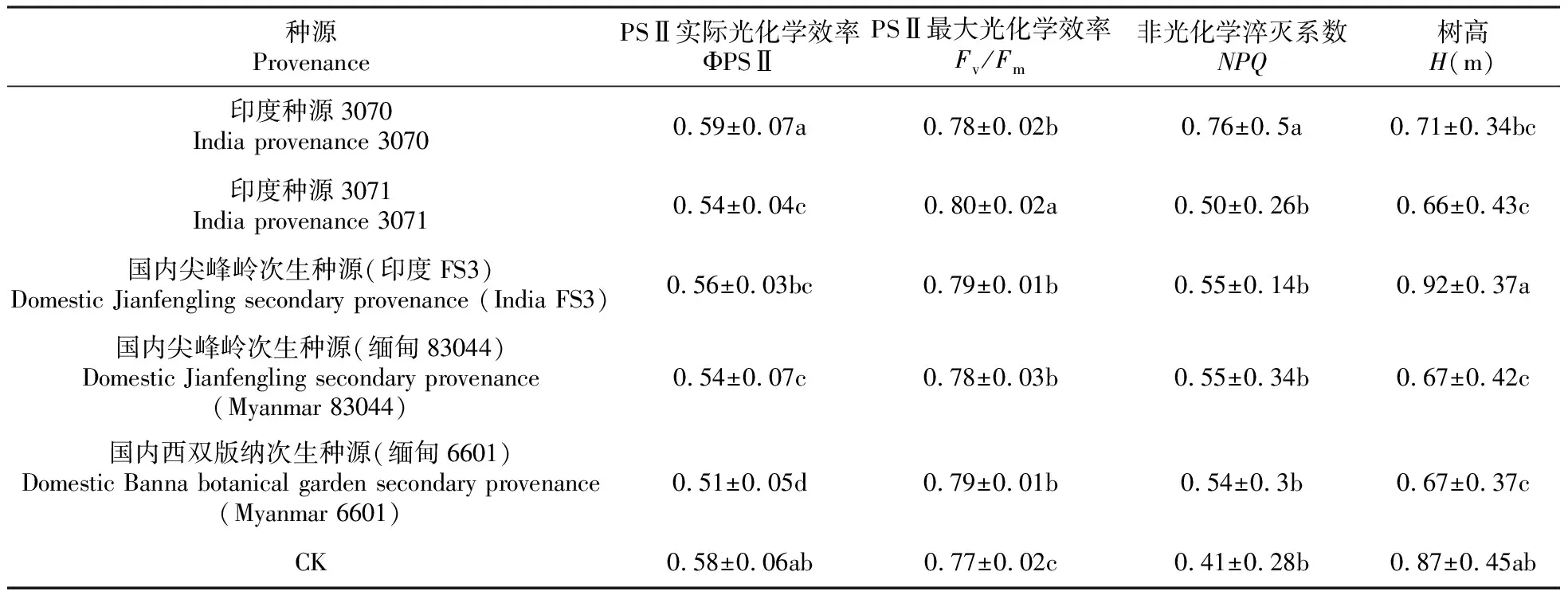
表7 柚木不同种源叶绿素荧光参数和树高特征值
表8 柚木无性系气体交换、叶绿素荧光、水分利用效率与生长参数的相关性分析
Table 8 Correlation analysis among gas exchange,chlorophyⅡ fluorescence,WUE and growth parameters of teak clones
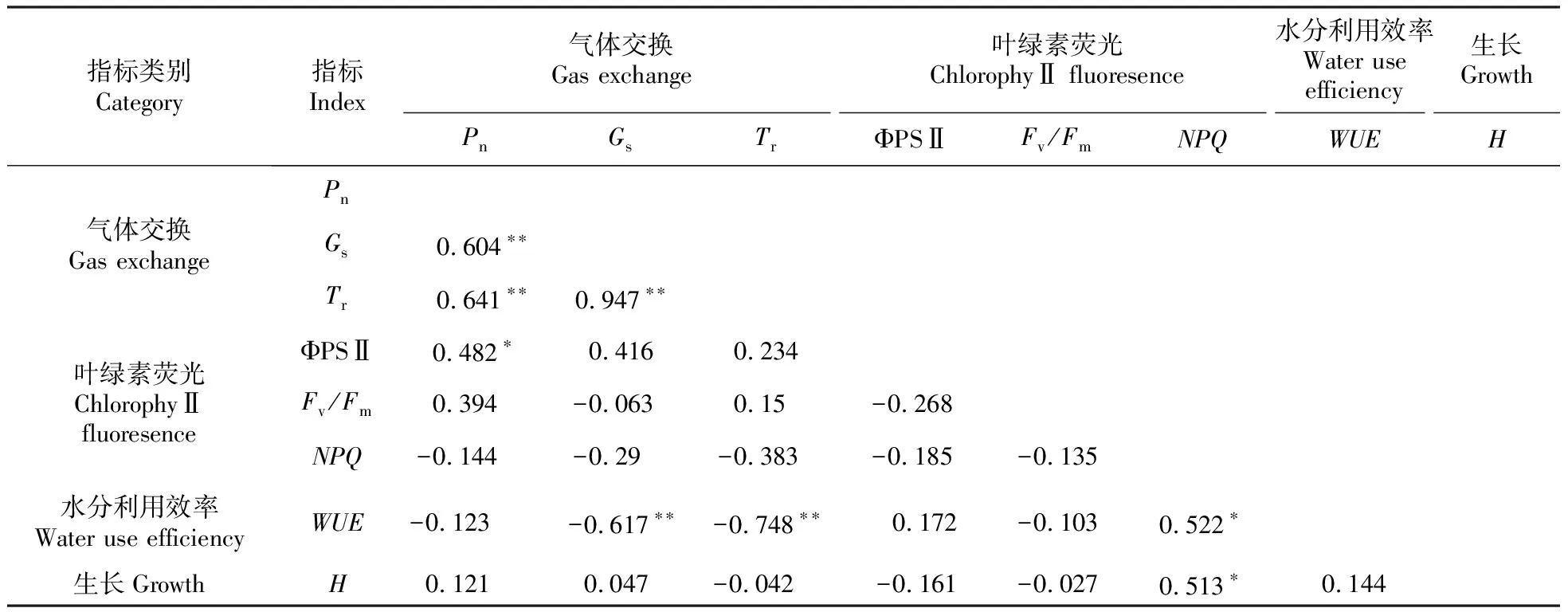
指标类别Category指标Index气体交换Gas exchange叶绿素荧光ChlorophyⅡ fluoresence水分利用效率Water use efficiency生长GrowthPnGsTrΦPSⅡFv/FmNPQWUEH气体交换Gas exchangePnGs0.604∗∗Tr0.641∗∗0.947∗∗叶绿素荧光ChlorophyⅡ fluoresenceΦPSⅡ0.482∗0.4160.234Fv/Fm0.394-0.0630.15-0.268NPQ-0.144-0.29-0.383-0.185-0.135水分利用效率Water use efficiencyWUE-0.123 -0.617∗∗-0.748∗∗ 0.172-0.1030.522∗生长GrowthH0.1210.047-0.042-0.161-0.0270.513∗0.144
2.3 柚木无性系光合特征、水分利用效率与生长的相关性
柚木无性系各参数的相关性分析表明(表8),净光合速率与气孔导度、蒸腾速率呈极显著正相关,与PSⅡ实际量子产量呈显著正相关,但与树高没有显著正相关。
柚木无性系气孔导度和蒸腾速率呈极显著正相关,说明气孔导度大,有利于蒸腾作用。但是,水分利用效率与气孔导度、蒸腾速率呈极显著负相关,说明气孔导度大,蒸腾作用强的柚木资源,其水分利用效率低。另外,柚木无性系水分利用效率、树高与非光化学淬灭系数呈显著正相关。
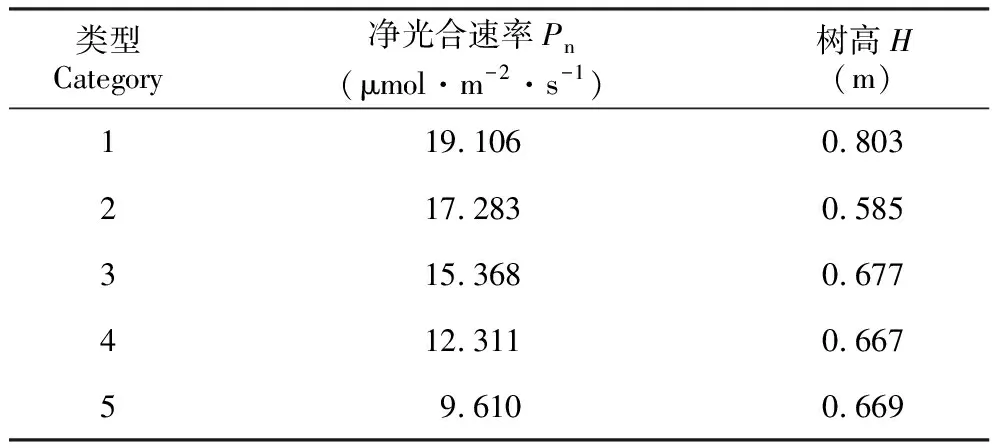
2.4 柚木无性系净光合速率和树高的聚类分析
用 SPSS软件以欧氏距离尺度对20个柚木无性系的净光合速率和树高均值进行聚类分析。根据分析结果将20个柚木无性系分为5类(图1)。第一类是CK、FS3、71-7,第二类是7114、7663、7111、7773,第三类是7514、7703、7551、6601、7549、7024,第四类是7544、7559、7886、7772、7813、7765,第五类是7552。由表9可以看出,第一类柚木无性系的净光合速率与树高均为最高。
表9 柚木无性系净光合速率与树高聚类分析结果
Table 9 The result ofPnand tree height Cluster analysis among teak clones
类型Category净光合速率Pn(μmol·m-2·s-1)树高H(m)119.1060.803217.2830.585315.3680.677412.3110.66759.6100.669

图1 柚木无性系净光合速率与树高的系统聚类图Fig.1 Cluster analysis of Pn and tree height among teak clones
3 讨论
植物的生长、产量与光合生理密切相关[3~4],植物的光合生理受遗传控制和立地因子的影响,正是遗传与立地的相互作用影响着植物的生理和生长[19]。目前,已有较多关于胁迫环境对林木光合生理影响的研究[20~23]。从育种角度出发,前期对柚木无性系多点大田测定生长性状进行了分析评价[24],本研究重点研究柚木基因资源的光合生理特征及其与生长的关系,为柚木育种的早期快速评价提供了借鉴和参考,对今后柚木资源的引种、改良和利用具有重要的理论意义和实践意义。
本研究结果表明,气体交换参数、叶绿素荧光参数以及树高在柚木无性系间都存在极显著差异,除了PSⅡ最大光化学效率Fv/Fm(0.033)变异系数较小外,其他各参数的变异系数(0.115~0.670)均较大,说明柚木不同基因型在这些性状上存在广泛的变异,这为柚木高光效新品种的培育提供了理论基础与基因资源。早期初步筛选出无性系71-7和FS3具有较高的净光合速率。进一步分析表明:柚木不同种源气体交换、叶绿素荧光和生长参数都具有丰富的变异。从柚木不同种源来看,尖峰国内次生种源(印度FS3)、印度种源3071和3070为光合效率高的柚木种源;从不同国家来看,起源于印度的柚木种质资源具有相对高的光合效率,这与黄桂华等[14]研究结果一致。但是,前期大田测定结果显示,选自缅甸柚木种源的无性系耐寒性、适应性和生长普遍优于来自印度的无性系。印度与缅甸虽然均处于热带季风气候,但其地理位置相差较大,受不同洋流的影响,气象条件不同,并且不同的立地条件、土壤性质导致两个种源的柚木生长特性差异明显,其深层次的原因,有待收集更多的柚木种源、无性系,开展不同立地条件的多地点测定,从生长、光合生理和立地因子进行综合全面的解析。本研究与前期研究[14]一致发现,大田自然生长柚木的光合速率明显高于盆栽柚木无性系光合速率,可见盆栽柚木在根系空间和水分利用上受到了一定程度的胁迫,抑制了光合作用和生长速度。另外,本研究柚木PSⅡ最大光化学效率(Fv/Fm)遗传变异系数相对其他光合生理指标较小,这与欧洲黑杨无性系的光合生理特征相似[8]。
相关性分析表明,本研究大田柚木净光合速率等光合参数与树高没有显著正相关。黄桂华等[14]研究的苗圃盆栽柚木无性系光合速率与苗高显著正相关,而和同批无性系大田的树高没有显著正相关,二者结果也相互吻合。这点和欧洲黑杨基因资源光合与生长的研究结果相同[8],其他树种研究也得出了类似的结论[25~26]。因此,通过光合生理特征进行柚木无性系早期选择,需要结合柚木大田生长测定的结果。
相关性分析还表明,水分利用率和蒸腾速率呈显著负相关关系,说明当达到一天蒸腾速率高值时,水分利用率可能会下降。这与黄桂华等[13]在广州8月和10月测得柚木无性系净光合速率的日变化为双峰曲线而出现“午休”现象相吻合,可知夏季晴天中午光照强,温度高时,蒸腾过于旺盛,水分利用率由高降低,生长可能会受到影响。
本研究柚木净光合速率和气孔导度极显著正相关,这也与前期研究[14]认为柚木净光合速率主要受气孔因素控制的结果一致。但同时植物动态光合作用不仅受自身气孔、叶绿素含量等遗传因素的影响,还受到CO2浓度、光照、养分、温度、水分等多因素综合作用,是植物内因和外因及其互作的复杂过程[27]。
本研究柚木无性系净光合速率差异远大于欧洲黑杨无性系[8]和美洲黑杨无性系[9],这是由柚木不同无性系光合生理遗传差异所决定,还是由于其他原因所导致,需要深入研究。另外,树木生长受光合效率和光合面积的共同制约[28~29],下一步还需要测定柚木不同无性系的单株叶面积,才能评选出真正光能利用率高的优良无性系。最后,有待进一步开展更多种源、更多无性系的光合生理与大田生长性状遗传变异规律的研究,进行多地点的光合生理和生长性状相结合分析。
