一种新型的R-肾上腺素生物不对称合成工艺
2020-04-07韦亚锋周勇
韦亚锋 周勇
摘 要: 目前合成R-肾上腺素的方法主要是手性拆分的方法和以氨基酸为原料通过生物法制备R-肾上腺素。传统的手性拆分工艺因工艺路线长、拆分收率低导致R-肾上腺素生产成本高。氨基酸生物转化法也因存在着杂质多且生产成本高的问题而未被广泛应用。在此,建立了一种全新的生物不对称合成方法直接制备手性药物R-肾上腺素,以2-氯-3,4-二羟基苯乙酮为原料,经甲胺化反应、成盐反应合成得到盐酸肾上腺酮,再经酶不对称催化反应合成手性药物R-肾上腺素。最优工艺参数为:氮气保护下2-氯-3,4-二羟基苯乙酮和甲胺摩尔比为1∶8,生物酶的用量为盐酸肾上腺酮重量3.3%、酶催化反应温度为(30±2)℃,酶催化反应时间为24 h,制备得到的R-肾上腺素手性纯度不低于99.0%。以生物不对称法合成R-肾上腺素,避免了手性拆分步骤,缩短了工艺流程,收率显著提高,产品杂质少,方法可行,适合于工业化生产。
關 键 词:R-肾上腺素; 生物不对称合成; 手性纯度
中图分类号:TQ 016 文献标识码: A 文章编号: 1671-0460(2020)03-0615-04
Study on Bioasymmetric Synthesis of R-Epinephrine
WEI Ya-feng1, ZHOU Yong2
(1. Bengbu BBCA Medicine Science Development Co., Ltd., Anhui Bengbu 233010, China;
2. COFCO Biochemistry (Anhui) Co., Ltd., Anhui Bengbu 233010, China)
Abstract: At present, the main methods for preparing R-epinephrine are chiral separation and bioconversion with amino acid. The traditional chiral separation resolution process has high product cost due to long process route and low yield. Amino acid bioconversion method is not widely used because of the problems of high impurities and high production cost. In this paper, a new bioasymmetric synthesis method to prepare chiral drug of R-epinephrine was established. In the specific preparation process, using 3,4-dihydroxyphenacyl chloride as raw material,adrenalone hydrochloride was synthesized by methamination reaction and salt formation reaction. And then R-epinephrine was synthesized by enzymatic asymmetric reaction. The optimal process parameters were determined as follows: the molar ratio of 3,4-dihydroxyphenacyl chloride and methylamine 1:8,the amount of biological enzyme 3.3% of the weight of adrenalone hydrochloride, the enzyme catalyzed reaction temperature (30±2)℃,the enzyme catalyzed reaction time 24 h. The chiral purity of R-epinephrine prepared under above process parameters was not less than 99.0%. Using the bioasymmetric synthesis method to prepare chiral drug of R-epinephrine avoided the chiral separation step and shorten the process flow, the yield was obviously improved, and the impurity of the product was low. So the method is feasible, and suitable for industrial production.
Key words: R-epinephrine; bioasymmetric synthesis; chiral purity
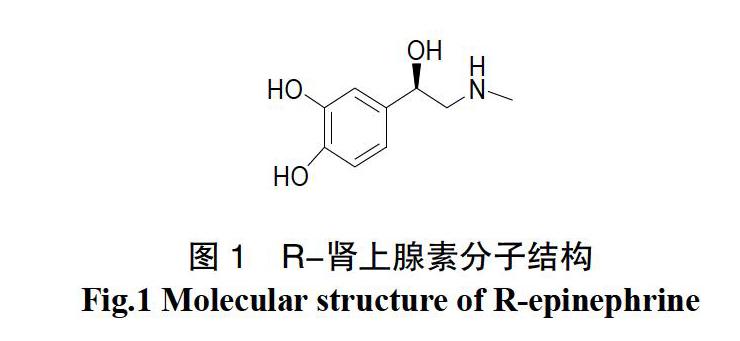
腎上腺素是人体分泌出的一种激素,它和去甲肾上腺素一样是一种α-肾上腺素能受体激动剂[1]。它会使心脏收缩力上升,使心脏、肝和筋骨的血管扩张和皮肤、黏膜的血管收缩。在肾上腺素中,存在二个对映体S-肾上腺素和R-肾上腺素,主要具有生理活性的为R-肾上腺素,其活性较S-肾上腺素强12倍[2]。R-肾上腺素临床上是用于抗休克的急救药物,它能够增强心肌收缩力,为我们全身组织灌注源源不断的血流。其分子结构见图1。
合成R-肾上腺素原料药的传统工艺路线是以2-氯-3,4-二羟基苯乙酮(氯乙酰儿茶酚)为起始原料,制备出苄基肾上腺酮中间体,再经加氢还原反应制备R,S-肾上腺素消旋体,最后通过手性拆分得到R-肾上腺素[3]。其合成工艺路线见图2。
中国专利[4]在传统的工艺路线基础上改进了催化剂,通过不对称金属手性催化剂对苄基肾上腺酮进行不对称催化,然后通过加氢反应制备了R-肾上腺素。此种金属催化的方法也有文献报道用于L-去氧肾上腺素的合成[5],但关键中间体仍然是苄基肾上腺酮。其合成工艺路线见图3。
中国专利[6]报道了以酪氨酸为原料,通过酪氨酸羟化酶生成3,4-二羟基苯丙氨酸,再通过L-脱羧酶作用脱去羧基形成多巴胺,进一步通过多巴胺羟化酶得到去甲肾上腺素,最后通过苯乙醇胺-N-转甲基酶甲基化合成肾上腺素。其合成工艺路线见图4。
以苄基肾上腺酮为关键中间体经催化加氢反应制备消旋体肾上腺素,再经手性拆分得到R-肾上腺素的传统工艺路线,其明显的缺点是工艺路线长,手性拆分收率低,生产成本高。其改进后的以手性金属催化剂对苄基肾上腺酮进行不对称转化的工艺,仍然存在着金属催化剂昂贵的缺点。然以苄基肾上腺酮为关键中间体的合成工艺路线其另一个明显的缺点是存在着苄基肾上腺酮和苄基肾上腺素杂质的存在,因为分子结构中苄基的存在导致还原过程中存在难以对苄基彻底脱除的可能。而完全以酶法对酪氨酸采取生物转化的方法制备R-肾上腺素在市场上并不是主流工艺。鉴于以上原因,目前,国内市场上尚未有大量生产R-肾上腺素的生产企业。
针对以上合成R-肾上腺素的技术缺陷,本文创造性地建立一种全新的合成工艺,以肾上腺酮代替苄基肾上腺酮中间体,开展催化还原反应,避免了苄基的引入导致肾上腺素产物中杂质的增加。同时,以特定高选择性的酶为催化剂,不对称催化还原肾上腺酮,直接将其转化为R-肾上腺素,避免传统手性拆分的合成工艺路线,也克服了使用昂贵的不对称金属催化剂的缺点。
本文建立的合成工艺以2-氯-3,4-二羟基苯乙酮为起始原料,经甲胺化反应制备盐酸肾上腺酮中间体,再经酶法不对称合成制备R-肾上腺素。其中甲胺化反应采用在无氧环境下反应,显著提高了本步骤的收率,酶法不对称合成所用的酶为具有对肾上腺酮高度选择性的羰基还原脱氢酶,盐酸肾上腺酮的不对称转化率几乎达100%。本文所述合成R-肾上腺素的方法目前尚未见文献报道,具体工艺路线见图5。
1 实验部分
1.1 主要仪器与试剂
集热式恒温加热磁力搅拌器:型号DF-101S;
2-氯-3,4-二羟基苯乙酮:杭州康多医药化工有限公司,纯度≥99.0%; 一甲胺乙醇溶液:衢州奥凯化工有限公司,浓度30%; EPI酶:自制;其余试剂购于国药集团化学试剂有限公司,分析纯。
1.2 合成方法
1.2.1 化合物1(肾上腺酮)和化合物2(盐酸肾上腺酮)的合成
将2-氯-3,4-二羟基苯乙酮(氯乙酰儿茶酚)20.0 g(0.107 mol)、一甲胺乙醇溶液88.5 g(含一甲胺0.856 mol)一起加入到500 mL单口反应瓶中,30~35℃搅拌使物料均匀。通入氮气置换反应瓶中的空气4次后通氮气保护,保温30~35 ℃下反应8 h,停止反应,过滤,得到灰绿色固体(化合物1),无水乙醇洗涤后抽干。将灰绿色固体潮品加入到烧杯中,加入乙醇和浓盐酸的混合溶液(乙醇30 mL,浓盐酸18 mL)进行成盐反应,搅拌,调反应液的pH=2~3。搅拌0.5 h后,过滤,无水乙醇洗涤,得到化合物2(盐酸肾上腺酮)白色晶体,无水乙醇洗涤,烘干后重量为19.0 g(0.0873 mol)。收率为81.6% ,HPLC归一化含量为99.8%。
1.2.2 化合物3(R-肾上腺素)的合成
将盐酸肾上腺酮15.0 g(0.069 mol)和30 mL水加入到250ml反应瓶中,搅拌至全溶。加入异丙醇30 mL、NAD(辅酶I)0.1 g和EPI酶液50 mL(含固体酶0.5 g),用浓氨水调节pH = 6.0~6.5,保温(30±2)℃,反应24 h。反应结束,抽真空去除反应液中残留的有机溶剂,得到澄清溶液。加入氨水调节反应液pH = 8.0~9.0,析出大量固体,过滤,烘干,得化合物3(R-肾上腺素)白色粉末状结晶12.1 g(0.066 mol),收率96%。含量99.5%。
2 结构鉴定
产物R-肾上腺素结构鉴定:m.p.=208.5 ℃;比旋度-52.0°(2015版中国药典为-50.0°~ -53.5°);元素分析结果为C : 58.33% (理论值59.00%),H: 7.07% ( 理论值7.15%),N: 8.01% ( 理论值7.65%);MS-ESI+图显示分子离子峰m/z 166.09 [M-OH]+、m/z 184.11 [M+H]+、m/z367.20[2M+H]+,与化合物的分子量183.2相符。
1H-NMR(400MHz,DMSO-d6,DMSO-d6+D2O)谱中,核磁共振1H、COSY、HSQC谱数据见表1,各原子归属见图6。
3 结果与讨论
3.1 甲胺化反应抗氧化措施的考察
由于甲胺化反应过程中,产物易被空气氧化导致反应液颜色加深,收率较低,因此有必要采取考察抗氧化措施以确保反应顺利进行。实验方案如下:
取反应物料2-氯-3,4-二羟基苯乙酮10.0 g(0.053 6 mol)和30%甲胺乙醇溶液40.0 g(约含甲胺13.12 g,0.424 mol),溶剂乙醇100 mL,反应温度35 ℃,HPLC法跟踪反应至化学平衡,分别采用抗氧化措施,考察甲胺化反应的进度。
抗氧化措施1:反应液中加入亚硫酸氢钠0.5 g;抗氧化措施2: 氮气保护下反应。
按照上述实验方案,HPLC法跟踪反应进度,考察结果见表2。根据实验结果可知,采取措施2对甲胺化反应进行抗氧化保护,可明显减少杂质的产生,提高肾上腺酮的含量(表2)。
3.2 物料比对甲胺化反应的影响
氮气保护下,在改变反应物料2-氯-3,4-二羟基苯乙酮(10.0 g,0.053 6 mol)和甲胺(30%甲胺乙醇)物料摩尔比的条件下,加入无水乙醇100 mL,反应温度(35±2)℃,以HPLC归一化法跟踪反应,考察改变反应物料摩尔比对甲胺化反应的影响。考察结果见表3。
根据实验结果可知,在2-氯-3,4-二羟基苯乙酮和甲胺物料比为1∶8 时,反应较为完全,反应液中产物肾上腺酮含量最高。
3.3 EPI酶用量的考察
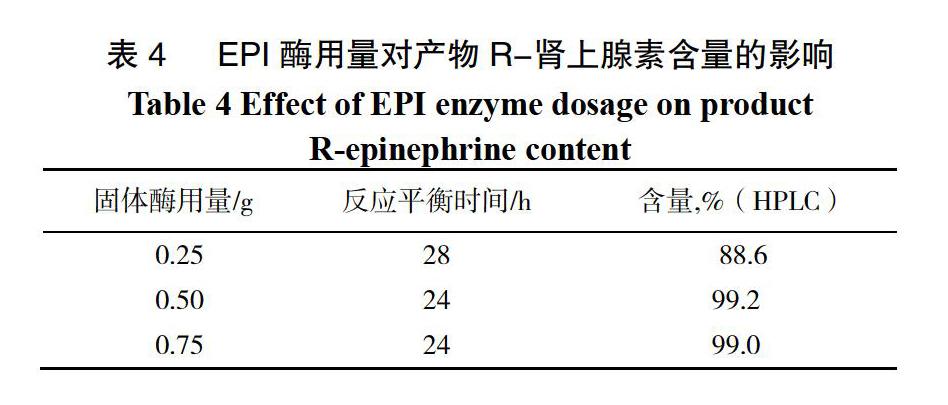
以EPI酶为不对称还原催化剂,对盐酸肾上腺酮進行不对称催化反应。反应温度(30±2)℃,以盐酸肾上腺酮15 g为底物,加入水和异丙醇各30 mL、NAD 0.1 g,分别考察加入不对称转化酶EPI酶液25 mL(含固体酶0.25 g)、50 mL(含固体酶0.5 g)和75 mL(含固体酶0.75 g)时,对肾上腺酮还原反应的影响。以HPLC归一法跟踪反应液中R-肾上腺素的含量,确定反应终点。考察结果见表4。
根据实验结果可知,当固体酶用量0.5 g时,即用量盐酸肾上腺酮重量的3.3%时,可以满足酶催化还原反应的要求,合成出高纯的R-肾上腺素。
3.4 酶催化反应温度的考察
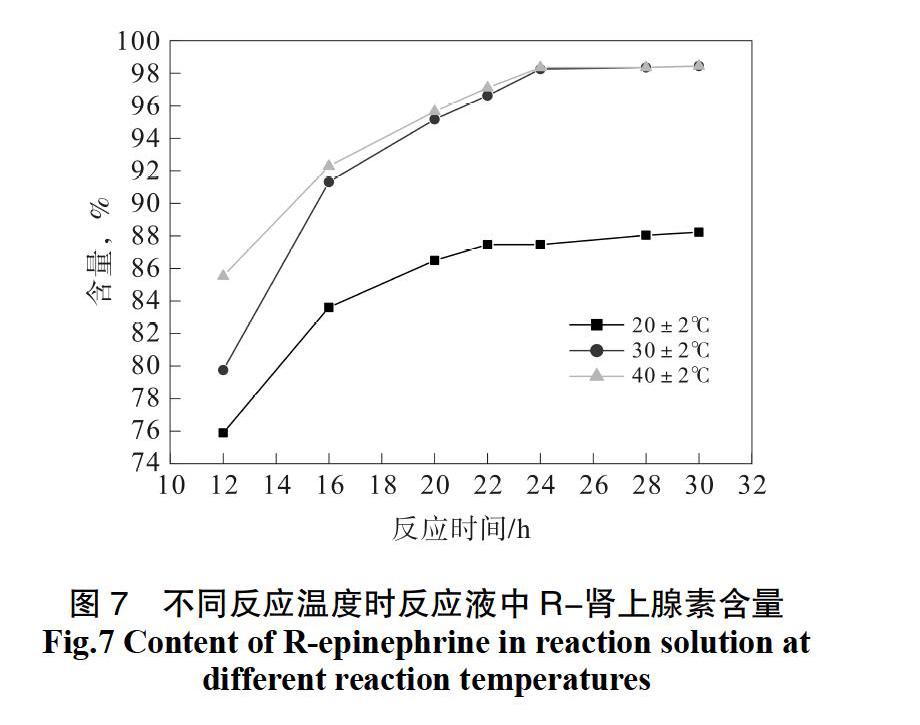
按照3.3的实验方案投料,固体酶用量为0.5 g,分别考察(20±2)℃、(30±2)℃、(40±2)℃的反应温度对不对称还原反应的影响。HPLC归一化法跟踪反应液中R-肾上腺素的含量,以确定反应平衡时间。考察结果见图7。
根据实验结果可知,当反应温度为(30±2)℃时,不对称还原反应的效果较好,反应液中R-肾上腺素的含量达99.2%。
4 结 论
生物酶法不对称合成R-肾上腺素的工艺步骤中,甲胺化反应必须采取抗氧化保护措施以避免产生大量的氧化杂质,其中氮气保护法优于加入还原剂亚硫酸氢钠的方法。氮气保护下2-氯-3,4-二羟基苯乙酮和甲胺物料比为优选为1∶8。酶催化还原反应中催化剂EPI酶的用量优选为盐酸肾上腺素酮重量的3.3%,最佳反应温度为(30±2)℃。本文以生物不对称法合成R-肾上腺素,方法可行,反应条件温和,收率高,与传统手性拆分法相比,缩短了工艺路线,降低了成本,适合于工业化生产。
参考文献:
[1] 杨淋森,乔海燕,曹祖斌,李霞,耿静,郭兴辉.B-Z化学震荡法测定重酒石酸去甲肾上腺素[J].当代化工,2018,47(4):802-805.
[2] TAN Shijie.The Pharmacological Basis of Therapeutics ( Vol 1) ( 上册)[M]. Beijing: Peoples Medical Publishing House,1987:126.
[3] Yadav Ramprasad, Shaikh, Zakir Gafoor, et al. Process for the preparation of Epinephrine: WO,2009004593[P]. 1-12.
[4] 贝林格尔英格海姆法玛公司.肾上腺素的制备方法:CN,1368949[P]. 1-7.
[5] 李国华,张文博,石兆瑞等.L-去氧肾上腺素合成研究进展 [J].化工进展,2015,34(11): 4036.
[6] 徐小平,李忠琴等.一种生物不对称转化制备R-肾上腺素的方法 :CN ,101906457[P]. 1-9.
