酸性电解水对4 ℃贮藏鲈鱼片品质的影响
2020-04-07向雅芳熊光权乔宇汪兰吴文锦丁安子李新石柳卢素芳黎彩
向雅芳 熊光权 乔宇 汪兰 吴文锦 丁安子 李新 石柳 卢素芳 黎彩

摘 要:探究酸性电解水(acidic electrolyzed water,AEW)处理后鲈鱼片4 ℃贮藏期间品质指标、微生物多样性及其菌群动态变化。分别采用AEW浸泡3(AEW1)、5(AEW2)、7 min(AEW3)的方式对鲈鱼片进行处理,测定鲈鱼片的感官评分、菌落总数、挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量与pH值,采用高通量测序技术分析4 ℃条件下贮藏鲈鱼片中全部微生物的16S rDNA序列,比较各组鲈鱼片菌群的物种组成和丰度,通过Alpha多样性分析和主坐标分析考察AEW处理鲈鱼片的微生物菌群组成。结果表明:AEW处理对鲈鱼片有一定的抑菌效果,其中AEW2组的保鲜效果较为明显,且感官评分较高;贮藏0、3 d的8 组样品中共有27 个门、576 个属的微生物,基于门水平,鲈鱼片的优势菌为厚壁菌门(Proteobacteria);基于属水平,鲈鱼片的优势菌为不动杆菌属(Acinetobacter),AEW2组鲈鱼片贮藏末期不动杆菌属相对丰度明显降低。上述结果表明,AEW能有效抑制鲈鱼片中微生物的生长繁殖,尤其是优势菌不动杆菌属。
关键词:酸性电解水;鲈鱼片;微生物;品质变化
Abstract: The objective of our present work was to investigate changes in the quality indicators and microbial diversity and community structure of largemouth bass fillets treated with acidic electrolyzed water (AEW) during storage at 4 ℃. Largemouth bass fillets were soaked in AEW for 3 (AEW1), 5 (AEW2) or 7 min (AEW3). The sensory score, total colony count, total volatile basic nitrogen (TVB-N) content and pH value of fish fillets were determined. High-throughput sequencing technology was used to analyze the 16S rDNA sequences of all microbes in fish fillets. The species composition and abundance of microbial community were compared among the experimental groups. Alpha diversity analysis and principal coordinate analysis (PCoA) were used to investigate the microbial community composition. Results indicated that AEW treatment had an antibacterial effect in largemouth bass fillets. Notably AEW2 exhibited good quality preservation with high sensory scores. In 8 groups of samples stored for 0 and 3 d, a total of 576 bacteria genera belonging to 27 phyla were detected, and the dominant phylum and genus were Proteobacteria and Acinetobacter respectively. In the AEW2 group, the relative abundance of Acinetobacter was significantly reduced at the late stage of storage. In conclusion, acidic electrolyzed water can effectively inhibit the growth and reproduction of microorganisms in largemouth bass fillets, especially the dominant bacteria Acinetobacter.
Keywords: acidic electrolyzed water; largemouth bass fillet; microorganism; quality change
電解水杀菌技术作为一种新型非热杀菌技术,常用于食品加工、农业生产等方面。电解水最初由俄罗斯研究人员发明,并应用于水净化、水再生和医疗器械消毒[1]。电解水又称为氧化电位水,是通过电解槽将NaCl或K2CO3溶液进行电解,并用隔膜分离而生成的酸性电解水(acidic electrolyzed water,AEW)和碱性电解水[2]。AEW是一种新型、绿色、环保杀菌剂[3],目前,对于AEW杀菌机制的研究较多,AEW杀菌的主要影响因素包括pH值、氧化还原电位(oxidation reduction potential,ORP)、活性氧和有效氯等[4]。王文清等[5]认为,AEW杀菌以有效氯为主要影响因素,其他因素(pH值、ORP、活性氧等)具有协调作用。还有一些学者认为,AEW通过破坏微生物的细胞壁和细胞膜以达到杀菌效果[6-8]。对于AEW的杀菌机制尚未有明确的定论,还需进一步研究与探讨。
AEW具有瞬时、广谱、高效、安全和无残留的杀菌特性[9],适用于水产品加工。许多研究人员发现,AEW不仅能延缓虾的腐败变质[10-12],改变虾肠道微生物的多样性[13],而且能抑制多酚氧化酶活性[14-16]。AEW能明显抑制鱼类腐败微生物的生长繁殖,如产气肠杆菌(Enterobacter aerogenes)[17]、摩氏摩根菌(Morganella morganii)[18]、大肠杆菌[19]、单增李斯特菌、沙门氏菌及副溶血性弧菌等[20-21]。AEW还可以与其他杀菌方式结合,Huang等[22]采用AEW结合CO气体处理改善金枪鱼鱼排的卫生质量和鲜度,以延长金枪鱼鱼排冷藏时间;Mahmoud等[23]发现,AEW结合精油化合物处理能显著抑制鲤鱼片脂类氧化,并延长鲤鱼片的保质期;Xu Guangchun等[24]采用AEW结合壳聚糖处理鲱鱼,在抑制微生物生长、蛋白质降解和脂质氧化方面有一定效果。
目前,AEW已被广泛应用于水产品保鲜研究,有关AEW对鲈鱼微生物组成的影响研究较少,本研究以大口黑鲈为研究对象,分析鱼肉经AEW处理后4 ℃冷藏条件下菌落总数、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、pH值及微生物群落的变化情况,为进一步研究大口黑鲈的腐败变质机理提供借鉴,同时为AEW技术在水产品安全中的应用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜鲈鱼(大口黑鲈)购于湖北省武汉市武商量贩农科院店。选择的鲈鱼大小一致、体质量400~600 g,鱼体鱼鳍无破损,鱼鳃鲜红,鱼眼饱满、黑白分明、無浑浊,肉质弹性较好,冰藏条件下30 min内运至实验室进行处理。
真空高温蒸煮袋(聚乙烯材质,8 cm×8 cm) 雄县旭日真空包装有限公司。硫酸、盐酸、氯化钠、乙醇、冰乙酸、2-硫代巴比妥酸、无水碳酸钠、硼酸、三氯乙酸、高氯酸、氢氧化钠(均为分析纯) 国药集团化学试剂有限公司;营养琼脂 青岛高科技工业园区海博生物技术有限公司;溴甲酚绿、甲基红、次甲基蓝(均为分析纯) 连云港市鑫源化工股份有限公司。
1.2 仪器与设备
LCE-NC-1500 AEW制水机 湖北珞格商用设备有限责任公司;JHK-A洁净工作台 天津市中环实验电炉有限公司;SPX-250B-Z生化培养箱 上海博讯实业有限公司医疗设备厂;FSH-2A可调高速均质机 常州越新仪器制造有限公司;DZD-400/S真空包装机 江苏腾通包装机械有限公司;FG2 pH计、pH/ORP测定仪 梅特勒-托利多仪器(上海)有限公司;RC-3F高浓度有效氯质量浓度(available chlorine concentration,ACC)测定仪 北京中西远大科技有限公司;3K15高速冷冻离心机 北京博劢行仪器有限公司。
1.3 方法
1.3.1 AEW制备
用AEW制水机制得AEW,将AEW装入棕色瓶。测定AEW pH值、ORP及ACC。由于AEW中有效氯具有时效性,实验中AEW均采取现制现用的方式。经测定,本研究所用AEW pH值为2.60±0.05,ORP为(1 147.00±0.58) mV,ACC为(60±1) mg/L。
1.3.2 鲈鱼前处理与分组
将新鲜宰杀的鲈鱼置于冰盒中暂时贮存,迅速用灭菌超纯水对鲈鱼进行冲洗,将鱼体清洗干净,沥水。将鲈鱼去皮、取背肉,切成相同尺寸(2 cm×3 cm×1 cm)的块状鱼片,随机分成4 份:1)未经AEW处理(对照组,CK);2)AEW浸泡处理3 min(AEW1);3)AEW浸泡处理5 min(AEW2);4)AEW浸泡处理7 min(AEW3)。沥水1 min后,将所有鱼片立即真空包装并置于4 ℃条件下冷藏3 d,每组3 个平行,每天测定1 次指标。
1.3.3 指标测定
1.3.3.1 感官评价
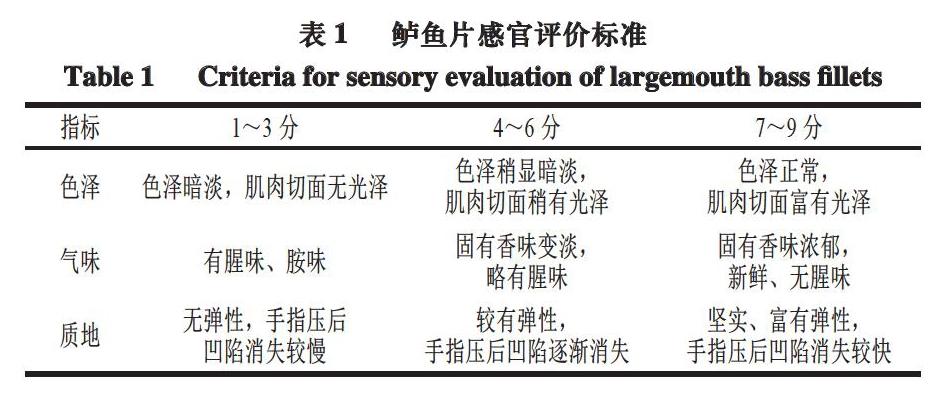
感官评价小组由6 名经过培训的评价员组成,以鲈鱼片的色泽、气味、质地作为评价标准进行感官评价,标准如表2所示,最高分为9 分,最低分为1 分。其中7~9 分为感官一级鲜度,4~6 分为感官二级鲜度,小于4 分为不新鲜。感官评价总分通过加权统计计算,分别设置色泽、气味、质地3 个指标权重为0.3、0.4、0.3,所得评分结果取平均值。
1.3.3.2 菌落总数测定
参考GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[25]。取10 g鱼肉剪碎并加入90 mL无菌生理盐水,充分振荡,取合适梯度的稀释液1 mL于营养琼脂培养基中,适当摇匀,冷却凝固后,翻转平板,放置在30 ℃恒温箱内培养72 h,进行菌落计数。
1.3.3.3 TVB-N含量测定
参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[26]。取10 g鱼肉于均质杯中,加入50 mL 20 g/L三氯乙酸溶液,均质2 min,过滤;取滤液进行TVB-N含量测定。
1.3.3.4 pH值测定
参考GB/T 5009.45—2003《水产品卫生标准的分析方法》[27]中的酸度计法。取10 g鱼肉,剪碎,加入100 mL去离子水,均质,静置30 min,过滤,取滤液50 mL,用pH计进行测定。每个处理组测定2 次,取平均值。
1.3.3.5 总DNA提取与聚合酶链式反应(polymerase chain reaction,PCR)扩增
参考张皖君等[28]的方法。将1.3.2节处理过后样品均置于-18 ℃下冷冻,无菌状态下取出样品;采用OMEGA E.Z.N.ATM Mag-Bind Soil DNA Kit试剂盒提取样品中总菌群的基因组DNA。用琼脂糖凝胶电泳检测DNA完整性,置于-20 ℃备用。PCR所用引物已融合Miseq测序平台的V3~V4通用引物341F(5′-CCTACGGGNGGCWGCAG-3′)与805R(5′-GACTACHVGGGTATCTAATCC-3′)。其中包括2 轮PCR扩增。第1轮扩增,30 ?L PCR反应体系:2×Taq Master Mix 15 ?L、10 ?mol/L引物各1 ?L、DNA模板10 ng,加ddH2O至30 ?L,PCR扩增条件为:94 ℃预变性3 min,94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5 个循环,94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,20 个循环,72 ℃延伸5 min。第2轮扩增,引入Illumina桥式PCR兼容引物,DNA模板加入量20 ng,PCR扩增条件为:95 ℃预变性30 s,95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸30 s,5 个循环,72 ℃延伸5 min。
第2轮PCR扩增产物进行琼脂糖凝胶电泳,观察扩增效果。
1.3.3.6 PCR产物纯化及测序
使用SanPrep柱式DNA胶回收试剂盒对DNA进行回收,使用Qubit 3.0 DNA检测试剂盒对回收的DNA进行精确定量,按照体积比1∶1等量混合后測序。由北京博云华康基因科技有限公司进行Illumina MiSeq高通量测序。
1.4 数据处理
各组实验均做3 个平行,数据间差异通过SPSS 22.0统计软件中的Duncans新复极差法进行方差分析和多重比较,P<0.05表示差异显著;采用Origin 8.0软件绘图。
2 结果与分析
2.1 AEW对鲈鱼片贮藏期间感官评分的影响
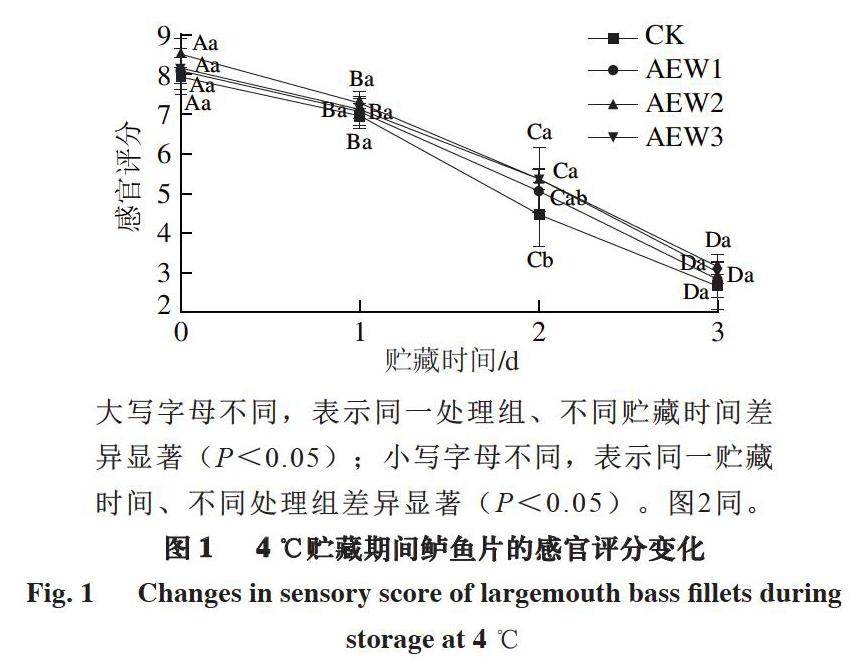
大写字母不同,表示同一处理组、不同贮藏时间差异显著(P<0.05);小写字母不同,表示同一贮藏时间、不同处理组差异显著(P<0.05)。图2同。
由图1可知,在贮藏期间,各组鲈鱼片的感官评分均呈现下降趋势。贮藏第3天,CK组鲈鱼片感官评分明显低于3 个处理组,且感官评分低于4,鱼肉已不新鲜,而AEW1、AEW2、AEW3组间无显著差异。蓝蔚青等[29]也发现,带鱼样品AEW处理组之间的感官评分差异不显著,但与CK组差异明显。贮藏末期(3 d),各处理组鲈鱼片均出现不同程度的腐败变质,CK、AEW1、AEW2、AEW3组的感官评分分别降低至2.68、2.84、3.16、3.02,其中CK组鲈鱼片腐败变质最为明显,鱼肉颜色暗淡,且有腥臭味。在整个贮藏过程中,AEW2处理组鲈鱼片感官评分始终高于其他3 组,且下降趋势较为平缓,说明AEW2处理组有一定的保鲜效果。岑剑伟等[30]也发现,微酸性电解水处理后的罗非鱼片,贮藏期间感官评分均高于CK组。
2.2 AEW对鲈鱼片贮藏期间菌落总数的影响
一般认为,淡水鱼菌落总数达到106 CFU/g时鱼体已经腐败,超过可食用限度[31-32]。由图2可知,随着贮藏时间的延长,CK、AEW1、AEW2、AEW3组鲈鱼片菌落总数均呈现上升趋势,其中AEW1、AEW2、AEW3组明显低于CK组,说明AEW可以有效抑制鲈鱼片的腐败变质,一定程度上延长其保质期。周然[33]、赵莉[34]等也发现,AEW可有效延缓河豚和南美白对虾菌落总数的升高,起到一定的抑菌效果。这主要是由于细菌酶的巯基遭到AEW中氯气、次氯酸、次氯酸根、二氧化氯等的破坏,导致其代谢受阻;AEW pH值较低,能够破坏微生物表面结构中的两性物质,如寡肽、多糖等,从而增加细胞膜通透性,微生物代谢被中断,导致微生物死亡[35]。同时,AEW具有较高的ORP,氧化性强,可吸收细菌细胞膜上的电子,破坏细胞膜的平衡,使抗菌物质更容易进入细菌内部,从而干扰细菌代谢,最终导致细菌死亡[36]。贮藏0 d时,CK、AEW1、AEW2、AEW3组鲈鱼片菌落总数分别为5.22、5.08、4.73、5.00(lg(CFU/g)),其中AEW2组显著低于CK组(P<0.05),AEW1、AEW3组明显高于AEW2组,这可能是由于AEW1组AEW浸泡鲈鱼片的时间较短,抑菌效果较小,而AEW3组AEW浸泡鲈鱼片时间过长,导致其中的有效氯部分挥发,抑菌效果降低。李建雄等[37]同样发现,与CK组相比,AEW组冷却肉的菌落总数明显降低。贮藏第3天,CK、AEW1、AEW2、AEW3组鲈鱼片菌落总数分别为6.34、6.20、5.39、5.37 (lg(CFU/g)),其中CK、AEW1组均超过6.00 (lg(CFU/g)),达到腐败程度,而AEW2组仍在可食用范围内。综上所述,AEW处理在鲈鱼片冷藏期间有一定的抑菌作用,其中AEW2组抑菌效果最为明显。
TVB-N是指在微生物活动和内源酶作用下,鱼肉中蛋白质分解产生的肽及氨基酸等,氨基酸还能降解成分子质量更小的物质,其中氨和胺类物质呈碱性并具有挥发性[38]。由图3可知,随着贮藏时间的延长,4 组鲈鱼片的TVB-N含量均呈现上升趋势,这是由于鱼肉中含有极易氧化的高不饱和脂肪酸,同时在微生物作用下产生氨、胺类碱性物质[39]。4 ℃贮藏期间,AEW1、AEW2、AEW3组鲈鱼片TVB-N含量明显低于CK组,说明AEW处理能延缓鱼肉的腐败变质。贮藏0 d时,与CK组相比,AEW1、AEW2、AEW3组鲈鱼片TVB-N含量分别下降1.19、0.56、1.54 mg/100 g,说明贮藏初期AEW对鱼肉有一定的抑菌效果,这与蓝蔚青等[39]研究结果一致。TVB-N含量上限可根据不同鱼类产品来设定[40]。有研究发现,银鲤的TVB-N含量可接受上限为35~40 mg/100 g,大口黑鲈为10 mg/100 g[41-42]。由于TVB-N含量在贮藏过程中的变化主要是微生物繁殖造成的,根据已有的菌落总数结果确定货架期(3 d),设定12 mg/100 g作为鲈鱼片TVB-N含量的可接受上限。贮藏3 d时,CK、AEW1、AEW2、AEW3组鲈鱼片TVB-N含量分别为12.81、10.71、10.29、11.20 mg/100 g,其中CK组鲈鱼片已超过食用限度,达到腐败程度,AEW2组TVB-N含量最小,对鲈鱼片的抑菌效果较好,这与菌落总数测定结果一致。
Al-Bachir[43]、张晗[44]等采用电子束对鲈鱼进行辐照处理,结果表明,贮藏初期对照组TVB-N含量显著低于辐照组;赵宏强等[45]利用超高压处理鲈鱼,发现贮藏初期超高压组TVB-N含量与对照组无明显差异;潘艳艳等[46]发现,壳聚糖处理鲈鱼贮藏前期的TVB-N含量与对照组较为接近。而本研究中贮藏初期,AEW处理鲈鱼片TVB-N含量明显低于CK组。可见,AEW对鲈鱼片贮藏前期TVB-N含量的增加有抑制作用。
2.4 AEW对鲈鱼片贮藏期间pH值的影响
pH值是判断鱼肉品质优劣的指标之一。由表2可知:CK、AEW1、AEW2、AEW3组鲈鱼片初始pH值分别为5.93、5.90、5.97、6.03,4 组差异不显著;贮藏1 d时,与初始值相比,CK、AEW1、AEW2、AEW3组鲈鱼片pH值分别上升0.12、0.11、0.14、0.12;贮藏2 d后,4 组鲈鱼片pH值略有下降。鲈鱼片贮藏0~2 d期间pH值呈现先上升后下降的趋势,可能是由于微生物代谢分解蛋白质,从而产生胺类物质,导致pH值上升,同时糖原被分解,产生的二氧化碳等酸性物质溶于鱼肉中使pH值下降[47]。贮藏2~3 d期间,AEW1、AEW2、AEW3组鲈鱼片pH值略有上升,这是由于微生物适应贮藏环境后大量繁殖,产生胺类碱性物质,导致pH值上升。综上所述,AEW处理后鲈鱼片冷藏期间pH值出现微小的波动变化。
2.5 AEW处理鲈鱼片贮藏期间微生物Alpha多样性分析
由图4可知,随着测序深度的提高,稀释曲线趋于平缓,说明此次测序量合理,测序深度已基本覆盖样品中的所有物种,能很好地体现样品微生物的多样性和分布,测序结果可代表4 ℃贮藏条件下鲈鱼片各样品中细菌群落的分布情况。
通过基于Illumina MiSeq平台的高通量测序分析贮藏初始阶段(第0天)和腐败时(第3天)鲈鱼片的微生物群落组成。由表3可知,样品经质控、过滤处理后,通过细菌16S rRNA基因Illumina测序获得总共1 500 212 个高质量读数,每个样品的有效序列数均在10 000以上,有效序列百分比达50%以上,表明测序所得到的有效序列可达到后续微生物多样性分析的要求。在97%相似水平下,进行OTU生物信息统计,随着贮藏时间的延长,CK、AEW1、AEW2组鲈鱼片OTU数量明显增加,AEW3组贮藏末期较少,表明AEW3组鲈鱼片菌群种类较少。贮藏0 d时,AEW3组鲈鱼片ACE指数、Chao1指数最高,香农指数最大且辛普森指数最小,说明贮藏初期AEW3组鲈鱼片的物种丰富度和微生物多样性最大。CK、AEW1、AEW2组鲈鱼片贮藏第3天的ACE指数、Chao1指数和辛普森指数明显高于第0天,而AEW3组贮藏第3天的ACE指数、Chao1指数和香农指数明显低于第0天,表明AEW3组鲈鱼片贮藏末期微生物群落丰富度和多样性降低。
2.6 AEW处理鲈鱼片贮藏期间细菌群落结构分析
通过高通量测序得到8 组4 ℃条件下贮藏鲈鱼片门水平的菌群变化情况,共27 门。由图5可知,细菌群落中门水平相对丰度大于1%的为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)。贮藏0 d时,CK、AEW1、AEW2、AEW3组鲈鱼片中占比最大的为变形菌门,相对丰度分别为42.41%、36.49%、44.65%、40.04%。贮藏3 d时,CK、AEW1、AEW2、AEW3组鲈鱼片中变形菌门的相对丰度分别增加至60.09%、59.91%、64.42%、65.03%,而拟杆菌门相对丰度分别降低至7.04%、9.09%、14.97%、10.74%,说明贮藏期间鲈鱼片的优势菌为变形菌门。
由图6可知,基于属水平绘制AEW处理鲈鱼片贮藏期间微生物群落结构变化图,所有样品细菌群落分为576 个属,不同贮藏阶段鲈鱼片的菌群结构存在一定差异。贮藏初期(第0天),4 组样品的菌群结构主要以不动杆菌属(Acinetobacter)和未分类菌属为主,其中占比最大的为不动杆菌属,CK、AEW1、AEW2、AEW3组相对丰度分别为14.87%、8.85%、17.21%和11.55%。不动杆菌为淡水鱼中常见的细菌。Parlapani等[49]研究养殖海鲈的初始微生物结构时发现不动杆菌。王玲[50]研究AEW处理对鲟鱼冰温贮藏品质的影响时也发现,鲟鱼贮藏初始阶段优势菌为不动杆菌属。随着贮藏时间的延长,鲈鱼片细菌群落结构发生变化,贮藏末期(第3天),CK、AEW1、AEW2、AEW3组鲈鱼片乳球菌属(Lactococcus)相对丰度分别增长至4.48%、8.59%、7.33%、12.23%,其中AEW3组鲈鱼片乳球菌属相对丰度增长较为迅速。Saraoui等[51]认为,乳球菌属与食品腐败有关,可能由于贮藏期间AEW中有效氯成分挥发,抑菌效果降低,导致微生物生长繁殖。AEW2组鲈鱼片不动杆菌属相对丰度由贮藏初期(第0天)的17.21%下降到贮藏末期(第3天)的3.39%,说明AEW2组鲈鱼片中优势菌(不动杆菌属)的生长繁殖受到一定的抑制作用。
热图使用颜色及其深度的变化来表示不同属的相对丰度。由图7可知,贮藏第0天时,CK、AEW1、AEW2、AEW3组样品中不动杆菌属相对丰度较高,贮藏3 d后,不动杆菌属相对丰度明显降低。基于属的丰度相似性,分别在热图上方和左侧构建样本聚类树。样品的聚类分析表明,8 个样本可以组成2 个主要分支,贮藏0 d样品形成1 个分支,贮藏3 d样品形成另1 个分支,说明贮藏初期与末期,鲈鱼片的微生物组成有明显变化。第1分支由2 个簇中的4 个样品组成,贮藏0 d时,AEW1组形成第1簇,CK、AEW2、AEW3组形成第2簇。第2分支中,贮藏3 d时,CK组作为1 簇,AEW1、AEW2、AEW3组为另外1 簇。
2.7 AEW处理鲈鱼片贮藏期间微生物物种主坐标分析(principal co-ordinates analysis,PCoA)采用QIIME及UniFrac软件进行Beta多樣性分析,用来表示样本中微生物菌落组成的相似程度。图中每个点代表1 个样本,点与点之间的距离通过2 个菌群间的序列相似度比较得到[52]。基于bray_curtis距离绘制PCoA图。
由图8可知,PCoA1的贡献率为58.02%,PCoA2的贡献率为13.49%,累计贡献率超过70%,说明样本组间差异有统计学意义。贮藏第0天与贮藏第3天的样品距离较远,说明贮藏初期与贮藏末期的样品微生物多样性变化明显。贮藏0 d时,AEW1组与AEW2组样品距离较近,表明2 组鲈鱼片贮藏初期的菌群组成相近。贮藏3 d时,AEW2组与AEW3组样品距离较近,表明2 组鲈鱼片贮藏末期微生物菌群组成相近。
3 结 论
探讨AEW对鲈鱼片4 ℃贮藏过程中微生物组成和品质的影响。AEW2组鲈鱼片贮藏期间感官特性较好。CK组鲈鱼片的菌落总数在第3天时超出食用范围,也反映在TVB-N含量上,而AEW2组鲈鱼片的菌落总数、TVB-N含量较低,说明AEW2组处理有一定的抑菌作用。AEW处理鲈鱼片4 ℃贮藏期间pH值出现微小波动。采用高通量测序技术分析4 ℃条件下贮藏鲈鱼片的微生物菌落组成,发现AEW3组鲈鱼片贮藏末期微生物群落丰富度和多样性降低,鲈鱼片的微生物菌落主要由27 个门、576 个属组成。基于门水平,鲈鱼片的优势菌为变形菌门;基于属水平,鲈鱼片的优势菌为不动杆菌属,贮藏末期,AEW2组鲈鱼片属水平物种相对丰度明显降低。AEW能抑制鲈鱼片优势菌不动杆菌属的生长繁殖,延长其保质期,本研究为后续水产品的贮藏与保鲜研究提供了参考。
参考文献:
[1] HRICOVA D, STEPHAN R, ZWEIFEL C. Electrolyzed water and its application in the food industry[J]. Journal of Food Protection, 2008, 71(9): 1934-1947. DOI:10.4315/0362-028x-71.9.1934.
[2] 杜明润, 李信, 肖伟, 等. 电解水与电解水技术的研究进展[J]. 长江蔬菜, 2018(10): 27-29.
[3] JEONG J, KIM J Y, YOON J. The role of reactive oxygen species in the electrochemical inactivation of microorganisms[J]. Environmental Science and Technology, 2006, 40(19): 6117-6122. DOI:10.1021/es0604313.
[4] 赵永强, 张红杰, 李来好, 等. 水产品非热杀菌技术研究进展[J]. 食品工业科技, 2015, 36(11): 394-399. DOI:10.13386/j.issn1002-0306.2015.11.071.
[5] 王文清, 陈红梅, 张选明, 等. 酸性氧化电位水制备和杀菌机理的研究进展[J]. 现代化工, 2008, 28(11): 24-28. DOI:10.3321/j.issn:0253-4320.2008.11.005.
[6] LIAO L B, CHEN W M, XIAO X M. The generation and inactivation mechanism of oxidation-reduction potential of electrolyzed oxidizing water[J]. Journal of Food Engineering, 2007, 78(4): 1326-1332. DOI:10.1016/j.jfoodeng.2006.01.004.
[7] 王春芳, 于勇, 和勁松, 等. 酸性电解水杀菌技术在农业中的应用[J]. 农业工程, 2012, 2(9): 33-37.
[8] 谢军, 孙晓红, 潘迎捷, 等. 酸性电解水在水产品安全中的应用[J]. 渔业现代化, 2010, 37(2): 55-58. DOI:10.3969/j.issn.1007-9580.2010.02.013.
[9] 朱志伟, 李保明, 张玥, 等. 不同处理对酸性电解水物理化学特性的影响[J]. 食品科技, 2008, 33(5): 119-122. DOI:10.3969/j.issn.1005-9989.2008.05.036.
[10] LIN Ting, WANG Jingjing, LI Jibing, et al. Use of acidic electrolyzed water ice for preserving the quality of shrimp[J]. Journal of Agricultural and Food Chemistry, 2013, 61(36): 8695-8702. DOI:10.1021/jf4019933.
[11] 谢军. 电解水清洗杀菌虾体效果的研究[D]. 上海: 上海海洋大学, 2011: 5-10. DOI:10.7666/d.y1946967.
[12] 莫根永, 曹荣, 徐丽敏, 等. 强酸性电解水用于对虾减菌化前处理的试验研究[J]. 渔业现代化, 2010, 37(3): 37-41. DOI:10.3969/j.issn.1007-9580.2010.03.009.
[13] 付娇娇, 彭织云, 刘海泉, 等. 酸性电解水处理后南美白对虾贮藏过程中肠道微生物的多样性变化[J]. 食品工业科技, 2015, 36(4):
344-356. DOI:10.13386/j.issn1002-0306.2015.04.066.
[14] WANG Meng, WANG Jingjing, SUN Xiaohong, et al. Preliminary mechanism of acidic electrolyzed water ice on improving the quality and safety of shrimp[J]. Food Chemistry, 2015, 176: 333-341. DOI:10.1016/j.foodchem.2014.12.089.
[15] SUN Jiangping, WANG Meng, LIU Haiqua, et al. Acidic electrolysed water delays browning by destroying conformation of polyphenoloxidase[J]. Journal of the Science of Food and Agriculture, 2017, 98(1): 147-153. DOI:10.1002/jsfa.8449.
[16] 孙江萍, 赵莉, 俞文英, 等. 酸性电解水对南美白对虾中多酚氧化酶活性的影响[J]. 食品科学, 2018, 39(9): 7-12. DOI:10.7506/spkx1002-6630-201809002.
[17] PHUVASATE S, SU Y C. Effects of electrolyzed oxidizing water and ice treatments on reducing histamine-producing bacteria on fish skin and food contact surface[J]. Food Control, 2010, 21(3): 286-291. DOI:10.1016/j.foodcont.2009.06.007.
[18] OZER N P, DEMIRCI A. Electrolyzed oxidizing water treatment for decontamination of raw salmon inoculated with Escherichia coli O157:H7 and Listeria monocytogenes Scott A and response surface modeling[J]. Journal of Food Engineering, 2006, 72(3): 234-241. DOI:10.1016/j.jfoodeng.2004.11.038.
[19] 沈晓盛, 于慧娟, 唐鸟林. 氧化电解水对水产食品中病原菌的抑菌效果比较[J]. 食品与发酵工业, 2010, 36(3): 51-54. DOI:10.13995/j.cnki.11-1802/ts.2010.03.025.
[20] 许愈, 赵莉, 刘海泉, 等. 酸性电解水对副溶血性弧菌和单核细胞增生李斯特氏菌杀菌效果的比较研究[J]. 食品安全质量检测学报, 2018, 9(16): 45-50.
[21] 杜苏萍. 酸性电解水作为新的传压介质用于超高压杀菌技术保障水产品品质安全及其降低风险的研究[D]. 上海: 上海海洋大学, 2016: 20-50.
[22] HUANG Y R, SHIAU C Y, HUNG Y C. Change of hygienic quality and freshness in tuna treated with electrolyzed water and carbon monoxide gas during refrigerated and frozen storage[J]. Journal of Food Science, 2006, 71(4): 127-133. DOI:10.1111/j.1750-3841.2006.00023.x.
[23] MAHMOUD B S M, YAMAZAKI K, MIYASHITA K, et al. A new technology for fish preservation by combined treatment with electrolyzed NaCl solutions and essential oil compounds[J]. Food Chemistry, 2006, 99(4): 656-662. DOI:10.1016/j.foodchem.2005.08.037.
[24] XU Gangchun, TANG Xue, TANG Shihan, et al. Combined effect of electrolyzed oxidizing water and chitosan on the microbiological, physicochemical, and sensory attributes of American shad (Alosa sapidissima) during refrigerated storage[J]. Food Control, 2014, 46: 397-402. DOI:10.1016/j.foodcont.2014.06.010.
[25] 中華人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016: 1-4.
[26] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中挥发性盐基氮的测定: GB 5009.228—2016[S]. 北京: 中国标准出版社, 2016: 1-3.
[27] 上海市食品卫生监督检验所, 江苏省卫生防疫站, 浙江省卫生防疫站, 等. 水产品卫生标准的分析方法: GB/T 5009.45—2003[S]. 北京: 中国标准出版社, 2003: 1-5.
[28] 张皖君, 蓝蔚青, 段贤源, 等. 基于高通量测序分析不同保鲜冰处理对鲈鱼菌群组成与代谢功能的影响[J]. 食品科学, 2019, 40(5): 234-241.
DOI:10.7506/spkx1002-6630-20180123-314.
[29] 蓝蔚青, 谢晶. 酸性电解水对冷藏带鱼保鲜效果的影响研究[J].
天然产物研究与开发, 2011, 23(5): 913-917. DOI:10.3969/j.issn.1001-6880.2011.05.028.
[30] 岑剑伟, 于福田, 杨贤庆, 等. 微酸性电解水对罗非鱼片保鲜效果的研究[J]. 食品与发酵工业, 2019, 45(18): 209-214. DOI:10.13995/j.cnki.11-1802/ts.021022.
[31] EMBORG J, LAURSEN B G, DALGAARD P. Significant histamine formation in tuna (Thunnus albacares) at 2 ℃: effect of vacuum- and modified atmosphere-packaging on psychrotolerant bacteria[J]. International Journal of Food Microbiology, 2005, 101(3): 263-279. DOI:10.1016/j.ijfoodmicro.2004.12.001.
[32] GHARIBZAHEDI S M T, MOHAMMADNABI S. Effect of novel bioactive edible coatings based on jujube gum and nettle oil-loaded nanoemulsions on the shelf-life of beluga sturgeon fillets[J]. International Journal of Biological Macromolecules, 2017, 95: 769-777.
DOI:10.1016/j.ijbiomac.2016.11.119.
[33] 周然, 刘源, 谢晶, 等. 电解水对冷藏河豚鱼肉质构及品质变化的影响[J]. 农业工程学报, 2011, 27(10): 365-369. DOI:10.3969/j.issn.1002-6819.2011.10.064.
[34] 赵莉, 张布克, 刘红平, 等. 酸性电解水通过抑制总菌及特定腐败菌保鲜南美白对虾的研究[J]. 上海海洋大学学报, 2018, 27(4):
616-622. DOI:10.12024/jsou.20180502319.
[35] 王潇. 酸性电解水对中华管鞭虾保鲜效果的研究[D]. 杭州: 浙江工商大学, 2015: 40-44.
[36] MAHMOUD B S M, YAMAZAKI K, MIYASHITA K, et al. Preservative effect of combined treatment with electrolyzed NaCl solutions and essential oil compounds on carp fillets during convectional air-drying[J]. Japanese Journal of Occupational Medicine and Traumatology, 2006, 106(3): 331-337. DOI:10.1016/j.ijfoodmicro.2005.09.010.
[37] 李建雄, 謝晶, 潘迎捷, 等. 酸性电解水结合冰温对冷却肉保鲜的影响[J]. 山西农业科学, 2011, 39(7): 91-95. DOI:10.3969/j.issn.1002-2481.2011.07.25.
[38] 汪兰, 曾俊杰, 吴文锦, 等. 不同冻藏温度对鲈鱼品质的影响[J]. 食品工业科技, 2018, 39(21): 293-298.
[39] 蓝蔚青, 谢晶. 酸性电解水与溶菌酶对冷藏带鱼品质变化的影响[J]. 福建农林大学学报(自然科学版), 2013, 42(1): 100-105. DOI:10.3969/j.issn.1671-5470.2013.01.019.
[40] OCA?O-HIGUERA V M, MARQUEZ-R?OS E, CANIZALES-D?VILA M, et al. Postmortem changes in cazon fish muscle stored on ice[J]. Food Chemistry, 2009, 116(4): 933-938. DOI:10.1016/j.foodchem.2009.03.049.
[41] FAN Wenjiao, SUN Junxiu, CHEN Yunchuan, et al. Effects of chitosan coating on quality and shelf life of silver carp during frozen storage[J]. Food Chemistry, 2009, 115(1): 66-70. DOI:10.1016/j.foodchem.2008.11.060.
[42] KOSTAKI M, GIATRAKOU V, SAVVAIDIS I N, et al. Combined effect of MAP and thyme essential oil on the microbiological, chemical and sensory attributes of organically aquacultured sea bass (Dicentrarchus labrax) fillets[J]. Food Microbiology, 2009, 26(5): 475-482. DOI:10.1016/j.fm.2009.02.008.
[43] AL-BACHIR M. Effect of gamma irradiation on the microbial load, chemical and sensory properties of Borak, as prepared chilled meals[J]. Acta Alimentaria, 2007, 36(1): 15-25. DOI:10.1556/aalim.36.2007.1.4.
[44] 张晗, 吕鸣春, 梅卡琳, 等. 电子束辐照对鲈鱼肉杀菌保鲜效果及品质的影响[J]. 食品科学, 2018, 39(21): 66-71. DOI:10.7506/spkx1002-6630-201821010.
[45] 赵宏强, 吴金鑫, 张苑怡, 等. 超高压处理对冷藏鲈鱼片品质及组织结构变化的影响[J]. 高压物理学报, 2017, 31(4): 494-501. DOI:10.11858/gywlxb.2017.04.019.
[46] 潘艳艳, 雷丽萍, 卢佳芳, 等. 壳聚糖对冰藏鲈鱼品质及其菌群变化的影响[J]. 核农学报, 2017, 32(12): 2346-2354. DOI:10.11869/j.issn.100-8551.2018.12.2346.
[47] LI Qian, LI Dongping, QIN Na, et al. Comparative studies of quality changes in white and dark muscles from common carp (Cyprinus carpio) during refrigerated (4 ℃) storage[J]. International Journal of Food Science and Technology, 2016, 51(5): 1130-1139. DOI:10.1111/ijfs.13090.
[48] 赵凤, 李小义, 张效平, 等. 鲟鱼发酵过程中微生物的演替变化分析[J]. 食品科学技术学报, 2019(3): 67-75. DOI:10.3969/j.issn.2095-6002.2019.03.009.
[49] PARLAPANI F F, MEZITI A, KORMAS K A, et al. Indigenous and spoilage microbiota of farmed sea bream stored in ice identified by phenotypic and 16S rRNA gene analysis[J]. Food microbiology, 2013, 33(1): 85-89. DOI:10.1016/j.fm.2012.09.001.
[50] 王玲. 酸性電解水处理对鲟鱼冰温贮藏品质变化的影响[D]. 大连: 大连工业大学, 2019: 50-60.
[51] SARAOUI T, LEROI F, BJ?RKROTH J, et al. Lactococcus piscium: a psychrotrophic lactic acid bacterium with bioprotective or spoilage activity in food: a review[J]. Journal of Applied Microbiology, 2016, 121(4): 907-918. DOI:10.1111/jam.13179.
[52] 赵飞. 活菌多样性分析技术解析酸性电解水处理后南美白对虾中微生物多样性变化[D]. 上海: 上海海洋大学, 2017: 40-60.
