DPA-Zn金属阳离子脂质的合成及其DNA相互作用研究
2020-04-07阿地力江阿不力米提易文婧赵志刚
阿地力江·阿不力米提,易文婧,赵志刚
(西南民族大学 化学与环境保护工程学院,四川 成都 610041)
基因治疗为癌症等重大疾病的治疗提供了一条富有潜力的新途径。发展安全和高效的基因传递载体是基因治疗的关键所在[1]。阳离子脂质是一类重要的非病毒基因载体[2],其结构主要由阳离子极性头部,疏水尾部以及这两个部分之间的连接键三部分组成。阳离子脂质的头部基团可通过静电作用与核酸中带负电荷的磷酸骨架结合,包裹缩合DNA[3]。近年来,金属复合物作为一种新型的DNA缩合剂和传递载体受到了研究者们的关注[4-5]。金属复合物具有丰富的结构和合理的正电荷密度,能通过多种相互作用(如静电结合,π-π作用等)与聚阴离子核酸结合[4-5]。Kawakami[6-7]和Yu等[8]分别将Zn(II)引入含咪唑基的聚合物和大环多胺聚阳离子体系,发现Zn(II)可以极大地提高基因传递效率。Guo[9-11]和Chen[12]等将具有刺激响应特性的Zn-DPA化合物修饰低分子量的聚乙烯亚胺(PEI)构建的基因载体,实现了基因的低毒和高效传递。Liu等将Zn-DPA复合物用于共载荧光染料ICG和治疗基因siRNA,协同实现光/基因组合治疗[13]。
目前,通过组合和利用阳离子脂质和金属络合物各自优势构建的金属-脂质基因载体的研究还较少。Yu等[14],合成了系列Zn(II)-Cyclen头部的金属-脂质基因载体具有较低的细胞毒性和较高的转染效率。最近,我们也制备了一系列Zn-DPA头部的新型金属阳离子脂质[15-16]。在前期的研究基础上,为了增加基因在细胞内的释放,进一步提高基因转染效率,本研究基于Zn-DPA亲水头部,胆固醇和皂素疏水尾部,设计合成了生物可降解二硫键桥连的金属脂质,并通过多种实验手段考察其与DNA的相互作用。
1 实验部分
1.1 仪器和试剂
仪器:琼脂糖凝胶水平电泳仪,全自动凝胶成像分析仪:美国Bio-Rad公司生产;荧光光谱:Fluoromax-4 (JOBIN-YYON,HORIBA) 型荧光分光光度计;恒温摇床:上海新苗医疗器械制造有限公司生产;纳米粒度及电位分析仪(ZEN 3600):英国Malvern公司生产;质谱:HR-MS:Bruker Daltonics Bio TOF 型质谱仪;核磁:Varian INOVA-400MHz 核磁共振仪(1H:400 MHz,13C:100 MHz,0.5% TMS 为内标)。
试剂:琼脂糖购自Invitrogen公司;0.22 μm无菌滤器购自Millipore公司。溶剂使用前都经过标准方法进行纯化和干燥。
1.2 金属脂质的制备
1.2.1 化合物1~3,4a,4b的合成
中间体1~3[17],4a[18],4b[19]参照文献方法合成。目标金属脂质的合成路线如Scheme 1所示。

路线1 目标金属脂质的合成示意图
Scheme 1 The synthetic route for target metallo-lipids
1.2.2 化合物5的合成
将化合物3 (0.78 mmol)溶于10 mL 二氯甲烷中,冰浴下,依次加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI,0.93 mmol),1-羟基苯并三唑(HOBt,0.93 mmol)和N,N-二异丙基乙胺(DIEA,1.6 mmol)。搅拌30 min后,缓慢滴加化合物4(0.78 mmol)的二氯甲烷溶液(10 mL)。室温搅拌过夜。依次用饱和碳酸氢钠,1%柠檬酸,饱和食盐水洗涤,碱性三氧化二铝柱分离,产物为黄色固体。
5a,产率:49%。1H NMR (400 MHz,CDCl3) δ: 8.55 (d,J = 4.7 Hz,2H,H-6(Py)),7.58~7.63 (m,2H,H-4(Py)),7.25~7.27 (m,2H,H-3(Py)),7.14~7.17 (m,2H,H-5(Py)),5.32~5.34 (m,1H,H-(Chol)),4.43~4.48 (m,1H,H-(Chol)),3.83 (s,4H,-CH2NCH2-),3.61 (q,J = 6.2 Hz,2H,-CH2NH),3.45 (q,J = 5.9 Hz,2H,-CH2NH),3.30 (s,2H,-CH2N),2.92~2.74 (m,4H,-CH2S),2.21~2.35 (m,2H,H-(Chol)),1.72~2.02 (m,6H,H-(Chol)),0.82~1.57 (m,33H,H-(Chol)),0.65 (s,3H,H-(Chol))。13C NMR (101 MHz,CDCl3) δ: 171.52,158.08,149.31,136.64,123.31,122.45,60.41,58.00,56.64,56.08,49.96,42.27,39.69,39.47,38.51,38.32,37.80,37.74,36.94,36.52,36.14,35.76,31.87,31.83,31.40,30.15,29.66,28.20,28.12,27.98,24.25,23.79,22.79,22.66,22.53,21.00,19.30,18.68,11.82.HR-MS (ESI):C46H69N5NaO3S2+(M+Na)+:826.4734,found:826.4714。
5b,产率:51%。1H NMR (400 MHz,CDCl3) δ: 8.55 (d,J = 4.3 Hz,2H,H-6(Py)),7.59~7.63 (m,2H,H-4(Py)),7.27~7.28 (m,2H,H-3(Py)),7.10~7.18 (m,2H,H-5(Py)),5.35 (s,1H,H-diosgenin),4.36~4.42 (m,1H,H-diosgenin),3.85 (s,4H,NCH2Py),3.59~3.64 (m,2H,-CH2NH),3.43~3.47(m,2H,-CH2NH),3.31 (s,2H,N-CH2CO),2.78~2.85 (m,4H,-CH2S),2.22~2.36 (M,2H,H-diosgenin),0.94-2.03 (m,31H,H-diosgenin),0.75~0.78 (m,6H,H-diosgenin)。13C NMR (101 MHz,CDCl3) δ: 171.50,158.07,149.28,136.66,123.30,122.45,109.23,80.77,66.79,62.02,60.36,57.99,56.38,49.87,41.56,40.21,39.68,38.48,37.72,36.91,36.65,32.00,31.80,31.36,30.25,29.66,28.76,28.08,20.78,19.32,17.11,16.25,14.50。HR-MS (ESI):C46H65N5NaO5S2+(M+Na)+:854.4319,found:854.4303。
1.2.3 化合物6的合成
将1 mL Zn(NO3)2·6H2O (0.0250 mmol)的水溶液加入到1 mL化合物5(0.025 mmol)的甲醇溶液中。室温搅拌1 h。减压蒸馏除去溶剂,真空干燥后得到金属-脂质复合物。
6a: HR-MS:C46H68N5O3S2Zn+(M+Zn-H)+:866.4050,found:866.4040。
6b: HR-MS:C46H64N5O5S2Zn+(M+Zn-H)+:894.3635,found:894.3629。
1.3 阳离子脂质体的制备
室温下,将阳离子脂质(0.0025 mmol)与等物质的量比的辅助脂质(二油酰磷脂酰乙醇胺,DOPE)加入到已灭菌的10 mL圆底玻璃管中,用2.5 mL的无水氯仿溶解。用旋转蒸发仪缓慢蒸除溶剂,得到脂质体膜,真空干燥8 h。将脂质体膜用2.5 mL灭菌二次蒸馏水溶解,并将混合物置于4℃冰箱中溶胀过夜。涡旋1~2 min以溶解粘附于玻璃管壁的脂质体膜,室温下超声5 min生成多层囊泡。进一步使用探头超声制备阳离子脂质体溶液(1 mmol/L)。用220 μm滤膜过滤后,置于4 ℃冰箱中保存备用[16]。
1.4 凝胶电泳实验
根据不同的电荷比,取适当体积的阳离子脂质体溶液与pUC19质粒DNA(0.125 μg)的混合,于37℃水浴孵化30 min后,进行凝胶电泳实验。
1.5 粒径、电位测定
根据不同的电荷比,取适当体积的阳离子脂质体溶液与1 μg的pUC19质粒DNA混合,25℃条件下测定其粒径和zeta电位(总体积为1 mL水溶液)。
1.6 溴乙锭(EB)置换实验
将EB(5 μL,1.0 mg/mL)放入含有2.5 mL 10 mmol/L 4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)溶液(pH值7.4)的石英比色杯中。搅拌均匀后,测量EB的荧光强度(FEB)。然后,将CT DNA(10 μL,1.0 mg/mL)加入到上述EB溶液中,混合均匀后,测定DNA-EB复合物的荧光强度(F0)。随后进一步测量将脂质6的溶液(1.0 mmol/L,每次添加7.5 μL)加入上述混合溶液的荧光强度(F)。所有样品在520 nm激发,并在600 nm测量发射光谱。纯EB溶液和不含阳离子脂质体的DNA-EB溶液分别用作阴性和阳性对照。使用公式%F = (F-FEB)/(F0-FEB)测定相对荧光百分比(%F),其中FEB和F0分别表示纯EB溶液和DNA-EB溶液的荧光强度[16]。
2 结果与讨论
2.1 目标金属脂质的合成
金属脂质的合成路线如Scheme 1所示。化合物4可通过甾醇羰基酰氯与胱胺反应合成。将化合物3用 EDCI活化,与4反应得到化合物5。5进一步与等当量的Zn(NO3)2反应,得到目标金属脂质6。化合物的结构通过核磁和质谱鉴定。
2.2 金属阳离子脂质体与DNA的相互作用研究
2.2.1 凝胶电泳实验
金属阳离子脂质体由金属脂质和DOPE按物质的量比1∶1制备。通过凝胶电泳考察了金属脂质体对DNA的包裹缩合能力。图1显示,含皂素的脂质体6b可在电荷比为4时,完全包裹DNA,阻滞DNA的迁移,而胆固醇脂质体6a需要电荷比为6时才能完全包裹缩合DNA。说明皂素脂质6b具有比胆固醇脂质6a更强的DNA结合能力。
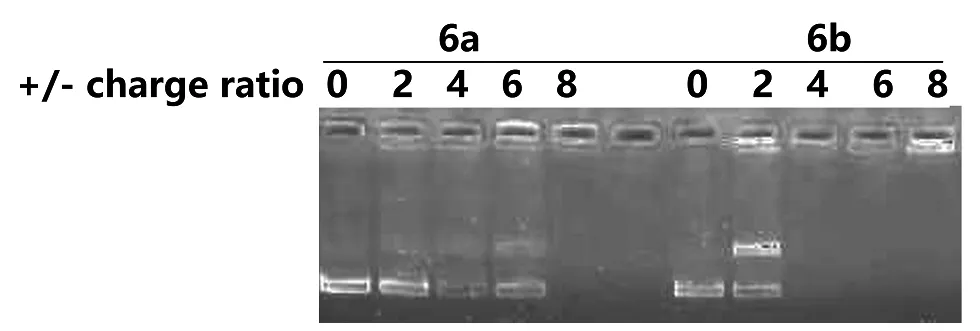
图1 不同电荷比条件下脂质6a-b的凝胶电泳
2.2.2 溴乙锭(EB)置换实验
通过溴乙锭置换实验,进一步考察了脂质体6a-b与DNA的结合能力。图2显示,随着电荷比的增加(从0到4),EB/DNA复合物的原始荧光强度显著降低。当EB/DNA复合物荧光强度淬灭为原始强度的50%时,6b的所需的电荷比小于6a (6a=2.3,6b=1.4),表明皂素金属脂质6b的结合能力强于胆固醇金属脂质6a。凝胶电泳和溴乙锭置换实验均证明金属脂质6a-b对DNA有很好的结合能力,且6b强于6a。

图2 不同电荷比条件下脂质6a-b的溴乙锭置换
2.2.3 金属脂质体与DNA形成复合物的粒径电位表征
金属脂质体6a-b与DNA形成复合物的粒径和zeta电位结果如图3所示。图3A显示,脂质体/DNA复合物的粒径分布具有类似的趋势。复合物的粒径随着电荷比的增加,先逐渐增加,达到最大值后,逐渐减小。脂质6a,6b的粒径分别在电荷比为6和4 时粒径达到最大值。在完全能包裹DNA的情况下,皂素脂质6b与DNA形成复合物的粒径,明显小于6a/DNA复合物。结果表明,6b对DNA有更强的缩合能力。这个结果与凝胶电泳和溴乙锭置换实验结果一致(图1和2)。由图3B可知,脂质体6a-b /DNA复合物的电位均随着电荷比的增加而增加。6a/DNA复合物的电位在电荷比为8时变为正值,而6b/DNA复合物的电位在电荷比为6时变为正值。结果同样表明,脂质6b 比6a有更强的DNA结合能力。这个结果与凝胶电泳结果一致。

图3 不同电荷比条件下脂质6a-b/DNA复合物的粒径(A)和电位(B)
Fig.3 Mean particle sizes (A) and surface charge (B) of the lipoplex 6a-b under various charge ratios (2,4,6,8 and 10).
3 结论
本文基于DPA-Zn金属阳离子头部,以胆固醇和皂素为疏水尾部、二硫键为连接键,制备了金属阳离子脂质6a-b。通过凝胶电泳、溴乙锭置换和粒径电位等实验方法考察了其与DNA的相互作用。结果表明,皂素金属脂质具有比胆固醇脂质更强的DNA相互作用能力。后续研究,将进一步考察其DNA释放性能和细胞内转染活性,开发新型的具有刺激响应特性的"智能型"金属脂质基因载体。
