AT1受体在同型半胱氨酸致动脉粥样硬化斑块不稳定性中的作用机制研究*
2020-04-07李天翔祝志波郝祥宇郭建强
李天翔,祝志波,郝祥宇,郭建强
(内蒙古医科大学附属医院 心内科,内蒙古 呼和浩特 010050)
同型半胱氨酸(Homocysteine,Hcy)是导致或加重动脉粥样硬化的独立危险因素,可直接引起内皮损伤及功能障碍、炎症细胞通透性增加、平滑肌细胞凋亡、增强氧化应激反应、血小板聚集性增加、凝血因子活化增强等血栓前状态[1-6],Hcy 与斑块的稳定性密切相关,但其机制尚不清楚。本文拟探讨血管紧张素Ⅱ1 型受体(angiotension Ⅱ type 1 receptor,AT1)在Hcy 致病过程的作用机制。
1 材料与方法
1.1 实验动物
21只6周龄雄性清洁级小鼠购自北京维通利华公司,动物合格证号:CNAS0004,C57BL/6L 为背景的载脂蛋白E 敲除(apolipoprotein E knocked out,ApoE-/-)小鼠于内蒙古医科大学动物实验室饲养,饲养环境温度18~23℃,湿度50%~60%,保持室内空气新鲜,每只笼具7只小鼠,照明12 h,无污染饮水,所有饲料购自北京科奥协力有限公司。小鼠背毛浓密有光泽,眼睛明亮活泼,行动迅速,反应灵敏,食欲良好,发育正常,体型丰满。
1.2 动物分组
将21只ApoE-/-小鼠称重,按体重从轻到重编号1~21,按随机数字表法进行分组,分别为对照组(CTL组)、高同型半胱氨酸组(HHcy 组)、高同型半胱氨酸+替米沙坦(HHcy+TLM 组)[1.5%蛋氨酸+替米沙坦10 ng/(kg·d)灌胃],每组7只,共饲养12周。3组均采用含21%猪油和0.15%胆固醇的高胆固醇饲料喂养。参考文献[7-8]在饲料中加入1.5%蛋氨酸复制高同型半胱氨酸血症模型,并采用替米沙坦10 mg/(kg·d)(勃林格殷格翰药业有限公司)[9]+5 g/L 羧甲基纤维素的磷酸盐缓冲液(PBS)[10]配制的混悬液灌胃,CTL 组和HHcy 组均给予5 g/L 羧甲纤维素液灌胃。
1.3 小鼠体重、血压的检测
从第7周(灌胃前)开始,每周1 次规律测量小鼠体重,直至治疗结束,记录平均值;从第10周开始用无创 鼠尾测压仪(BP-300A,成都泰盟软件公司,2014年)测量鼠尾动脉血压,每2周测量1 次,测量前将箱体加温至36℃,鼠尾加热后,保证动物在清醒状态及安静环境中测量血压,血压重复测量3~5 次,取平均值,记录收缩压(SBP)值。
1.4 小鼠血清学指标的检测
饲养12周后,应用2%戊巴比妥钠注射液80 mg/kg 麻醉,摘眼球取血于1.5 ml 无菌EP 管,4℃、3 000 r/min 离心10 min,吸取上清液,储存于-80℃冰箱冷冻保存备用。采用全自动生化分析仪测量血脂,循环酶直接法检测Hcy。
1.5 小鼠主动脉硬化斑块面积的检测
解剖显微镜下剥离主动脉弓,剥离周围脂肪组织,用镊子小心提起主动脉弓,于无名动脉分叉处剪断,置于含有0.1 mmol/L PBS 的EP 管中,置于冰上,用手术刀在平行左右心耳连线下方1 mm 处将心脏下部切除,心脏上部进行OCT 包埋,10 μm 厚度切片。显微镜下观察,3 个主动脉瓣同时出现的第1 张组织切片标记为0,向上第2 张标记为10,以此类推。从主动脉0 点开始每间隔100 μm 取1 张切片进行斑块的面积测量,共测量6 张,计算这6 张切片斑块面积的均值,即为主动脉根部斑块的面积。切片后进行油红O 染色,用4 倍物镜采集图像后,用Image-Pro Plus 6.0 软件测量油红O 染色阳性斑块面积,并计算斑块面积占血管管腔面积的百分比。
1.6 HE 和Masson 染色
HE 染色:将OCT 包埋的主动脉根部组织以6 μm 厚度进行切片;用10%中性甲醛固定1 min;1 mmol/L PBS 洗3 次,3 min/次,主要以浸泡的方式,防脱片;Weigert 铁苏木精染液3~5 min;流水(自来水)洗去苏木精染液5~10 s;1%盐酸乙醇分化1~3 s,自来水中返蓝20 s;伊红染色10~20 s;脱水、透明、中性树胶封片。染色结果:细胞核蓝染,细胞浆红染。
Masson 染色(北京卡柏莱公司):将厚度为5 μm 冷冻切片,用10%中性甲醛固定1 min;Weigert 铁苏木精染液3~5 min;1%盐酸乙醇分化1~3 s,流水(自来水)洗3 min,至返蓝;丽春红品红染液染色5 min;0.1%~0.3%乙酸溶液洗1 min;1%磷钼酸液洗1 min;重复步骤0.1%~0.3%乙酸溶液洗1 min;直接放入苯胺蓝染液1 min;重复步骤0.1%~0.3%乙酸溶液洗1 min;95%乙醇快速脱水,100%乙醇脱水3 次,5~10 s/次;二甲苯透明3 次,1~2 min/次;中性树胶封片。染色结果:胶原纤维、细胞核蓝染,肌肉、细胞浆红染。
1.7 免疫组织化学SP 法
制备5 μm 冷冻切片,4%多聚甲醛固定15 min,PBS 冲洗3 次,每次5 min,吸水纸吸干载玻片上的残余水分,按照试剂盒(SP0022)(北京博奥森公司)说明书的步骤进行操作,首先加3%过氧化氢温孵育10 min,为减少内源性过氧化物酶的活性;采用A 液血清封闭15 min,分别加入抗巨噬细胞表面分子(mac-3)抗体(1∶100,AB13524)、抗IL-6 抗体(1∶100,AB7737)、抗MCP-1抗体(1∶100,AB7202)、MMP-9 抗体(1∶100,AB76003),DAB 显色(购自福州迈新公司),Leica 显微镜用4 倍物镜采集图像后,应用Image-Pro Plus 6.0 软件计算斑块内平均光密度,平均光密度=积分光密度(IOD)/区域面积(Area)。
1.8 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 3组小鼠血脂、Hcy、SBP、体重情况
3组小鼠甘油三酯(TG)、总胆固醇(TC)、低密度 脂蛋白胆固醇(LDL-C)、高密度脂蛋白(HDL-C)比较,差异无统计学意义(P>0.05);3组小鼠Hcy 比较,差异有统计学意义(P<0.05),HHcy 组较CTL 组高(P< 0.05);治疗前3组小鼠SBP、体重比较,差异无统计学意义(P>0.05);治疗后3组小鼠SBP、体重比较,差异有统计学意义(P<0.05),治疗后HHcy+TLM 组SBP、体重比HHcy 组低。见表1、2。
2.2 3组小鼠主动脉根部斑块面积占血管管腔面积百分比的比较
油红O 染色阳性斑块面积占血管管腔面积的百分比,CTL 组为(18.72±1.96)%,HHcy 组为(22.17± 2.07)%,HHcy+TLM 组为(10.02±1.96)%,3组比较,差异有统计学意义(F=73.269,P=0.000);HHcy 组油红O 染色阳性斑块面积占血管管腔面积的百分比较CTL 组、HHcy+TLM 组大(P<0.05)。见图1、2。
表1 3组小鼠Hcy 和血脂指标比较(n =7,±s)
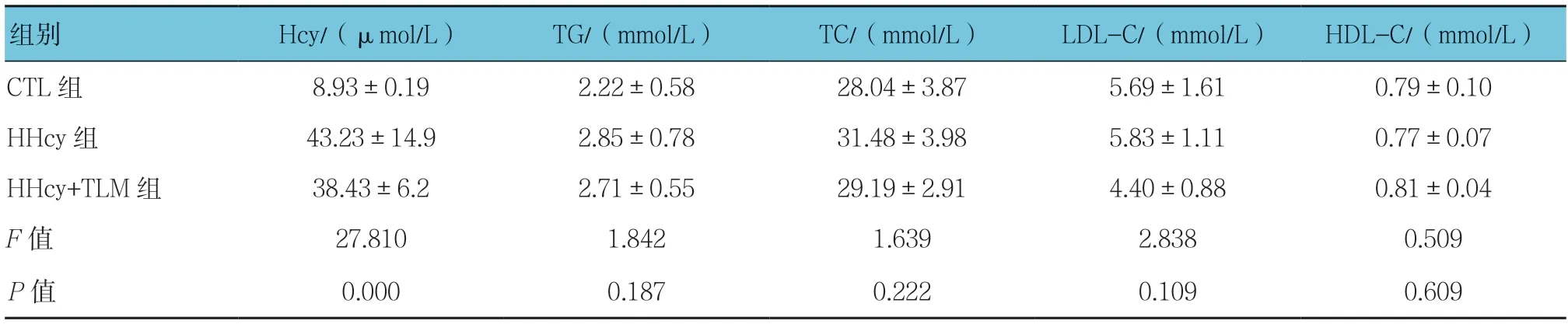
表1 3组小鼠Hcy 和血脂指标比较(n =7,±s)
?
表2 3组小鼠SBP 及体重情况(n =7,±s)
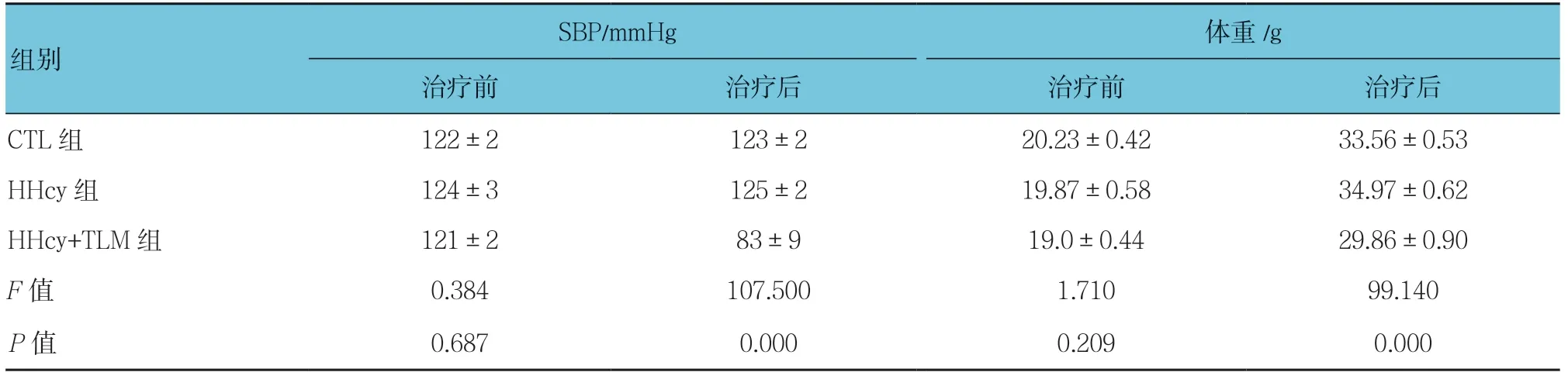
表2 3组小鼠SBP 及体重情况(n =7,±s)
?
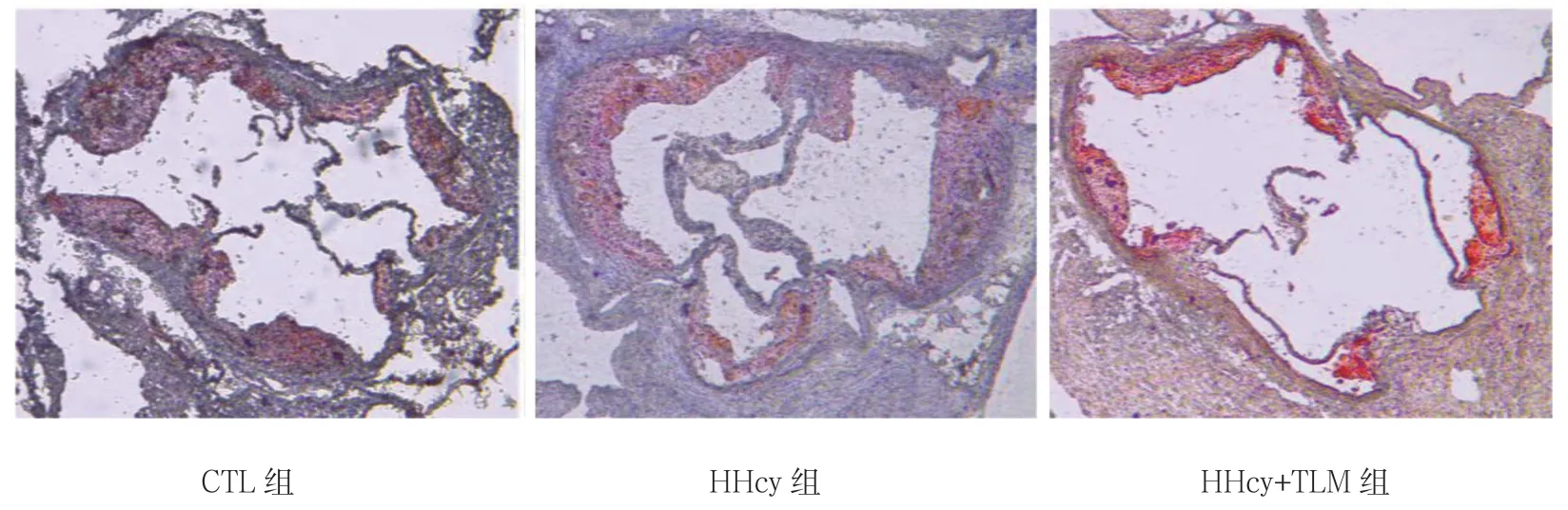
图1 3组小鼠主动脉根部阴性斑块面积(油红O 染色×40)

图2 3组小鼠主动脉根部斑块面积占血管管腔面积 百分比的比较(±s)
2.3 3组小鼠主动脉根部斑块稳定性
HHcy 组可见纤维帽变薄,大量泡沫细胞,较大的脂质/坏死核心,可见胆固醇结晶;HHcy+TLM 组纤维帽较厚,少许泡沫细胞,脂质/坏死核心减小。见图3。
2.4 3组小鼠炎症因子表达
免疫组织化学SP 法结果显示,HHcy 组斑块内mac-3、MCP-1、IL-6 的棕黄色颗粒沉积最多,半定量分析平均光密度值最高,HHcy+TLM 组炎症因子的表达下降。mac-3 的值分别为:CTL 组(0.123±0.015)、HHcy 组(0.633±0.035)、HHcy+TLM 组(0.167±0.021),3组比较,差异有统计学意义(F=235.947,P=0.000),HHcy 组较CTL 组、HHcy+TLM 组多(P<0.05);MCP-1 的值分别为:CTL 组(0.150±0.021)、HHcy 组(0.637± 0.086)、HHcy+TLM 组(0.187±0.025),3组比较,差异有统计学意义(F=78.075,P=0.000),HHcy 组较CTL 组、HHcy+TLM 组多(P<0.05);IL-6 的值分别为:CTL 组(0.103±0.015)、HHcy 组(0.337±0.032)、HHcy+TLM组(0.167±0.021),3组比较,差异有统计学意义(F=77.08,P=0.000),HHcy 组较CTL 组、HHcy+TLM 组多(P<0.05)。见图4、5。
2.5 3组小鼠胶原蛋白分泌及MMP-9 的表达
Masson 染色结果显示,HHcy+TLM 组与HHcy 组比较,蓝染的胶原蛋白明显增加(见图6)。斑块内MMP-9 的表达水平分别为:CTL 组(0.237±0.021)、HHcy 组(0.393±0.031)、HHcy+TLM 组(0.187±0.015),3组比较,差异有统计学意义(F=65.396,P=0.000),HHcy 组较CTL 组、HHcy+TLM 组多(P<0.05)。见图7、8。

图3 3组小鼠主动脉根部斑块形态观察(HE 染色×200)
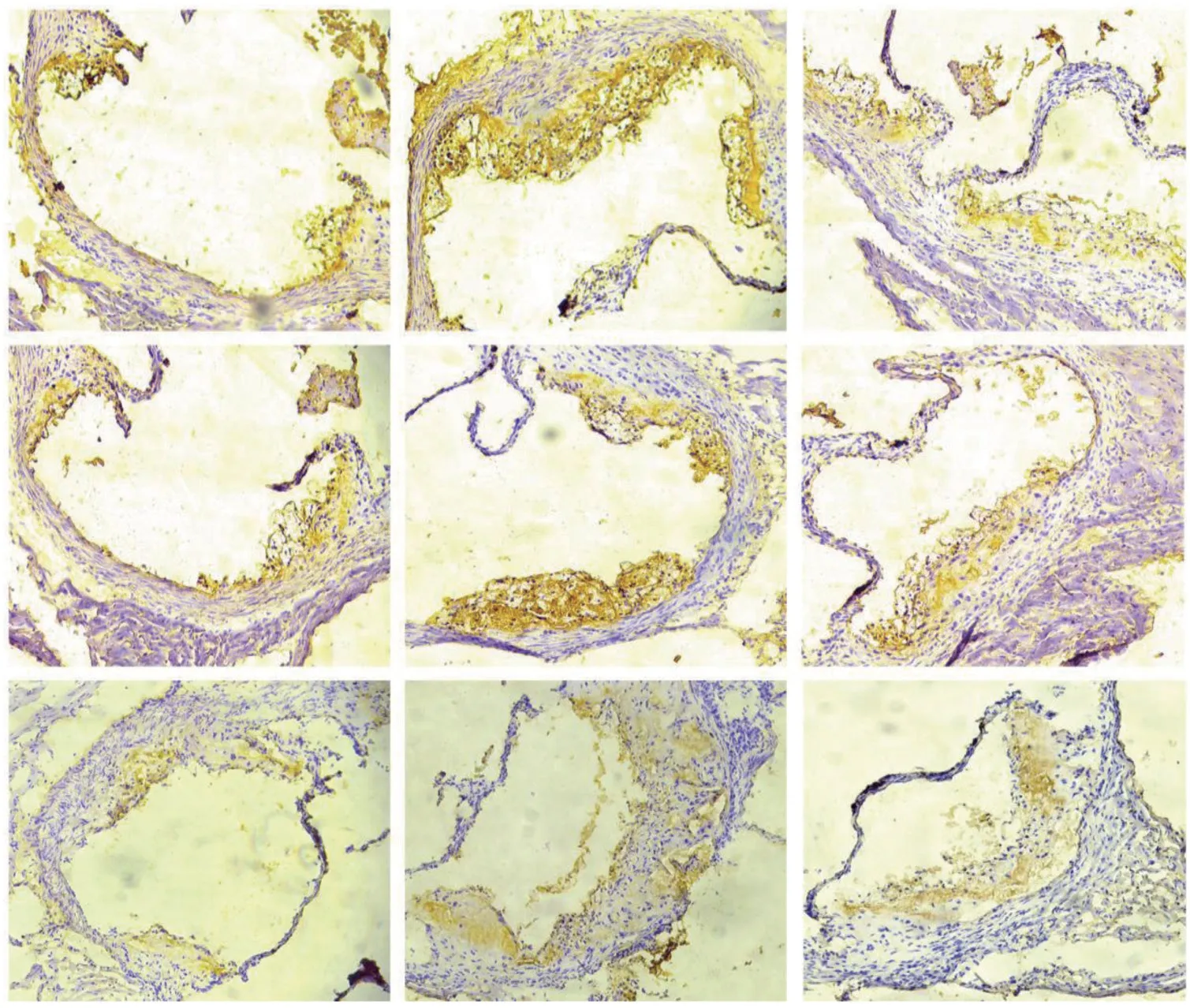
图4 3组小鼠主动脉根部斑块内mac-3、MCP-1、IL-6 的表达(DAB 染色×40)

图5 3组小鼠主动脉根部斑块mac-3、MCP-1、IL-6 的平均光密度值比较(±s)
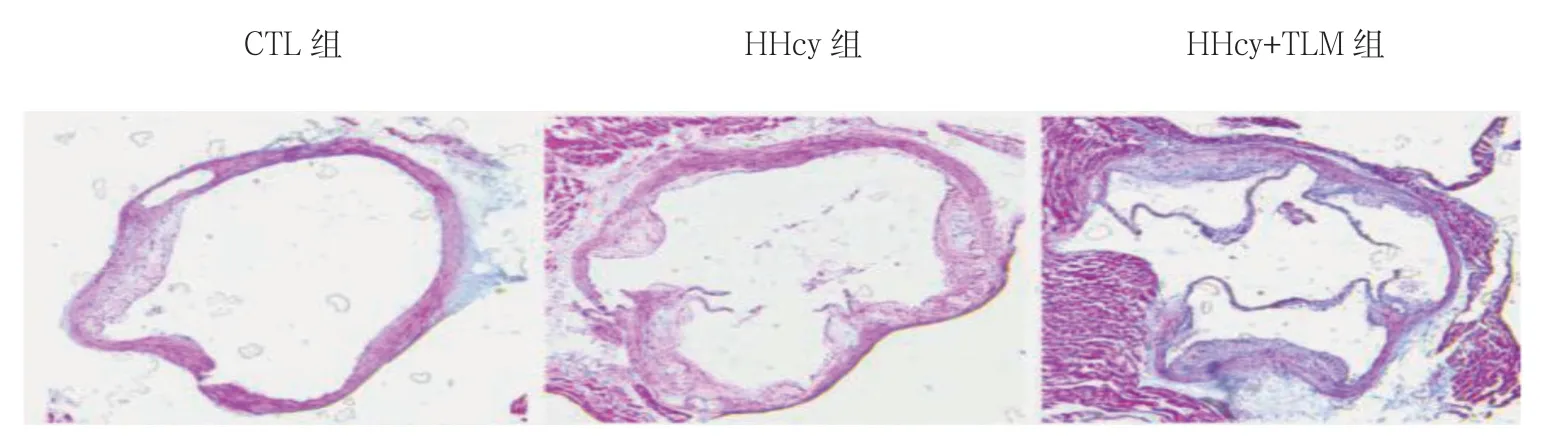
图6 3组小鼠主动脉根部斑块内胶原蛋白比较(Masson 染色×40)

图7 3组小鼠主动脉根部斑块MMP-9 的表达(DAB 染色×40)
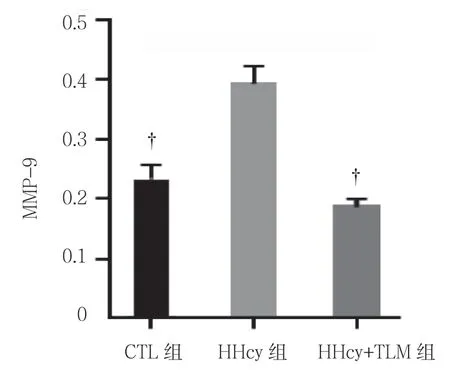
图8 3组小鼠主动脉根部斑块内MMP-9 水平比较(±s)
3 讨论
动脉粥样硬化表现为动脉壁粥样斑块形成,致使管腔狭窄,斑块破裂时会导致急性心血管不良事件发生[11];ApoE-/-给予蛋氨酸饮食诱导,可导致高同型半胱氨酸血症,HHcy 除具有可引起内皮损伤、平滑肌细胞凋亡、增加血小板聚集等致动脉粥样硬化形成的机制外,还有促动脉粥样硬化斑块不稳定性的作用[12]。Hcy 可通过内质网应激和腺苷酸活化蛋白激酶作用,上调肿瘤坏死因子-α 和MMP-9 的表达[13-14],增加斑块不稳定性,但Hcy 结合受体并不清楚。本实验结果显示,HHcy+TLM组血清中Hcy含量高于CTL组,但HHcy+TLM 组Hcy 含量较HHcy 组无明显下降,一方面说明模型复制成功,一方面说明TLM 并不是直接通过降低Hcy 的含量来减轻动脉粥样硬化;HHcy 组主动脉根部斑块面积占血管管腔面积的百分比与CTL 组比较,差异有统计学意义。文中主动脉根部HE 染色、免疫组织化学SP 法结果提示Hcy 不仅具有促动脉粥样硬化斑块形成作用,而且使斑块内出现较大的脂质坏死核心,巨噬细胞大量浸润,炎症因子高表达,MMP-9分泌增加,细胞外基质、胶原蛋白降解,纤维帽变薄,降低了斑块的稳定性,加速斑块的进展及破裂;应用AT1 受体阻断剂替米沙坦干预后,能够逆转HHcy 的这些作用,斑块面积明显减小、稳定性增加,表明AT1 受体与Hcy 存在一定的联系。
肾素血管紧张素系统在动脉粥样硬化的发生中具有重要作用,如细胞生长、增殖、分化、迁移和凋亡、细胞外基质重构、炎症反应等方面[15],其中主要是通过血管紧张素Ⅱ与AT1 受体结合,在动脉粥样硬化的起始、进展和并发症发挥着多重生物活性作用。除血管紧张素Ⅱ之外,还有一些因素,如膜环境、机械拉伸、自身抗体相互作用等[16]亦可激活AT1 受体。
LIU 等[17]发现AT1 受体阻滞剂可消除高水平Hcy加重的腹主动脉瘤,还发现Hcy 可直接激活AT1 受体,加重血管炎症。本研究也证实,替米沙坦阻断AT1 受体可减小高水平Hcy 致动脉粥样斑块面积及促进斑块的稳定,也进一步证实Hcy 与AT1 受体有密切的关系。
同时发现HHcy+TLM 组治疗后的SBP 较CTL 组和HHcy 组下降。学术界一直存在着一种争议——降压药物在减轻动脉粥样硬化的作用中,是得益于降压作用,还是其本身独立于降压因素之外而起的作用?本研究中HHcy+TLM 组的SBP 降低比较明显,因此尚不能确定动脉粥样硬化的改善作用是否来源于替米沙坦的降压作用,这需要进一步探索研究。但目前已有文献表明,Hcy 和血管紧张素Ⅱ在动脉瘤的致病方面具有协同作用,Hcy 可促进血管内皮细胞AT1 受体的活化[17],因此,可以认为Hcy 的致病作用可能部分与AT1 受体相关。
Hcy 可通过拮抗过氧化物酶体增殖物激活受体(peroxisomal proliferators activate receptors,PPARγ),促进脂肪的积累、导致代谢紊乱和血管重塑[18];PPARγ 受体是脂肪代谢主要调节因子,在脂肪组织中高表达,血管紧张素受体阻滞剂亦有部分激活PPARγ受体的作用[19],减少脂肪的堆积,可能是TLM 组体重下降的原因之一。本实验替米沙坦拮抗Hcy 在动脉粥样硬化斑块易损性的作用中,是否包含PPARγ 这一因素并不明确,也是本实验局限性所在,有待于下一步深入研究。
替米沙坦阻断AT1 受体可减小高水平Hcy 致动脉粥样硬化斑块面积,促进斑块的稳定,表明Hcy 的致病机制与AT1 受体相关,本研究结果将Hcy 与肾素血管紧张素系统联系在一起,丰富了动脉粥样硬化的理论,也丰富了Hcy 的致病机制理论。
