超声处理的大豆分离蛋白/麦芽糊精混合物酸诱导凝胶性质研究
2020-04-03赵城彬尹欢欢鄢健楠许秀颖吴玉柱刘景圣
赵城彬 尹欢欢 鄢健楠 曹 勇 张 浩 许秀颖 吴玉柱 刘景圣
(吉林农业大学食品科学与工程学院 小麦和玉米深加工国家工程实验室 长春130118)
蛋白质凝胶是溶液中的蛋白质发生变性后暴露出活性基团,通过蛋白质之间及相邻肽链之间的相互作用和蛋白质与水之间的相互作用,使分子有规律的聚集、交联,分子间与分子内的作用力达到平衡,形成占据原来液体空间的三维网络结构[1]。对于大豆蛋白而言,凝胶性尤为重要,利用该特性可使传统的豆腐和豆腐脑等食品的质构及感官得到显著的改善,有利于增加肉制品的嫩度、风味及切片性。蛋白质和多糖之间的相互作用能够形成混合凝胶,蛋白质和多糖的分子结构、理化特性和加工条件等因素会影响混合凝胶体系的流变特性、微观结构和质构特性,蛋白质与多糖之间发生的相互作用在一定程度上会改善蛋白质的功能特性及加工特性[2]。Zhang 等[3]发现在中性条件下,共同加热果胶和乳清蛋白形成的络合物能够形成更加坚固的凝胶,与乳清蛋白溶液相比,果胶/乳清蛋白络合物具有更为光滑的网络结构。闵维等[4]对大豆分离蛋白/葡聚糖冷致凝胶性质进行研究,随着葡聚糖浓度的增加,混合凝胶的黏弹性呈先上升后下降的趋势;而混合凝胶的黏弹性随着葡聚糖分子质量的增加变化更加显著。超声波是指频率超过人类听觉范围的声波,是一种弹性振荡波[5]。将超声波直接作用于蛋白分子,通过对蛋白分子结构的修饰,进而改善蛋白质的溶解性、乳化性、凝胶性等功能特性[6]。此外,超声作用还可能促进大分子物质之间的相互作用,例如蛋白质与多糖之间的互溶或相分离,这对蛋白质的功能特性具有重要影响。目前,关于超声处理下大豆分离蛋白(SPI)/麦芽糊精(MD)混合物酸诱导凝胶性质的研究鲜有报道。本试验对SPI 与MD 混合溶液进行超声处理,测定酸诱导凝胶流变性、微观结构、凝胶强度及持水性,探讨超声处理对SPI/MD 混合物酸诱导凝胶性质的影响,为改善大豆蛋白凝胶特性及开发凝胶型大豆制品奠定理论基础。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(SPI),哈高科食品有限责任公司;麦芽糊精(MD),美国Sigma 公司;葡萄糖酸内酯(GDL),北京沃海环球科技有限公司;无水乙醇,南京化学试剂厂;其它化学试剂均为国产分析纯级。
1.2 仪器与设备
JY92-2D 超声探头发生器,宁波Scientz 生物科技股份有限公司;电热恒温水浴锅,余姚市东方电工仪器厂;GL-21M 高速冷冻离心机,上海市离心机械研究所;Bohlin 旋转流变仪,英国马尔文仪器有限公司;S-3400N 型扫描电镜,日本日立公司;TA-XT2 质构仪,英国Stable Microsystems 公司。
1.3 方法
1.3.1 超声处理下SPI/MD 混合凝胶的制备 将SPI 分散到磷酸盐缓冲液(0.1 mol/L,pH 7.0)中,配制成质量分数为6%的SPI 溶液。将SPI 溶液室温下磁力搅拌2 h,95 ℃水浴中热处理30 min,冷却至室温后添加质量分数为2%的MD,混合均匀即得SPI/MD 混合液。在超声功率为200 W 下,分别对蛋白/多糖混合液进行超声处理0,5,15,25 min,超声处理模式为开启3 s,关闭2 s,同时采用冰水浴控制温度为25~30 ℃。向超声处理后的混合液中添加质量分数为0.6%的GDL,充分混匀后25 ℃下酸化5 h,酸化结束后4 ℃冷藏过夜,即得酸诱导凝胶。未经超声处理且不含MD 的SPI 凝胶为对照组。
1.3.2 凝胶流变性测定 根据Zhao 等[7]的方法测定凝胶样品的流变性。将样品溶液加入GDL 后置于流变仪平板之间,平板距离1 mm,平板间充满溶液后擦去多余的溶液,滴2~3 滴植物油于溶液裸露部位以防止水分蒸发,然后加上保温套准备测定。设定应变为0.5%,频率为1 Hz,25 ℃下酸化5 h,进行时间扫描,记录整个酸化过程中样品的储能模量(G′)及损耗模量(G″)随时间的变化。初始应变扫描试验显示流变性的测定在线性粘弹区域内。时间扫描结束后分别对样品进行0.01~10 Hz 范围内的频率扫描和0.0001~1 范围内的振幅扫描,记录G′及G″随频率和应变的变化。
1.3.3 凝胶微观结构观察 根据Chin 等[8]的测定方法,取一定量的凝胶样品,加入戊二醛溶液固定后冷冻,用磷酸缓冲液冲洗,然后分别用30%,50%,70%,90%,100%的乙醇进行脱水10 min,按100%乙醇∶叔丁醇=1∶1 脱水10 min,纯叔丁醇脱水10 min,然后冻干。将冻干凝胶样品进行离子溅射喷金镀膜后置于扫描电镜观察台上进行微观结构观察。电镜加速电压为5 kV,放大倍数为2 000倍。
1.3.4 凝胶强度测定 采用TA-XT2 质构仪对凝胶强度进行测定[9]。将凝胶样品放于测量台上,采用P/0.5 的探头进行测定,模式选择TPA 模式,设置压缩前、压缩中、压缩后的速度分别为3.0,2.0,3.0 mm/s,凝胶压缩比例为35%,两次下压间隔5 s,触发力为5 g。测定后得质构参数,凝胶强度以探头下压过程中的最大感应力表示。
1.3.5 凝胶持水性测定 采用Zhao 等[10]的离心法测定凝胶持水性。将空离心管进行称重后放入适当质量的凝胶样品,在3 000×g 下离心15 min,离心结束后将离心管取出,室温下静置10 min,将上清液吸出后称重,凝胶持水性计算公式如下:
持水性(%)=(M2-M0)/(M1-M0)×100%
式中:M0——空离心管的质量,g;M1——离心前装有凝胶的离心管质量,g;M2——吸出水分后离心管质量,g。
1.3.6 统计分析 每组试验重复3 次,采用SPSS V17.0 软件进行ANOVA 差异显著性分析,作图采用Origin8.5 软件完成,P<0.05 为显著性差异。
2 结果与分析
2.1 凝胶流变性分析
不同超声时间下SPI/MD 混合物酸化过程中G′和G″的变化如图1所示。SPI/MD 混合物G′和G″的变化趋势与SPI 非常相似。酸化开始时,所有体系的G′<G″,更趋向于流体的特性,且G′和G″的变化不明显;随着酸化时间的延长,G′和G″逐渐增加,且G′增加速率大于G″;当达到凝胶点即G′=G″后,G′和G″急剧增加,且G′>G″;当G′和G″达到一定数值时,增加速率变得缓慢,最终达到一个平衡值,这表明一个稳定凝胶结构的形成[11]。然而,与SPI(图1a)相比,SPI/MD 混合物(图1b~图1e)的初始平衡时间较短,其G′和G″增加的较早,这使SPI/MD 混合物比SPI 更早到达凝胶点,缩短了凝胶形成时间,这也可从表1中凝胶时间的减少得到验证。对于SPI/MD 混合物来说,只有超声处理5 min 的混合物凝胶时间显著缩短(P<0.05),而超声处理15 min 和25 min 的混合物凝胶时间与非超声处理的混合物凝胶相比没有显著不同(P>0.05),这说明适当的超声处理会缩短SPI/MD混合物凝胶的形成时间,利于凝胶性质的改善。

图1 不同超声时间下SPI/MD 混合物酸化过程中G′和G″的变化Fig.1 Changes in G′ and G″ of SPI/MD mixtures with different ultrasound time during acidification
超声时间对SPI/MD 混合物酸化后G′和G″的影响见图2。由图2可以看出,酸化后所有体系的G′值远大于G″值,这表明所有体系都形成了具有一定强度的凝胶。与SPI 凝胶相比,SPI/MD 混合物凝胶的G′值显著增加(P<0.05),且凝胶时间缩短(表1),这说明在SPI 中混入MD 会强化凝胶网络,同时能够使蛋白质更快的形成凝胶,这可能与两种大分子之间的相分离作用有关[12]。蛋白质和多糖的相分离会使蛋白质在一定区域内的有效浓度增加,促进蛋白凝聚物的交联形成网络结构,导致凝胶作用的增强[13]。此外,蛋白质形成的连续相可以容纳多糖链,多糖的填充作用也是导致凝胶网络强化的一个原因[14]。
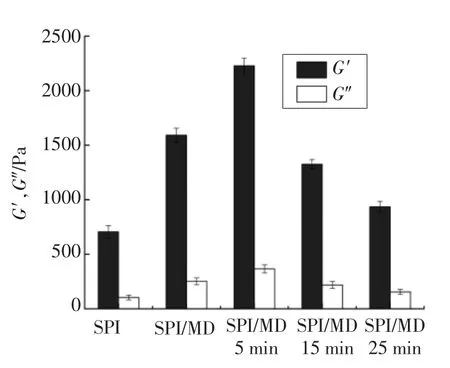
图2 超声时间对SPI/MD 混合物酸化后G′和G″的影响Fig.2 Effect of ultrasound time on G′ and G″of SPI/MD mixtures after acidification

表1 不同超声时间下SPI/MD 混合物的凝胶时间(tgel)Table1 Gelation time (tgel)of SPI/MD mixtures with different ultrasound time
超声处理对SPI/MD 混合物凝胶的G′值具有显著影响,与未经超声处理的混合物凝胶相比,只有超声处理5 min 的混合物凝胶G′值显著增加(P<0.05),且凝胶时间显著缩短(表1),而超声处理15 min 和25 min 又会使混合物凝胶G′值显著降低(P<0.05),但均高于SPI 凝胶。这表明随着超声时间的延长,SPI/MD 混合物凝胶的G′值呈先增加后降低的趋势,适当的超声处理能够增强SPI/MD 混合物凝胶网络结构,而过度的超声作用不利于凝胶网络的建立。Farahnaky 等[15]对超声处理卡拉胶冷致凝胶的机械力学特性进行研究,结果表明随着超声时间的延长,卡拉胶凝胶的机械强度呈先增加后降低的趋势,这与本文的研究结果相似。
超声引起的空化作用和物理剪切作用同时对蛋白质和多糖产生影响,这直接表现为对分子的降解。由于多糖分子呈线性的链状结构,更易被超声作用降解;而球状结构的蛋白分子具有粒子性,这会降低被超声作用破坏的可能[16]。适当的超声处理对热变性大豆蛋白分子结构影响较小,不会破坏蛋白连续相,主要对多糖起到降解作用,使多糖分子质量下降,减少多糖分子的空间占有体积,改善蛋白质和多糖之间的热力学不相容性,促进分子间的相互作用,导致蛋白质/多糖混合物形成更牢固的三维网络结构,宏观上表现为凝胶强度的增加和凝胶时间的缩短。而过度的超声作用会降解热变性大豆蛋白分子,破坏蛋白连续相,削弱蛋白质的凝胶性,同时多糖分子被破坏得更加严重,不利于维持高强度的三维网络结构,导致凝胶网络的弱化[17]。
为了进一步检验超声处理后SPI/MD 混合物凝胶网络的形成情况,动态扫描后进行频率扫描。不同超声时间下SPI/MD 混合物酸诱导凝胶的频率扫描如图3所示。所有体系的G′值始终大于G″值,且G′和G″的曲线彼此平行,表示GDL 酸化后均已形成了弹性凝胶。根据Winter 等[18]的研究,这是形成典型凝胶结构的表现。在全频率扫描范围内,所有体系的G′和G″随着频率的增加呈微弱的上升趋势,即G′和G″对振荡频率显示出较低的依赖性,这说明所有体系形成的凝胶网络结构稳定。此外,SPI/MD 混合物凝胶G'的变化趋势与SPI 凝胶相似,超声作用会使SPI/MD 混合物凝胶的G′值先增大后降低,凝胶网络的强弱顺序依次为:超声5 min 混合物凝胶>非超声混合物凝胶>超声15 min 混合物凝胶>超声25 min 混合物凝胶>SPI 凝胶,这与动态流变性所得到的结果一致,进一步证实了适当的超声处理能够强化SPI/MD 混合物酸诱导凝胶。
不同超声时间下SPI/MD 混合物酸诱导凝胶的振幅扫描如图4所示。与SPI 凝胶相比,在整个振幅扫描区域范围内,SPI/MD 混合物凝胶的G′和G″相对不变的区域增加,即线性粘弹区域增加,这表明在MD 混入SPI 中能够提高混合物凝胶的抗破坏能力,使凝胶网络结构保持相对完整性。随着超声时间的延长,SPI/MD 混合物凝胶的线性粘弹区域先增加后减少,且超声处理5 min 的SPI/MD混合物凝胶的线性粘弹区域最大,这一结果与动态流变性和频率扫描的结果一致,这表明适当的超声处理会进一步提高SPI/MD 混合物凝胶的抗破坏能力。此外,所有体系的线性粘弹区域均大于1%,而试验采用0.5%的应变值,这表明应变值均在凝胶形成的线性粘弹范围内,整个测试过程均在非破坏性的小振幅条件下进行。
2.2 凝胶微观结构分析

图3 不同超声时间下SPI/MD 混合物酸诱导凝胶的频率扫描Fig.3 Frequency sweep for acid induced gels of SPI/MD mixture with different ultrasound time

图4 不同超声时间下SPI/MD 混合物酸诱导凝胶的振幅扫描Fig.4 Amplitude sweep for acid induced gels of SPI/MD mixture with different ultrasound time

图5 不同超声时间下SPI/MD 混合物酸诱导凝胶的扫描电镜图Fig.5 Scanning electron micrographs for acid induced gels of SPI/MD mixture with different ultrasound time
采用扫描电镜放大2 000 倍对凝胶样品进行观察,不同超声时间下SPI/MD 混合物酸诱导凝胶的扫描电镜见图5。由图5可以看出,SPI 酸诱导凝胶呈多孔的蜂窝状结构,有不规则的孔洞,且空间结构不均一(图5a)。而SPI/MD 混合物形成的酸诱导凝胶空间结构更加致密、均一,孔洞明显变小,蛋白质间的交联度明显增大(图5b),说明向SPI 中混入MD 能够强化蛋白质的凝胶结构。Monteiro 等[19]研究发现在乳清蛋白中混入半乳甘露聚糖会使混合凝胶微观结构变得更加致密,这会导致凝胶强度和持水性的增加,这与本研究的结果一致。未经超声处理的SPI/MD 混合物凝胶呈链状网络结构,它是由有序的分子排列构成的。而超声处理后SPI/MD 混合物凝胶的微观结构变得粗糙,呈颗粒状网络结构,它是由无序排列的具有三维结构的聚集体组成的,这可能是由于超声作用使蛋白质分子聚集导致的[20]。随着超声时间的延长,这种颗粒状结构更明显。Stading 等[21]研究表明,链状凝胶比颗粒状凝胶更均一,网络结构更完整,对水分子的固定作用更好,凝胶持水性更高,这与后面凝胶持水性的研究结果一致。
此外,与SPI/MD 混合物凝胶相比,只有超声5 min 后的SPI/MD 混合物凝胶(图5c)的交联度稍有增加,且凝胶网络结构完整性较好,而超声15 min(图5d)和25 min(图5e)后的SPI/MD 混合物凝胶微观结构中出现较大的裂痕,网络结构的完整性严重被破坏,这些都会影响凝胶强度和凝胶持水性。凝胶微观结构分析与本文中凝胶流变性的研究结果一致,再次印证了适当的超声处理能够强化SPI/MD 混合物酸诱导凝胶,而过度的超声处理会导致SPI/MD 混合物凝胶网络的弱化。
2.3 凝胶强度和持水性分析
超声时间对SPI/MD 混合物凝胶强度和持水性的影响如图6所示。与SPI 凝胶相比,所有SPI/MD 混合物凝胶强度均增加,说明在SPI 中混入MD 能够增加蛋白质的凝胶强度。Pan 等[22]在大豆分离蛋白/海藻酸钠混合凝胶机械性能的研究中发现,蛋白质和多糖混合体系由于相分离作用而导致凝胶强度增加,这与本文的研究结果一致。超声处理5 min 能使SPI/MD 混合物凝胶强度进一步增加,而超声处理15 min 和25 min 则会降低混合物的凝胶强度,这表明适当的超声处理可以提高SPI/MD 混合物的凝胶强度,而过度的超声作用会破坏混合物的凝胶网络,这与流变性的研究结果相似。分析原因可能是由于适当的超声处理会促进蛋白质和多糖的互溶,使多糖能够更好地填充到SPI 凝胶网络中,进而增强了凝胶强度;而过度的超声作用会打断蛋白质连续相,严重降解多糖分子,从而破坏蛋白质/多糖凝胶网络,导致凝胶强度降低[23]。这也与本文中流变性的分析结果一致。
对于凝胶持水性来说,在SPI 中混入MD 能够增加凝胶持水性。然而,超声处理会降低SPI/MD 混合物凝胶的持水性,这可能与凝胶微观结构有关。Çakır 等[24]对WPI/卡拉胶混合凝胶持水性的研究中发现,WPI/卡拉胶混合凝胶持水性的变化与凝胶微观结构密切相关,当凝胶微观结构由链状变为颗粒状会导致持水性的降低。由凝胶微观结构(图5)可以看出,未经超声处理的SPI/MD混合物凝胶呈均匀、致密的链状网络结构,孔隙度低,凝胶持水能力强;而经超声处理的SPI/MD 混合物凝胶呈粗糙的颗粒状网络结构,且凝胶微观结构中出现较大的裂痕,网络结构的完整性被破坏,导致凝胶持水能力减弱。此外,Kao 等[25]对硫酸钙豆腐的研究中发现具有均一、致密网络结构的豆腐具有更高的持水性,这也与本研究的结果一致,再次证明凝胶微观结构对持水性具有重要影响。

图6 超声时间对SPI/MD 混合物凝胶强度和持水性的影响Fig.6 Effect of ultrasound time on gel strength and WHC of SPI/MD mixtures
3 结论
对超声条件下SPI/MD 混合物酸诱导凝胶性质进行研究。在SPI 中混入MD 由于相分离作用会促进蛋白凝聚物的交联形成网络结构,导致凝胶网络的强化和凝胶时间的缩短。超声处理5 min 能够进一步增强SPI/MD 混合物凝胶网络结构和抗破坏能力,同时加快凝胶的形成速度。而超声处理15 min 和25 min 不利于混合物凝胶网络的建立,且会使混合物的凝胶强度降低。凝胶微观结构分析表明SPI 与MD 混合能够使酸诱导凝胶空间结构更加致密、均一,孔洞变小,蛋白质间的交联度增大。超声处理会使SPI/MD 混合物凝胶由链状结构向颗粒状结构转变,且随着超声时间的延长,这种颗粒状结构更明显。超声处理5 min 能够使SPI/MD 混合物凝胶的交联度增加,且凝胶网络结构完整性较好;而超声15 min 和25 min 的混合物凝胶微观结构中出现较大的裂痕,网络结构的完整性被破坏,导致凝胶强度和持水性降低。
