龙眼果肉多糖超微粉碎-酶解提取工艺优化及其免疫活性
2020-04-03刘慧君张瑞芬董丽红邓媛元魏振承张名位
刘慧君 黄 菲 张瑞芬 董丽红 邓媛元 刘 磊 魏振承 张名位*
(1 华南农业大学食品学院 广州510642 2 广东省农业科学院蚕业与农产品加工研究所 农业农村部功能食品重点实验室广东省农产品加工重点实验室 广州510610)
龙眼俗称“桂圆”,是传统药食两用水果,据《神农本草经》、《本草纲目》等古医书记载,其具有养血安神、益智宁心、补益心脾、壮阳益气、延年益寿等功效[1]。现代研究发现,水溶性多糖是其果肉的主要活性成分之一[2-3],具有免疫调节、抗肿瘤、抗氧化和抗炎等多种功能活性[4-6]。基于龙眼生物活性机制的研究及其开展精深加工的需要,开展龙眼果肉多糖的提取技术研究显得至关重要。
超微粉碎技术是近期出现的一种提取技术,其可以将原料粉碎至1nm~100μm 粒径的微小颗粒,从而改变原料表面结构,增加原料与提取剂的接触面积,实现高效提取。超微粉碎因具有高效、节能等特点而逐渐被应用于功能性成分的提取制备。有研究表明超微粉碎辅助提取多糖能改变多糖的分子质量、化学组成等,从而影响其生物活性[7-8],然而,超微粉碎技术对龙眼果肉多糖的理化性质及其免疫调节活性的影响尚鲜见报道。此外,生物酶解技术因具有特异性、高效性被应用于活性多糖的提取。易阳[9]和贺寅[10]等分别优化建立了超声波-酶解、酶法提取龙眼多糖的工艺,而对生物酶解与物理的超微粉碎相结合后,两者对龙眼多糖的得率、理化性质及其免疫活性的影响尚不知晓。本研究比较了热水浸提法、超微粉碎提取法和超微粉碎-酶法提取技术对龙眼果肉多糖的提取率、理化性质以及免疫活性的影响。
1 材料与方法
1.1 材料与仪器
龙眼品种“储良”,由广东省农业科学院果树研究所提供,于2016年9月采自其实验果园。新鲜龙眼采用热风干燥得到龙眼干。
葡萄糖醛酸、葡聚糖、葡萄糖、木糖、阿拉伯糖、甘露糖、半乳糖、鼠李糖标准品,甲基噻唑基四唑(MTT),纤 维 素 酶(Cellulase from Aspergillus niger,Sigma-22178),脂多糖(LPS)和青链霉素,购自美国Sigma 公司;间羟基联苯,购自日本TCI 公司;NO 试剂盒、考马斯亮蓝蛋白测定试剂盒,购自南京建成科技有限公司;TNF-α、IL-6 和IL-1β 酶联免疫试剂盒,购自深圳欣博盛生物科技有限公司;其它试剂均为国产分析纯。
小鼠巨噬细胞株RAW264.7 由中国科学院典型培养物保藏委员会细胞库提供,本实验室继代培养。
UV-1800 紫外可见分光光度计,日本岛津有限公司;振动式细胞级超微粉碎机,济南达微机械有限公司;冷冻干燥仪,东京理化器械株式会社;GHRH-20 热泵干燥机,广东省农业机械研究所;Eyelan-1100 旋转蒸发器,东京理化器械株式会社;Infinite Pro 200 酶标仪,瑞士Tecan 公司;气相色谱-质谱联用仪,美国Agilent 公司;AR1500EX 流变仪,美国TA 公司;Acquity APC超高效聚合物色谱系统,美国Waters 公司。
1.2 试验方法
1.2.1 龙眼果肉多糖的提取 将龙眼干用80%的乙醇浸泡5 次脱去小分子糖后50 ℃烘干72 h,超微粉碎处理后,按料液比1 ∶40(mg/mL)加入蒸馏水,匀浆,调节pH 值,添加适量纤维素酶,浸提一定时间后,升温至90 ℃灭酶5 min 后过滤,得到龙眼多糖提取液。
提取率的计算:多糖提取率=(提取液中总糖质量-提取液中还原糖质量)/龙眼干质量×100%。总糖含量采用苯酚-硫酸法,还原糖含量采用DNS法。
1.2.2 龙眼果肉多糖提取响应面的工艺优化试验本试验在单因素试验的基础上,依据Box-Benhnken 中心组合原则,分别选取超微时间、酶添加量和提取时间3 个参数,采用3 因素3 水平的响应面分析法,以多糖提取率为响应值(Y),以超声时间(X1)、酶添加量(X2)和提取时间(X3)为自变量,具体设计见表1,试验方案及结果见表2。
1.2.3 不同提取方法的对比试验
1.2.3.1 热水提取法 将乙醇浸泡后的龙眼干按照文献[11]进行热水浸提,采用的提取条件为:料液比1∶40(mg/mL),温度50 ℃,浸提时间90 min。将获得的多糖提取液浓缩后用Sevag 法脱蛋白后,超滤(Mw = 3 ku)处理30 min,用95%乙醇醇沉 (乙醇终体积分数为80%),4 ℃冰箱静置12 h后收集沉淀,将沉淀冻干后得龙眼多糖记为LP。
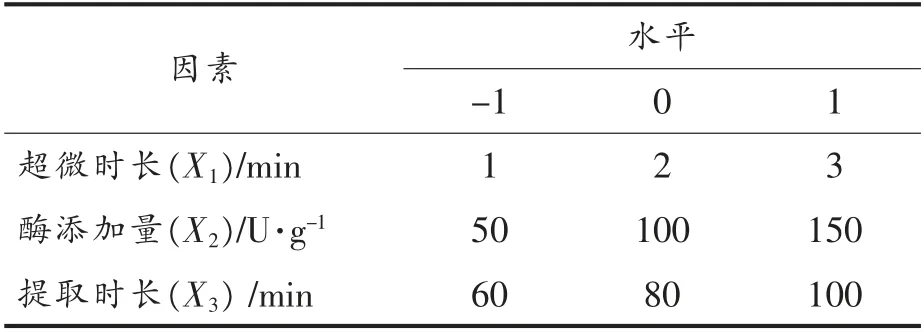
表1 响应面因素水平表Table 1 Response surface analysis factors and levels
1.2.3.2 超微粉碎辅助提取 将乙醇浸泡后的龙眼干超微粉碎2 min 预处理后再按照上述进行热水浸提、脱蛋白、超滤、乙醇沉淀、冻干得到龙眼果肉多糖,记为LP-S。
1.2.3.3 超微-酶解提取 将乙醇浸泡后的龙眼干超微粉碎2 min 预处理后采用响应面优化的最佳条件提取龙眼多糖溶液,再将多糖溶液按照上述方法脱蛋白、超滤、乙醇沉淀、冻干得到龙眼果肉多糖,记为LP-SE。
1.2.4 不同提取工艺制备的龙眼果肉多糖的理化性质分析
1.2.4.1 龙眼多糖的得率 多糖得率=提取得到的龙眼果肉多糖冻干粉质量/提取所用龙眼干干基质量×100%。
1.2.4.2 基本成分 中性糖含量测定:采用苯酚-硫酸法。还原糖含量测定:采用DNS 法。糖醛酸含量测定:采用Blumenkrantz 和Asboe-Hanaen 的方法[12]。蛋白质含量测定:采用考马斯亮蓝蛋白试剂盒测定蛋白含量。
单糖组成:单糖标准品的衍生化:等量称取各类单糖标准品共10 mg,加入10 mg 的盐酸羟胺,再加1 mL 吡啶,混匀后于90 ℃反应0.5 h,冷却后再加1 mL 乙酸酐,于90 ℃继续反应0.5 h。冷却至室温后,加入少量无水Na2SO4,混匀后过0.2 μm 滤膜,然后进行GC-MS 分析。
龙眼果肉多糖的水解:称取多糖样品10 mg于安培瓶中,加入2 mL 4 mol/L 的三氟乙酸后,酒精喷灯封口。在110 ℃水解6 h 后,50 ℃减压蒸干。加入适量甲醇复溶后再蒸干,重复3 次。然后按照标准品衍生化方法进行衍生化,进行GC-MS分析。其结果根据单糖标准品的保留时间进行分析,并通过峰面积比计算各单糖物质的量分数。气质色谱条件:HP-1701 毛细管柱 (30 m × 0.25 m,0.33 μm);检测器温度:290 ℃;汽化室温度:260 ℃,柱温初温为190 ℃,以2 ℃/min 程序升温至230 ℃,保持2 min,再以5 ℃/min 程序升温至240 ℃,保持2 min。载气为N2,流速是1 mL/min;不分流,进样量是1 μL。
1.2.4.3 分子质量分布 将龙眼果肉多糖溶液(5 mg/mL)过0.45 μm 水相滤膜,经超高效聚合物色谱仪(APC)检测分子质量分布。采用葡聚糖标品(5.2,11.6,23.8,48.6,148,273,410,668 ku)建 立标准曲线。色谱条件为:色谱柱选用ACQUITY APCTM AQ 450、ACQUITY APCTM AQ 125 和ACQUITY APCTM AQ 45 三根串联,流动相为50 mmol/L 硫酸钠,流速为0.7 mL/min,检测器为示差检测器,柱温箱和检测器温度控制在35 ℃,进样量为20 μL。
1.2.4.4 黏度及溶解性 黏度:参考文献报道[13],将龙眼果肉多糖配制成20 mg/mL 的多糖溶液,用流变仪测定表观黏度,测定参数为:温度25 ℃,剪切速率0.1/s,保持3 min,测定采用流体模式,检测表观黏度。测定重复3 次。
溶解性:参考文献[14]报道,取一定质量龙眼果肉多糖,按50 mg/mL 称量加水溶解,常温涡旋振荡30 min,10 000 r/min 离心10 min,取上清1 mL,上清与残渣均真空干燥,称量干燥后上清质量,计算溶解性,以每mL 中溶解的龙眼果肉多糖质量表征其溶解性。测定重复3 次。
1.2.5 免疫调节作用分析
1.2.5.1 龙眼果肉多糖对巨噬细胞毒性分析RAW264.7 巨噬细胞经DMEM 完全培养液 (含10%胎牛血清、1%双抗)调整浓度为5×105cells/mL,以100 μL/孔加入96 孔板中,置于培养箱中贴壁培养6 h 后,吸除上清培养液除去未贴壁细胞。每孔加入含有龙眼果肉多糖的培养液100 μL(多糖终质量浓度为0,25,50,100,150,200,300,400 μg/mL,每个浓度设6 个复孔),另设完全培养基为空白对照。培养板于培养箱中孵育24 h 后,按照MTT 试剂盒操作,检测每孔OD 值,计算巨噬细胞的存活率。
细胞存活率(%)= (试验孔OD-对照孔OD)/对照孔OD×100
1.2.5.2 龙眼果肉多糖刺激巨噬细胞分泌NO 及细胞因子 在明确龙眼果肉多糖对巨噬细胞无毒性的浓度范围内,分析不同提取方式获得的龙眼果肉多糖对巨噬细胞分泌NO 和细胞因子的影响。5×105cells/mL 的巨噬细胞以100 μL/孔加入96 孔培养板中,置于培养箱中贴壁培养6 h 后,吸除上清培养液除去未贴壁细胞。每孔加入含样品的培养液100 μL (0,25,50 和100 μg/mL,LPS 终质量浓度为1 ng/mL,每个浓度设4 个复孔)。另加100 μL 培养液的细胞孔作为空白对照。培养板于培养箱中孵育24 h 后,取100 μL 上清液,采用小鼠NO 试剂盒和IL-1β、IL-6 或TNF-α 酶联免疫吸附试剂盒,按使用说明测定巨噬细胞分泌NO 及细胞因子表达水平。
1.2.6 统计分析 采用 SPSS 19.0 统计软件进行单因素方差分析,并以S-N-K 检验比较各组间差异,显著性水平为P<0.05,以不同小写字母表示。结果以均数±标准差(±SD)表示。
2 结果与分析
2.1 超微粉碎纤维素酶辅助提取龙眼果肉多糖工艺优化
2.1.1 响应面结果与分析 响应面设计各因素水平龙眼果肉多糖提取率见表2。通过软件进行数据分析,建立二次响应面回归模型如下:
Y=35.79+2.46X1+5.51X2+3.49X3+1.11X1X2+2.66X1X3+2.41X2X3-6.34X12-4.92X22-5.11X32
对上述模型进行方差分析,结果见表3。从表3可以看出,回归模型P<0.0001,说明回归模型达到极显著水平;失拟项P=0.1369>0.05,不显著,说明该模型是合适的。模型复相关系系数的平方R2为0.988,说明该方程拟合度较高,故该模型可以用于本工艺的实际推测。对各项F 值检验可知,交互项中因素X1超微时长与因素X3提取时长以及因素X2酶添加量与因素X3提取时长均有显著性交互作用(P<0.05)。各因素对龙眼果肉多糖提取率的影响程度从大到小依次为:酶添加量>提取时长>超微时长。
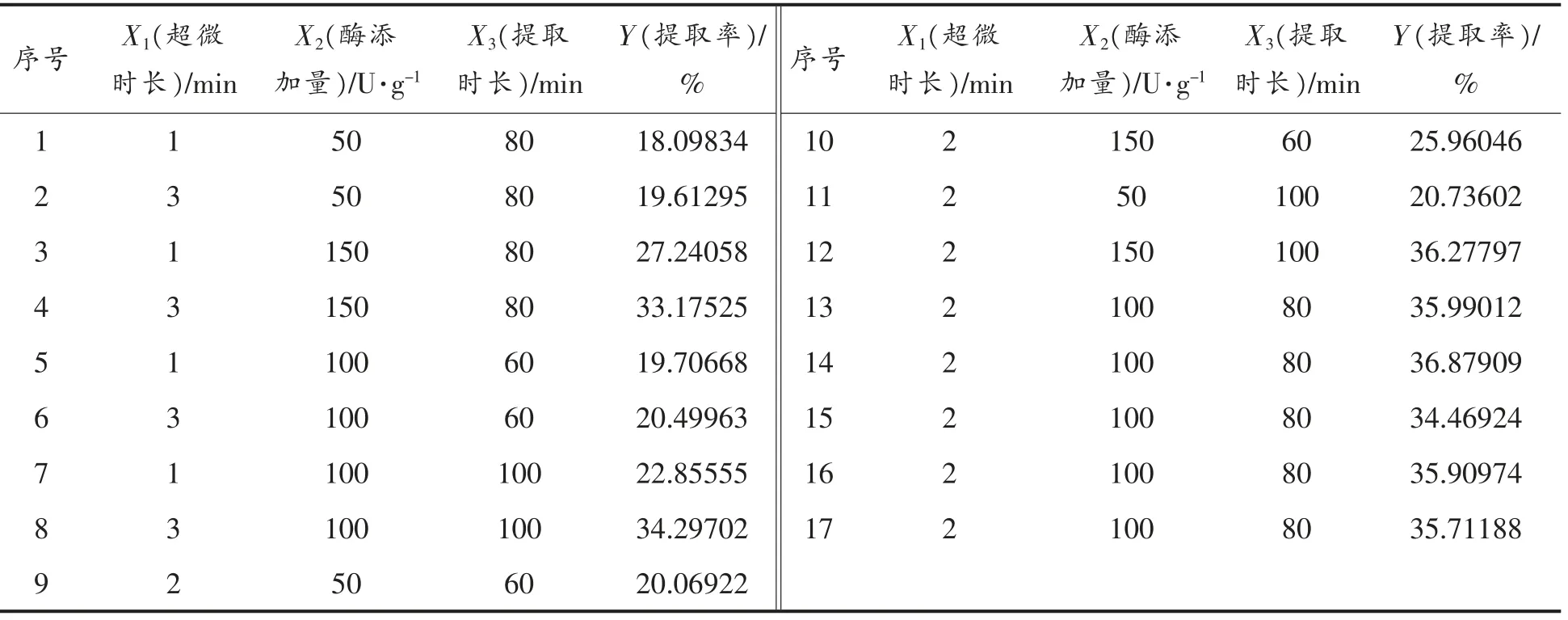
表2 响应面分析方案及结果Table 2 Response surface analysis and results
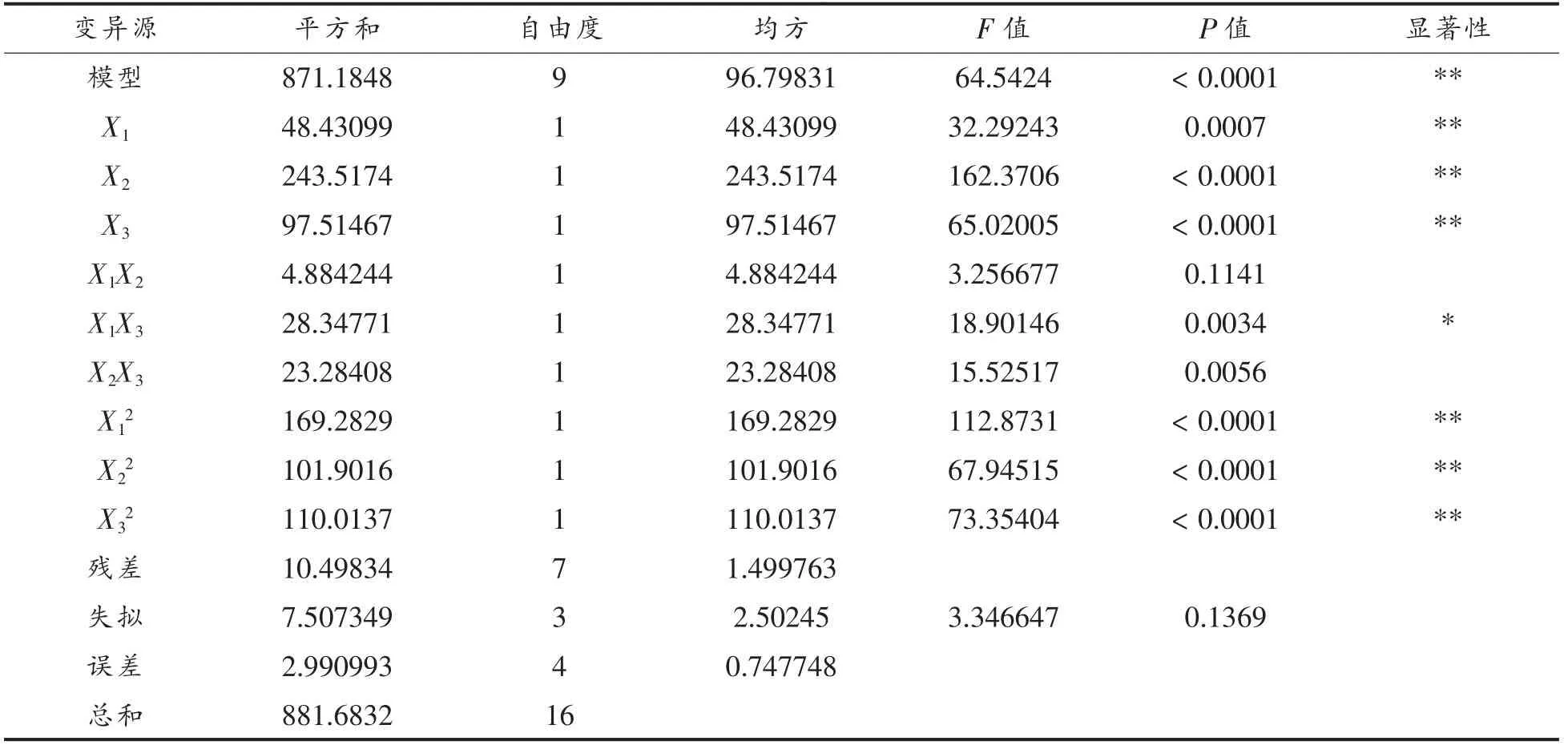
表3 试验结果方差分析表Table 3 Variance analysis of test results
2.1.2 优化与验证 软件模拟计算得到的最优提取方案为:超微时长2.39 min,酶添加量137.85 U/g,提取时长为92.45 min,在该条件下,提取率预计达到最大值为39.45%。
根据试验可行性,优化各因子,修正提取方案为:超微时长2 min,酶添加量140 U/g,提取时长为90 min,带入方程算得提取率预测值为38.49%。
验证试验在上述条件下重复3 次,得到实际提取率为38.99%±1.17%,与预测值之间相对误差为1.30%,因此采用此模型优化得到的参数准确可靠,具有实用价值。
2.2 不同提取方式所得龙眼果肉多糖的基本特性
2.2.1 提取率及化学组成 3 种提取方式所得龙眼果肉多糖的提取率及其化学组成见表4。由表4可见,与传统热水浸提相比,超微粉碎处理使龙眼粗多糖得率提高90.74%。超微粉碎技术可以使龙眼干颗粒变小,增加其与溶剂的接触面积,从而提高得率。利用纤维素酶辅助浸提,龙眼粗多糖的得率进一步提高59.22%。纤维素酶可以破坏龙眼果肉细胞壁,降解不可溶的果胶和纤维素等成分,使其溶于水,从而增强水溶性多糖的得率。
3 种龙眼多糖的分子质量大小为:LP>LP-S>LP-SE,超微粉碎可能通过破坏多糖链以及分子间的氢键,从而降低多糖的分子质量,此结果与Zhang[8]对枸菊子多糖的研究结果一致。酶可以作用于多糖的糖苷键,使多糖水解/降解,降低其分子质量,所以超微粉碎-酶解处理提取的多糖具有更小的分子质量。
3 种多糖均主要由中性糖、糖醛酸组成,含有少量的还原糖和蛋白质。其中LP 的中性糖含量最高,LP-S 含量最低;LP-SE 的还原糖含量最高,LP-S 含量最低;LP-S 的糖醛酸含量显著高于LP和LP-SE(P<0.05)。3 种多糖的蛋白质含量无显著差异。

表4 不同提取方式龙眼粗多糖基础构成Table 4 The basic composition of longan polysaccharides of different extraction methods
进一步分析3 种多糖的单糖组成,结果见表5。3 种提取方式制备的龙眼果肉多糖均主要由阿拉伯糖和半乳糖组成,含有少量的鼠李糖、葡萄糖和甘露糖。其中传统热水浸提制备的LP 中葡萄糖含量显著高于LP-S 和LP-SE(P<0.05),辅助超微粉碎处理的LP-S 中半乳糖显著高于LP 和LP-SE(P<0.05),超微粉碎-纤维素酶提取的LP-SE 的阿拉伯糖和鼠李糖含量显著高于LP 和LP-S (P<0.05)。
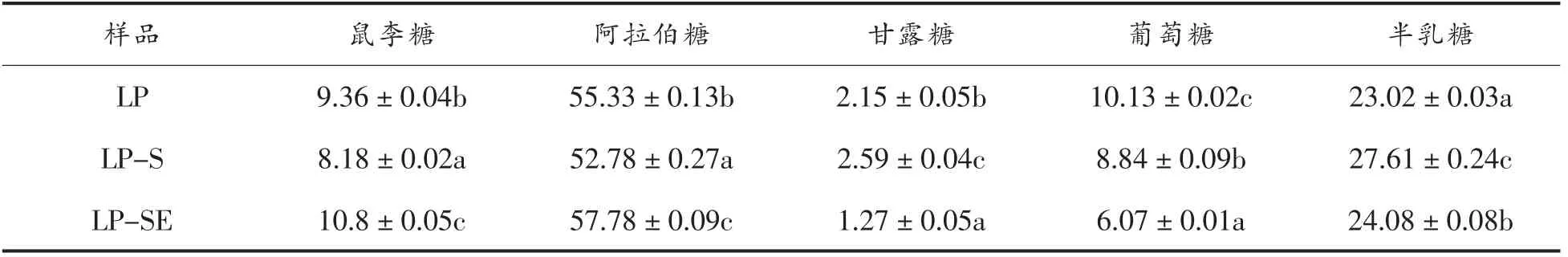
表5 不同提取方式龙眼果肉多糖单糖组成(%)Table 5 Monosaccharide composition of longan polysaccharides of different extraction methods (%)
2.2.2 表观黏度及溶解性 3 个样品的表观黏度和溶解性见表6,在相同浓度下,3 种龙眼多糖的表观黏度大小为:LP>LP-S>LP-SE,LP 的表观黏度是LP-SE 的47.7 倍。三者的溶解度大小为:LP<LP-S<LP-SE,LP-SE 的溶解度是LP 的2.3 倍。多糖的黏度、溶解度与其分子质量、分子链等相关,胡婕伦等[13]发现车前子多糖的表观黏度随着分子质量的降低而降低,Tiwari 等[15]也报道多糖的表观黏度的下降与其分子质量的降低有关。
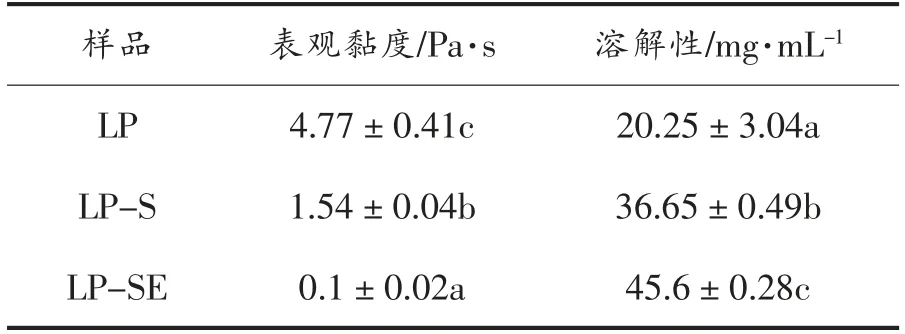
表6 不同提取方式龙眼果肉多糖的表观黏度和溶解性Table 6 Apparent viscosity and solubility of longan polysaccharides of different extraction methods
2.3 不同提取方式所得龙眼果肉多糖的免疫调节活性
2.3.1 毒性分析 分析3 种龙眼果肉多糖对巨噬细胞的毒性,发现3 种多糖在小于400 μg/mL 的浓度范围内,均能使细胞的存活率高于90%,表明其在此浓度范围内无细胞毒性,可用于后续的细胞活性评价。
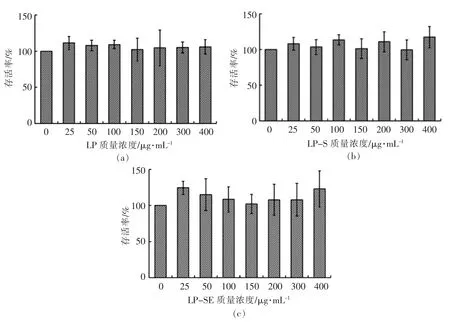
图1 3 种龙眼果肉多糖对巨噬细胞的MTT 毒性Fig.1 The toxicity of longan polysaccharides LP(a),LP-S(b),LP-SE(c)to RAW264.7 macrophages
2.3.2 对巨噬细胞分泌NO 及细胞因子的影响进一步分析3 种龙眼果肉多糖刺激巨噬细胞分泌NO 及其细胞因子的影响,结果如图2所示。由图2a 和图2c 可知,与对照组相比,LP 和LP-S 对巨噬细胞分泌NO 和IL-6 无显著影响(P>0.05),而LP-SE 在25~100 μg/mL 范围内均能显著刺激NO的分泌(图2a);LP-SE 在低浓度对IL-6 无刺激作用,在50 和100 μg/mL 高浓度下,显著刺激IL-6分泌(P<0.05)(图2c)。3 种多糖在25~100 μg/mL范围内均能显著刺激巨噬细胞分泌TNF-α,且呈现一定的剂量效应关系,且在相同剂量下,LP-SE的刺激作用显著强于LP 和LP-S (P<0.05)(图2b)。同样的,3 种多糖均能刺激巨噬细胞分泌IL-1β,在相同剂量下,LP-SE 的刺激作用显著强于LP 和LP-S(P<0.05)(图2d)。
3 种龙眼多糖对巨噬细胞分泌功能的影响差异与其化学组成及理化性质有关。多糖的免疫调节活性与其分子质量、溶解性和黏度等密切相关,Sun 等[16]研究紫球藻多糖不同级分发现,分子质量最低的级分对淋巴细胞和巨噬细胞的刺激作用最强;竹节参多糖[17]、茯苓多糖[18]的低黏度、高溶解性的特性有助于其发挥免疫调节活性。此外,多糖分子链的单糖组成、糖基连接方式和支链特性等决定其是否能被免疫细胞受体识别而引发免疫应答,荔枝果肉多糖中的半乳糖和阿拉伯糖对其发挥免疫调节作用有重要作用[19],当归多糖的半乳糖-鼠李糖骨架和半乳糖支链是其表现出免疫调节活性的特殊结构[20]。因此,具有低黏度、高溶解性、富含阿拉伯糖和鼠李糖的LP-SE 表现出最好的免疫调节活性。
3 结论
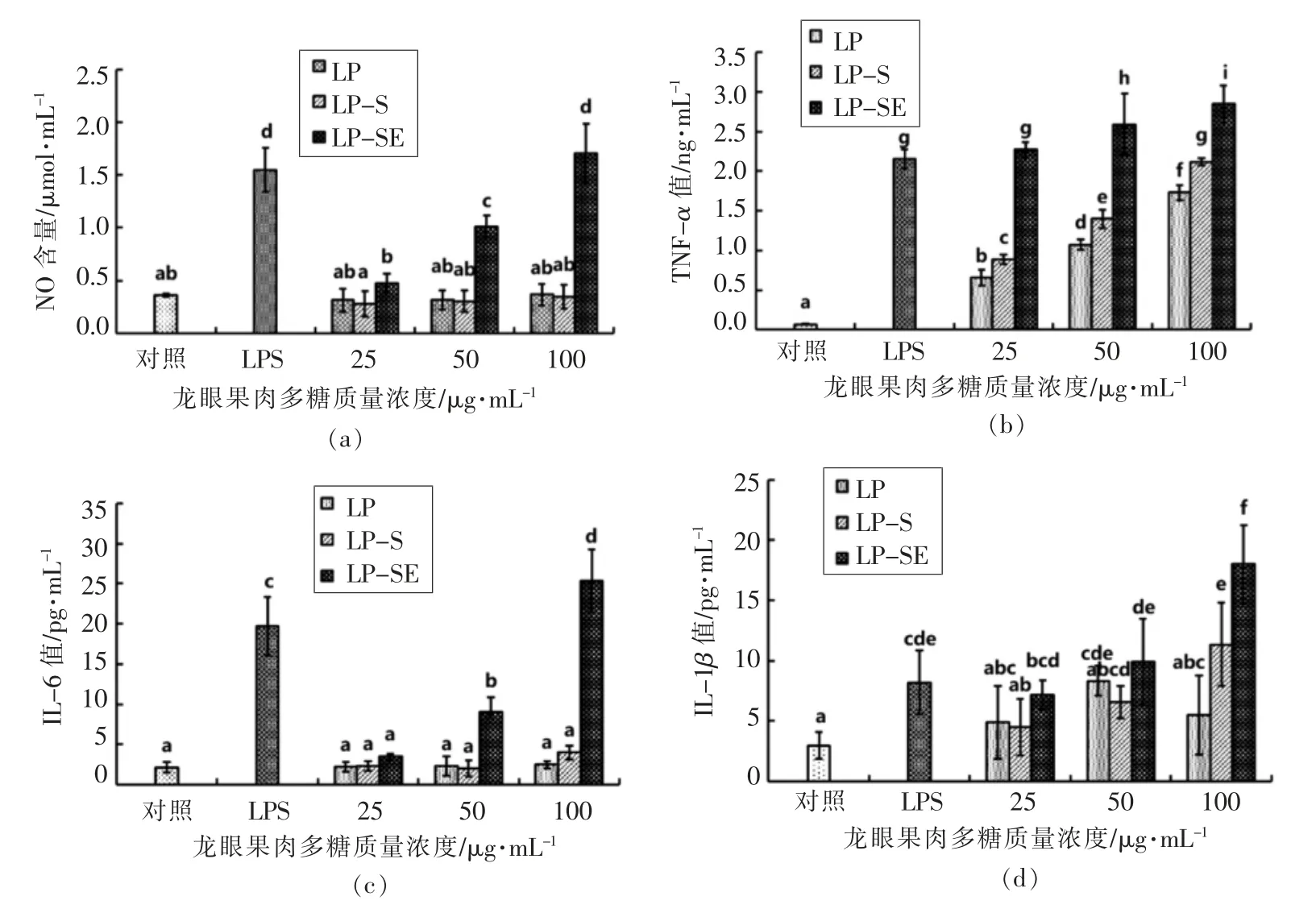
图2 龙眼果肉多糖对巨噬细胞分泌NO、TNF-α、IL-6 和IL-1β 的影响Fig.2 Effect of longan polysaccharides on the production of NO (a),TNF-α (b),IL-6 (c)and IL-1β (d)of RAW264.7 macrophages
1)采用响应面分析法优化龙眼果肉多糖的超微粉碎酶解提取工艺参数为:超微时长2 min,酶添加量140 U/g,pH 值5,料液比1 ∶40,提取温度50 ℃,提取时长90 min,在该条件下多糖的提取率为38.49%。
2)超微粉碎纤维素酶辅助法提取的龙眼果肉多糖LP-SE 相比热水浸提和超微粉碎辅助法提取的龙眼果肉多糖(LP 和LP-S),具有得率高,分子质量小,糖醛酸含量低,鼠李糖和阿拉伯糖含量高,低黏度和高溶解性的特性,且其对巨噬细胞分泌NO、TNF-α、IL-6 和IL-1β 的刺激作用显著强于LP 和LP-S。
